Кинетика и катализ, 2021, T. 62, № 6, стр. 757-772
Синергизм каталитического действия кобальта и церия в селективном окислении CO на модифицированных цеолитах Сo/Ce/ZSM-5
И. А. Иванин a, *, И. Н. Кротова a, О. В. Удалова b, К. Л. Занавескин c, М. И. Шилина a, **
a Московский государственный университет имени М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 3, Россия
b Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
119991 Москва, просп. Косыгина, 4, к. 1, Россия
c Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Ленинский просп., ГСП-1, 29, Россия
* E-mail: ivanin.post@gmail.com
** E-mail: mish@kinet.chem.msu.ru
Поступила в редакцию 04.06.2021
После доработки 28.07.2021
Принята к публикации 28.07.2021
Аннотация
Серия моно- и биметаллических кобальт-цериевых катализаторов на основе цеолита ZSM-5
с различным силикатным модулем (SiO2/Al2O3 = 30, 55, 80) синтезирована методом пропитки по влагоемкости. Атомное отношение металлов
(Co + Ce)/Al в биметаллических образцах находилось в пределах 0.5–1.5. В полном и
селективном окислении CO в избытке водорода (CO-PROX) проявляется синергизм каталитического
действия кобальта и церия в полученных композитах. Наибольшей активностью обладают
катализаторы, в которых атомное соотношение Co и Ce близко к 3. Конверсия CO в реакции
CO-PROX достигает в этих случаях 95% при 190–200°С. С использованием методов ПЭМ,
СЭМ, а также ИК-спектроскопии диффузного отражения адсорбированного CO, включая исследования
in situ процессов восстановления под действием CO, показано, что ключевую роль в реакциях
окисления играют оксокатионы кобальта и смешанные оксокатионы кобальта и церия, расположенные
в обменных позициях цеолита. Достижению оптимального баланса между высокой активностью
Сo/Ce-катализаторов в окислении CO и селективностью образования CO2 в присутствии водорода способствует использование цеолита с SiO2/Al2O3 = 55.
Графический реферат
1. ВВЕДЕНИЕ
Процесс селективного окисления CO в присутствии водорода (CO-PROX) на сегодняшний день рассматривается с практической и экономической точек зрения как наиболее простой и эффективный подход для удаления CO из потока водорода, что позволяет получать высокочистый водород для работы топливных элементов с протонообменными мембранами [1]. В этом процессе возможно параллельное протекание окисления CO и водорода, чему способствует конкурентная адсорбция CO и H2 на поверхности катализатора и близкие значения энтальпий реакций:
(I)
${\text{CO}} + 0.5{{{\text{O}}}_{2}} \to {\text{C}}{{{\text{O}}}_{2}},\,\,\,\,\Delta {{H}_{{298}}} = --283\,\,{\text{кДж/моль,}}$(II)
${{{\text{H}}}_{2}} + 0.5{{{\text{O}}}_{2}} \to {{{\text{H}}}_{2}}{\text{O}},\,\,\,\,\Delta {{H}_{{298}}} = --242\,\,{\text{кДж/моль}}{\text{.}}$Таким образом, необходимо достичь высокой скорости окисления CO при умеренной температуре и с высокой селективностью, избегая побочных реакций окисления водорода и метанирования [1, 2].
Часто для селективного окисления CO используют катализаторы, содержащие нанесенные благородные металлы (Pt [3, 4], Rh, Ru, Ir [3], Au [5], Pd [6]). В последнее время внимание исследователей привлекают более доступные и дешевые альтернативы – системы на основе оксидов переходных металлов, особенно – Co [2, 7–12] и Cu [1, 13–17]. По данным [18] наночастицы чистого Co3O4, подвергнутого восстановительной предобработке, демонстрируют высокую эффективность в реакции CO-PROX. На активность и селективность систем на основе оксидов переходных металлов большое влияние оказывает взаимодействие между нанесенными частицами и носителем, например, Al2O3 [12]. Значительный интерес представляют каталитические системы, в которых осуществляется взаимодействие частиц Co3O4 или CuO с оксидом церия CeO2, который в отличие от Al2O3 способен к обратимому восстановлению–окислению в условиях протекания каталитической реакции. Так, системы CuO/CeO2 почти не уступают, а в некоторых случаях и превосходят благородные металлы по каталитическим характеристикам в процессе PROX [19, 20]. Это объясняется высокой кислородной емкостью таких систем, легкостью восстановления Ce4+ → Ce3+, а также синергическим взаимодействием Cu–Ce. В системах Co3O4–CeO2, также как и в системах CuO–CeO2, наблюдается эффект синергизма: так, по данным [2] температура 90% конверсии CO составила 170°С на Co3O4 и 142°С на 10% CeO2–Co3O4, а скорость реакции при 70°С в присутствии CeO2–Co3O4 оказалась более чем в 2.5 раза выше по сравнению с Co3O4. Синергическое взаимодействие Co–Ce на поверхности приводит к увеличению количества ионов Co3+, которые, как считается, ответственны за каталитическую активность в окислении CO [7]. К недостаткам систем на основе оксидов кобальта относят их относительно низкую стабильность, а также невысокую селективность в процессах PROX [2, 7, 8]. Одной из причин нестабильной работы считают сильную адсорбцию молекул CO2 на ионах Co2+, препятствующую их обратному окислению в Co3+ кислородом газовой фазы или решеточным кислородом CeO2, что приводит к разрыву каталитического цикла и дезактивации катализатора [21].
Известно, что цеолиты могут способствовать стабилизации нетипичных степеней окисления переходных металлов и созданию активных центров, не характерных для оксидных систем [22–24]. В ряде работ сообщается о высокой активности катализаторов на основе цеолитов, модифицированных переходными металлами, в окислении CO кислородом при отсутствие водорода [25, 26]. Недавно мы показали [27], что катализатор на основе Co-модифицированного цеолита ZSM-5 оказывается более активным и стабильным в окислении CO по сравнению с нанесенным Co3O4. Ключевую роль в адсорбции и окислении CO на таком катализаторе играют оксокатионы кобальта [CoxOy]n+ (n = 1, 2), содержащие Co(III). Биметаллические системы на основе Cu–Ce/ZSM-5 [26] и Co–Ce/ZSM-5 [28] обладают высокой активностью в окислении CO в отсутствие водорода, значительно превосходя монометаллические аналоги. С применением различных физико-химических методов мы продемонстрировали [28], что синергизм в каталитическом действии кобальта и церия в модифицированных цеолитах обусловлен взаимодействием между оксокатионами двух металлов в каналах цеолита или даже с образованием новых Co–Ce-содержащих структур.
Цель настоящей работы – выяснить возможность использования каталитических систем на основе цеолитов ZSM-5, модифицированных кобальтом и церием, в процессе селективного окисления CO-PROX в избытке H2 и установить роль оксокатионных комплексов в этой реакции. Состав приготовленных катализаторов был выбран так, чтобы атомное отношение (Co + Ce)/Al не превышало 1. В этом случае формирование и возможное участие в катализе оксидных частиц на поверхности цеолита минимизируется. В то же время количество оксокатионных структур в катализаторах близкого состава можно варьировать путем изменения силикатного модуля исходного носителя.
С применением метода ИК-спектроскопии адсорбированных молекул, включая термо-восстановление in situ под действием CO, мы показали, что оксокатионные Co и Ce структуры проявляют высокую каталитическую активность не только по отношению к CO, но и к H2. Соблюдение баланса между активностью катализатора и селективностью окисления CO возможно за счет использования Co–Ce-цеолита ZSM-5 с отношением SiO2/Al2O3 = 55.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Исходные реагенты
Цеолиты NH4ZSM-5 (“Zeolyst”) с разным силикатным модулем (SiO2/Al2O3 = 0; 55; 30) и удельными поверхностями (425, 425 и 405 м2/г соответственно) прессовали в таблетки, которые затем измельчали. Использовали гранулы диаметром 0.4–0.8 мм. Для получения водородной формы исходный цеолит прокаливали при 550°С в токе воздуха в течение 8 ч. Тетрагидрат ацетата кобальта(II) Co(CH3COO)2 ⋅ 4H2O (х. ч., “Иреа 2000”) и гексагидрат нитрата церия(III) Ce(NO3)3 ⋅ 6H2O (99%, “Aldrich”) применяли без дополнительной очистки.
2.2. Приготовление катализаторов
Синтез монометаллических образцов Co/ZSM-5 осуществляли методом пропитки по влагоемкости. Навеску ацетата кобальта растворяли в небольшом количестве дистиллированной воды, полученным раствором пропитывали гранулы прокаленного цеолита. Сушили при комнатной температуре в течение суток, затем в печи при 120°С в течение 8 ч. После этого образцы прокаливали в токе воздуха при 450°С в течение 3 ч.
Синтез монометаллических образцов Ce/ZSM-5 проводили аналогично, но вместо ацетата кобальта использовали нитрат церия.
Для приготовления биметаллических катализаторов Co/Ce/ZSM-5 гранулы прокаленного HZSM-5 вначале пропитывали раствором нитрата церия, сушили при комнатной температуре в течение суток, затем в печи при 120°С в течение 8 ч. После этого выполняли пропитку раствором ацетата кобальта и термообработку как описано выше для получения Co/ZSM-5.
Образец 4Ce/1.7Co/Z-55 готовили по аналогичной методике, однако порядок введения металлов был обратным описанному выше: вначале пропитывали раствором ацетата кобальта, а затем – раствором нитрата церия.
2.3. Анализ образцов
2.3.1. Атомно-эмиссионная спектроскопия. Состав катализаторов определяли методом атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (АЭС) на спектрометре iCAP 6300 Duo (“Thermo Fisher Scientific”, США); результаты представлены в табл. 1. Удельную поверхность образцов измеряли на приборе Autosorb 1-C/TCD/MS (“Quantachrome”, США) по адсорбции азота при –196°С по методу БЭТ. Перед измерением образцы дегазировали в течение 3 ч при 250°С. Для измерения объема микропор использовали метод t-plot.
Таблица 1.
Состав приготовленных катализаторов
| Образец | Содержание металлов, ммоль/га | M/Al, ат.б | Ce/(Co + Ce), ат. | |
|---|---|---|---|---|
| Co | Ce | |||
| 2Ce/Z-30 | 0.00 | 0.14 | 0.14 | 1.00 |
| 2Co/Z-30 | 0.34 | 0.00 | 0.33 | 0.00 |
| 2Co/2Ce/Z-30 | 0.34 | 0.14 | 0.5 | 0.3 |
| 2Ce/Z-55 | 0.00 | 0.14 | 0.25 | 1.00 |
| 2Co/Z-55 | 0.34 | 0.00 | 0.6 | 0.00 |
| 4Ce/1.7Co/Z-55 | 0.29 | 0.29 | 1.00 | 0.5 |
| 1.7Co/4Ce/Z-55 | 0.29 | 0.29 | 1.00 | 0.5 |
| 1.7Co/2Ce/Z-55 | 0.29 | 0.14 | 0.75 | 0.33 |
| 2.5Co/2Ce/Z-55 | 0.42 | 0.14 | 1.00 | 0.25 |
| 4Co/2Ce/Z-55 | 0.68 | 0.14 | 1.4 | 0.17 |
| 2Co/1.6Ce/Z-80 | 0.34 | 0.11 | 1.1 | 0.25 |
| 2.7Co/2.1Ce/Z-80 | 0.46 | 0.15 | 1.5 | 0.25 |
2.3.2. Сканирующая (СЭМ) и просвечивающая (ПЭМ) электронная микроскопия. Исследование поверхности катализаторов методом СЭМ проводили на сканирующем электронном микроскопе JSM-6000 NeoScope (“JEOL”, Япония) со встроенным рентгеновским анализатором EX-230 для энергодисперсионного анализа (ЭДА). Изображения регистрировали в режиме высокого вакуума с ускоряющим напряжением 10–15 кВ. Режим детектирования сигнала – SEI (изображение во вторичных электронах).
Микроструктуру образцов методом ПЭМ исследовали на просвечивающем электронном микроскопе JEM-2100F/UHR (“JEOL”, Япония) с ускоряющим напряжением 200 кВ. Образцы диспергировали в этаноле ультразвуковой обработкой и наносили на медную сетку с углеродным покрытием. ЭДА и элементное картирование проводили с помощью рентгеновского спектрометра JED-2300 (“JEOL”, Япония). Межплоскостные расстояния измеряли путем Фурье-преобразования ПЭМ-изображений высокого разрешения, содержащих видимые области упорядоченных атомов. Данную процедуру осуществляли с использованием программы ImageJ [29].
2.3.3. ИК-спектроскопические исследования. Исследования методом Фурье ИК-спектроскопии диффузного отражения (ДО) выполняли на Фурье-спектрометре Инфралюм ФТ-801 (“Люмэкс-Сибирь”, Россия), снабженном приставкой ДО, в диапазоне 6000–900 см–1. ИК-спектры ДО образцов с величиной гранул 0.4–0.8 мм регистрировали в кварцевых кюветах, оснащенных отростком с оптическим окошком из фторида кальция, при комнатной температуре. Образцы подвергали предварительной термовакуумной обработке: нагревали при вакуумировании до остаточного давления 1 × 10–3 кПа до 200°C и выдерживали при этой температуре в течение 60 мин, затем поднимали температуру до 400°C и выдерживали при ней в течение 100 мин. После охлаждения закрытую кювету отсоединяли от вакуумной установки и регистрировали опорный спектр. Далее образцы снова подсоединяли к вакуумной установке и подавали в кювету определенный объем CO при измеренном давлении (для адсорбции малых количеств CO, 5–25 мкмоль/г), либо отбирали газ при равновесном давлении (0.2–0.67 кПа). Отбор CO проводили с использованием низкотемпературной ловушки из жидкого N2 для предотвращения возможного попадания примесей воды и CO2. После регистрации спектра образец вакуумировали и повторяли адсорбцию CO, переходя от меньших количеств CO к бóльшим.
2.4. Каталитические испытания
Реакцию каталитического окисления монооксида углерода осуществляли в проточном режиме в кварцевом реакторе при температурах 50–250°С и атмосферном давлении циклами нагревания–охлаждения (2–4 цикла). Порцию катализатора 250 мг (гранулы 0.4–0.8 мм) смешивали с 250 мг кварцевого песка и помещали на сетку реактора с внутренним диаметром 6 мм. Карман с термопарой располагался в слое катализатора, температуру измеряли с помощью измерителя температур “Овен” (Россия). Температуру регулировали с помощью программатора Ursamar-RK42 (Германия). Образцы предварительно прогревали в потоке Не при 450°С в течение 60 мин. Изменение температуры проводили с шагом 20°С и выдерживали при каждом значении в течение 20 мин. Точность поддержания заданной температуры составляла 1°С.
Окисление CO исследовали как в отсутствие водорода (состав исходной смеси: 1 об. % CO, 1 об. % O2, 98 об. % He), так и в его присутствии (1 об. % CO, 1 об. % O2, 98 об. % Н2). Анализ состава газовой смеси на выходе реактора осуществляли с помощью хроматографа Кристалл 2000 (“Хроматек”, Россия) с детектором по теплопроводности. Для оценки каталитической активности образцов использовали две характеристики: температуру достижения 50% конверсии CO (T50, °С) и кажущуюся скорость реакции r (моль ${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ с–1) при определенной температуре. Кажущуюся скорость реакции вычисляли по формуле:
где NCO – скорость потока CO на входе реактора (моль/с), XCO – конверсия CO, mкат – масса катализатора в реакторе. В свою очередь, конверсию CO находили по формуле:Селективность окисления CO в CO2 рассчитывали по формуле:
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Серию катализаторов приготовили согласно методике, описанной в Экспериментальной части. Состав полученных образцов указан в табл. 1. Содержание кобальта и церия, силикатный модуль использованного цеолита и порядок введения компонентов отражены в обозначении образца: например, образец 1.7Co/4Ce/Z-55 содержит 1.7 мас. % Co и 4 мас. % Ce, для приготовления применяли цеолит с отношением SiO2/Al2O3 = 55; сначала вводили церий, а затем кобальт. Образец 4Ce/1.7Co/Z-55 отличается обратным порядком введения компонентов.
3.1. Анализ катализаторов
3.1.1. Текстурные характеристики и морфология. На рис. 1 приведены микрофотографии ПЭМ биметаллического образца 2.5Co/2Ce/Z-55. На изображениях наблюдаются небольшие темные пятна, соответствующие оксидным частицам размером в несколько нанометров, расположенным на поверхности кристаллов цеолита (рис. 1а). Измеренные на изображениях высокого разрешения (рис. 1б и 1в) межплоскостные расстояния 3.2 ± 0.1 Å соответствуют кристаллографическим плоскостям (111) структуры оксида церия CeO2, а 2.9 ± 0.1 Å и 4.7 ± 0.1 Å – плоскостям (220) и (111) кристаллов оксида кобальта Co3О4. Частицы Co3O4 склонны скапливаться в определенных местах поверхности и образовывать агрегаты (рис. 1в).
Элементное картирование поверхности катализаторов выполнено методами СЭМ-ЭДА и ПЭМ-ЭДА. На рис. 2 для примера приведены СЭМ- и ПЭМ-изображения поверхности образца 2.5Co/2Ce/Z-55 и соответствующие им карты распределения элементов. Из рис. 2а–2г видно, что в масштабах одной гранулы катализатора по данным СЭМ-ЭДА кобальт (рис. 2в) и церий (рис. 2г) распределены равномерно по всей поверхности образца.
Рис. 2.
Микрофотографии СЭМ (a) и ПЭМ в режиме темного поля (д) образца 2.5Co/2Ce/Z-55 и соответствующие карты распределения элементов: Al (б), Co (в), Ce (СЭМ) (г), Al (е), Co (ж), Ce (ПЭМ) (з).

Аналогичный вывод следует также из данных ПЭМ-ЭДА (рис. 2ж, 2з), где локализацию элементов на отдельных участках поверхности можно увидеть уже на уровне индивидуального кристалла цеолита. Как видно, распределение модифицирующих добавок Co и Ce по поверхности катализатора в целом равномерное и совпадает с таковым алюминия (рис. 2е). Таким образом, метод последовательной пропитки по влагоемкости позволяет равномерно нанести металлы на поверхность катализатора и создать условия для их контакта. Небольшие локальные неоднородности, связанные, по-видимому, со скоплением оксидных частиц в некоторых местах поверхности, практически совпадают на картах кобальта и церия, что также говорит о возможности их тесного контакта.
В табл. 2 приведены текстурные характеристики образцов, полученные методом низкотемпературной адсорбции азота. Как видно из табл. 2, введение 2–4 мас. % церия в цеолиты Z-30 и Z-55 практически не приводит к изменению внутренней поверхности и объема микропор исходных носителей. Это может быть связано с тем, что только некоторая часть катионов церия занимает ионообменные позиции цеолита; остальная часть откладывается на внешней поверхности в виде оксидных наночастиц, что подтверждается данными ПЭМ. При введении 2–2.5 мас. % кобальта внутренняя поверхность и объем микропор образцов заметно сокращаются, что указывает на протекание при синтезе Co/Z обменных процессов с формированием катионов и оксокатионов кобальта в каналах цеолита. В случае биметаллических образцов, содержащих Co и Ce, уменьшение внутренней поверхности и объема микропор происходит в еще большей степени. Например, для цеолита Z-30 величина внутренней поверхности снижается в образце 2Co/2Ce/Z-30 на 46 м2/г, в то время как при введении такого же количества Co – только на 27 м2/г, что в ~1.5 раза меньше. Аналогичный эффект наблюдался ранее и для цеолита Z-55 для образцов близкого состава [28]. По всей видимости, кобальт и церий совместно находятся в каналах цеолита, формируя смешанные структуры.
Таблица 2.
Текстурные характеристики катализаторов по данным низкотемпературной адсорбции азота
| Состав | Поверхность (БЭТ), м2/г | Поверхность (внешн.), м2/г | Поверхность (внутр.), м2/г | Объем микропор, см3/г |
|---|---|---|---|---|
| HZ-30 | 417 | 19 | 398 | 0.161 |
| 2Ce/Z-30 | 418 | 23 | 395 | 0.160 |
| 2Co/Z-30 | 383 | 13 | 371 | 0.147 |
| 2Co/2Ce/Z-30 | 374 | 22 | 352 | 0.139 |
| HZ-55a | 409 | 45 | 364 | 0.153 |
| 4Ce/Z-55a | 398 | 37 | 361 | 0.152 |
| 1.7Co/Z-55a | 383 | 38 | 345 | 0.146 |
| 2.5Co/2Ce/Z-55a | 371 | 44 | 327 | 0.138 |
| HZ-80 | 457 | 37 | 419 | 0.174 |
| 2.7Co/2.1Ce/Z-80 | 475 | 29 | 446 | 0.178 |
a Данные работы [28].
Таким образом, в биметаллических образцах кобальт и церий равномерно распределены и могут находиться в тесном контакте не только на внешней поверхности, но и в каналах цеолита.
3.2. Исследование адсорбционных центров методом ИК-спектроскопии ДО адсорбированного CO
3.2.1. Сравнение моно- и биметаллических образцов на основе цеолита Z-30. На рис. 3 приведены ИК-спектры ДО образцов 2Co/Z-30 и 2Co/2Ce/Z-30 в области валентных колебаний CO после адсорбции разных количеств монооксида углерода. После адсорбции малых порций CO (до 25 мкмоль CO/г) в спектрах обоих образцов наблюдается одна интенсивная полоса в области 2208–2206 см–1, относящаяся к комплексам CO с наиболее сильными адсорбционными центрами, представленными преимущественно катионами Co2+, находящимися в ионообменных позициях цеолита [27, 28, 30, 31]. Адсорбция CO на исходном HZSM-5 и церийсодержащем цеолите не проявляется в ИК-спектрах при этих условиях [22, 28]. Повышение давления приводит к увеличению интенсивностей и уширению полос в спектрах CO, что свидетельствует о присутствии и других, более слабых, адсорбционных центров в образцах. Несмотря на кажущуюся близость спектров двух образцов на рис. 3, детальный анализ свидетельствует об изменении электронного состояния кобальта в присутствии церия. В этом можно убедиться, сравнивая разностные спектры, полученные путем вычитания спектров, записанных при адсорбции малого количества CO (25 мкмоль CO/г) из спектров, измеренных при более высоком давлении газа (рис. 3в, 3г).
Рис. 3.
ИК-спектры ДО образцов 2Co/Z-30 (а, в) и 2Co/2Ce/Z-30 (б, г): после адсорбции разных количеств CO (5, 10, 15 и 25 мкмоль/г) и равновесных давлениях СО 0.2 и 0.67 кПа (а и б) и после адсорбции CO при равновесном давлении 0.67 кПа и 25 мкмоль/г CO, и их разностные спектры (в и г).

Из рис. 3в видно, что при повышении давления CO в спектре образца 2Co/Z-30 наблюдается прирост интенсивности полосы поглощения в области 2200 см–1. Смещение максимума полосы в область более низких частот обусловлено вкладом адсорбционных центров оксокатионов кобальта [Co–O–Co]2+, которым соответствуют более низкие частоты νCO колебаний (2188–2195 см–1) [27, 28, 30, 31].
В случае церийсодержащего образца 2Co/2Ce/Z-30 (рис. 3г) максимум прироста полосы поглощения еще сильнее сдвинут в область низких частот (2192 см–1). По всей видимости, присутствие церия влияет на состав формирующихся адсорбционных центров, и наряду с оксокатионами кобальта в Co/Ce-модифицированном цеолите 2Co/2Ce/Z-30 также образуются смешанные кобальт-цериевые оксокатионы [CoxOyCe]n+, обнаруженные нами ранее в катализаторах на основе цеолита Z-55 [28]. В ИК-спектрах адсорбированного CO они проявляются в области ~2180 см–1. Для лучшего понимания состава формирующихся центров мы провели деление спектров исследованных образцов на составляющие компоненты.
3.2.2. Влияние силикатного модуля цеолита на формирование адсорбционных центров. Ранее на примере цеолита Z-55 мы показали, что спектр адсорбированного CO на Co/ZSM-5 и Co/Сe/ZSM-5 можно разложить как минимум на 4 гауссовых компоненты, соответствующие оксокатионам Co(III) (2216–2218 см–1), катионам Co2+ (2205–2206 см–1), оксокатионам Co(II) (2188–2194 см–1) и суперпозиции оксида CoO и смешанных Co/Ce-оксокатионам (2175–2180 см–1) [28].
Монометаллические образцы. На рис. 4а показано разложение спектров двух монометаллических образцов 2Co/Z-30 и 2Co/Z-55 после адсорбции CO при давлении 0.67 кПа. Интегральные интенсивности полученных компонентов представлены в табл. 3. Из приведенных данных видно, что в спектре образца 2Co/Z-30 интегральная интенсивность компоненты 2205–2206 см–1, относящейся к катионам Co2+ в ионообменных позициях цеолита, оказалась значительно выше, чем в спектре 2Co/Z-55. Повышенное содержание алюминия в каркасе цеолита с меньшим силикатным модулем обеспечивает больше ионообменных позиций, что благоприятствует стабилизации “голых” катионов Co2+ [30]. Действительно, отношение Co/Al в образцах 2Co/Z уменьшается почти в 2 раза при переходе от Z-55 к Z-30 (0.6 и 0.3 соответственно). В то же время доля оксидных частиц, проявляющихся в спектрах адсорбированного CO при 2175–2180 см–1, заметно ниже в цеолите 2Co/Z-30, чем в образце 2Co/Z-55 (рис. 4а).
Рис. 4.
ИК-спектры ДО адсорбированного CO на образцах 2Co/Z-55 и 2Co/Z-30 до (а) и после (б) восстановительной обработки путем нагревания в атмосфере CO при давлении 0.67 кПа и температуре 280°С в течение 30 мин. Все спектры сняты при комнатной температуре и давлении 0.67 кПа. Приведено разложение исходных спектров (а) на гауссовы компоненты.

Таблица 3.
Результаты разложения на гауссовы компоненты ИК-спектров моно- и биметаллических образцов в области валентных колебаний адсорбированного CO
| Образец | Площади компонентов спектров, ед. К.–М. см–1 | |||
|---|---|---|---|---|
| 2217 см–1 | 2206 см–1 | 2191 см–1 | 2178 см–1 | |
| 2Co/Z-30 | 8.4 | 107.4 | 45.3 | 8.6 |
| 2Co/Z-55 | 12.4 | 50.5 | 32.8 | 16.8 |
| 2Co/2Ce/Z-30 | 31.0 | 119.4 | 50.3 | 28.6 |
| 1.7Co/2Ce/Z-55 | 11.6 | 36.6 | 14.6 | 22.8 |
Кроме того, в образце 2Co/Z-30 с меньшим силикатным модулем интегральная интенсивность полос 2190 и 2217 см–1, отвечающих оксокатионам кобальта(II и III) также значительно выше, чем в цеолите 2Co/Z-55, что свидетельствует о формировании большего количества не только катионов, но также и оксокатионов кобальта в случае Z-30. Этот вывод подтверждают данные по восстановлению образцов под действием CO, полученные методом ИК-спектроскопии ДО in situ.
На рис. 4б приведены спектры тех же цеолитов 2Co/Z-30 и 2Co/Z-55, записанные после нагревания в атмосфере CO при температуре 280°C в течение 30 мин, вакуумирования и последующей адсорбции CO при том же давлении, что и на исходные образцы. Из рис. 4б видно, что кроме вышеупомянутой широкой полосы в районе 2205 см–1 появляются новые полосы в низкочастотной области спектра, относящиеся к бикарбонилам Co+(CO)2 (2113 и 2043 см–1) и трикарбонилам Co+(CO)3 (2137, 2089, 2080 см–1) [24, 31]. Катионы кобальта в степени окисления +1 являются продуктами восстановления оксокатионов кобальта(III) и (II):
Видно, что интенсивность полос карбонилов Co+ в спектре образца 2Co/Z-30 выше, чем в спектре 2Co/Z-55. По всей вероятности, большее количество катионов Co+, образовавшихся после восстановления первого образца, связано с большим исходным содержанием оксокатионных форм кобальта [CoxOy]n+ в этом катализаторе по сравнению с 2Co/Z-55.
Таким образом, количество катионных и оксокатионных форм кобальта увеличивается в Co-содержащих цеолитах при уменьшении отношения Si/Al.
Биметаллические образцы. На рис. 5 показаны ИК-спектры ДО двух образцов Сo/Ce-цеолитов с разным отношением Si/Al и близким содержанием модифицирующих добавок. Здесь же приведено разложение спектров на 4 гауссовых компоненты, соответствующие разным типам адсорбционных центров, по аналогии с тем, как сделано выше для монометаллических систем. Из рис. 5 и данных табл. 3 видно, что в образце 2Co/2Ce/Z-30 с более низким силикатным модулем интенсивность всех четырех компонент спектра выше, чем в более высококремнистом аналоге 1.7Co/2Ce/Z-55. Особенно заметно увеличение вклада полос 2206 и 2191 см–1, отвечающих катионам Co2+ в ионообменных позициях и оксокатионам [Сo–O–Co]2+ соответственно, что объясняется, как и в случае монометаллических образцов 2Сo-Z, бóльшим числом обменных позиций в цеолите с пониженным силикатным модулем.
Рис. 5.
ИК-спектры ДО образцов 1.7Co/2Ce/Z-55 и 2Co/2Ce/Z-30 после адсорбции CO при равновесном давлении 0.67 кПа и комнатной температуре. Показано разложение на гауссовы компоненты.

В то же время сравнение результатов разложения спектров образцов 2Co/2Ce/Z-30 и 2Co/Z-30 (табл. 3) показывает, что присутствие церия приводит к заметному росту вклада компонент 2217 и 2175–2178 см–1. Первая относится к оксокатионам Co(III) [27], а вторая – к оксиду CoO [27, 28, 30] и смешанным Co–Ce-оксокатионам [28]. Поскольку для катализаторов 2Co/Z-30 и 2Co/2Ce/Z-30 отношение M/Al cоставляет 0.3 и 0.5, т.е. значительно меньше 1 в обоих случаях, то образование большого количества оксида в них маловероятно, а значит, обе полосы 2217 и 2175–2178 см–1 отвечают оксокатионным центрам. Аналогичная картина наблюдается и в случае Сo- и Co/Ce-цеолитов Z-55 (рис. 5).
Ранее [28] мы показали, что формирование смешанных оксокатионных структур [CoxOyCe]n+ сопровождается изменением электронного состояния обоих металлов. По данным РФЭ-спектроскопии в биметаллических образцах увеличивается доля кобальта и церия в степенях окисления 3+. Таким образом, в цеолитах Co/Ce/ZSM-5 при (Co + Ce)/Al < 1 и близком содержании модифицирующих добавок доля стабилизированных в обменных позициях катионных форм металлов, включая изолированные ионы, оксокатионы и смешанные Co–Ce-структуры, возрастает при уменьшении силикатного модуля цеолита. Большее содержание оксокатионных композиций в цеолитах Z-30 может способствовать более высокой каталитической активности этих систем в окислении CO.
3.3. Каталитическое окисление моноокида углерода
Ранее [28], на примере моно- и биметаллических цеолитов Co/Ce/Z-55, мы детально исследовали зависимость активности катализаторов в реакции полного окисления CO от соотношения Co : Ce. В настоящей работе мы проверили активность этих систем в реакции CO-PROX в избытке водорода, а также проанализировали влияние силикатного модуля цеолита на активность образцов Co/Ce-Z близкого состава в полном и селективном окислении CO.
3.3.1. Реакция полного окисления CO в отсутствие водорода. В табл. 4 приведены данные тестирования моно- и биметаллсодержащих цеолитов с различным отношением SiO2/Al2O3. Видно, что активность катализаторов, в состав которых входит кобальт, увеличивается при уменьшении силикатного модуля цеолита. Например, для образцов 2Co/Z температура 50% конверсии CO снижается с 176 до 142°C при переходе от Z-55 к Z-30. Аналогично, и в биметаллических композитах близкого состава (Co/Ce ~ 3) максимальная активность наблюдается для Co/Ce-катализаторов, содержащих наибольшее количество атомов алюминия в кристаллической решетке.
Таблица 4.
Кажущиеся скорости окисления CO в смеси 1% CO, 1% О2, 98% He при 130°С (в расчете на г катализатора (r130) и на г кобальта (r130(Co)) и температуры 50%-конверсии CO (T50)
| Катализатор | Co : Ce | T50, °С | r × 107, моль ${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ с–1 |
r(Co) × 104, моль ${\text{г}}_{{{\text{Co}}}}^{{ - 1}}$ с–1 |
|---|---|---|---|---|
| 2Cе/Z-30 | – | >250 | 2.9 | – |
| 2Ce/Z-55 | – | >250 | 1.8 | – |
| 2Co/Z-30 | – | 142 | 27 | 5.3 |
| 2Co/Z-55 | – | 176 | 8.6 | 1.7 |
| 2Co/2Ce/Z-30 | 2.4 : 1 | 78 | 74 | 15 |
| 1.7Co/2Ce/Z-55a | 2 : 1 | 135 | 32 | 7.6 |
| 2.5Co/2Ce/Z-55a | 3 : 1 | 98 | 71 | 11 |
| 2Co/1.6Ce/Z-80 | 3 : 1 | 157 | 19 | 3.9 |
| 2.7Co/2.1Ce/Z-80 | 3 : 1 | 116 | 51 | 7.5 |
a Пересчитанные данные работы [28]. Прочерки во 2-м столбце (атомное отношение кобальта к церию) означают, что в составе соответствующих образцов присутствует только один металл (Co либо Ce). Прочерки в 5-м столбце (скорость реакции в расчете на 1 г кобальта) означают отсутствие кобальта в образцах.
По данным ИК-спектроскопии адсорбированного CO в образцах 2Сo/Z-30 и 2Co/2Ce/Z-30 формируется повышенное количество Co- и Co/Ce-оксокатионов по сравнению с аналогичными образцами на цеолите Z-55 (табл. 3). Поскольку именно оксокатионные комплексы, как было показано ранее [28], являются самыми активными центрами в реакции окисления CO, то увеличение доли таких структур в обменных позициях цеолитов и приводит, по-видимому, к росту конверсии CO и снижению температурного интервала на катализаторах с меньшим отношением Si/Al. Однако присутствие водорода в реакционной смеси значительно осложняет протекание реакции.
3.3.2 Селективное окисление CO в присутствии водорода (PROX). На рис. 6a приведены зависимости конверсии CO от температуры в реакции PROX на моно- и биметаллических катализаторах Co/Ce/Z-55, содержащих различные количества кобальта и церия. Видно, что в присутствии водорода зависимость конверсии CO от температуры носит экстремальный характер, проходя через максимум. Наблюдаемое снижение конверсии CO при дальнейшем повышении температуры связано с протеканием побочной реакции (II) окисления водорода. Более активные катализаторы позволяют достичь большей конверсии CO при меньшей температуре.
Рис. 6.
Конверсия CO (а) и селективность образования CO2 (б) на различных моно- и биметаллических катализаторах Co/Ce/Z-55 в зависимости от температуры.

Многократные испытания в режимах последовательного повышения и понижения температуры показали, что образцы работают достаточно стабильно. Отклонения в температурах достижения 50% конверсии CO (Т50) не превышают ±3°C в 4-х последовательных циклах. Для характеристики катализаторов использовали значения Т50 и кажущиеся скорости реакции окисления CO, измеренные при температуре 130°С, которые были достигнуты в ходе первого цикла нагревания. Для сравнения образцов, отличающихся содержанием введенных металлов, значения скорости были отнесены к массовому содержанию в них кобальта (r(Co)) (табл. 5).
Таблица 5.
Кажущиеся скорости окисления CO в смеси 1% CO, 1% О2, 49% H2, 49% Hе при 130°С (в расчете на г катализатора (r130) и на г кобальта (r130(Co)) и температуры достижения 50% (T50) и максимальной конверсии CO
| Катализатор | Co : Ce | Макс. конверсия CO (T,°C) | T50, °C |
r × 107, моль ${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ с–1 |
r(Co) × 104, моль ${\text{г}}_{{{\text{Co}}}}^{{ - 1}}$ с–1 |
|---|---|---|---|---|---|
| 2Co/Z-30 | – | 77% (230°С) | 194 | 7.4 | 1.5 |
| 2Co/2Ce/Z-30 | 2.4 : 1 | 93% (210°С) | 148 | 28 | 5.6 |
| 2Ce/Z-55 | – | 32% (310°С) | – | 1.0 | 0.5 |
| 2Co/Z-55 | – | 73% (250°С) | 211 | 2.5 | 1.4 |
| 4Ce/1.7Co/Z-55 | 1 : 1 | 72% (250°С) | 200 | 6.0 | 1.2 |
| 1.7Co/4Ce/Z-55 | 1 : 1 | 76% (230°С) | 178 | 6.4 | 1.5 |
| 1.7Co/2Ce/Z-55 | 2 : 1 | 86% (230°С) | 168 | 11 | 2.5 |
| 2.5Co/2Ce/Z-55 | 3 : 1 | 95% (200°С) | 136 | 33 | 5.2 |
| 4Co/2Ce/Z-55 | 4.8 : 1 | 95% (190°С) | 136 | 32 | 3.2 |
| 2Co/1.6Ce/Z-80 | 3 : 1 | 82% (210°С) | 161 | 19 | 3.8 |
| 2.7Co/2.1Ce/Z-80 | 3 : 1 | 95% (190°С) | 141 | 27 | 4.0 |
Прочерки во 2-м столбце (атомное отношение кобальта к церию) означают, что в составе соответствующих образцов присутствует только один металл (Co либо Ce). Прочерк в 4-м столбце (температура 50% конверсии) означает, что на соответствующем катализаторе конверсия 50% в условиях эксперимента не достигается.
Как видно из приведенных данных, монометаллический церийсодержащий катализатор 2Ce/Z-55 малоактивен: максимальная конверсия CO на нем не превышает 32% при 310°C. На монометаллическом образце 2Co/Z-55 значение этого показателя достигает 73% уже при 250°C. Совместное введение церия и кобальта приводит к существенному возрастанию каталитической активности, то есть наблюдается синергизм действия двух металлов. Увеличение доли кобальта с 1.7 до 2.5% при одинаковом содержании церия (2 мас. %) сопровождается, как видно из рис. 6 и данных табл. 5, ростом максимальной конверсии CO и снижением температуры ее достижения. Однако дальнейшее повышение количества Co не оказывает почти никакого эффекта. Наибольшая кажущаяся скорость окисления CO отнесенная на 1 г Co (r(Co)) наблюдается в случае образца 2.5Co/2Ce/Z-55 (5.2 × 10–4 моль ${\text{г}}_{{{\text{Co}}}}^{{ - 1}}$ с–1); при увеличении содержания кобальта до 4% величина r(Co) падает до 3.2 × 10–4 моль ${\text{г}}_{{{\text{Co}}}}^{{ - 1}}$ с–1.
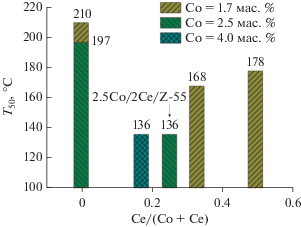
Зависимость активности катализаторов от соотношения в них металлов носит экстремальный характер. Это наглядно видно из рис. 7, где приведены температуры 50% конверсии CO для ряда образцов Co/Ce/Z-55 с суммарным содержанием металлов M/Al ≤ 1 и разным мольным отношением Ce/(Co + Ce). Наименьшие значения T50 в реакции CO-PROX наблюдаются для катализаторов, в которых отношение Ce/(Co + Ce), как и в случае полного окисления [28], близко к 0.25 (т.е. Co : Ce = 3 : 1). Таким образом, для окисления CO в присутствии водорода и в его отсутствие необходимо оптимальное соотношение Co и Ce в катализаторах на основе цеолита ZSM-5, способствующее формированию активных центров.
Рис. 7.
Температуры 50% конверсии CO в присутствии водорода (T50) на Сo/Ce/Z-55 в зависимости от состава катализатора.
Зависимость селективности реакции CO-PROX от температуры для наиболее активных катализаторов Co/Ce/Z-55 приведена на рис. 6б. Видно, что 100%-селективность образования CO2, наблюдаемая ниже 150°С, начинает падать при повышении температуры. Более сильное снижение происходит в образцах, где содержание кобальта выше при одинаковом количестве церия (4Co/2Ce и 2Co/2Ce соответственно). Аналогичная закономерность наблюдалась авторами работы [8] в ряду оксидных систем 1% CoOx/CeO2–2% CoOx/CeO2–10% CoOx/CeO2.
Таким образом, катализатор состава 2.5Co/2Ce в исследованной серии цеолитов Z-55 оказывается наилучшим с точки зрения баланса активности и селективности в реакции CO-PROX, как и в условиях полного окисления [28]. Представляет интерес проследить, как изменится активность катализаторов близкого к оптимальному состава, но полученных на цеолитах с различным силикатным модулем.
Из табл. 5 видно, что при уменьшении отношения SiO2/Al2O3 активность Co-содержащих катализаторов, как и случае реакции в отсутствие водорода (табл. 4), увеличивается. Например, для монометаллических образцов 2Co/Z температура 50% конверсии CO снижается с 211 до 194°С при переходе от цеолита Z-55 к Z-30. Аналогично, и в биметаллических композициях близкого к оптимальному состава (Co/Ce ~ 3) максимальная активность наблюдается у катализаторов, в кристаллической решетке которых находится больше атомов алюминия, что способствует, как показано выше, увеличению количества оксокатионных комплексов металлов. Значения кажущихся скоростей r(Co) возрастают в ряду 2.7Co/2.1Ce/Z-80 < < 2.5Co/2Ce/Z-55 < 2Co/2Ce/Z-30.
3.3.3. Сравнение реакций полного и селективного окисления CO на Co/Ce-цеолитах. Температуры достижения 50% конверсии повышаются при наличии в газовой смеси водорода практически для всех исследованных Сo/Ce-цеолитов. В то же время степень влияния водорода на свойства катализаторов близкого состава, но полученных на разных цеолитах, оказывается различной.
Из данных табл. 4 и 5 видно, что образец 2Co/Z-30 демонстрирует повышенную активность и пониженные значения T50 по сравнению с 2Co/Z-55 вне зависимости от условий. Наличие водорода приводит к росту T50, при этом более активный катализатор 2Co/Z-30 заметнее теряет свою активность в присутствии H2 (разность значений T50 для реакций полного и селективного окисления CO составляет 52 и 35°С для 2Co/Z-30 и 2Co/Z-55 соответственно).
Аналогичная картина наблюдается и для биметалических Co/Ce-цеолитов с близким содержанием металлов ~2Co/2Ce/Z, но с разным силикатным модулем. Из табл. 4 и 5 видно, что в отсутствие водорода Co/Ce-катализатор на основе цеолита Z-30 существенно превосходит по активности аналогичный образец на Z-80: значения T50 различаются почти на 80°С (78 и 157°С соответственно). В то же время при введении Н2 разница в значениях T50 на двух катализаторах не превышает 15°С. Похожий эффект наблюдается и в другой паре катализаторов с близким содержанием металлов – 2.7Co/2.1Ce/Z-80 и 2.5Co/2Ce/Z-55 (табл. 4, 5).
На рис. 8 приведены температурные зависимости конверсии CO и селективности образования CO2 в присутствии Co/Ce-катализаторов на основе цеолитов Z-30 и Z-80. Видно, что во всем диапазоне температур образец с меньшим отношением Si/Al оказывается более активным, однако селективность целевой реакции ниже. Если на Co/Ce/Z-80 100% селективность образования CO2 наблюдается во всем диапазоне температур вплоть до 170°С, то на катализаторе Co/Ce/Z-30 падение селективности целевой реакции начинается уже при 130°С.
Рис. 8.
Конверсия CO (сплошная линия) и селективность образования CO2 (пунктирная линия) на катализаторах 2Co/1.6Ce/Z-80 и 2Co/2Ce/Z-30 в зависимости от температуры.

Схожесть закономерностей окисления CO в присутствии и в отсутствие водорода (экстремальная зависимость активности Co/Ce-цеолитов от соотношения металлов на цеолите Z-55, увеличение активности с уменьшением отношения Si/Al), а также данные спектральных исследований свидетельствует в пользу того, что в реакции CO-PROX главную роль играют те же активные центры, что и обнаруженные нами ранее [28] в реакции полного окисления CO на Co/Ce/ZSM-5. В [28] было показано, что в каналах цеолита формируются оксокатионные структуры, в которых кобальт и церий находятся в тесном контакте и стабилизируются в степенях окисления +3. В качестве наиболее простой модели может быть предложен биядерный комплекс [Co–(μ-O)2–Ce]2+. Однако по данным ИК-спектроскопии ДО адсорбированного CO при восстановлении in situ самый активный катализатор Co/Ce/Z с атомным соотношением Co : Ce = 3 : 1 содержит одновременно два типа мостиковых структур: Co–O–Co и Co–O–Ce [28]. Они могут быть расположены поблизости или даже входить в состав активных центров более сложного состава, например, [Co2CeO3]2+ или [Co3CeO4]2+, включающих Co(II, III) и Ce(III). Подвижный атом кислорода, содержащийся в этих структурах, может участвовать в процессах окисления по механизму Марс-ван Кревелена.
Таким образом, наблюдаемый эффект синергизма Co и Ce в окислении CO на биметаллических катализаторах на основе цеолита ZSM-5 связан с формированием в каналах цеолита смешанных Co(III)–Ce(III)-оксокатионов. Однако в присутствии H2 образующиеся оксокатионы (в том числе – смешанные) обладают высокой активностью не только в целевой реакции окисления CO, но и в побочной реакции окисления водорода. Образующаяся при этом вода, даже в небольших количествах, может приводить к отравлению катализатора и снижать его активность. Кроме того, уменьшение активности может быть связано с конкурирующей адсорбцией водорода, находящегося в избытке и блокирующего активные центры для адсорбции CO. По данным [2] окисление водорода кислородом в отсутствие CO начинается на оксидах кобальта при более низкой температуре, чем в реакционных смесях в присутствии небольших количеств CO. Из-за конкуренции H2 и CO за ограниченное количество O2, доступного в условиях PROX, низкой концентрации CO при высоких конверсиях, различий в энергиях активации и того факта, что H2 находится в большом избытке, селективность по CO2 снижается по мере ускорения окисления H2.
Кроме того, известно, что при взаимодействии молекулярного водорода с катионами Co2+, стабилизированными в обменных позициях цеолита, происходит сильная активация Н–Н-связи, которая может приводить даже к диссоциативной адсорбции водорода [32, 33], являющейся, возможно, одной из причин дезактивации Co-содержащих цеолитов. В наибольшей степени влияние этого фактора должно проявляться на цеолитах Z-30, где содержание обменных катионов Co2+ по данным ИК-спектроскопии ДО максимальное (см. раздел 3.2.2). С другой стороны, согласно этим данным количество оксокатионых комплексов, формирующихся в катализаторах Co/Ce/Z близкого состава, уменьшается при увеличении силикатного модуля (Si/Al) исходного цеолита, а доля оксидных частиц на их поверхности немного увеличивается. При этом катализаторы на основе наиболее высококремнистых цеолитов Co/Ce/Z-80 проявляют значительно меньшую активность в окислении CO, чем аналогичные композиты на основе Z-55 и Z-30 (табл. 4). В то же время активность Co/Ce/Z-80 катализаторов почти не меняется при введении водорода в реакционную среду. В силу меньшей активности оксидных систем в окислении CO они не взаимодействуют и с водородом при температурах ниже 170°С. По данным [13] максимальная конверсия CO в присутствии H2 на оксидных катализаторах 1–7%CoO/CeO2 достигает только 67–84% при 230–240°С. Напротив, на полученных в настоящей работе образцах 2.5Co/2Ce/ZSM-5, в которых основными активными центрами являются оксокатионные комплексы металлов, наибольшее значение конверсии CO доходит до 95% при 190–200°С.
4. ЗАКЛЮЧЕНИЕ
Серия моно- и биметаллических катализаторов на основе цеолитов ZSM-5 (SiO2/Al2O3 = 80, 55, 30), модифицированных кобальтом и церием, была протестирована в окислении CO и реакции CO-PROX в избытке водорода. Синергизм в каталитическом действии Сo–Ce-цеолитов проявляется в обоих процессах окисления. Наибольшей активностью обладают катализаторы, в которых мольное соотношение Co и Ce близко к 3, что соответствует наименьшей T50 и наибольшей наблюдаемой скорости реакции, а при окислении в присутствии H2 – максимальной достигаемой конверсии. С применением ИК-спектроскопии ДО адсорбированного CO показано, что ключевую роль в реакциях окисления в отсутствие и в присутствии водорода играют одни и те же активные центры, а именно, оксокатионы кобальта и смешанные оксокатионы Co и Ce, расположенные в обменных позициях цеолита. В то же время оказалось, что эти же оксокатионные структуры проявляют активность и в побочной реакции окисления водорода. Использование цеолита с низким силикатным модулем позволяет получить более активный катализатор за счет формирования большего числа оксокатионов, однако селективность окисления при этом снижается. Соблюдение баланса между высокой активностью катализатора и селективностью окисления возможно за счет использования цеолита с промежуточным значением силикатного модуля.
Список литературы
Jing P., Gong X., Liu B., Zhang J. // Catal. Sci. Technol. 2020. V. 10. P. 919.
Lukashuk L., Föttinger K., Kolar E., Rameshan C., Teschner D., Hävecker M., Knop-Gericke A., Yigit N., Li H., McDermott E., Stöger-Pollach M., Rupprechter G. // J. Catal. 2016. V. 344. P. 1.
Liu K., Wang A., Zhang T. // ACS Catal. 2012. V. 2. P. 165.
Потёмкин Д.И., Конищева М.В., Задесенец А.В., Снытников П.В., Филатов Е.Ю., Коренев С.В., Собянин В.А. // Кинетика и катализ. 2018. Т. 59. № 4. С. 499.
Pereira J.M., Ciotti L., Vaz J.M., Spinacé E.V. // Mat. Res. 2018. V. 21. e20170756.
Zlotea C., Oumellal Y., Provost K., Morfin F., Piccolo L. // Appl. Catal. B: Environ. 2018. V. 237. P. 1059.
Gu C., Li Y., Lan J., Feng S. // React. Kinet. Mech. Catal. 2020. V. 129. P. 135.
Choi Y.I., Yoon H.J., Kim S.K., Sohn Y. // Appl. Catal. A: General. 2016. V. 519. P. 56.
Gawade P., Bayram B., Alexander A.-M.C., Ozkan U.S. // Appl. Catal. B: Environ. 2012. V. 128. P. 21.
Bao T., Zhao Z., Dai Y., Lin X., Jin R., Wang G., Muhammad T. // Appl. Catal. B: Environ. 2012. V. 119–120. P. 62.
Cwele T., Mahadevaiah N., Singh S., Friedrich H.B. // Appl. Catal. B: Environ. 2016. V. 182. P. 1.
Nyathi T.M., Fischer N., York A.P.E., Morgan D.J., Hutchings G.J., Gibson E.K., Wells P.P., Catlow C.R.A., Claeys M. // ACS Catal. 2019. V. 9. P. 7166.
Konsolakis M., Lykaki M. // Catalysts. 2020. V. 10. P. 160.
Guo X., Qiu Z., Mao J., Zhou R. // Phys. Chem. Chem. Phys. 2018. V. 20. P. 25983.
Фирсова А.А., Хоменко Т.И., Ильичев А.Н., Корчак В.Н. // Кинетика и катализ. 2008. Т. 49. № 5. С. 713.
Морозова О.С., Фирсова А.А., Тюленин Ю.П., Воробьева Г.А., Леонов А.В. // Кинетика и катализ. 2020. Т. 61. № 5. С. 741.
Ильичев А.Н., Быховский М.Я., Фаттахова З.Т., Шашкин Д.П., Корчак В.Н. // Кинетика и катализ. 2021. Т. 62. № 1. С. 44.
Nguyen L., Zhang S., Yoon S.J., Tao F. // ChemCatChem. 2015. V. 7. P. 2346.
Liu W., Flytzani-Stephanopoulos M. // Chem. Eng. J., Biochem. Eng. J. 1996. V. 64. P. 283.
Bae C., Ko J., Kim D. // Catal. Commun. 2005. V. 6. P. 507.
Guo Q., Chen S., Liu Y., Wang Y. // Chem. Eng. J. 2010. V. 165. P. 846.
Шилина М.И., Удалова О.В., Невская С.М. // Кинетика и катализ. 2013. Т. 54. № 6. С. 731.
Shilina M.I., Vasilevskii G.Yu., Rostovshchikova T.N., Murzin V.Yu. // Dalton Trans. 2015. V. 44. P. 13282.
Oda A., Mamenari Y., Ohkubo T., Kuroda Y. // J. Phys. Chem. C. 2019. V. 123. P. 17842.
Tkachenko O., Greish A., Kucherov A., Weston K., Tsybulevski A., Kustov L. // Appl. Catal. B: Environ. 2015. V. 179. P. 521.
Bin F., Wei X., Li B., Hui K. // Appl. Catal. B: Environ. 2015. V. 162. P. 282.
Shilina M., Rostovshchikova T., Nikolaev S., Udalova O. // Mat. Chem. Phys. 2019. V. 223. P. 287.
Shilina M., Udalova O., Krotova I., Ivanin I., Boichenko A. // ChemCatChem. 2020. V. 12. P. 2556.
Abramoff M., Magalhaes P., Ram S. // Biophot. Int. 2004. V. 11. P. 36.
Gora-Marek K., Gil B., Sliwa M., Datka J. // Appl. Catal. A: General. 2007. V. 330. P. 33.
Hadjiivanov K., Tsyntsarski B., Venkov Tz., Klissurski D., Daturi M., Saussey J., Lavalley J.-C. // Phys. Chem. Chem. Phys. 2003. V. 5. P. 1695.
Kazansky V.B. // J. Catal. 2003. V. 216. P. 192.
Казанский В.Б. // Кинетика и катализ. 2014. Т. 55. № 4. С. 517.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ



