Кинетика и катализ, 2021, T. 62, № 6, стр. 706-713
Роль водорода в реакциях синтеза аммиака и метанола
В. Н. Меньшов a, *, Л. А. Тубин a
a ООО “НИАП”
301670 Тульская обл., Новомосковск, ул. Кирова, 11, Россия
* E-mail: vnmenshov@gmail.com
Поступила в редакцию 22.11.2020
После доработки 22.07.2021
Принята к публикации 23.07.2021
Аннотация
Проанализированы публикации, посвященные механизмам синтеза аммиака на железном катализаторе
и метанола на медь–цинк-алюминиевом катализаторе. На основе анализа энергетического
баланса отдельных стадий реакций предложена гипотеза, согласно которой водород является
источником энергии, необходимой для хемосорбции других реагентов. При синтезе аммиака
это реализуется через образование поверхностных гидридов железа, а при синтезе метанола
– поверхностных гидридов цинка. Показана энергетическая диаграмма, где на стадии диссоциации
фрагменты адсорбированной молекулы азота получают дополнительную энергию в результате
формирования гидрида железа, что обеспечивает разрыв связи в молекуле азота. Предложена
схема синтеза метанола, согласно которой медная и оксидноцинковая поверхности катализатора
проявляют себя как самостоятельные фазы, синтез протекает на медной поверхности, а
промежуточная стадия окисления СО до СО2 – на оксидноцинковой и медной одновременно. Рассмотрен механизм превращения СО2 в метанол, включающий стадии посадки его на хемосорбированный на медной поверхности
водород, образования формиата, гидрирования формиата до муравьиной кислоты, расщепления
муравьиной кислоты на гидроксил и формил с дальнейшим гидрированием до метанола. При
этом молекулы СО2 перемещаются с оксидноцинковой поверхности на медную, а молекулы Н2О – в обратном направлении. Гетерогенный катализ рассматривается с позиций потенциальной
теории адсорбции, в рамках которой предложены кинетические уравнения синтеза аммиака
и метанола. Целью работы является уточнение механизма рассматриваемых процессов.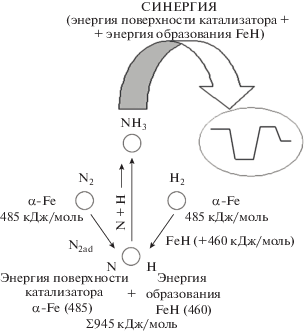
ВВЕДЕНИЕ
В работе авторов [1] представлен энергетический баланс диссоциативной хемосорбции молекулы азота на поверхности железного катализатора, который дополняет механизм реакции синтеза аммиака и позволяет по-новому оценить роль водорода в этой реакции.
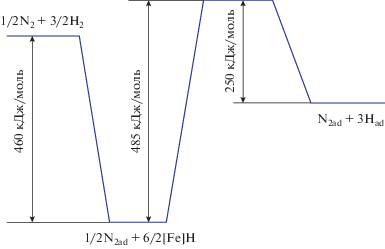
Суть изложенного материала сформулирована в виде энергетической диаграммы диссоциативной хемосорбции молекул азота и водорода на железном катализаторе, которая представлена на рис. 1.
Из энергетической диаграммы (рис. 1) видно, что свободной энергии активного центра α-Fe (460 кДж/моль) для диссоциации молекулы азота недостаточно. В работе [2] были выведены значения для прочности химической связи (550 кДж/моль) между металлом и азотом на поверхности Fe(100) и Fe(111), что подтверждает порядок рассчитанной нами свободной энергии поверхности. На стадии диссоциации реакционные фрагменты адсорбированной молекулы азота дополнительно получают энергию от адсорбированной системы за счет образования гидрида железа (порядка 460 кДж/моль), преодолевая активационный барьер разрыва связи в молекуле азота. Диссоциативная хемосорбция азота была изложена авторами [3] в виде следующей последовательности стадий: ${{{\text{N}}}_{2}} \rightleftarrows {{{\text{N}}}_{{2{\text{ad}}}}} \to 2{{{\text{N}}}_{{{\text{ad}}}}},$ т.е. “прямой” механизм ${{{\text{N}}}_{2}} \to 2{{{\text{N}}}_{{{\text{ad}}}}}$ представляется маловероятным, что подтверждается энергетической диаграммой.
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ ПО СИНТЕЗУ АММИАКА
Гетерогенный катализ на неоднородной поверхности рассматривается с позиций потенциальной теории адсорбции, в рамках которой предложено кинетическое уравнение [4, 5]:
где k – константа скорости процесса; b – постоянная, изменяющаяся с температурой; t – время контактирования; $Y = \frac{X}{{{{X}_{{\text{р}}}} - X}}~$, X и Xp – соответственно текущая и равновесная концентрации аммиака или метанола в прореагировавшем газе, об. %.Для синтеза аммиака параметр А = 0, и интегральная форма уравнения (1) имеет вид:
(2)
$X = {{X}_{{\text{р}}}}\frac{1}{b}\frac{{\ln \left( {bkt + \exp \left( {b{{Y}_{0}}} \right)} \right)}}{{1 + \frac{1}{b}\ln \left( {bkt + \exp \left( {b{{Y}_{0}}} \right)} \right)}},$Время контактирования, вычисляемое для рабочих условий в реакторе, с:
(5)
$t = {{E}_{0}}\frac{{3600}}{{{{V}_{{{\text{vol}}}}}}}\frac{P}{{{{P}_{0}}}}\frac{{{{T}_{0}}}}{T}~,$На рис. 2 и 3 приведены кривые, рассчитанные по уравнению (1), и точки, характеризующие опытные данные, для широкого диапазона изменения условий синтеза аммиака.
Рис. 2.
Зависимость концентрации аммиака в прореагировавшем газе X1 от температуры при объемной скорости азото-водородной смеси 3 × 104 ч–1, давлении 30 МПа и различном составе (мольном отношении H2 : N2) смеси: 1 : 3 (1); 1 : 1 (2); 2 : 1 (3); 10 : 1 (4); 7 : 1 (5); 5 : 1 (6); 3 : 1 (7).

Рис. 3.
Зависимость концентрации аммиака в прореагировавшем газе X1 от его концентрации в исходном газе X0 при объемной скорости азото-водородной смеси 3 × 104 ч–1, давлении 30 МПа и различной температуре: 350 (1), 385 (2), 400 (3), 425 (4), 450 (5), 475 (6), 500 (7), 525 (8) и 550°С (9).

Как видно из рис. 2 и 3, опытные и расчетные значения по содержанию аммиака в прореагировавшем газе хорошо согласуются. Следовательно, уравнение (1) применимо в широких пределах изменений технологических параметров. Температура процесса учитывается константами k и b, а давление – равновесной концентрацией аммиака. Исследования синтеза аммиака проводили на установке проточного типа. Применяли гранулированный железный катализатор марки СА-1 со средним ситовым диаметром 0.75 мм.
Кинетическое уравнение (1) использовали для расчета температурного режима в насадке промышленной колонны синтеза аммиака. Рассчитанные температуры в катализаторных коробках с помощью как уравнения (1), так и уравнения Темкина–Пыжова, удовлетворительно согласуются с данными, полученными промерами этих температур применением термопары в промышленных условиях.
Логичным будет продолжение работы по уточнению влияния водорода в процессе синтеза метанола на катализаторе Cu/ZnO/Al2O3.
НЕКОТОРЫЕ ЭКСПЕРИМЕНТАЛЬНЫЕ ОСОБЕННОСТИ СИНТЕЗА МЕТАНОЛА
В промышленных условиях метанол производят из нестехиометрической смеси водорода, диоксида углерода и окиси углерода при давлении 50–100 бар и температуре 500–550 К с использованием катализатора Cu/ZnO/Al2O3 марки KATALKO 51-8 фирмы “Klariant” [6, 7].
Водород и оксиды углерода, содержащиеся в синтез-газе, вступают в следующие основные обратимые химические реакции:
(I)
$\begin{gathered} {\text{CO}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}} \rightleftarrows {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}, \\ \Delta Н = --{\kern 1pt} 90.7\,\,{\text{кДж/моль}}, \\ \end{gathered} $(II)
$\begin{gathered} {\text{СO}} + {\text{ }}{{{\text{Н}}}_{{\text{2}}}}{\text{O}} \rightleftarrows {\text{С}}{{{\text{O}}}_{2}} + {{{\text{Н}}}_{{2~}}}, \\ \Delta Н = --49.8{\text{ кДж/моль}}, \\ \end{gathered} $(III)
$\begin{gathered} {\text{С}}{{{\text{О}}}_{2}} + {\text{ }}3{{{\text{Н}}}_{2}} \rightleftarrows {\text{С}}{{{\text{H}}}_{3}}{\text{OH}} + {{{\text{Н}}}_{2}}{\text{O}},~ \\ \Delta Н = --40.9{\text{ кДж/моль}}. \\ \end{gathered} $Термодинамическое равновесие диктует проведение процесса с низкой конверсией за проход и большой кратностью циркуляции реакционной смеси. Реакция сильно экзотермична, поэтому максимальной конверсия будет при низких температурах и высоких давлениях. Оптимальное стехиометрическое соотношение компонентов синтез-газа для синтеза метанола достигается при М = 2. Модуль М определяется через концентрации компонентов реакционной смеси следующим образом: М = ([Н2] – [СО2])/([СО] + [СО2]). Вместе с тем, модуль М не зависит от равновесия реакции паровой конверсии СО (уравнение (II)), и поэтому его не следует использовать для описания реакционной способности синтез-газа. Для этой цели применимо соотношение СО/СО2.
Эксперименты по изотопному обмену и другие исследования показывают, что основным источником углерода для образования метанола, полученного из синтез-газа на Cu/ZnO/Al2O3-катализаторе, является СО2, и по этому вопросу достигнут консенсус [6, 8–10]. Однако, несмотря на большое количество работ по каталитическому гидрированию СО2 в метанол, механизм реакции на молекулярном уровне до сих пор остается спорным.
Проанализируем влияние водорода на процесс синтеза метанола из СО2, СО, Н2 на Cu/ZnO/Al2O3-катализаторе. Катализатор производится как однородная смесь оксидов меди, цинка, алюминия и перед вводом в эксплуатацию подвергается восстановлению, после которого твердыми фазами становятся металлическая Cu, ZnO и Al2O3. Общепризнано, что металлическая медь представляет собой активную фазу в гидрировании СО2 [6, 8, 9]. При деформации кристаллов на стадии приготовления и восстановления катализатора формируется его поверхностная система. Свободная энергия поверхности YS связана с энергией когезии твердого тела, Hcoh, и с числом связей между атомом и его ближайшими соседями, которые необходимо разорвать для образования поверхности [7]:
где Zs – число недостающих ближайших соседей у поверхностного атома; Z – координационное число объемного атома; Ns – плотность атомов на поверхности.С использованием имеющихся данных по энергии когезии кристаллической меди, равной 387 кДж/моль, и типичных для гранецентрированной кубической (ГЦК) решетки значений (Zs/Z) и Ns находим, что свободная энергия поверхности меди в катализаторе равна порядка 422 кДж/моль.
Рассмотрим процесс диссоциации Н2 на Cu-поверхности катализатора. Авторы [11] утверждают, что молекулярно адсорбированное состояние не существует для молекулы Н2 на чистых поверхностях меди и никеля. Энергия диссоциации молекулы водорода составляет порядка 435–460 кДж/моль. Свободная энергия поверхности медного компонента катализатора (422 кДж/моль) близка к энергии диссоциации молекулы водорода. При анализе вариантов дополнительного источника энергии на поверхности катализатора можно предположить, что одним из них способен быть оксид цинка, который может выступать в качестве промотора меди. Свободная энергия поверхности кристалла оксида цинка, при энергии когезии порядка 400 кДж/моль, достигает более 360 кДж/моль, что вполне компенсирует дефицит энергии для диссоциации молекулы водорода на поверхности медной фазы катализатора:
При адсорбции молекулы СО на активные центры поверхности медного компонента катализатора может проходить его гидрирование по реакции (I) до формила НСО (энергия связи составляет более 75 кДж/моль) и далее через формальдегид до метанола.
Однако параллельно с синтезом метанола протекает процесс паровой конверсии CO на поверхности катализатора. Эксперименты по изотопному обмену [6] показали, что метанол синтезируется главным образом из СО2, произведенного по реакции паровой конверсии СО и, соответственно, роль СО в процессе изменяется.
Свободные энергии поверхности компонентов катализатора меди и оксида цинка равновелики, они могут проявлять себя как самостоятельные фазы. Поэтому допускается адсорбция молекул реагентов на разных фазах поверхности катализатора. Дополнительным источником энергии на поверхности оксида цинка может выступать энергия связи гидрида цинка, а также медная составляющая поверхности катализатора в качестве промотора оксида цинка.
Понимание того, как создается активный центр на Cu/ZnO/Al2O3, является ключом для разработки активных и селективных каталитических систем. Возможность водорода адсорбироваться на разных компонентах катализатора позволяет молекулам СО и СО2 взаимодействовать с ним и другими адсорбированными образованиями как на Cu-, так и на Zn-поверхности. Базовые плоскости кристалла оксида цинка (структура вюрцита) полярны. Плоскости (0001) соответствует поверхность, ограниченная катионами цинка (Zn–ZnO), плоскости (0001*) – поверхность, ограниченная анионами кислорода (O–ZnO). В результате адсорбции и диссоциации молекулы водорода на поверхности оксида цинка (Zn–ZnO) формируется гидрид цинка, средняя энергия связи которого составляет 263 кДж/моль. При адсорбции СО2 на ZnO-поверхность создаются условия для взаимодействия с водородом и протекания обратной реакции паровой конверсии СО с образованием воды:
(V)
${\text{C}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{2}} = {\text{CO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.~~~~$Исследование адсорбции воды на поверхности ZnO различными методами показало, что часть молекул воды находится непосредственно в форме Н2О, часть – в диссоциативной форме [12, 13]. При адсорбции молекулы СО на ZnO-поверхность, где имеются адсорбированные молекулы Н2О, возможна прямая реакция паровой конверсии СО по окислительно-восстановительному механизму. Таким образом, фиксируется, что ZnO-поверхность катализатора располагает избытком свободной энергии для протекания на ней реакции паровой конверсии СО параллельно с паровой конверсией СО и синтезом метанола на Cu-поверхности. В результате протекания трех процессов одновременно появляется избыток воды в системе, которая смещает химическое равновесие в сторону увеличения образования СО2. Вновь образованная молекула СО2 по реакции (II) десорбируется с ZnO-поверхности (энергия десорбции – 15 кДж/моль) и затем адсорбируется на Cu-поверхность, где взаимодействует с поверхностным атомом водорода, превращаясь в метанол по реакции (III). Источником кислорода в метаноле служит СО2, образующийся из СО [14]. Известно, что на атомно-гладких плоскостях Cu(111) u Cu(100) характер адсорбции воды недиссоциативный. Энергия адсорбции недиссоциированной Н2О на Сu-поверхности не превышает 34 кДж/моль, что делает возможным ее десорбцию с последующей адсорбцией на ZnO-поверхность c сохранением ее молекулярной формы [15]. Кроме того, не исключается поверхностная диффузия воды с образованием водно-молекулярных ассоциатов из нескольких молекул воды. Экспериментальные оценки энергетического барьера поверхностной диффузии воды для металлов составляют от 5 до 20 кДж/моль. Необходимо подчеркнуть особенность процесса паровой конверсии СО. Реакцию осуществляют, как правило, с использованием нестехиометрической смеси, и при избытке водяного пара побочные реакции практически не протекают. Вероятно поэтому процесс (II) идет на относительно “свободной от других реакций” поверхности оксида цинка. Молекула CO2, которая десорбируется с ZnO на освободившиеся активные центры Сu-поверхности, создает замкнутый цикл обмена с молекулой воды в процессе паровой конверсии СО. Это также дает основание заключить, что бóльшая часть молекул СО превращается в СО2 на ZnO-поверхности и, возможно, подтверждает причину неучастия углеродосодержащих промежуточных соединений в паровой конверсии СО. Напрашивается идея рассматривать протекание процесса синтеза метанола из СО, СО2 и Н2 на Сu/ZnO/Al2O3-катализаторе по уравнению (I) в две стадии последовательно по СО2: реакция (II) на ZnO- и Cu-поверхностях и реакция (III) на Cu-поверхности.
ОБСУЖДЕНИЕ РАССМОТРЕННЫХ ВАРИАНТОВ
В результате изложенного представляется необходимым ввести в схему механизма синтеза метанола на Cu/ZnO/Al2O3-катализаторе стадии реакции паровой конверсии СО на оксиде цинка:
(VI)
${{{\text{Н}}}_{2}} + {\text{ }}\left[ {{\text{ZnO}}} \right] \rightleftarrows {{{\text{H}}}_{2}}\left[ {{\text{ZnO}}} \right],$(VII1)
${\text{C}}{{{\text{O}}}_{2}} + \left[ {{\text{ZnO}}} \right] \rightleftarrows {\text{C}}{{{\text{O}}}_{2}}\left[ {{\text{ZnO}}} \right],$(VIII)
$\begin{gathered} {\text{CO}}\left[ {{\text{ZnO}}} \right] + {{{\text{H}}}_{{\text{2}}}}{\text{О}}\left[ {{\text{ZnO}}} \right] \rightleftarrows \\ \rightleftarrows {\text{C}}{{{\text{O}}}_{2}}\left[ {{\text{ZnO}}} \right] + {{{\text{H}}}_{2}}\left[ {{\text{ZnO}}} \right], \\ \end{gathered} $(IX)
${\text{CO}} + \left[ {{\text{Cu}}} \right] \rightleftarrows {\text{CO}}\left[ {{\text{Cu}}} \right],$(X)
${\text{CO}}\left[ {{\text{Cu}}} \right] + {{{\text{H}}}_{{\text{2}}}}{\text{O}}\left[ {{\text{Cu}}} \right] \rightleftarrows {\text{C}}{{{\text{O}}}_{2}}\left[ {{\text{Cu}}} \right] + {{{\text{H}}}_{2}}\left[ {{\text{Cu}}} \right].$Проведенный авторами [10] анализ литературы показывает, что для медьсодержащих катализаторов формиатный механизм синтеза метанола из СО2 наиболее убедителен. Схема механизма включает следующие стадии: диссоциативную адсорбцию водорода на медной части поверхности катализатора, непосредственное взаимодействие СО2 с поверхностным Н* и образование формиатов (НСОО*) по механизму Или–Ридила. Отметим, что формиат и метоксигруппа являются единственными экспериментально наблюдаемыми интермедиатами в условиях синтеза метанола на коммерческом катализаторе:
(XI)
${\text{C}}{{{\text{O}}}_{2}}\left[ {{\text{Cu}}} \right] + {\text{H}}\left[ {{\text{Cu}}} \right] \rightleftarrows {\text{HCOO}}\left[ {{\text{Cu}}} \right] + \left[ {{\text{Cu}}} \right].$Механизм синтеза метанола через последовательное гидрирование формиата в муравьиную кислоту рассмотрен в работе [16, 17]. Полученные данные подтверждают благоприятность протекания маршрута реакции через муравьиную кислоту. Монодентантный формиат легко переходит в бидентантный формиат. Молекула водорода затем внедряется по связи Cu–О формиата, в результате чего атом водорода присоединяется к кислороду, преобразуя формиат в муравьиную кислоту, а оставшийся гидрид-ион регенерирует активный центр, образуя Н* [10]:
(XII)
$\begin{gathered} {\text{HCOO}}\left[ {{\text{Cu}}} \right] + {\text{H}}\left[ {{\text{Cu}}} \right] \rightleftarrows \\ \rightleftarrows \,\,{\text{HCOOH}}\left[ {{\text{Cu}}} \right] + \left[ {{\text{Cu}}} \right].~ \\ \end{gathered} $Представляется, что гидрирование адсорбированных формиатов является стадией, определяющей скорость синтеза метанола на Cu, т.к. метанол десорбируется при той же температуре, что и адсорбированный формиат разлагается до CO2 и H2 [8].
От остальных карбоновых кислот муравьиная кислота отличается тем, что карбоксильная группа в ней связана не с углеводородным радикалом, а с атомом водорода. Муравьиная кислота проявляет свойства как карбоновых кислот, так и альдегидов, т.е. представляет собой альдегидокислоту. Специфические свойства муравьиной кислоты (*НСООН) создают условия расщепления ее (элиминирует ОН), подобно альдегиду, на формил (*НСО) и гидроксил (*ОН) на активном центре катализатора. Энергия связи между атомом углерода и гидроксилом в муравьиной кислоте составляет около 360 кДж/моль и является наименьшей между ее атомами.
(XIII)
$\begin{gathered} {\text{HCOOH}}\left[ {{\text{Cu}}} \right] + \left[ {{\text{Cu}}} \right] \rightleftarrows \\ \rightleftarrows \,\,{\text{HCO}}\left[ {{\text{Cu}}} \right] + {\text{OH}}\left[ {{\text{Cu}}} \right]. \\ \end{gathered} $Дальнейшее превращение поверхностного формила (*НСО) в метанол протекает через гидрирование в формальдегид (*Н2СО) и метокси (*Н3СО):
(XIV)
$\begin{gathered} {\text{HCO}}\left[ {{\text{Cu}}} \right] + {\text{H}}\left[ {{\text{Cu}}} \right] + {\text{OH}}\left[ {{\text{Cu}}} \right] \rightleftarrows \\ \rightleftarrows \,\,{\text{HCOH}}\left[ {{\text{Cu}}} \right] + {\text{OH}}\left[ {{\text{Cu}}} \right] + \left[ {{\text{Cu}}} \right], \\ \end{gathered} $(XV)
$\begin{gathered} {\text{HCOH}}\left[ {{\text{Cu}}} \right] + {\text{H}}\left[ {{\text{Cu}}} \right] + {\text{OH}}\left[ {{\text{Cu}}} \right] \rightleftarrows \\ \rightleftarrows {{{\text{H}}}_{{\text{2}}}}{\text{COH}}\left[ {{\text{Cu}}} \right] + {\text{OH}}\left[ {{\text{Cu}}} \right] + \left[ {{\text{Cu}}} \right], \\ \end{gathered} $(XVI)
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{\text{COH}}\left[ {{\text{Cu}}} \right] + {\text{H}}\left[ {{\text{Cu}}} \right] + {\text{OH}}\left[ {{\text{Cu}}} \right] \rightleftarrows \\ \rightleftarrows {{{\text{H}}}_{{\text{3}}}}{\text{COH}}\left[ {{\text{Cu}}} \right] + {\text{OH}}\left[ {{\text{Cu}}} \right] + \left[ {{\text{Cu}}} \right], \\ \end{gathered} $(VIII)
$\begin{gathered} {{{\text{H}}}_{{\text{3}}}}{\text{COH}}\left[ {{\text{Cu}}} \right] + {\text{H}}\left[ {{\text{Cu}}} \right] + {\text{OH}}\left[ {{\text{Cu}}} \right] \rightleftarrows \\ \rightleftarrows {{{\text{H}}}_{{\text{3}}}}{\text{COH(газ}}) + {{{\text{H}}}_{{\text{2}}}}{\text{O(газ}}). \\ \end{gathered} $Кинетику синтеза метанола оценивали с помощью уравнения (1) при следующих условиях: давление – 5–30 МПа; температура – 220–300°С; время контактирования ключевого реагента – 0.4–10 с; состав исходного газа, об. %: Н2 – 69–79; СО – 9–29; СО2 – 0–12; параметр А – 0.45–1.97. Часть данных заимствована из работы [18].
Константы b и k уравнения (1) для медьсодержащего катализатора определяются уравнениями:
Параметр А, учитывающий соотношения между реагентами в исходном газе, рассчитывали по соотношению А = ${{0.5{\text{ }}({{N}_{{{{{\text{Н}}}_{{\text{2}}}}}}}--{{N}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}})} \mathord{\left/ {\vphantom {{0.5{\text{ }}({{N}_{{{{{\text{Н}}}_{{\text{2}}}}}}}--{{N}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}})} {({{N}_{{{\text{CO}}}}} + 2{{N}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}})}}} \right. \kern-0em} {({{N}_{{{\text{CO}}}}} + 2{{N}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}})}}.$
На рис. 4 приведены кривые, рассчитанные по уравнению (1), и точки, характеризующие опытные данные по содержанию метанола в прореагировавшем газе. Между расчетными и экспериментальными результатами наблюдается хорошее согласие.
ЗАКЛЮЧЕНИЕ
Представленный материал позволяет по-новому посмотреть на роль водорода в процессах синтеза аммиака и метанола.
1) Энергетическая диаграмма (рис. 1) иллюстрирует диссоциативную адсорбцию молекулы азота, при которой необходимая дополнительная энергия обеспечивается за счет образования гидрида железа. Кинетическое уравнение (1), основанное на закономерностях потенциальной теории адсорбции, хорошо описывает экспериментальные данные в широком диапазоне их изменения.
2) Представляется обоснованным добавить в схему механизма синтеза метанола из СО, СО2 и Н2 на Cu/ZnO/Al2O3-катализаторе реакцию паровой конверсии СО (II) на ZnO-поверхности, которая становится основной по производству молекулы СО2 – непосредственного предшественника метанола. Появляется замкнутый цикл, в котором молекулы СО2, полученные по реакции (II), десорбируются с ZnO-поверхности и направляются на освободившиеся активные центры Cu-поверхности для гидрогенизации в метанол, а десорбированные с Cu-поверхности молекулы Н2О адсорбируются на поверхность ZnO, смещая равновесную реакцию (II) вправо.
Список литературы
Меньшов В.Н., Тубин Л.А. // Изв. Акад. наук. Серия хим. 2018. № 6. С. 1104.
Borso F., Ertl G., Grunze M., Weiss M. // J. Catal. 1977. V. 49. P. 18.
Эртль Г., Ли С.Б., Вайс М. / Кинетика адсорбции азота на поверхности Fe(111). В: Наука о поверхности, 114, 1982. С. 515.
Анохин В.Н., Меньшов В.Н., Зуев А.А. // Журн. прикладной химии. 1975. Т. 18. Вып. 3. С. 16.
Анохин В.Н., Меньшов В.Н., Тарасов Л.А., Шарков А.В., Бабанков В.П. Теоретические основы катализа в технологии связанного азота. Вып. 1. Москва: НИИТЭХИМ, 1978. 33 с.
Розовский А.Я., Лин Г.И. Теоретические основы процесса синтеза метанола. Москва: Химия, 1992. 272 с.
Чоркендорф И., Наймантсведрайт Х. Современный катализ и химическая кинетика. Долгопрудный: ИД Интеллект, 2013. 504 с.
Waugh K.C. / Catal. Lett. 2012. V. 142. P. 1153.
Chinchen G.C., Mansfied K., Spencer M.S. // Chemtech. 1990. V. 20. P. 692.
Волнина Э.А., Кипнис М.А. // Кинетика и катализ. 2020. Т. 61. № 1. С. 107.
Norskov J.K. // Rep. Progr. Phys. 1990. V. 53. № 10. P. 1253.
Woll C. // Prog. Surf. Sci. 2007. V. 82. P. 55.
Wang Y., Meyer B., Yin X., Kunat M., Lan genberg D., Traeger F., Birkner A., Woll Ch. // Phys. Rev. Lett. 2005. V. 95. P. 266104.
Rozovskii A.Ya., Lin G.I. // Top. Catal. 2003. V. 22. P. 137.
Кузнецов А.М. // Соровский образовательный журн. 2000. Т. 6. № 5. С. 45.
Kattel S., Ramirez P.J., Chen J.G., Rodriguez J.A., Liu P. // Science. 2017. V. 355. P. 1296.
Grabow L.C., Mavrikakis V. // ACS Catal. 2011. V. 1. P. 365.
Барковский А.И., Померанцев В.М., Анохин В.Н. / Физ.-хим. основы синтеза метанола. “Метанол-3”. Тез. докл. 3-го всесоюзного совещания. Наука, 1986. С. 16.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ