Кинетика и катализ, 2022, T. 63, № 2, стр. 203-211
Каталитическое озонирование щавелевой кислоты в водном растворе в присутствии ионов марганца
А. В. Леванов a, *, О. Я. Исайкина b, Р. А. Грязнов b
a Химический факультет МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1–3, Россия
b Филиал МГУ им. М.В. Ломоносова в Баку, пос. Ходжасан
AZ 1146 Баку, ул. Университетская, 1, Азербайджан
* E-mail: levanov@kge.msu.ru
Поступила в редакцию 15.06.2021
После доработки 02.11.2021
Принята к публикации 22.11.2021
- EDN: UENLHS
- DOI: 10.31857/S045388112202006X
Аннотация
Исследована кинетика минерализации щавелевой кислоты Н2С2О4 под действием озона в кислом водном растворе (С(НClО4) = 0.1 М, рН ~ 1) с добавками ионов ${\text{MnO}}_{4}^{ - }$ или Mn2+. Показано, что ионы марганца являются эффективными катализаторами реакции О3 с щавелевой кислотой. Независимо от того, в каком виде соединения марганца (${\text{MnO}}_{4}^{ - }$ или Mn2+) добавлены в раствор, в ходе реакции они превращаются в оксалатный комплекс четырехвалентного марганца, который и является устойчивой формой катализатора в рассматриваемой системе. Определены кинетические закономерности выделения диоксида углерода – продукта реакции Н2С2О4 с О3 – в зависимости от концентраций озона в газовом потоке, щавелевой кислоты и марганца в растворе. Предложена базовая схема катализа изучаемой реакции ионами марганца и построена кинетическая модель, которая хорошо описывает экспериментальные результаты. Схема основана на том, что окисление оксалата до СО2 происходит в ходе сложной реакции разложения оксалатного комплекса четырехвалентного марганца, при этом Mn(IV) восстанавливается до Mn2+. Регенерация комплекса происходит в результате окисления озоном Mn2+ до Mn(IV).
ВВЕДЕНИЕ
Удаление щавелевой кислоты и ее солей, оксалатов, из растворов различного состава требуется при очистке технологических и сточных вод различных производств [1–3]. Окислительная минерализация щавелевой кислоты широко применяется в промышленных процессах переработки отработанного ядерного топлива [4–6]. При этом озон представляет собой оптимальный окислитель, так как может быть получен на месте, и при его использовании не образуется каких-либо дополнительных отходов [7]. Однако щавелевая кислота и оксалаты напрямую не взаимодействуют с молекулой О3 [8]. Окисление оксалатов при обычном озонировании может происходить за счет побочных реакций, в основном под действием свободного гидроксильного радикала ОН• – промежуточного вещества сложной реакции саморазложения озона в водном растворе [3], причем эти процессы наиболее заметно протекают в щелочной среде при высокой температуре [7, 9], а в кислых растворах их вклад обычно незначителен. Поэтому исследование каталитического озонирования щавелевой кислоты является актуальной задачей.
Известно, что эффективные катализаторы процессов озонирования – ионы марганца. Как правило их добавление приводит к ускорению минерализации органических примесей [10–14], однако в некоторых случаях каталитический эффект не наблюдается [15, 16].
Катализ ионами марганца процесса озонирования щавелевой кислоты исследован недостаточно. Не определены промежуточные вещества и активные формы катализаторов, но имеются различные предположения об их природе (напр. [10]). Не изучен катализ перманганат-ионами, хотя их каталитическое действие вполне можно ожидать. Действительно, перманганат-ионы достаточно эффективно реагируют с Н2С2О4 (см. напр. [5]), а с другой стороны, озон может окислять ионы марганца в низших степенях окисления до перманганата [17, 18] и таким образом регенерировать катализатор. Кроме того, практически не изучено озонирование растворов щавелевой кислоты относительно высокой концентрации в присутствии сильных кислот, что актуально для процессов переработки отработанного ядерного топлива.
Целью настоящей работы является экспериментальное исследование кинетики гомогенно-каталитического окисления щавелевой кислоты до диоксида углерода при озонировании ее кислых водных растворов, идентификация промежуточных соединений и определение механизма (кинетической схемы) каталитической реакции. В качестве исходных форм катализаторов использованы пермангантат-ионы ${\text{MnO}}_{4}^{ - }$ или ионы двухвалентного марганца Mn2+.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты выполняли на установке, описанной в работе [19]. Взаимодействие между озоном и растворами щавелевой кислоты осуществляли в барботажном реакторе при комнатной температуре 20 ± 1°С. Исходный состав растворов: щавелевая кислота 0.02–0.2 М, хлорная кислота 0.1 М, перманганат калия или сульфат марганца 3 × 10–5–4.2 × 10–4 М. Для их приготовления использовали дистиллированную воду, концентрированную хлорную кислоту “х. ч.”, щавелевую кислоту 2-водную “х. ч.”, марганец(II) сульфат 5-водный “ч. д. а.”, перманганат калия фармакопейный. Реактор имел отвод для отбора проб реакционного раствора. Регистрацию УФ-видимых спектров жидких образцов в диапазоне 190–1100 нм выполняли на спектрофотометре Agilent-8453 (“Agilent Technologies”, США).
Озон синтезировали в озонаторе барьерного разряда из чистого кислорода – газа. Концентрацию озона в газовом потоке измеряли на входе и выходе из реактора с помощью фотометрических озонометров Медозон-254/5 (“Медозон”, Россия); на входе она составляла в различных экспериментах от 10 до 40 г/м3. Скорость поглощения (расходования) озона в реакторе (моль л−1 мин−1) находили из соотношения:
Количественное определение диоксида углерода СО2, образующегося при окислении щавелевой кислоты, осуществляли по времени нейтрализации (∆t, мин) раствора NaОН [19]. Выходящие из реактора газы пропускали через печь, нагретую до температуры ~500°С, для разложения озона, что обеспечивало практически полное удаление О3 [21]. Затем они поступали в ловушку, заполненную 100 мл раствора 0.01–0.001 М NaOH (приготовленного из гидроксида натрия “х. ч.”) с добавлением индикатора фенолфталеина согласно [19]. Для точного нахождения времени нейтрализации из ловушки периодически отбирали пробы раствора и регистрировали на фотометре КФК-3 (ОАО “Загорский оптико-механический завод”, Россия) оптическую плотность на максимуме поглощения окрашенной формы фенолфталеина при 552 нм; после измерений пробы возвращали обратно. Скорость выделения СО2 (моль л–1 мин–1) рассчитывали по формуле:
Скорости поглощения озона и выделения диоксида углерода находили в стационарном режиме функционирования реактора. Такой режим устанавливается вследствие того, что реактор проточный, а параметры эксперимента, в частности, скорости потока газов и подачи озона, не меняются с течением времени. Строго говоря, режим примерно стационарный, так как в ходе реакции происходит невосполняемое расходование щавелевой кислоты. Однако она находится в большом избытке, и уменьшением ее концентрации за время эксперимента (не более 3% от исходной величины) можно пренебречь.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При озонировании растворов щавелевой кислоты в отсутствие солей марганца скорость выделения диоксида углерода составляет менее предела обнаружения (<1 × 10–5 моль л–1 мин–1). Добавление в реакционный раствор перманганата калия или сульфата марганца приводит к протеканию реакции окисления щавелевой кислоты под действием озона и значительному выделению СО2. Экспериментальные данные представлены на рис. 1–4 (точки). Скорость выделения СО2 прямо пропорциональна концентрации озона в исходных газах (рис. 1); зависимости r (CO2) от концентраций щавелевой кислоты (рис. 2) и ионов марганца (рис. 3) более сложные и обсуждаются ниже. Важно отметить, что каталитическое действие солей марганца не зависит от того, в какой исходной форме, ${\text{MnO}}_{4}^{ - }$ или Mn2+, они добавлены в раствор.
Рис. 1.
Зависимость скорости выделения диоксида углерода от концентрации озона в газовом потоке
на входе в реактор; С(Н2С2О4) = 0.2 М, C(Mn) = (3.9–4.0) × 10–4 М. Точки – экспериментальные данные при добавлении KMnO4 ( ) или MnSO4 (
) или MnSO4 ( ); линия – расчет по модели.
); линия – расчет по модели.
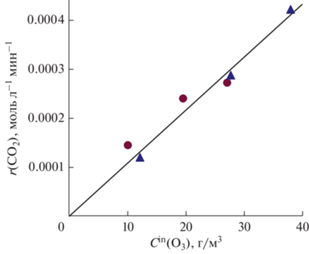
Рис. 2.
Зависимость скорости выделения диоксида углерода от концентрации щавелевой кислоты
в реакционном растворе; Cin(O3) = 28–29 г/м3, C(Mn) = (3.9–4.0) × 10–4 М. Точки – экспериментальные данные при добавлении KMnO4 ( ) или MnSO4 (
) или MnSO4 ( ); линия – расчет по модели.
); линия – расчет по модели.
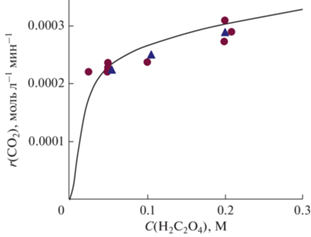
Рис. 3.
Зависимость скорости выделения диоксида углерода от концентрации ионов марганца в
реакционном растворе; Cin(O3) = 28–29 г/м3, С(Н2С2О4) = 0.2 М. Точки – экспериментальные данные при добавлении KMnO4 ( ) или MnSO4 (
) или MnSO4 ( ); линия – расчет по модели.
); линия – расчет по модели.
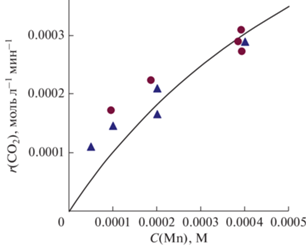
Рис. 4.
Зависимость отношения скоростей выделения СО2 и расходования О3 от концентрации ионов марганца в растворе во всех экспериментах настоящей работы; Cin(O3) = 10–40 г/м3, С(Н2С2О4) = 0.02–0.2 М.
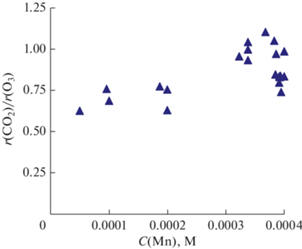
Отношение скоростей выделения СО2 и расходования О3 показано на рис. 4; для всех экспериментов настоящей работы оно попадает в диапазон 0.6–1.1. При возрастании концентрации катализатора величина r (CO2)/r (O3) имеет тенденцию к росту. Стехиометрическое уравнение реакции окисления щавелевой кислоты озоном имеет вид:
Если бы озон расходовался только в целевой реакции, то соотношение r (CO2)/r (O3) должно быть равным 2. Меньшие значения r (CO2)/r (O3) в наших экспериментах свидетельствуют о протекании побочных реакций озона, не ведущих к окислению Н2С2О4.
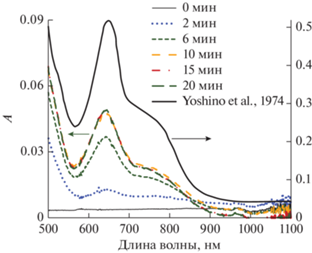
Анализ спектров реакционных растворов, записанных в различные моменты времени после начала озонирования (рис. 5, 6), показывает, что независимо от того, какие исходные ионы марганца (${\text{MnO}}_{4}^{ - }$ или Mn2+) взяты, они трансформируются в одно и то же новое соединение. Характерными особенностями его спектра является плечо высокой интенсивности при 385–390 нм (рис. 5, рис. 6), а также менее интенсивный пик с максимумом при 645 нм и плечом при 735 нм (рис. 7). Сравнение с известными из литературы [22] спектрами оксалатного комплекса четырехвалентного марганца (рис. 7) подтверждает, что в наших растворах ионы марганца превращаются именно в этот комплекс. Его строение окончательно не установлено, и ему приписывают химические формулы [Mn(C2O4)2(OH)2]2– [23] или [(C2O4)2MnO2Mn(C2O4)2]4– [22]; в настоящей работе будем записывать формулу как ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}})_{2}^{{2 - }}.$ Константа устойчивости комплекса в литературе не приводится, однако он легко образуется при наличии в растворе ионов Mn(IV) и оксалата [22–24], что свидетельствует о достаточно большом ее значении. В публикации [22] оценены молярные коэффициенты поглощения комплекса, что позволяет определить его концентрацию в растворе. Оказывается, что в условиях наших экспериментов в стационарном режиме от 85 до 100% марганца присутствует в виде ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}})_{2}^{{2 - }},$ т.е. в наших реакционных растворах именно этот комплексный ион является преобладающей формой существования марганца.
Рис. 5.
Спектры раствора 0.05 М Н2С2О4 + + 0.1 М HClO4 + 3.9 × 10–4 М ${\text{MnO}}_{4}^{ - }$ в зависимости от времени озонирования; Cin(O3) = 27–28 г/м3.
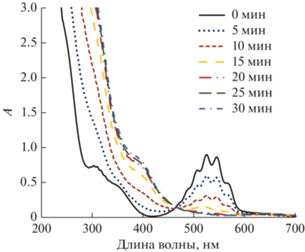
Рис. 6.
Спектры раствора 0.05 М Н2С2О4 + + 0.1 М HClO4 + 4 × 10–4 М Mn2+ в зависимости от времени озонирования; Cin(O3) = 27–28 г/м3.
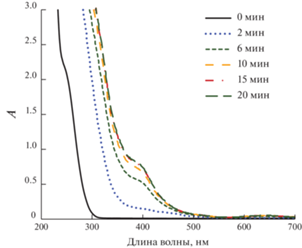
Рис. 7.
Наложение спектров реакционного раствора 0.05 М Н2С2О4 + 0.1 М HClO4 + 4 × 10–4 М Mn2+ в ходе озонирования (Cin(O3) = 27–28 г/м3) и комплекса ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}})_{2}^{{2 - }}$ из литературы (Yoshino et al., 1974) [22].
Известно, что ионы двух- и трехвалентного марганца также могут образовывать устойчивые оксалатные комплексы. Мы выполнили расчет равновесного состава растворов Mn(II) и Mn(III), аналогичных по кислотности и содержанию оксалата нашим реакционными растворам, с использованием справочных данных по константам устойчивости комплексов [25] и диссоциации щавелевой кислоты [26]. Результаты расчета показывают, что основная форма двухвалентного марганца – свободный ион (аквакомплекс) Mn2+(aq) (его доля составляет более 94% от всего Mn(II)), трехвалентного марганца – комплексный ион ${\text{Mn}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{ - }$ (более 96% от всего Mn(III)). Спектр ${\text{Mn}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{ - }$ хорошо известен [27], что позволяет идентифицировать этот ион в водных растворах. В наших реакционных растворах ионы ${\text{Mn}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{ - }$ не найдены.
Оксалатный комплекс четырехвалентного марганца ${\text{Mn}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{ - }$ в водных растворах неустойчив и подвергается разложению с окислением лиганда – оксалат-иона – до СО2 и восстановлением Mn(IV) до Mn(III) и далее до Mn(II) [22–24]:
Мы выполнили предварительные эксперименты по изучению кинетических закономерностей разложения ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{{2 - }}$ в наших реакционных растворах. В присутствии озона исчезновение комплекса происходит по реакции нулевого кинетического порядка, причем спектральные сигналы трехвалентного марганца (оксалатного комплекса ${\text{Mn}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{ - }$) не обнаружены; конечным продуктом является Mn2+(aq). Определение механизма разложения требует особых исследований, которые планируется выполнить в дальнейшем.
Полученные данные позволяют предложить следующую базовую схему катализа ионами марганца реакции щавелевой кислоты с озоном в условиях наших экспериментов (в стационарном режиме). Окисление оксалата до диоксида углерода происходит в ходе сложной реакции распада комплекса четырехвалентного марганца ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{{2 - }};$ при этом Mn(IV) восстанавливается до Mn2+. В оксалат-ионе, связанном в виде лиганда, распределение электронной плотности существенно изменено по сравнению со свободными ионами ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$ и ${\text{H}}{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{ - }$ и молекулой Н2С2О4, что облегчает его взаимодействие с окислителями. Поэтому можно предположить возможность довольно быстрого окисления оксалатного лиганда в комплексе ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{{2 - }}$ под действием озона.
Ионы двухвалентного марганца быстро окисляются озоном до четырехвалентного по реакции:
(I)
${\text{M}}{{{\text{n}}}^{{2 + }}} + {{{\text{O}}}_{3}} \to {\text{Mn}}{{{\text{O}}}^{{2 + }}} + {{{\text{O}}}_{2}}.~$Взаимодействие Mn2+ с O3 исследовано достаточно подробно [17, 28, 29]. В работах [17, 29] сделан вывод, что оно происходит по механизму переноса атома кислорода, и первичным продуктом является ион MnO2+. Константа скорости реакции (I) в водных растворах, подкисленных хлорной кислотой, при 20°С составляет kI = 1500 л моль–1 с–1 [29].
При избытке щавелевой кислоты ионы четырехвалентного марганца сразу же образуют оксалатный комплекс:
(II)
${\text{Mn}}{{{\text{O}}}^{{2 + }}} + {\text{ }}2{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }} \rightleftarrows {\text{MnO}}\left( {{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}} \right)_{2}^{{2 - }},$Каталитическое озонирование подкисленных растворов щавелевой кислоты с добавлением ионов Mn2+ изучено также в работе [10], однако авторы не выполнили идентификацию соединений марганца в реакционной системе. На основании косвенных данных предполагается [10, 11], что окисление оксалатов происходит при взаимодействии с трехвалентным марганцем (возможно, внутри оксалатного комплекса Mn(III)). В настоящей работе выяснено, что основной активной формой катализатора является оксалатный комплекс Mn(IV), а соединения Mn(III) не обнаружены.
На основе вышеприведенной схемы мы выполнили моделирование кинетики выделения СО2 и расходования О3 при озонировании щавелевокислых растворов в стационарном режиме наших экспериментов. Следует отметить, что модель упрощенная, и в ней учтены только основные процессы. По причине недостатка информации детальный механизм разложения оксалатного комплекса четырехвалентного марганца ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{{2 - }}$ не обсуждается. Кинетика разложения ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{{2 - }}$ описывается формально-кинетическими соотношениями, причем рассматривается два возможных варианта протекания этого процесса.
| Вариант А – с участием озона | Вариант Б – без участия озона | |
| Стехиометрическое уравнение реакции разложения: | ||
| MnO(C2O4)$_{2}^{{2 - }}$ + О3 + 4H+ → Mn2+ + 4CO2 + 2H2O + О2 | MnO(C2O4)$_{2}^{{2 - }}$ + 2H+ → Mn2+ + 2CO2 + C2O$_{4}^{{2 - }}$ + H2O | (III) |
| Выражения скоростей разложения комплекса и выделения СО2: | ||
| rIII= kIII[MnO(C2O4)$_{2}^{{2 - }}$][О3][H+]n r(СО2) = 4rIII |
rIII= kIII[MnO(C2O4)$_{2}^{{2 - }}$][H+]n r(СО2) = 2rIII |
(1) |
Здесь kIII – эффективная константа скорости сложной реакции (III), n – кинетический порядок по концентрации ионов H+; а [X] обозначает концентрацию вещества Х в растворе. При моделировании рассматривали возможные значения n = 0, 1, 2, … .
Комплексный ион ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{{2 - }}$ является ведущим интермедиатом нашей модели, поскольку именно при его разложении осуществляется окисление оксалата и образование СО2. Его концентрацию рассчитывали в квазиравновесном приближении, из условий равновесия в реакции (II) образования этого комплекса:
(2)
${{K}_{{{\text{II}}}}} = \frac{{[{\text{MnO(}}{{{\text{C}}}_{2}}{{{\text{O}}}_{4}})_{2}^{{2 - }}]}}{{{{{[{\text{Mn}}{{{\text{O}}}^{{2 + }}}{\text{(}}{{{\text{C}}}_{2}}{{{\text{O}}}_{4}})_{2}^{{2 - }}]}}^{2}}}},$(3)
${{k}_{{\text{I}}}}[{\text{M}}{{{\text{n}}}^{{2 + }}}][{{{\text{O}}}_{3}}] = {{k}_{{{\text{III}}}}}{{[{\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}})_{2}^{{2 - }}\left] {\left[ {{{{\text{О}}}_{3}}} \right]} \right[{{{\text{H}}}^{ + }}]}^{n}}\,\,\left( {{\text{вариант А}}} \right),$(4)
$С\left( {{\text{Mn}}} \right) = [{\text{M}}{{{\text{n}}}^{{2 + }}}] + [{\text{Mn}}{{{\text{O}}}^{{2 + }}}] + [{\text{MnO}}\left( {{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}} \right)_{2}^{{2 - }}{\kern 1pt} ].$Здесь KII – константа равновесия реакции (II), С(Mn) – суммарная концентрация ионов марганца в реакционном растворе, равная начальной концентрации перманганата калия или сульфата марганца. Решение системы уравнений (2)–(4) приводит к выражению концентрации
(5)
$\begin{gathered} \text{[}{\text{MnO(}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{{2 - }}{\kern 1pt} ]{\text{ }} = \frac{{C({\text{Mn}})}}{{\frac{{{{k}_{{{\text{III}}}}}}}{{{{k}_{{\text{I}}}}}}{{{[{{{\text{H}}}^{ + }}]}}^{n}} + \frac{1}{{{{K}_{{{\text{II}}}}}{{{[{{{\text{C}}}_{2}}{\text{O}}_{4}^{{2 - }}]}}^{2}}}} + 1}}\,\,({\text{вариант}}\,\,{\text{А}}), \\ [{\text{MnO(}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{{2 - }}{\kern 1pt} ]{\text{ }} = \frac{{C({\text{Mn}})}}{{\frac{{{{k}_{{{\text{III}}}}}{{{[{{{\text{H}}}^{ + }}]}}^{n}}}}{{{{k}_{{\text{I}}}}[{{{\text{O}}}_{3}}]}} + \frac{1}{{{{K}_{{{\text{II}}}}}{{{[{{{\text{C}}}_{2}}{\text{O}}_{4}^{{2 - }}]}}^{2}}}} + 1}}\,\,({\text{вариант}}\,\,{\text{Б}}). \\ \end{gathered} $Скорость выделения диоксида углерода рассчитывали по формулам (1), в которые подставлены соотношения (5).
Концентрацию растворенного озона [O3] определяли из системы уравнений
(6)
$\begin{gathered} \frac{\upsilon }{{{{V}_{{{\text{реак}}}}}}}(С{\kern 1pt} ^\circ ({{{\text{O}}}_{3}}) - С({{{\text{O}}}_{3}})) = \\ = {{k}_{L}}a({{H}_{{\text{O}}}}_{{_{3}}}C\left( {{{{\text{O}}}_{3}}} \right)--\left[ {{{{\text{O}}}_{3}}} \right]) = {{k}_{{{{{\text{О}}}_{3}}}}}[{{{\text{О}}}_{3}}],~~~~~~~~~ \\ \end{gathered} $(7)
$[{{{\text{O}}}_{3}}] = \frac{{{{H}_{{{{{\text{O}}}_{3}}}}}C{\kern 1pt} ^\circ ({{{\text{O}}}_{3}})}}{{1 + \frac{{{{k}_{{{{{\text{O}}}_{3}}}}}}}{{{{k}_{L}}a}} + {{k}_{{{{{\text{O}}}_{3}}}}}\frac{{{{V}_{{{\text{реак}}}}}}}{\upsilon }{{H}_{{{{{\text{O}}}_{3}}}}}}}.$В модели скорость реакций озона в растворе описывается соотношениями:
(8)
$\begin{gathered} r({{{\text{O}}}_{3}}){\text{ }} = {{k}_{{\text{d}}}}[{{{\text{O}}}_{3}}] + \\ + \;\;2{{k}_{{{\text{III}}}}}{{[{\text{MnO(}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{{2 - }}\left] {\left[ {{{{\text{О}}}_{3}}} \right]} \right[{{{\text{H}}}^{ + }}]}^{n}}\left( {{\text{вариант А}}} \right), \\ r({{{\text{O}}}_{3}}) = {{k}_{{\text{d}}}}[{{{\text{O}}}_{3}}] + \\ + \,\,{{k}_{{{\text{III}}}}}[{\text{MnO(}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}})_{2}^{{2 - }}]{{[{{{\text{H}}}^{ + }}]}^{n}}\left( {{\text{вариант Б}}} \right). \\ \end{gathered} $Соответствующие выражения удельной скорости реакций озона следующие:
(9)
$\begin{gathered} {{k}_{{{{{\text{O}}}_{3}}}}} = {{k}_{{\text{d}}}} + {\text{ }}2{{k}_{{{\text{III}}}}}[{\text{MnO(}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}})_{2}^{{2 - }}]{{[{{{\text{H}}}^{ + }}]}^{n}}\,\,\left( {{\text{вариант А}}} \right),~~ \\ {{k}_{{{{{\text{O}}}_{3}}}}} = {{k}_{{\text{d}}}} + \\ + \,\,{{k}_{{{\text{III}}}}}[{\text{MnO(}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}})_{2}^{{2 - }}]{{[{{{\text{H}}}^{ + }}]}^{n}}{\text{/}}[{{{\text{O}}}_{3}}]{\text{ }}\left( {{\text{вариант Б}}} \right). \\ \end{gathered} $Следует отметить, что система уравнений (6) справедлива в случае, когда расходованием озона на границе раздела газ–жидкость можно пренебречь по сравнению с реакциями озона в основном объеме реакционного раствора. Аналогично тому, как это сделано в публикации [31 ] , можно показать, что в экспериментах настоящей работы это действительно имеет место.
Концентрации в реакционном растворе ионов Н+, недиссоциированной молекулы щавелевой кислоты Н2С2О4 и анионов гидроксалата ${\text{Н}}{{{\text{С}}}_{{\text{2}}}}{\text{О}}_{4}^{ - }$ и оксалата ${{{\text{С}}}_{{\text{2}}}}{\text{О}}_{4}^{{2 - }}$ рассчитывали на основе квазиравновесного приближения путем решения системы алгебраических уравнений, включающей выражения констант равновесия диссоциации кислоты в водном растворе:
(10)
${{K}_{{{\text{a1}}}}} = \frac{{[{{{\text{H}}}^{ + }}][{\text{H}}{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{ - {\kern 1pt} }}]}}{{[{{{\text{H}}}_{2}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}}]}},\,\,\,\,{{K}_{{{\text{a2}}}}} = \frac{{[{{{\text{H}}}^{ + }}][{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - {\kern 1pt} }}]}}{{[{\text{H}}{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{ - }]}},$(11)
$С({{{\text{Н}}}_{{\text{2}}}}{{{\text{С}}}_{{\text{2}}}}{{{\text{О}}}_{4}}) = [{{{\text{H}}}_{{\text{2}}}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}] + [{\text{H}}{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{ - {\kern 1pt} }}] + [{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}],$(12)
$[{{{\text{H}}}^{ + }}] = [{\text{H}}{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{ - }] + 2{\kern 1pt} [{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}] + С({\text{НCl}}{{{\text{О}}}_{4}}).$Здесь Ka1 и Ka2 – первая и вторая константы диссоциации щавелевой кислоты (их значения в условиях наших экспериментов оценены из данных [26]), С(Н2С2О4) и С(НClО4) – ацидиметрические концентрации щавелевой и хлорной кислот в реакционном растворе.
Выражения (5), (7), (8), (10)–(12) образуют систему алгебраических уравнений, которые позволяют вычислить концентрации участников сложной каталитической реакции щавелевой кислоты с озоном в нашем растворе в стационарном режиме. Последовательность действий при расчете была следующей. Сначала определяли концентрации Н+, Н2С2О4, ${\text{H}}{{{\text{C}}}_{2}}{\text{O}}_{4}^{ - }$ и ${{{\text{С}}}_{{\text{2}}}}{\text{О}}_{4}^{{2 - }}$ путем решения уравнений (10)–(12); при этом расходованием щавелевой кислоты в ходе озонирования пренебрегали. Затем из уравнений (7), (8) и (5) находили концентрации в растворе О3 и ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}})_{2}^{{2 - }},$ причем уравнения решали методом простой итерации в программе Microsoft Excel. Далее рассчитывали скорости выделения диоксида углерода по формулам (1) и скорость расходования озона с помощью выражений (8).
Неопределенными параметрами модели являлись величины KII, kIII, n и kd. Значения KII, kIII, n определяли из условия наилучшего совпадения экспериментальных и расчетных скоростей выделения СО2. Величину kd оценивали на основе согласования экспериментальных и расчетных отношений скоростей выделения СО2 и расходования О3.
Воспроизвести прямо пропорциональную зависимость r (CO2) от концентрации озона во входящем газовом потоке удается только для варианта А разложения ведущего интермедиата ${\text{MnO}}({{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}})_{2}^{{2 - }}$ с участием озона. При расчетах по варианту Б зависимость r (CO2) от Cin(O3) получается в виде нелинейной возрастающей кривой, быстро выходящей на насыщение, что противоречит экспериментальным результатам (см. рис. 1). Поэтому в дальнейшем рассматривается только вариант А.
Расчетные скорости выделения СО2 достигают экспериментальных значений только для n = 0 или 1. При оптимальных значениях остальных констант kd, KII и kIII расчетная зависимость r (CO2) от С(Н2С2О4) ближе к эксперименту при n = 1; таким образом получаем оптимальную величину n = 1. Оптимальное значение kd = 3 × 10–2 с–1 найдено на основе того, что расчетное отношение r (CO2)/r (O3) соответствует экспериментальному диапазону 0.6–1.1 при аналогичных экспериментальных условиях.
На рис. 1–3 сопоставлены экспериментальные и расчетные скорости выделения диоксида углерода для различных условий эксперимента при оптимальных значениях параметров модели n = 1, kd = 3 × 10–2 с–1, KII = 1 × 1011 М–2, kIII = = 390 л2 моль–2 с–1. Видно, что расчетные и экспериментальные результаты хорошо согласуются (с учетом погрешности экспериментальных данных). При этом модель правильно воспроизводит качественный вид экспериментальных кривых, в том числе нелинейные зависимости r (CO2) от концентраций щавелевой кислоты (рис. 2) и ионов марганца (рис. 3). Это подтверждает то, что схема и кинетическая модель верно описывают основные химические процессы при катализе солями марганца реакции окисления щавелевой кислоты озоном в условиях наших экспериментов. Высокое значения параметра KII – константы равновесия реакции (II) – согласуется с экспериментальными данными [22–24] о том, что оксалат и Mn(IV) очень легко образуют комплексное соединение друг с другом.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе обнаружен эффективный катализ ионами марганца реакции щавелевой кислоты с озоном в кислых растворах, причем каталитическое действия перманганат-ионов исследовано впервые. Показано, что независимо от того, какие исходные соединения марганца (${\text{MnO}}_{4}^{ - }$ или Mn2+) взяты, они трансформируются в одну и ту же активную форму катализатора – оксалатный комплекс четырехвалентного марганца. Идентификация этого комплекса в системе озон–щавелевая кислота–ионы марганца выполнена впервые. Предложена схема и соответствующая ей кинетическая модель каталитической реакции, которые хорошо описывают экспериментальные кинетические закономерности и объясняют каталитическое действие ионов марганца.
Список литературы
Marcì G., García-López E., Palmisano L. // J. Appl. Electrochem. 2008. V. 38. № 7. P. 1029.
Bangun J., Adesina A.A. // Appl. Catal. A: General. 1998. V. 175. № 1. P. 221.
Von Sonntag C., Von Gunten U. Chemistry of Ozone in Water and Wastewater Treatment. From Basic Principles to Applications. London: IWA Publishing, 2012.
Michael K.M., Rizvi G.H., Mathur J.N., Ramanujam A. // J. Radioanal. Nucl. Chem. 2000. V. 246. № 2. P. 355.
Ganesh S., Desigan N., Chinnusamy A., Pandey N.K. // J. Radioanal. Nucl. Chem. 2021. V. 328. № 3. P. 857.
Ананьев А.В., Тананаев И.Г., Шилов В.П. // Успехи химии. 2005. Т. 74. № 11. С. 1132.
Селиверстов А.Ф., Лагунова Ю.О., Ершов Б.Г., Шашковский С.Г. // Журн. общей химии. 2017. Т. 87. № 11. С. 1789.
Hoigné J., Bader H. // Water Res. 1983. V. 17. № 2. P. 185.
Шилов В.П., Гарнов А.Ю., Гоголев А.В., Ананьев А.В. // Радиохимия. 2006. Т. 48. № 1. С. 33.
Andreozzi R., Insola A., Caprio V., D’amore M.G. // Water Res. 1992. V. 26. № 7. P. 917.
Andreozzi R., Caprio V., D’amore M.G., Insola A. // Env. Tech. 1995. V. 16. № 9. P. 885.
Andreozzi R., Caprio V., Insola A., Marotta R., Tufano V. // Water Res. 1998. V. 32. № 5. P. 1492.
Ma J., Graham N.J.D. // Water Res. 2000. V. 34. № 15. P. 3822.
Qin W., Tan P., Song Y., Wang Z., Nie J., Ma J. // Sep. Pur. Tech. 2021. V. 261. P. 118272.
Xiao H., Liu R., Zhao X., Qu J. // J. Mol. Catal. A: Chem. 2008. V. 286. № 1. P. 149.
Dong Y., Yang H., He K., Song S., Zhang A. // Appl. Catal. B: Environ. 2009. V. 85. № 3. P. 155.
Reisz E., Leitzke A., Jarocki A., Irmscher R., Von Sonntag C. // J. Water Supply: Res. Tech. Aqua. 2008. V. 57. № 6. P. 451.
Леванов А.В., Кусков И.В., Антипенко Э.Е., Лунин В.В. // Журн. физ. химии. 2006. Т. 80. № 4. С. 653. (Levanov A.V., Kuskov I.V., Antipenko E.E., Lunin V.V. // Russ. J. Phys. Chem. 2006. V. 80. № 4. P. 556.)
Леванов А.В., Исайкина О.Я., Харланов А.Н. // Журн. физ. химии. 2020. Т. 94. № 11. С. 1616. (Levanov A.V., Isaikina O.Y., Kharlanov A.N. // Russ. J. Phys. Chem. A. 2020. V. 94. № 11. P. 2219.)
Леванов А.В., Исайкина О.Я., Гасанова Р.Б., Лунин В.В. // Журн. физ. химии. 2017. Т. 91. № 8. С. 1307. (Levanov A.V., Isaikina O.Y., Gasanova R.B., Lunin V.V. // Russ. J. Phys. Chem. A. 2017. V. 91. № 8. P. 1427.)
Леванов А.В., Кусков И.В., Зосимов А.В., Антипенко Э.Е., Лунин В.В. // Журн. аналит. химии. 2003. Т. 58. № 5. С. 496. (Levanov A.V., Kuskov I.V., Zosimov A.V., Antipenko E.E., Lunin V.V. // J. Anal. Chem. 2003. V. 58. № 5. P. 439.)
Yukichi Y., Iwao T., Masakazu K., Takashi U. // Bull. Chem. Soc. Japan. 1974. V. 47. № 11. P. 2787.
Cartledge G.H., Ericks W.P. // J. Am. Chem. Soc. 1936. V. 58. № 10. P. 2069.
Takashi U., Iwao T., Yukichi Y. // Bull. Chem. Soc. Japan. 1975. V. 48. № 10. P. 2809.
Martell A.E., Smith R.M. Critical Stability Constants. V. 3. Other Organic Ligands. Boston, MA: Springer US, 1977.
Kettler R.M., Palmer D.A., Wesolowski D.J. // J. Solut. Chem. 1991. V. 20. № 9. P. 905.
Adler S.J., Noyes R.M. // J. Am. Chem. Soc. 1955. V. 77. № 8. P. 2036.
Тюпало Н.Ф., Якоби B.A. // Журн. неорг. химии. 1980. Т. 25. № 6. С. 1557.
Jacobsen F., Holcman J., Sehested K. // Int. J. Chem. Kinet. 1998. V. 30. № 3. P. 207.
Леванов А.В., Кусков И.В., Антипенко Э.Е., Лунин В.В. // Журн. физ. химии. 2008. Т. 82. № 7. С. 1275. (Levanov A.V., Kuskov I.V., Antipenko E.E., Lunin V.V. // Russ. J. Phys. Chem. A. 2008. V. 82. № 7. P. 1126.)
Леванов А.В., Исайкина О.Я., Лунин В.В. // Журн. физ. химии. 2020. Т. 94. № 1. С. 75. (Levanov A.V., Isaikina O.Y., Lunin V.V. // Russ. J. Phys. Chem. A. 2020. V. 94. № 1. P. 81.)
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


