Кинетика и катализ, 2022, T. 63, № 2, стр. 193-201
Влияние природы пара-заместителя на кинетические закономерности расходования изомерных форм ароматических нитрозооксидов
Р. Л. Сафиуллин a, *, А. Н. Терегулова a, А. Р. Яруллин a, М. Ю. Овчинников a, С. Л. Хурсан a
a Уфимский Институт химии – обособленное структурное подразделение Уфимского ФИЦ РАН
450054 Уфа, Просп. Октября, 69, Республика Башкортостан, Россия
* E-mail: kinetic@anrb.ru
Поступила в редакцию 03.06.2021
После доработки 28.09.2021
Принята к публикации 02.11.2021
- EDN: EQAYPJ
- DOI: 10.31857/S0453881122020095
Аннотация
Импульсный фотолиз ароматических азидов 4-R–C6H4N3 (где R = –Ph, –ОPh, –CH2Ph) в аэрированных растворах ацетонитрила приводит к промежуточному образованию цис- и транс-изомеров соответствующих арилнитрозооксидов, которые далее предположительно трансформируются с раскрытием ароматического кольца в R-замещенные ненасыщенные нитрилоксиды. Зарегистрированы электронные спектры цис- и транс-изомеров 4-R–C6H4NOO, определены эффективные константы скорости мономолекулярной гибели изомеров и найдены активационные параметры констант скорости. Константы скорости ktrans существенно ниже величин kcis, слабо меняются в ряду изученных нитрозооксидов и лежат в интервале 0.15–0.22 с–1 (295 K). Константы скорости kcis для фенил- (2.5 с–1) и бензил- (2.8 с–1) замещенных арилнитрозооксидов в пределах экспериментальной погрешности совпадают, а фенокси-заместитель приводит к увеличению kcis примерно в 1.5 раза (4.3 с–1). Процесс гибели 4-R–C6H4NOO описан системой из трех элементарных стадий, включающих обратимую изомеризацию цис- и транс-изомеров и орто-циклизацию цис-формы нитрозооксидов в соответствующий нитрилоксид. Решением системы дифференциальных уравнений, описывающих кинетику гибели 4-R–C6H4NOO, найдена аналитическая зависимость изменения оптической плотности реакционной смеси от времени, совпадающая по форме с эмпирически установленной ранее. Это дало возможность раскрыть физический смысл эффективных констант скорости и вычислить элементарные константы скорости процесса гибели ароматических нитрозооксидов. DFT-расчеты активационных барьеров цис–транс-изомеризации и необратимой орто-циклизации цис-изомеров 4-R–C6H4NOO хорошо согласуются с экспериментальными данными.
ВВЕДЕНИЕ
Нитрозооксиды – лабильные частицы общей формулы RNOO, представители класса 1,3-диполярных пероксидных частиц X–O–O – являются интермедиатами в термических и фотохимических реакциях, протекающих с участием триплетных нитренов в присутствии молекулярного кислорода. В настоящее время имеется несколько обзоров, посвященных органическим азидам, азот- и кислородсодержащим гетероциклическим соединениям [1–5], где большое внимание уделяется уникальным свойствам нитрозооксидов, существенный прогресс в изучении которых достигнут в последние годы. В работах [6–13] подробно рассмотрены структура, спектральные свойства, методы генерации, реакционная способность и механизмы различных превращений ароматических нитрозооксидов ArNOO.
В [14] было установлено, что простейший нитрозооксид HNOO имеет плоскую структуру и существует в виде двух устойчивых пространственных изомеров – транс- и цис-:
Особенностью электронного строения HNOO в основном состоянии является трехцентровая 4π-электронная система. Дополнительное π-связывание обусловливает рост порядка связей N–O и O–O и соответственное уменьшение межатомных расстояний на ~0.15 Å по сравнению с одинарными связями [15]. В изомерах HNOO наблюдается инверсия соотношения длин связей нитрозооксидного фрагмента: в транс-изомере r(NO) > > r(OO) и, наоборот, для цис-формы вследствие аномерного стабилизирующего взаимодействия nN → $\sigma _{{{\text{OO}}}}^{*},$ возможного только в цис-изомере. По этой же причине цис-форма HNOO термодинамически стабильнее транс-формы на 8.1–10.9 кДж/моль [16].
Наличие ароматического заместителя в ArNOO, сопряженного с 4π-электронной нитрозооксидной группой, существенно стабилизирует ее. Арилнитрозооксиды, как и простейший нитрозооксид, также существуют в двух планарных (цис- и транс-) конформациях, которые близки по энергии. цис- и транс-Состояния ArNOO разделены значительным конформационным барьером [17] вследствие частичного π-связывания между атомами N и O. Относительно низкая скорость конформационного цис–транс-перехода объясняет экспериментальный факт, в соответствии с которым цис- и транс-ArNOO ведут себя как кинетически независимые частицы с различными химической природой и реакционной способностью. Согласно теоретическим оценкам [18], оптический спектр поглощения HNOO характеризуется максимумом при длине волны ~260 нм. Образование общей π-системы электронов заметно сдвигает полосу поглощения в электронных спектрах ароматических нитрозооксидов в длинноволновую область. Высокая полярность и динамичность π-электронной системы ароматических нитрозооксидов объясняет влияние растворителя на распределение электронной плотности: в работе [19] показано ее увеличение на нитрозооксидном фрагменте и рост дипольного момента цис–транс-изомеров ряда 4-R–C6H4NOO при увеличении диэлектрической проницаемости в ряду газовая фаза–н-гептан–бензол–ацетонитрил.
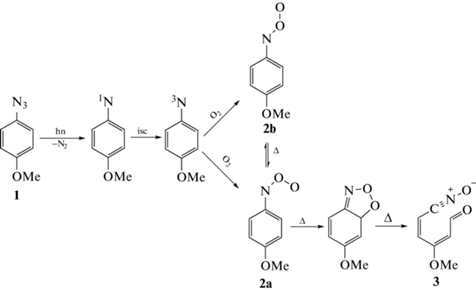
Поскольку нитрозооксиды являются короткоживущими интермедиатами, впервые их смогли зафиксировать лишь в 1971 г., используя матричную изоляцию в сочетании со спектральными методами [20]. На сегодняшний день в нашей лаборатории для изучения изомерных форм этих лабильных частиц успешно применяется еще один метод – импульсный фотолиз с разрешенной во времени спектрофотометрией, с помощью которого в средах различной полярности при комнатной и выше температуре были идентифицированы изомеры для ряда арилнитрозооксидов. Гибель Ar‑NOO, в отличие от родственных арилкарбонилоксидов Ar2COO, протекает по кинетическому закону первого порядка [8] даже когда отсутствует субстрат окисления. Объяснение наблюдаемому кинетическому закону расходования ArNOO дано на примере фотоокисления 4-метоксифенилазида 1 в растворе ацетонитрила [9]. Было доказано протекание нетривиальной внутримолекулярной реакции [21], в которой терминальный атом кислорода цис-формы нитрозооксида 2а координируется по орто-углеродному атому ароматического кольца (схема 1 ) с образованием бициклического диоксазола. Является ли это соединение стабильной структурой или переходным состоянием, на сегодняшний день неизвестно. Сведения о спектральной идентификации диоксазола отсутствуют, а теоретические оценки дают неоднозначные результаты: расчеты методом G2MP2B3 свидетельствуют о наличии активационного барьера высотой 15 кДж/моль для реакции распада диоксазола [22], тогда как при моделировании в приближении M06L/6-311 + G(d,p) минимума на поверхности потенциальной энергии (ППЭ) реакционной системы, соответствующего диоксазолу, не найдено [23]. В любом случае, раскрытие метастабильного диоксазолового цикла по связям С–С и О–О приводит к нитрилоксиду 3. Очевидно, что реакцию орто-циклизации может претерпевать только цис-изомер нитрозооксида. Тем не менее, авторы [10] показали, что в продукт 3 превращаются оба изомера нитрозооксида 2, т.е. основным каналом расходования 2b является его транс–цис изомеризация в 2a:
Схема 1 . Механизм фотоокисления ароматических азидов.
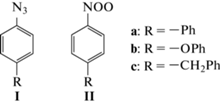
В зависимости от электронных свойств заместителя R в ароматическом кольце исходного нитрозооксида стабильность образующегося нитрилоксида 3 изменяется. Для сравнительно устойчивого нитрилоксида (R = OMe) осуществлена его прямая спектральная идентификация [10]. В других случаях промежуточное образование 3 зафиксировано по стабильным продуктам его последующих внутримолекулярных трансформаций [12, 23] и (3 + 2)-циклоприсоединения к растворителю – ацетонитрилу [13]. Движущей силой этих превращений является наличие реакционного центра – кратной связи или неподеленной электронной пары, по которому происходит электрофильная атака нитрилоксида с образованием гетероциклических оксимов [23], бензизоксазолов [12] и оксадиазолов [13]. Ароматический заместитель в нитрозооксиде также представляет собой потенциальный реакционный центр для атаки нитрилоксида, но такая возможность до сих пор не изучена. По этой причине объектами исследования в настоящей работе стали азиды Ia–Ic, фотоокисление которых должно приводить к нитрозооксидам IIa–IIc интересующего нас строения. Однако реакционная способность IIa–IIc в реакции орто-циклизации не изучена. В работах [21, 24] проведено систематическое теоретическое исследование влияния свойств и положения заместителя R в бензольном кольце на активационный барьер ΔH≠ внутримолекулярной орто-циклизации ароматических нитрозооксидов. Известно, что наличие заместителя в орто-положении существенно воздействует на величину энтальпии активации орто-циклизации [24], тогда как роль пара-заместителя не столь очевидна [21]. В связи с этим в представленной работе с помощью импульсного фотолиза арилазидов 4-R–C6H4N3 (где R = –Ph, –ОPh, –CH2Ph) (Ia–IIc) в ацетонитрильных растворах изучено влияние заместителя в пара-положении на спектральные характеристики изомерных форм ароматических нитрозооксидов 4-R–C6H4NOO (IIa–IIc), а также на закономерности их кинетического поведения и термодинамические параметры. Полученные результаты сопоставлены с соответствующими параметрами для других ранее исследованных ароматических нитрозооксидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ацетонитрил (“Криохром”) для высокоэффективной жидкостной хроматографии (ВЭЖХ) использовали без предварительной очистки. Арилазиды синтезировали согласно [25].
Кинетические исследования проводили на установке импульсного фотолиза известной конструкции [26]. Фотолитический источник – лампа ИФП 5000-2 (“РадиоТехИндустрия”, Россия), максимальная энергия импульса – 400 Дж при U = = 5 кВ, С = 32 мкФ, ∼90% световой энергии излучается за 50 мкс. Спектрофотометрическая часть установки состоит из зондирующего источника непрерывного излучения – ксеноновой лампы ДКСШ-150 (“Западприбор”, Россия) с системой кварцевых линз и диафрагм для формирования зондирующего луча, монохроматора МДР-4 (ООО “ТД Лабор”, Россия), фотоэлектронного умножителя ФЭУ-97 (“Западприбор”, Россия) и запоминающего осциллографа С9-8 (“Минский завод "Калибр”, Беларусь). Эта установка дополнена устройством компьютерной обработки импульсного сигнала. Сигнал с ФЭУ после предварительной компенсации постоянной составляющей усиливается и поступает на вход цифрового осциллографа, работающего в ждущем режиме. Осциллограф позволяет запоминать сигнал (2048 точек) с минимальным разрешением по времени 50 нс и дискретностью по напряжению в 256 уровней. Оцифровку сигнала осуществляли через интерфейс КОП (IEEE-488, GIPB). Обработку кинетических кривых проводили методом нелинейного регрессионного анализа. Ошибка в определении констант скорости составляла не более 10%. Реактор – термостатируемая кварцевая кювета с оптической длиной l = = 10 см и внутренним диаметром ~1 см. Оптические спектры изученных нами пара-замещенных фенилазидов Ia–Ic имеют схожие черты со спектрами других фенилазидов [27]: основной максимум в области 250–260 нм (lg ε ≥ 4) и широкое плечо на 280–300 нм (lg ε ≥ 3), затухающее примерно к 360–380 нм. Импульсный фотолиз растворов арилазидов в ацетонитриле осуществляли фильтрованным светом (светофильтр УФС-2, диапазон пропускания λ = 270–380 нм). Начальная концентрация азидов составляла (1–2) × 10–4 моль/л. Чтобы уменьшить скорость разложения азидов под действием зондирующего луча, область их поглощения вырезали светофильтром СС-15, пропускающим свет в интервале волн 300–520 нм, а при подготовке измерения зондирующую лампу перекрывали специальной шторкой. Холостыми опытами показано, что при указанных концентрациях ArN3 разложение азида за время эксперимента (несколько секунд) незначительно и не вносит погрешности в результаты измерений. Активационные параметры реакции определяли в интервале температур 277–333 К.
Все DFT-вычисления проводили с использованием функционала плотности M06L [28] и поляризационного базисного набора тройного валентного расщепления 6-311 + G(d,p) [29, 30]. В работе [17] было показано, что данный уровень теории адекватно воспроизводит геометрическое строение ароматических нитрозооксидов, их равновесные и неравновесные энергетические параметры, а также колебательные спектры ArNOO. Квантово-химические расчеты выполняли на кластерном суперкомпьютере Уфимского института химии УФИЦ РАН с применением программного пакета Gaussian 09, Revision C.1 [31].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
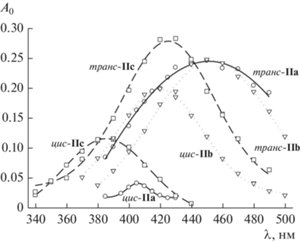
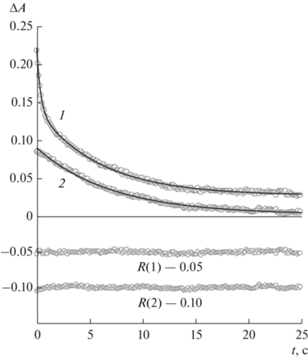
При импульсном фотолизе ацетонитрильных растворов азидов Ia–Ic в присутствии кислорода воздуха образуются цис- и транс-изомеры соответствующих нитрозооксидов IIa–IIc, которые регистрируются по оптическому поглощению в области длин волн 380–500 нм. Наблюдаемый сигнал уменьшается до некоторого постоянного значения в течение нескольких секунд (рис. 1). В спектральном диапазоне длин волн, в котором свет поглощают обе изомерные частицы, кинетические кривые убыли оптической плотности состоят из быстрого и медленного участков (рис. 1, кривая 1): они соответствуют расходованию обоих форм ArNOO, отличающихся реакционной способностью, и хорошо описываются пятипараметровым биэкспоненциальным уравнением (1):
(1)
$\Delta A = {{A}_{\infty }} + A_{0}^{{{\text{cis}}}}{{e}^{{ - {{k}_{{{\text{cis}}}}}t}}} + A_{0}^{{{\text{trans}}}}{{e}^{{ - {{k}_{{{\text{trans}}}}}t}}},$Рис. 1.
Типичные кинетические кривые убыли дифференциальной оптической плотности раствора Ic ([Ic]0 = 2 × 10–4 моль/л) после облучения светом импульсной лампы, записанные на длине волны 380 нм (1) и 460 нм (2) и их апроксимация (сплошные линии) по уравнениям (1) и (2) соответственно; T = 295 К, ацетонитрил. Ниже приведены отклонения аппроксимирующей функции от экспериментальных значений оптической плотности R для обеих кинетических кривых.
Электронные спектры поглощения изомеров IIa–IIc (рис. 2) определяли по рассчитанным величинам A0(λ) при выполнении условия, что генерация ArNOO и слежение за оптической плотностью на всех длинах волн проводится в идентичных условиях (концентрация азида, энергия импульса света). Вид оптических спектров IIa–IIc, положение максимумов поглощения соответствуют ранее установленным закономерностям для других арилнитрозооксидов [8] и теоретическим расчетам [12], согласно которым спектры поглощения транс-изомера нитрозооксидов смещены в длинноволновую область по сравнению со спектрами цис-изомера. Значения λmax для IIa–IIc представлены в табл. 1, в которую для сравнения внесены данные [8] о максимумах поглощения изомерных форм фенилнитрозооксида (IId), 4-метил- (IIe) и 4-метокси-фенилнитрозооксида (IIf). В ряду –H < –Me < –Ph наблюдается батохромный сдвиг максимумов поглощения цис-изомеров ArNOO при переходе от незамещенного фенилнитрозооксида IId к IIa. Для транс-изомеров батохромное смещение λmax еще более заметно. Наблюдаемый порядок закономерен в рамках теории цветности: энергия электронного π → π*- перехода, ответственного за полосу поглощения арилнитрозооксидов в видимой области спектра, уменьшается при увеличении области сопряжения в IIa. Нарушение сопряжения за счет мостиковой метиленовой группы –CH2–Ph в нитрозооксиде IIc приводит к обратному смещению максимума поглощения до значения, близкого к λmax для метилзамещенного ArNOO IIe. Кислородный мостик в IIb (–O–Ph) также нарушает сопряжение между двумя бензольными кольцами, которые располагаются в перпендикулярных плоскостях (M06L расчет). Однако атом кислорода за счет неподеленных электронных пар донирует электронную плотность в π-систему ароматического нитрозооксида. Сильный донорный эффект заместителей –OPh и –OMe обусловливает значительный батохромный сдвиг на 40–50 нм максимумов поглощения цис-изомеров IIb и IIf и на 50–55 нм – для транс-изомеров по сравнению с простейшим арилнитрозооксидом IId.
Таблица 1.
Максимумы поглощения (λmax), эффективные константы скорости (k) и активационные параметры (lgA, Еакт, Т = 277–333 К) гибели изомерных форм пара-замещенных фенилнитрозооксидов в ацетонитриле
| Параметры | Изомерная форма | Группа | |||||
|---|---|---|---|---|---|---|---|
| –Ph | –OPh | –CH2Ph | –H [8] | –Me [8] | –ОMe [8] | ||
| λmax, нм | цис- | 405 | 420 | 385 | 380 | 390 | 430 |
| транс- | 450 | 455 | 425 | 405 | 425 | 460 | |
| k, с–1 (295 K) | цис- | 2.5 ± 0.3 | 4.3 ± 0.4 | 2.78 ± 0.06 | 1.19 ± 0.06 | 2.25 ± 0.06 | 11.3 ± 0.2 |
| транс- | 0.19 ± 0.02 | 0.22 ± 0.02 | 0.15 ± 0.02 | 0.10 ± 0.01 | 0.17 ± 0.01 | 0.37 ± 0.02 | |
| lgA, (с–1) | цис- | 12.9 ± 0.2 | 12.0 ± 0.1 | 12.5 ± 0.1 | 12.6 ± 0.2 | – | 11.7 ± 0.1 |
| транс- | 10.3 ± 0.2 | 12.4 ± 0.1 | 11.4 ± 0.2 | 10.0 ± 0.3 | – | 11.4 ± 0.2 | |
| Еакт, кДж/моль | цис- | 70 ± 1 | 64 ± 1 | 69 ± 1 | 70 ± 1 | – | 60.5 ± 0.3 |
| транс- | 63 ± 1 | 74 ± 1 | 70 ± 2 | 62 ± 2 | – | 67.2 ± 0.9 | |
Обращает на себя внимание интересная закономерность: отношение величин ${{A_{0}^{{{\text{trans}}}}} \mathord{\left/ {\vphantom {{A_{0}^{{{\text{trans}}}}} {A_{0}^{{{\text{cis}}}}}}} \right. \kern-0em} {A_{0}^{{{\text{cis}}}}}}$ в максимумах поглощения изомеров IIa–IIc заметно меняется в зависимости от природы пара-заместителя (рис. 2). Аналогичную закономерность наблюдали в работе [8] для нитрозооксидов IId–IIf. Для незамещенного нитрозооксида и ArNOO с C‑центрированными заместителями это отношение велико (~3–5). В оптических спектрах IIb и IIf величина $A_{0}^{{{\text{cis}}}}$ составляет примерно 80% от $A_{0}^{{{\text{trans}}}}.$ Очевидно, на отношение ${{A_{0}^{{{\text{trans}}}}} \mathord{\left/ {\vphantom {{A_{0}^{{{\text{trans}}}}} {A_{0}^{{{\text{cis}}}}}}} \right. \kern-0em} {A_{0}^{{{\text{cis}}}}}}$ должны влиять начальные концентрации цис- и транс-изомеров ArNOO, генерируемые при фотолизе азидов, коэффициенты экстинкции изомеров. Следует также учитывать сложную кинетическую схему гибели нитрозооксидов (схема 1 ), согласно которой совместное протекание обратимой цис–транс-изомеризации и необратимой орто-циклизации может оказывать заметное влияние на расчетные величины предэкспоненциальных членов в уравнении (1). Исследование природы наблюдаемого эффекта проводится в настоящее время в нашей лаборатории.
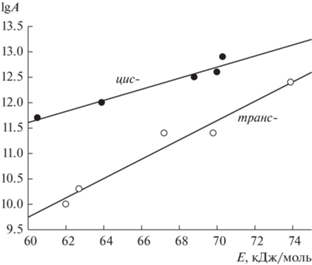
Эффективные константы скорости гибели изомеров нитрозооксидов IIa–IIc, определенные с помощью уравнений (1) и (2) и представленные в табл. 1, демонстрируют закономерности, аналогичные установленным ранее для IId–IIf и ряда других арилнитрозооксидов. Константы скорости ktrans примерно на порядок-полтора ниже величин kcis, слабо меняются в ряду изученных нитрозооксидов и лежат в интервале 0.15–0.22 с–1 (295 K). Константы скорости kcis для IIa и IIc в пределах экспериментальной погрешности совпадают, а фенокси-заместитель приводит к увеличению kcis примерно в 1.5–2 раза. В табл. 1 также включены результаты исследования температурных зависимостей констант скорости гибели цис- и транс-конформеров IIa–IIc и литературные данные для IId и IIf. Видно, что энергии активации расходования как цис-, так и транс-изомеров изменяются в одном и том же интервале значений – 60–70 кДж/моль, а отмеченное выше различие в реакционной способности изомеров определяется в первую очередь величиной предэкспоненциального множителя в уравнении Аррениуса. Интересно отметить, что для обоих изомеров арилнитрозооксидов наблюдается близкая к линейной (коэффициент корреляции равен 0.98 в обоих случаях) зависимость между величинами lgA и энергии активации (рис. 3). Проявление компенсационного эффекта мы связываем с тем, что для всех изученных нитрозооксидов транс-изомер расходуется одинаковым образом – превращается в цис-изомер в результате конформационного поворота по связи N–O. Аналогично, все цис-изомеры IIa–IIf претерпевают необратимую трансформацию в соответствующий нитрилоксид согласно cхеме 1.
Рис. 3.
Компенсационный эффект в реакциях расходования цис- и транс-изомеров ароматических нитрозооксидов.
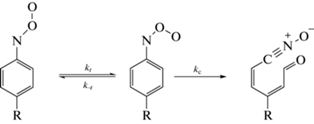
Действительно, в недавней работе [32] была показана общность механизма мономолекулярного расходования пара-замещенных арилнитрозооксидов на примере фотоокисления незамещенного фенилазида, а также его пара-замещенных аналогов с электронодонорным (MeO) и электроноакцепторными (Cl, Br) заместителями. Наряду с основными продуктами превращения ArNOO – нитрилоксидами или продуктами их дальнейшей трансформации – в реакционной смеси обычно регистрируется сравнительно небольшое количество нитро- (ArNO2) и нитрозосоединений (ArNO) [12, 13, 23, 32]. Мы связываем их образование с побочными фотоиндуцированными реакциями арилнитрозооксидов. Кинетически эти реакции могут проявляться в незначительном увеличении наблюдаемых констант скорости kcis и ktrans, и в пределах экспериментальной погрешности ими можно пренебречь. Таким образом, формально-кинетическая схема процесса гибели ароматических нитрозооксидов IIa–IIf сводится к трем стадиям с элементарными константами скорости kt, k–t и kc (схема 2 ):
Схема 2 . Кинетическая схема гибели ароматических нитрозооксидов.
Поскольку все реакции – суть мономолекулярные превращения, для системы дифференциальных уравнений, отвечающей схеме 2 , существует аналитическое решение, которое имеет вид взвешенной суммы экспонент [17]. Переходя от концентраций к значениям оптической плотности, нетрудно получить аналитическую пятипараметровую зависимость A(t), совпадающую по форме с эмпирически подобранным уравнением (1). Аналитическое решение позволяет дать строгую физико-химическую трактовку наблюдаемых констант скорости kcis и ktrans – уравнения (3)–(6):
(6)
${{\delta }} = {{\left[ {{{{{\sigma }}}^{2}} - 4{{k}_{{\text{c}}}}{{k}_{{\text{t}}}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}.$Уравнения (3)–(6) дают возможность рассчитать значения элементарных констант скорости из экспериментально определенных kcis и ktrans. Однако для однозначного решения необходимо дополнительное условие, связывающее элементарные константы скорости функциональной зависимостью. Таким условием является выражение для константы равновесия цис–транс-изомеризации. В соответствии с уравнением изотермы Вант-Гоффа
(7)
$\frac{{{{k}_{{\text{t}}}}}}{{{{k}_{{ - {\text{t}}}}}}} = K = {\text{exp}}\left( { - \frac{{\Delta G^\circ }}{{RT}}} \right),$Для нахождения элементарных констант скоростей стадий из эффективных констант выражения (3)–(7) были преобразованы в систему уравнений (8):
(8)
$\left\{ {\begin{array}{*{20}{c}} {{{k}_{{\text{c}}}} + {{k}_{{\text{t}}}} + {{k}_{{ - {\text{t}}}}} = {{k}_{{{\text{cis}}}}} + {{k}_{{{\text{trans}}}}}} \\ {{{k}_{{\text{c}}}}{{k}_{{\text{t}}}} = {{k}_{{{\text{cis}}}}}{{k}_{{{\text{trans}}}}}} \\ {{{k}_{{\text{t}}}} = {{k}_{{ - {\text{t}}}}}K} \end{array}} \right..$Из трех алгебраических уравнений с тремя неизвестными нетрудно получить квадратное уравнение относительно одной из элементарных констант скорости. Положительный корень квадратного уравнения представляет собой искомую константу скорости, подставляя которую в уравнения системы (8), находили остальные константы. Расчет элементарных констант скорости kt, k–t и kc проведен для всех нитрозооксидов во всем диапазоне температур наших экспериментов. Учет температурной зависимости константы равновесия ΔG° = ΔH° – TΔS° осуществляли в приближении постоянства энтальпии и энтропии цис–транс-изомеризации. Вычисленные константы элементарных стадий представлены в табл. 2.
Таблица 2.
Константы скорости гибели (k, с–1, 295 K), активационные параметры (lgA, (c–1); Е, кДж/моль) и M06L/6-311 + G(d,p) энтальпии активации (ΔH≠, кДж/моль) элементарных стадий процесса гибели ароматических нитрозооксидов
| ArNOO | kt | lgAt | Et | $\Delta H_{{\text{t}}}^{ \ne }$ | k–t | lgA–t | E–t | $\Delta H_{{ - {\text{t}}}}^{ \ne }$ | kc | lgAc | Ec | $\Delta H_{{\text{c}}}^{ \ne }$ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IIa | 0.21 | 10.2 | 62.2 | 68.4 | 0.20 | 10.3 | 62.6 | 68.9 | 2.23 | 12.8 | 70.5 | 77.7 |
| IIb | 0.22 | 12.4 | 73.9 | 69.6 | 0.04 | 12.2 | 76.9 | 72.6 | 4.24 | 11.9 | 63.5 | 74.1 |
| IIc | 0.15 | 11.4 | 69.9 | 67.7 | 0.07 | 11.2 | 70.4 | 68.2 | 2.71 | 12.5 | 68.8 | 74.4 |
| IId | 0.12 | 9.7 | 60.4 | 67.9 | 0.17 | 9.8 | 60.1 | 67.5 | 1.00 | 12.6 | 70.9 | 75.9 |
| IIe | 0.19 | – | – | 68.0 | 0.18 | – | – | 68.9 | 2.05 | – | – | 76.0 |
| IIf | 0.37 | 11.4 | 67.3 | 70.0 | 0.13 | 11.6 | 70.8 | 73.5 | 11.16 | 11.7 | 60.3 | 75.2 |
Результаты расчета элементарных констант скорости, описывающих расходование изомеров ароматических нитрозооксидов, позволяют сделать ряд заключений. Во-первых, реакция орто-циклизации выигрывает конкуренцию у изомеризации цис-изомера в транс-форму, kc$ \gg $ k–t. Поскольку и kc$ \gg $ kt, выражения для эффективных констант скорости существенно упрощаются: ktrans ≈ kt, kcis ≈ kc + k–t ≈ kc. Вклад изомеризации цис-изомера в общую скорость его расходования в нитрозооксидах IIb, IIc, IIf мал, в IIa, IIe составляет ~10% и только в IId достигает ~20%. По этой причине наблюдаемые величины энергий активации Ecis и Etrans близки к энергиям активации соответствующих элементарных стадий. Во-вторых, теоретические оценки активационных барьеров стадий схемы 2 свидетельствуют, что ΔH≠цис–транс-изомеризации определяются достаточно надежно: наблюдаемое отклонение от экспериментальных данных носит случайный характер, а среднее абсолютное отклонение равно 4.6 кДж/моль. Энергетический барьер орто-циклизации IIa–IIf систематически завышаются в среднем на 8.7 кДж/моль при расчетах в приближении M06L/6-311 + G(d,p). Хотя по абсолютной величине погрешность невелика, теория предсказывает соотношение констант скорости (kt, k–t > kc) отличное от экспериментально наблюдаемого (kt, k–t < kc). Это обстоятельство необходимо учитывать в дальнейшем при теоретическом анализе реакционной способности ароматических нитрозооксидов.
ЗАКЛЮЧЕНИЕ
Каскадные трансформации, реализующиеся при фотоокислении ароматических азидов и включающие цепочку высокоактивных интермедиатов: нитрен–нитрозооксид–нитрилоксид, завершаются образованием различных гетероциклических структур [12, 13, 23, 32] в зависимости от строения исходного арилазида, в частности, от природы заместителя в ароматическом кольце. Потенциальной ловушкой нитрилоксидной функции может быть ароматическая система, поэтому в настоящей работе нами исследованы кинетические закономерности гибели предшественников нитрилоксида – цис- и транс-изомеров нитрозооксидов IIa–IIc, содержащих ароматический заместитель в пара-положении. Определены константы скорости обратимой изомеризации транс-конформеров в соответствующую цис-форму, а также орто-циклизации цис-изомеров с образованием нитрилоксидов. Наличие фенильного фрагмента в заместителе влияет на реакционную способность изомеров ArNOO, что видно из сопоставления эффективных констант скорости для исследуемых соединений и структурно-аналогичных нитрозооксидов, но с алифатическими заместителями (табл. 1). Однако наблюдаемый эффект невелик, что в целом согласуется с выводами [24], сделанными на основании DFT-моделирования орто-циклизации ряда замещенных арилнитрозооксидов. Трехстадийный механизм гибели ArNOO позволяет получить аналитическое решение системы дифференциальных уравнений, описывающих совместное расходование цис- и транс-изомеров. Это обстоятельство существенно расширяет перспективы кинетического анализа реакционной способности ArNOO. В частности, вычисление элементарных констант скорости всех стадий механизма гибели нитрозооксидов с помощью экспериментально определяемых эффективных констант скорости (табл. 2). Другая возможность – использование спектрально-кинетических данных измерений методом импульсного фотолиза к раздельному определению коэффициентов экстинкции изомеров Ar‑NOO – исследуется в настоящий момент в нашей лаборатории.
Список литературы
Грицан Н.П., Притчина Е.А. // Успехи химии. 1992. Т. 61. № 5. С. 910. (Gritsan N.P., Pritchina E.A. // Russ. Chem. Rev. 1992. V. 61. № 5. P. 500.)
Грицан Н.П. // Успехи химии. 2007. Т. 76. № 12. С. 1218. (Gritsan N.P. // RUSS CHEM REV. 2007. V. 76. № 12. P. 1139.)
Ishiguro K., Sawaki Y. // Bull. Chem. Soc. Japan. 2000. V. 73. P. 535.
Sawwan N., Greer A. // Chem. Rev. 2007. V. 107. № 7. P. 3247.
Slayden S.W., Greer A., Liebman J.F. In The Chemistry of Hydrxylamines, Oximes and Hydroxamic Acids. Eds. Rappoport Z., Liebman J.F. John Wiley & Sons Ltd: 2011. V. 2.
Чайникова Е.М., Хурсан С.Л., Сафиуллин Р.Л. // Докл. АН. 2003. Т. 390. № 6. С. 796. (Chainikova E.M., Khursan S.L., Safiullin R.L. // Dokl. Phys. Chem. 2003. V. 390. P. 163.)
Чайникова Е.М., Хурсан С.Л., Сафиуллин Р.Л. // Докл. АН. 2005. Т. 403. № 3. С. 358. (Chainikova E.M., Khursan S.L., Safiullin R.L. // Dokl. Phys. Chem. 2005. V. 403. P. 133.)
Чайникова Е.М., Хурсан С.Л., Сафиуллин Р.Л. // Кинетика и катализ. 2006. Т. 47. № 4. С. 566. (Chainikova E.M., Safiullin R.L., Khursan S.L. // Kinetics and Catalysis. 2006. V. 47. № 4. P. 549.)
Чайникова Е.М., Сафиуллин Р.Л., Спирихин Л.В. // Докл. АН. 2012. Т. 442. № 2. С. 200. (Chainikova E.M., Safiullin R.L., Teregulova A.N., Spirikhin L.V., Galkin E.G. // Dokl Chem. 2012. V. 442. P. 30.)
Chainikova E.M., Safiullin R.L., Spirikhin L.V., Abdullin M.F. // J. Phys. Chem. A. 2012. V. 116. № 31. P. 8142.
Chainikova E.M., Pankratyev E.Y., Teregulova A.N., Gataullin R.R., Safiullin R.L. // J. Phys. Chem. A. 2013. V. 117. № 13. P. 2728.
Chainikova E.M., Yusupova A.R., Khursan S.L., Teregulova A.N., Lobov A.N., Abdullin M.F., Enikeeva L.V., Gubaydullin I.M., Safiullin R.L. // J. Org. Chem. 2017. V. 82. № 15. P. 7750.
Chainikova E.M., Khursan S.L., Yusupova A.R., Teregulova A.N., Abdullin M.F., Lobov A.N., Safiullin R.L. // J. Org. Chem. 2020. V. 85. № 16. P. 10813.
Nakamura S., Takahashi M., Okazaki R., Morokuma K. // J. Am. Chem. Soc. 1987. V. 109. № 14. P. 4142.
Талипов М.Р., Хурсан С.Л., Сафиуллин Р.Л. // Журн. физ. химии. 2011. Т. 85. № 3. С. 427. (Talipov M.R., Khursan S.L., Safiullin R.L. // Russ. J. Phys. Chem. A. 2011. V. 85. № 3. P. 364.)
Talipov M.R., Khursan S.L., Safiullin R.L. // J. Phys. Chem. A. 2009. V. 113. № 23. P. 6468.
Yusupova A.R., Safiullin R.L., Khursan S.L. // J. Phys. Chem. A. 2016. V. 120. № 28. P. 5693.
Талипов М.Р., Рыжков А.Б., Хурсан С.Л., Сафиуллин Р.Л. // Журн. структ. химии. 2006. Т. 47. № 6. С. 1062. (Talipov M.R., Safiullin R.L., Ryzhkov A.B., Khursan S.L. // J. Struct. Chem. 2006. V. 47. № 6. P. 1051.)
Талипов М.Р., Хурсан С.Л. // Вестник Башкирск. ун-та. 2005. Т. 10. № 2. С. 42. (Talipov M.R., Khursan S.L. // Vestn. Bashkir. univ. 2005. V. 10. № 2. P. 42.)
Brinen J.S., Singh B. // J. Am. Chem. Soc. 1971. V. 93. № 24. P. 6623.
Талипов М.Р., Хурсан С.Л., Сафиуллин Р.Л. // Журн. физ. химии. 2012. Т. 86. № 2. С. 292. (Talipov M.R., Khursan S.L., Safiullin R.L. // Russ. J. Phys. Chem. A. 2012. V. 86. № 2. P. 235.)
Chainikova E., Khursan S., Lobov A., Erastov A., Khalilov L., Mescheryakova E., Safiullin R. // Tetrahedron Lett. 2015. V. 56. № 32. P. 4661.
Chainikova E., Khursan S., Yusupova A., Lobov A., Abdullin M., Safiullin R. // Tetrahedron Lett. 2018. V. 59. № 34. P. 3267.
Yusupova A.R., Chainikova E.M., Safiullin R.L., Khursan S.L. // Int. J. Quantum Chem. 2020. V. 120. № 4. e26094.
Hu M., Li J., Yao S.Q. // Org. Lett. 2008. V. 10. № 24. P. 5529.
Масленников С.И., Николаев А.И., Комиссаров В.Д. // Кинетика и катализ. 1979. Т. 20. № 2. С. 326. (Maslennikov S.I., Nikolaev A.I., Komissarov V.D. // Kinet. Katal. 1979. V. 20. P. 326.)
UV/Visible Spectra by Talrose V., Yermakov A.N., Usov A.A., Goncharova A.A., Leskin A.N., Messineva N.A., Trusova N.V., Efimkina M.V., Eds., NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg MD, 20899 (retrieved July 31, 2021). https://doi.org/10.18434/T4D303
Zhao Y., Truhlar D.G. // J. Chem. Phys. 2006. V. 125. № 19. 194101.
Wachters A.J.H. // J. Chem. Phys. 1970. V. 52. № 3. P. 1033.
McLean A.D., Chandler G.S. // J. Chem. Phys. 1980. V. 72. № 10. P. 5639.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Petersson G.A., Nakatsuji H., Li X., Caricato M., Marenich A.V., Bloino J., Janesko B.G., et al. Gaussian 09, Wallingford, CT. 2009.
Chainikova E.M., Abdullin M.F., Lobov A.N., Teregulova A.N., Safiullin R.L. // Mendeleev Commun. 2021. V. 31. № 2. P. 233.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ