Кинетика и катализ, 2022, T. 63, № 2, стр. 187-192
Оценка интегральной токсичности фотокатализаторов на основе графитоподобного нитрида углерода в люминесцентном тесте
Е. Б. Чубенко a, *, А. В. Баглов b, Н. В. Дудчик c, Е. В. Дроздова c, О. А. Емельянова c, В. Е. Борисенко a, b
a Белорусский государственный университет информатики и радиоэлектроники,
220013 Минск, ул. П. Бровки, 6, Беларусь
b Национальный исследовательский ядерный университет “МИФИ”
115409 Москва, Каширское шоссе, 31, Россия
c Научно-практический центр гигиены,
220012 Минск, ул. Академическая, 8, Беларусь
* E-mail: eugene.chubenko@gmail.com
Поступила в редакцию 18.05.2021
После доработки 19.07.2021
Принята к публикации 19.08.2021
- EDN: VRMVOT
- DOI: 10.31857/S0453881122020010
Аннотация
Методом одностадийного разложения смеси тиомочевины и ацетата цинка получена тройная гетеросистема, состоящая из кристаллического графитоподобного нитрида углерода, оксида цинка и сульфида цинка (g-C3N4/ZnO/ZnS). Проведена оценка показателя интегральной токсичности полученного материала в люминесцентном тесте с генетически модифицированным штаммом Escherichia coli в качестве тест-объекта. Эффект гашения люминесценции E. coli был отмечен как под воздействием УФ-излучения за счет фотокаталитических реакций на поверхности g-C3N4/ZnO/ZnS, приводящих к образованию радикал-ионов с сильной окислительной способностью, взаимодействующих с клеточной мембраной, так и без облучения за счет механического взаимодействия с клетками бактерий. При концентрации g-C3N4/ZnO/ZnS в водном растворе 0.3 г/л под УФ-излучением индекс токсичности T достигает величины 75.6%. При этом превышение индекса токсичности Т тройной гетеросистемы в исследованном диапазоне концентраций от 0.1 до 0.3 г/л по сравнению с чистым графитоподобным нитридом углерода, полученным в тех же условиях синтеза, достигает 6% под УФ-излучением и 10–11% без освещения.
ВВЕДЕНИЕ
Чистая питьевая вода – важный стратегический ресурс для человечества, так как в настоящее время все еще четверть населения планеты не имеет к ней постоянного доступа [1]. Помимо неорганических и органических частиц и растворенных в воде химических соединений опасность представляют также различные находящиеся в ней патогенные микроорганизмы, такие как бактерии, вирусы, простейшие, грибки [2, 3]. Обычные методы обеззараживания предполагают использование химических веществ, содержащих в большинстве случаев ионы хлора, которые сами по себе не менее опасны для людей, чем патогенные микроорганизмы [3].
Альтернативным способом дезинфекции является использование фотокаталитических реакции на поверхности полупроводников, приводящих к появлению радикал-ионов с высокой реакционной способностью: OH•, ${\text{O}}_{2}^{{-- \bullet }}$ и 1O2, а также молекул H2O2, которые могут взаимодействовать с микроорганизмами, вызывая их гибель [4, 5]. Высокая эффективность фотокаталитической очистки воды была продемонстрирована при применении оксида титана (TiO2) [6, 7] и оксида цинка (ZnO) в качестве фотокатализаторов [8, 9]. Большая ширина запрещенной зоны и положение энергетических зон этих материалов обеспечивают эффективный гетерогенный фотокатализ, но при этом спектр поглощения вышеуказанных оксидов сужается до ультрафиолетового (УФ) диапазона, составляющего только 4% от энергии солнечного излучения [6–9]. Поэтому необходим поиск других материалов, обладающих высокой фотокаталитической активностью, простотой получения и не содержащих редкие или дорогостоящие элементы.
Графитоподобный нитрид углерода (g-C3N4) является уникальным органическим полупроводником с шириной запрещенной зоны 2.70–2.88 эВ при комнатной температуре [10, 11], обладающий высокой химической и термической стойкостью. Он признан эффективным фотокаталитическим материалом, который можно использовать для генерации водорода, очистки воды от химических примесей и ее обеззараживания [10–12]. Структура материала представляет собой мономолекулярные графеноподобные слои соединенных между собой молекул гептазина, удерживаемых друг с другом силами Ван-дер-Ваальса, что делает ее схожей со структурой графита [10, 13]. В связи с этим можно ожидать схожего механизма воздействия g-C3N4 на патогенные микроорганизмы, когда антибактериальный эффект достигается за счет как физического, так и химического взаимодействия [14–17]. Непосредственный контакт наночастиц или отдельных монослоев g‑C3N4 с белковой мембраной микроорганизма способен приводить к ее механическому повреждению и гибели организма вследствие утечки внутриклеточного матрикса. Кроме того, окислительный стресс повреждает ДНК и вызывает митохондриальную дисфункцию, что ведет к ингибированию размножения и роста бактерий [18].
Для повышения эффективности g-C3N4 для очистки и обеззараживания воды на его основе создают гетероструктуры, включающие различные широкозонные полупроводники, такие как ZnO, TiO2, ZrO2, ZnS, SiC или органические материалы [19–23], которые сами по себе также являются эффективными фотокатализаторами [24]. Для получения гетероструктур на основе g-C3N4 обычно используются многошаговые методы, в которых последовательно формируется ядро из g-C3N4, которое покрывается оболочкой из широкозонного полупроводника.
В настоящей работе применен другой принцип создания гетероструктур g-C3N4/широкозонный полупроводник, предусматривающий одновременное пиролитическое разложение исходных веществ – прекурсоров – и in situ образование гетероструктуры при использовании ацетата цинка для получения частиц широкозонных оксида и сульфида цинка в составе гетероструктуры, и проведена оценка их эффективности для очистки воды от санитарно значимых микроорганизмов по сравнению с чистым g-C3N4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Чистый g-C3N4 синтезировали методом пиролитического разложения прекурсоров с их последующей термической полимеризацией, описанный в работах [25, 26]. В качестве прекурсора применяли тиомочевину, навеску которой размещали в керамическом тигле, который затем герметизировали массивной крышкой через прокладку, выполненную из алюминиевой фольги. Это обеспечивало квазигерметичные условия, при которых избыточные газы могли покидать объем тигля, но при этом проникновение веществ извне было ограничено. Подготовленный таким образом тигель помещали в муфельную печь, нагревали до целевой температуры 500°С в течение 2 ч и выдерживали при ней 30 мин. Постепенное охлаждение тигля происходило в течение 8 ч. Полученный материал извлекали из тигля и механически измельчали до порошкообразного состояния с размером частиц менее 10 мкм.
Синтез гетеросистем на основе графитоподобного нитрида углерода, оксида и сульфида цинка также проводили методом пиролитического разложения прекурсоров с их последующей термической полимеризацией. В данном случае в качестве исходных соединений, как и в работах [27, 28], использовали тиомочевину и ацетат цинка. Равные по массе навески этих веществ помещали в керамический тигель, герметизировали и нагревали в муфельной печи до заданной температуры, равной 500°С.
Структура и состав полученных материалов были изучены методами растровой электронной микроскопии на электронном микроскопе S-4200 (“Hitachi”, Япония), рентгеновского микроанализа на спектрометре QUANTAX 200 (“Bruker”, Германия) и рентгеновской дифрактометрии на дифрактометре ДРОН-3 (Россия) с источником CuKα-излучения (λ = 1.54179 нм).
Токсическое воздействие фотокатализатора оценивали при помощи биосенсора “Эколюм” (Россия), основанного на лиофилизированной культуре специально подобранного генно-инженерного штамма люминесцентных бактерий кишечной палочки Escherichia coli (Е. coli) с внедренным lux-опероном. Представители бактерий кишечной группы являются санитарно-значимыми и могут контаминировать водные источники. Поэтому они хорошо подходят в качестве модельного загрязнителя, который может быть удален фотокаталитическим методом.
Воздействие фотокатализаторов на культуры бактерий оценивали при помощи прибора экологического контроля Биотокс-10М (“НЕРА-С”, Россия) путем сравнения интегральной люминесценции содержащих бактерии проб в присутствии частиц фотокатализатора и контрольных проб без фотокатализатора. Индекс токсичности T, %, определяли как процентное отношение изменения интенсивности свечения контрольной пробы I0 без фотокатализатора и пробы с фотокатализатором IF, к интенсивности свечения контрольной пробы I0.
(1)
$T = 100 \times {{\left( {{{I}_{0}} - {{I}_{{\text{F}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{I}_{0}} - {{I}_{{\text{F}}}}} \right)} {{{I}_{0}}}}} \right. \kern-0em} {{{I}_{0}}}}.$Перед проведением измерений токсичности образцов биосенсор “Эколюм” регидрировали путем добавления в стеклянную емкость с биосенсром 10 мл стерильной дистиллированной воды и выдерживания полученной суспензии при комнатной температуре в течение 30 мин. Затем в кюветы прибора экологического контроля Биотокс-10М помещали 0.1 мл рабочей суспензии бактерий и 0.9 мл взвеси частиц порошка исследуемого образца в дистиллированной воде. В контрольные пробы вместо этого добавляли 0.9 мл стерильной дистиллированной воды. Суммарный объем проб составлял, таким образом, 1 мл. Концентрацию частиц фотокатализатора в результирующей пробе изменяли от 0.1 до 0.3 г/л. Измерение токсичности проб проводили через 30 мин экспозиции. Часть проб, содержащих частиц материалов на основе нитрида углерода, была выдержана под воздействием УФ-излучения в течение 30 мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В результате термообработки тиомочевины при 500°С в закрытом тигле был получен твердый материал светло-желтого цвета, обладающей сложной микроструктурой, включающей большое число объектов – пластинок и частиц размером от 1 до 10 мкм – хаотично соединенных друг с другом (рис. 1а). По данным рентгеновского микроанализа синтезированный материал содержит углерод и азот в соотношении СC/СN = 0.48 (табл. 1). Эта величина меньше соответствующего стехиометрическому значения (0.75), что связано с неполной полимеризацией материала и так называемым “кинетическим ограничением”, обусловленным разложением образующегося g-C3N4 с выделением и испарением углеродсодержащих веществ (в частности, HСN) в процессе синтеза [17–19]. Концентрация кислорода в материале составляет 5.43 ат. %.
Рис. 1.
Электронные микрофотографии поверхности порошка, полученного термообработкой тиомочевины (а), и композита тиомочевина/ацетат цинка (б).

Таблица 1.
Элементный состав полученных материалов
| Прекурсор | Концентрация элемента, ат. % | Соотношение концентраций элементов | |||||
|---|---|---|---|---|---|---|---|
| СС | CN | CO | CZn | CS | CC/CN | CZn/CS | |
| Тиомочевина | 30.80 | 63.77 | 5.43 | – | – | 0.48 | – |
| Тиомочевина/ацетат цинка | 36.23 | 44.28 | 7.45 | 7.49 | 4.55 | 0.82 | 1.64 |
Материал, полученный в результате термообработки смеси тиомочевины и ацетата цинка, также представляет собой твердый порошок желто-коричневого цвета, но имеет нескольку другую микроструктуру, содержащую более крупные кристаллиты (рис. 1б). Соотношение углерода и азота равно 0.82, что превышает стехиометрическую величину 0.75. Это указывает на присутствие остаточного углерода, появление которого в осадке может быть следствием разложения кислотного остатка уксусной кислоты (CH3COO–) в составе ацетата цинка в замкнутом объеме тигля. Соотношение СZn/СS составляет 1.64, что превышает стехиометрическую величину равную единице. Наличие избыточного цинка может быть связано с кислородом, концентрация которого в достигает 7.45 ат. %. Это на 2 ат. % больше концентрации кислорода в материале, сформированном при отжиге тиомочевины, и близко к количеству свободного цинка, что говорит о возможности существования фазы ZnO.
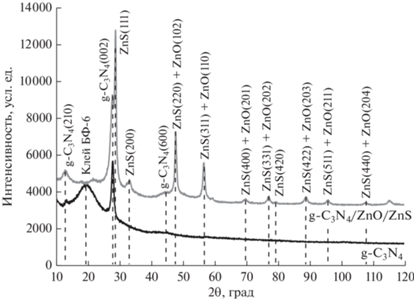
На рентгеновских дифрактограммах образцов (рис. 2) можно выделить линии, соответствующие отражению от кристаллографических плоскостей с индексами (210), (002) и (600) g-C3N4, находящихся на углах 2θ = 12.75°, 27.65° и 44.45° [21]. На дифрактограмме образца, синтезированного из смеси тиомочевины и ацетата цинка, присутствует большое число рефлексов, относящихся к отражениям от различных кристаллографических плоскостей ZnS с кубической кристаллической решеткой типа сфалерита и ZnO с гексагональной решеткой типа вюрцита. Самый интенсивный пик при угле 2θ = 27.5° соответствует плоскости ZnS (111), остальные пики связаны с отражением от плоскостей: ZnS (200) при 2θ = 33.2°, ZnS (220) или ZnO (102) при 47.6°, ZnS (311) или ZnO (110) при 56.5°, ZnS (400) или ZnO (201) при 69.5°, ZnS (331) или ZnO (202) при 76.9° [28].
Рис. 2.
Рентгеновские дифрактограммы порошка, полученного термообработкой тиомочевины, и композита тиомочевина/ацетат цинка.
Прокариотические тест-модели хорошо подходят для оценки показателей биологического действия, интегральной токсичности и антимикробного потенциала в отношении инновационных технологий и материалов [6, 29–32]. Результаты оценки показателя интегральной токсичности полученных материалов (рис. 3) показывают, что эффективность их разрушающего воздействия на условно-патогенные микроорганизмы Е. coli без выдержки под УФ-излучением линейно увеличивается пропорционально их концентрации. Токсичность частиц, синтезированных из смеси тиомочевины и ацетата цинка, в среднем выше на 10–11%.
Рис. 3.
Эффективность воздействия полученных материалов на патогенные микроорганизмы до и после воздействия УФ-излучением.
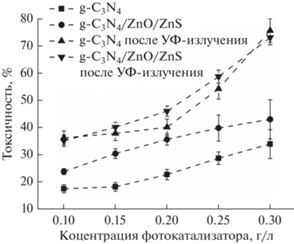
Облучение УФ-светом приводит к возрастанию индекса токсичности T на 10–20% и изменению характера зависимости его величины от концентрации исследуемых материалов в растворе от линейной к экспоненциальной. При концентрациях более 0.2 г/л она превышает 50%, что позволяет отнести полученные материалы к веществам с высокой токсичностью.
В соответствии с результатами рентгеновского микроанализа и рентгеновской дифрактометрии, синтезированный в результате пиролитического разложения тиомочевины материал представляет собой поликристаллический объемный g-C3N4 с хаотически расположенными кристаллитами. Добавление в состав исходных реагентов ацетата цинка приводит к формированию кристаллов ZnS и ZnO, которые оказываются встроенными в матрицу C3N4. Такой материал может быть обозначен как тройная гетеросистема – g-C3N4/ZnO/ZnS. Подробно процесс образования тройной наногетеросистемы путем пиролитического разложения тиомочевины и ацетата цинка был описан в [27, 28]. В этом процессе образующийся в результате разложения тиомочевины сероводород реагирует с оксидом цинка, являющимся продуктом разложения ацетата цинка, с формированием сульфида цинка в условиях ограниченного доступа кислорода.
Увеличение токсичности частиц чистого g-C3N4 при повышении их концентрации в растворе без освещения УФ-светом показывает, что они проявляют схожее с графеном [14–16] механическое токсическое воздействие на микроорганизмы, приводя при непосредственном соприкосновении к разрушению их клеточных оболочек. Продемонстрированная эффективность тройной гетеросистемы g-C3N4/ZnO/ZnS оказалась выше за счет дополнительного токсикологического действия при прямом контакте наночастиц ZnO и ZnS с протеиновыми оболочками бактерий. При таком контакте может происходить обмен электронами, приводящий к окислительному стрессу микроорганизмов [33–35] или фосфатному истощению их оболочек [33, 36].
При облучении УФ-излучением носители заряда генерируются как в g-C3N4, так и в наночастицах ZnO и ZnS, которые затем участвуют в образовании гидроксильных радикал-ионов OH•, ионов супероксида ${\text{O}}_{2}^{{-- \bullet }}$ и синглетного кислорода 1O2. Обладающие высокой окислительной способностью ионы реагируют с клеточными мембранами бактерий, вызывая их разрушение, что приводит к наблюдаемому росту токсического действия чистого g-C3N4 и гетеросистемы g-C3N4/ZnO/ZnS.
Разность эффективности g-C3N4/ZnO/ZnS и чистого g-C3N4 при облучении светом УФ-диапазона уменьшается по сравнению с результатами, полученными при отсутствии облучения, но при этом у гетеросистемы она остается все же несколько выше. Это указывает на более интенсивный фотокаталитический процесс, связанный с участием как электронов, так и дырок, что достигается за счет большей ширины запрещенной зоны ZnO и ZnS по сравнению с g-C3N4. Однако высокая эффективность при обеззараживании воды у чистого g-C3N4 сохраняется благодаря большой удельной площади поверхности.
ЗАКЛЮЧЕНИЕ
Тройная гетеросистема g-C3N4/ZnO/ZnS, полученная in situ в одном процессе методом термического разложения тиомочевины и ацетата цинка при температуре 500°С, продемонстрировала фотокаталитическую эффективность при облучении светом УФ-диапазона на микроорганизмы на примере Е. coli до 75.6% при максимальной исследованной концентрации 0.3 г/л. Фотокаталитическое воздействие гетеросистемы g-C3N4/ZnO/ZnS несколько выше, чем чистого g-C3N4, полученного при тех же условия, что обусловлено гетерогенным характером фотокаталитического процесса на поверхности кристаллов широкозонных полупроводников ZnO и ZnS.
Без облучения светом УФ-диапазона частицы чистого g-C3N4 и системы g-C3N4/ZnO/ZnS также обладают высокой токсичностью, связанной с механическим токсическим воздействием на микроорганизмы, приводящим при непосредственном соприкосновении к разрушению их клеточных оболочек. При этом g-C3N4/ZnO/ZnS проявляет бóльшую эффективность за счет токсикологического действия наночастиц ZnO и ZnS при их прямом контакте с протеиновыми оболочками бактерий.
Список литературы
Zhang C., Li Y., Shuai D., Shen Y., Xiong W., Wang L. // Chemosphere. 2019. V. 214. P. 462.
Дроздова Е.В. // Гигиена и санитария. 2012. Т. 6. С. 78.
Li Q., Mahendra S., Lyon D.Y., Brunet L., Liga M.V., Li D., Alvarez P.J. // Water Res. 2008. V. 42. P. 4591.
Wang D., Pillai S.C., Ho S.H., Zeng J., Li Y., Dionysiou D.D. // Appl. Catal. B: Environ. 2018. V. 237. P. 721.
Wang D., Zhu B., He X., Zhu Z., Hutchins G., Xu P., Wang W.N. // Environ. Sci. Nano 2018. V. 5. P. 1096.
Dudchik N.V., Drozdova E.V., Sychik S.I. // Health Risk Analysis. 2018. V. 3. P. 104–111.
Zhang C., Li Y., Wang D., Zhang W., Wang Q., Wang Y., Wang P. // Environ. Sci. Pollut. Res. 2015. V. 22. P. 10444.
Lee K.M., Lai C.W., Ngai K.S., Juan J.C. // Water Res. 2016. V. 88. P. 428.
Spasiano D., Marotta R., Malato S., Fernandez-Ibañez P., Di Somma I. // Appl. Catal. B: Environ. 2015. V. 170–171. P. 90.
Wen J., Xie J., Chen X., Li X. // Appl. Surf. Sci. 2017. V. 391. P. 72.
Wang A., Wang C., Fu L., Wong-Ng W., Lan Y. // Nano-Micro Lett. 2017. V. 9. P. 47.
Wang X., Maeda K., Thomas A., Takanabe K., Xin G., Carlsson J.M., Domen K., Antonietti M. // Nat. Mater. 2009. V. 8. P. 76.
Dong F., Li Y.H., Wang Z.Y., Ho W.K. // Appl. Surf. Sci. 2015. V. 358. P. 393.
Akhavan O., Ghaderi E. // ACS Nano. 2010. V. 4. P. 5731.
Li X., Li F., Gao Z., Fang L. // Bull. Environ. Contam. Toxicol. 2015. V. 95. P. 25.
Liu S., Zeng T.H., Hofmann M., Burcombe E., Wei J., Jiang R., Kong J., Chen Y. // ACS Nano. 2011. V. 5. P. 6971.
Wang X., Liu X., Han H. // Colloids Surf. B: Biointerfaces. 2013. V. 103. P. 136.
Zhao J., Wang Z., White J.C., Xing B. // Environ. Sci. Technol. 2014. V. 48. P. 9995.
Ong W.J., Tan L.L., Ng Y.H., Yong S.T., Chai S.P. // Chem. Rev. 2016. V. 116. P. 7159.
Shi L., Liang L., Wang F., Liu M., Chen K., Sun K., Zhang N., Sun J. // ACS Sustain. Chem. Eng. 2015. V. 3. P. 3412.
Jürgens B., Irran E., Senker J., Kroll P., Müller H., Schnick W. // J. Am. Chem. Soc. 2003. V. 125. P. 10288.
Ismael M. // J. Alloys Compd. 2020. V. 846. P. 156446.
Liang J., Yang X., Wang Y., He P., Fu H., Zhao Y., Zou Q., An X. // J. Mater. Chem. A. 2021. V. 9. P. 12898.
Vaizogullar A.I. // Kinet. Catal. 2018. V. 59. P. 418.
Chubenko E.B., Denisov N.M., Baglov A.V., Bondarenko V.P., Uglov V.V., Borisenko V.E. // Cryst. Res. Technol. 2020. V. 55. P. 1900163.
Baglov A.V., Chubenko E.B., Hnitsko A.A., Borisenko V.E., Malashevich A.A., Uglov V.V. // Semiconductors. 2020. V. 54. P. 226.
Chubenko E.B., Baglov A.V., Borisenko V.E. // Adv. Photonics Res. 2020. V. 1. P. 2000004.
Chubenko E.B., Baglov A.V., Leanenia M.S., Urmanov B.D., Borisenko V.E. // Mater. Sci. Eng. B. 2021. V. 267. P. 115109.
Дудчик Н.В. // Вестник Российской Военно-медицинской академии. 2008. Т. 1. С. 148.
Дудчик Н.В., Филонов В.П., Щербинская И.П. // Медицинский журн. 2010. № 3(33). С. 143.
Dudchik N.V., Sychik S.I., Shevlyakov V.V. // Theor. Appl. Ecology. 2018. № 4. P. 5.
Дроздова Е.В., Дудчик Н.В., Сычик С.И., Шевляков В.В. Оценка интегральной токсичности факторов и объектов среды обитания с использованием альтернативных биологических тест-моделей: методология и технологии. Минск: БелНИИТ “Транстехника”, 2017. С. 212.
Leung Y.H., Xu X., Ma A.P.Y., Liu F., Ng A.M.C., Shen Z., Gethings L.A., Guo M.Y., Djurišić A.B., Lee P.K.H., Lee H.K., Chan W.K., Leung F.C.C. // Sci. Rep. 2016. V. 6. P. 35243.
Li J., Wang G., Zhu H., Zhang M., Zheng X., Di Z., Liu X., Wang X. // Sci. Rep. 2014. V. 4. P. 4359.
Vecitis C.D., Zodrow K.R., Kang S., Elimelech M. // ACS Nano 2010. V. 4. P. 5471.
Gerber L.C., Moser N., Luechinger N.A., Stark W.J., Grass R.N. // Chem. Commun. 2012. V. 48. P. 3869.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


