Кинетика и катализ, 2022, T. 63, № 2, стр. 267-276
Кинетическая модель и механизм гидрирования ненасыщенных карбоциклических соединений на основе норборнадиена
В. В. Замалютин a, *, Е. А. Кацман a, А. В. Рябов a, А. Ю. Скрябина a, М. А. Шпынева a, В. Я. Данюшевский a, В. Р. Флид a, **
a МИРЭА – Российский технологический университет, Институт тонких химических технологий
имени М.В. Ломоносова,
119571 Москва, просп. Вернадского, 86, Россия
* E-mail: zamalyutin@mail.ru
** E-mail: vitaly-flid@yandex.ru
Поступила в редакцию 23.07.2021
После доработки 06.10.2021
Принята к публикации 19.11.2021
- EDN: BLTINP
- DOI: 10.31857/S0453881122020150
Аннотация
Жидкофазное гидрирование бицикло[2.2.1]гепта-2,5-диена (норборнадиена, ND) в присутствии промышленного палладиевого катализатора Pd/γ-Al2O3 (ПК-25) в среде н-гептана при 76°С проходит с последовательным образованием NE (норборнен, бицикло[2.2.1]гепт-2-ен) и NA (норборнан, бицикло[2.2.1]гептан), а также NT (нортрициклан, трицикло[2.2.1.02,6]гептан) в качестве минорного продукта. Идентифицированы продукты реакции, установлены основные маршруты ее протекания, изучен материальный баланс. Подтвержден эффект предпочтительной адсорбции ND по сравнению с остальными компонентами системы на активном палладиевом центре. На основании совокупности экспериментальных и теоретических данных предложена параллельно-последовательная схема механизма процесса. Установлен нулевой кинетический временной порядок в широком интервале начальных концентраций субстрата. Определены наблюдаемые константы скорости каждой стадии. На основе подхода Ленгмюра–Хиншелвуда и в допущении множественной адсорбции субстратов на одном активном центре гетерогенного катализатора составлена подробная кинетическая модель, адекватно описывающая полученные экспериментальные данные предложенным механизмом гидрирования ND. Обсуждена возможность “коктейльного” механизма протекания изучаемой реакции.
ВВЕДЕНИЕ
Химия норборнадиена (ND) и его производных вызывает неослабевающий интерес исследователей [1–8]. Эти соединения являются коммерчески доступными субстратами, синтезируемыми преимущественно по реакциям [4 + 2]-циклоприсоединения Дильса–Альдера из побочных продуктов переработки нефти в некаталитических условиях [1]. Норборненовые производные применяются для получения синтетического каучука СКЭПТ [2–4], эпоксидных смол [5–7], как альтернативные источники энергии [8–11], фармацевтические препараты [12, 13] и ароматизаторы [14]. Полинорборнены обладают уникальной структурой и могут быть использованы в качестве газоразделительных мембран [15, 16]. Высокоплотные полициклические насыщенные соединения, содержащие напряженные норборнановые фрагменты, имеют высокую удельную теплоту сгорания, что позволяет их применять в качестве компонентов ракетных и моторных топлив [17–20].
Селективное получение насыщенных карбоциклических структур, сохраняющих напряженный углеродный каркас, является важной фундаментальной и прикладной задачей. Для ее решения требуется разработка селективных катализаторов и подбор мягких условий для жидкофазного гидрирования модельных соединений норборненового ряда на основе систематически проводимых кинетических исследований. В этой связи ND представляется хорошим модельным объектом для изучения механизмов и закономерностей гидрирования в гетерогенном катализе. Понимание кинетических закономерностей гетерогенного гидрирования ND может стимулировать не только развитие представлений о строении и функционировании активных центров гетерогенного катализатора [21], но и создать предпосылки для разработки соответствующих технологий.
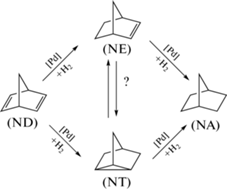
Ранее в процессах газо- и жидкофазного гетерогенного гидрирования ND использовали катализаторы на основе Сu, Ag, Au и Pt (2% металла), предварительно наносимые методом пропитки на различные подложки [22]. При температурах выше 80°C все катализаторы показывают высокую активность при гидрировании норборнена (NE) и ND в проточной системе. При этом также обнаруживаются продукты деструкции норборнанового каркаса. При гидрировании ND в присутствии Pt/SiO2 (50–100°C) последовательно образуются NE и NA. Для катализаторов на основе Cu и Au дополнительно формируется значительное количество нортрициклана (NT) (схема 1 ).
Схема 1 . Вероятные стадии механизма гидрирования ND [22].
Так, использование катализатора Cu/SiO2 при 155 и 210°C способствует получению смеси NT и NA в почти равном соотношении при 100%-ной конверсии ND [22]. Значительному выходу NT способствует высокая температура и кислотность поверхности носителя.
Однако систематические исследования, базирующиеся на специально разработанном плане кинетического эксперимента [23, 24], для гидрирования ненасыщенных карбоциклических алкенов и диенов не проводились. Без таких данных крайне затруднителен подбор катализатора и условий реакции, позволяющих в мягких условиях селективно гидрировать норборнены с сохранением норборнанового каркаса. Из анализа литературных источников следует, что для достижения поставленной цели следует использовать мезопористые катализаторы с низким содержанием активного компонента. Такими свойствами обладает палладиевый катализатор корочкового типа ПК-25, применяемый для гетерогенного селективного гидрирования ацетиленов и диенов [25].
Цель настоящего исследования заключается в установлении особенностей жидкофазного гидрирования ND в реакторе периодического типа, создании кинетической модели, адекватно описывающей превращение ND в NA в присутствии ПК-25, и в выборе гипотезы о механизме этой реакции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали ND, который перед исследованием сушили над натриевой проволокой и перегоняли, а также растворители н-гептан (эталонный, “ХИММЕД”) и н-нонан – внутренний стандарт (для хроматографии “х. ч.”, “РЕАХИМ”) – без дополнительной очистки. Газообразные водород (марка А, чистота 99.99%, ГОСТ 3022-80) и азот (марка ОСЧ (1 сорт), чистота 99.999%) применяли без дополнительной очистки.
В качестве гетерогенного катализатора использовали промышленный палладиевый катализатор корочкового типа ПК-25 (ТУ 38.102178-96) (0.25% Pd/γ-Al2O3, удельная поверхность – 220 м2/г, дробление – 0.1–0.2 мм), применяющийся для селективного гидрирования (удаления) примесей ацетилена и диеновых углеводородов в жидких и газообразных продуктах пиролиза [25]. Соотношения ND : Pd в ходе опытов составляли 0.4–1.8 моль/л : 0.3 ммоль/л.
Навеску катализатора ПК-25 (0.50 г) восстанавливали в токе водорода (4 л/ч) в течение 180 мин при температуре опыта. При этом визуально наблюдалось почернение гранул катализатора. Электронное состояние палладия в составе катализатора и в составе активных центров, планируется установить в дальнейших исследованиях.
Методики проведения кинетических экспериментов и анализа продуктов гидрирования ND в термостатируемом статическом реакторе периодического действия объемом 100 мл с обратным холодильником и пробоотборником подробно описаны в нашей предыдущей работе [26]. Специальными опытами подобраны режимы перемешивания: при интенсивности встряхивания выше 380 мин–1 обеспечивается протекание процесса без заметных диффузионных ограничений. С этой же целью оптимизировали форму и размеры гранул катализатора (0.1–0.2 мм). Для идентификации всех компонентов смеси использовали хроматомасс-спектрометр Agilent 5973N (“Agilent Technologies”, США) с приставкой Agilent 6890 (тип ионизации – электронный удар, колонка Agilent 122-5536 DB-5ms).
Отбор реакционных проб осуществляли с периодичностью 1.5–5 мин без нарушения режима кинетического эксперимента. Их анализ проводили на хроматографе Кристалл 2000М (“Хроматэк”, Россия) (колонка VS-101 50 м × 0.2 мм, фаза – диметилполисилоксан). Время анализа – 27 мин; температура детектора и испарителя – 180°С; начальная температура колонки – 70°С; температурный режим колонки – 70°С (10 мин) – 15°С (12 мин) – 250°С (3 мин); газ-носитель – гелий; поток – 0.8 мл/мин; деление потока – 1 : 125. ГЖХ-анализом установлено, что в исходном ND содержится около 5% NE. Дополнительную очистку ND от NE не проводили, однако эту примесь учитывали при анализе проб, отобранных в ходе эксперимента.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для термодинамического обоснования превращений в полученной авторами [22] схеме, отражающей ключевые стадии механизма гидрирования ND (схема 1 ), нами проведен квантово-химический расчет в пакете Gaussian [27]. Оптимизацию геометрии и определение термодинамических параметров выполняли методами МР2 и МФП с использованием обменно-корреляционного функционала b3lyp с помощью базисного набора 6-311g(d,p) (табл. 1 и 2). Обоснованность выбранных методов связана с их оптимальной точностью для расчетов термодинамики небольших молекулярных структур при разумных затратах компьютерного времени. Эти методы применяли ранее [29–32] для нахождения термодинамических параметров в сходных системах. Полученные в газовой фазе значения ΔrH° для основных стадий механизма гидрирования ND (схема 1 ) методами МФП и МР2 удовлетворительно согласуются с экспериментальными значениями [33] (табл. 1). Использование метода функционала плотности оказалось предпочтительнее в силу заметно меньших затрат компьютерного времени при практически той же результативности. Рассчитанные в газовой фазе значения ΔrG° (табл. 2) позволяют обосновать превращения в схеме 1 на основе термодинамики. Как ранее нами уже отмечалось [26], возможная изомеризация NE в NT в исследуемых условиях термодинамически разрешена, но маловероятна. Это подтверждается специально проведенными опытами [26], в которых продемонстрировано, что изомеризация NE и NT в обоих направлениях при 76°С не происходит. Данные расчетов ΔrG° также указывают на возможность гидрирования NT в NA (табл. 2).
Таблица 1.
Экспериментальные [33] и расчетные значения ΔrH° основных стадий механизма гидрирования ND
| Превращение | ΔrH° (МФП), кДж/моль | ΔrH° (МP2), кДж/моль |
ΔrH° (эксп) [33], кДж/моль |
|---|---|---|---|
| ND + H2 → NE | –156.42 | –160.34 | –148 |
| NE + H2 → NA | –133.82 | –137.48 | –102 |
| ND+ H2 → NT | –162.62 | –177.11 | –150 |
| NE → NT | –6.1988 | –16.7717 | –1.26 |
| NT → NE | 6.1988 | 16.7717 | 1.26 |
| NT + H2 → NA | –127.63 | –120.71 | –101 |
Таблица 2.
Расчетные значения ΔrG° основных стадий механизма гидрирования ND
| Превращение | ΔrG° (МФП), кДж/моль | ΔrG° (МP2), кДж/моль |
|---|---|---|
| ND + H2 → NE | –119.54 | –123.57 |
| NE + H2 → NA | –97.29 | –101.44 |
| ND+ H2 → NT | –123.91 | –138.35 |
| NE → NT | –4.3662 | –14.7763 |
| NT → NE | 4.3662 | 14.7763 |
| NT + H2 → NA | –92.92 | –86.67 |
Составление плана кинетического эксперимента
Изучение кинетики гидрирования ацетиленов и цис-диенов водородом на палладиевых катализаторах показало, что согласно большому количеству литературных данных (например, приведенных в работах [21, 23]) эта реакция протекает с практически полным разделением первой и второй стадий по времени. Иными словами, пока в системе остается непрореагировавший ацетилен или диен, гидрирование накапливающегося олефина практически не происходит. Этот факт находит следующее объяснение: степень связывания активных Pd-центров диолефином или ацетиленом очень велика, свободные центры отсутствуют, и образующийся олефин не подвергается гидрированию. После исчерпывания реагента гидрирование олефина резко ускоряется, поскольку он получает возможность связываться с освободившимися активными центрами. Термодинамическое обоснование базируется на проведенных в настоящей работе кинетических исследованиях и на соотношении свободных энергий связывания активным Pd-центром ацетилена (или диена) и олефина [35, 36]. Такой подход позволяет значительно улучшить кинетическую модель, но существенные несоответствия все же остаются. Так, не удается адекватно отобразить кинетику реакции в широком диапазоне концентраций и степеней превращения [21, 23]. Отсюда возникает неудовлетворительное описание селективности реакции, что препятствует применению кинетических моделей для проектирования промышленных реакторов очистки олефинов от диеновых примесей. Ранее для таких случаев было предложено отказаться от постулата Ленгмюра и внести допущение, что активный центр при гидрировании связывает более одной молекулы ненасыщенных соединений [37–39]. Это допущение в некоторой степени схоже с теорией многослойной адсорбции Брунауэра–Эммета–Теллера БЭТ [28].
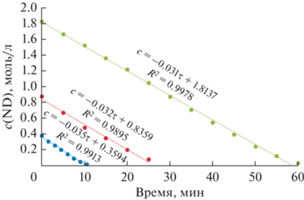
Для систематического проведения кинетических экспериментов был составлен подробный план (табл. 3). Рассмотрим экспериментальные зависимости “концентрация–время” (рис. 1). Они демонстрируют расходование NE с практически постоянной скоростью, что соответствует нулевому временному порядку по его концентрации. Такая особенность встречается редко и свидетельствует о сильном связывании олефина с активным центром катализатора, впрочем, существенно более слабым, чем с ND. Отметим, что скорости реакций гидрирования ND и NE практически совпадают. Вероятно, последовательность стадий главным образом зависит от способности реагентов к адсорбции, а скорость реакции – от состояния водорода перед присоединением к двойной связи. Последний вопрос о состоянии водорода на поверхности палладиевого катализатора является открытым и требует дополнительных исследований.
Рис. 1.
Концентрации ND и продуктов его гидрирования в зависимости от времени при начальной концентрации субстрата 1.82 моль/л; 76°С, н-гептан.
Для изучения особенностей кинетики гидрирования ND проведена серия из четырех опытов в реакторе периодического действия при 76°С в н-гептане согласно предварительно составленному плану кинетических экспериментов (табл. 3). Каждый опыт дублировали с целью проверки воспроизводимости получаемых кинетических данных. В ходе опыта число отобранных проб для ГЖХ-анализа достигало 25. В каждом эксперименте по концентрациям, определенным методом внутреннего стандарта, рассчитывали материальный баланс (суммарная погрешность была не более 5%). Условия проведенных опытов и их предварительные результаты обсуждены в нашей предыдущей работе [26].
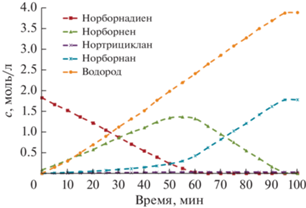
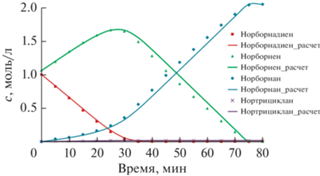
В настоящем исследовании остановимся более детально на кинетических особенностях изучаемого процесса. Кинетику жидкофазного гидрирования ND исследовали в интервале его начальных концентраций от 0.4 до 1.8 моль/л. На рис. 2 представлены типичные кинетические кривые ND и продуктов его гидрирования. Подобранный катализатор и условия опытов (в частности, температура реакции) способствуют селективному гидрированию ND в NA со 100%-ной конверсией субстрата с сохранением норборнанового каркаса. Прослеживается ярко выраженный стадийный характер процесса, что позволяет изучать кинетические особенности гидрирования не только ND, но промежуточного продукта – NE.
Рис. 2.
Концентрации ND и продуктов его гидрирования в зависимости от времени при начальной концентрации субстрата 0.38 моль/л; 76°С, н-гептан.
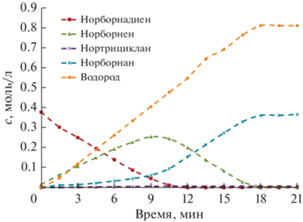
Во всех опытах в ходе гидрирования ND отношение его начальной концентрации к максимальной концентрации промежуточного продукта (NE) не изменяется и составляет примерно 1/0.71. Время достижения максимальной концентрации NE пропорционально увеличивается от 9 до 55 мин с ростом начальной концентрации ND. Сравнивая наклоны кинетических кривых ND и NE, можно сделать вывод об одинаковой скорости их расходования в ходе процесса. В присутствии ND промежуточный продукт в очень незначительной степени вступает во вторую стадию с образованием NA. После исчерпывания ND скорость образования NA значительно возрастает. Можно отметить практически одинаковые скорости поглощения водорода и образования NA.
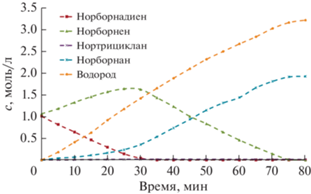
При гидрировании смеси, состоящей из ND и NE в эквимолярном соотношении, расходование NE происходит только после почти полного исчерпывания ND (рис. 3).
Рис. 3.
Концентрации ND, NE и продуктов их гидрирования в зависимости от времени при равных начальных концентрациях субстратов 1.0 моль/л; 76°С, н-гептан.
Кинетический временной порядок по ND и NE близок нулю в широких временных и концентрационных интервалах (рис. 4 и 5), что согласуется с порядками по субстрату и промежуточному продукту его гидрирования, определенными ранее для этих веществ [22]. Значения наблюдаемых констант скорости нулевого временного порядка гидрирования ND и NE равны между собой и в среднем составляют 0.033 моль л–1 мин–1. Особенность кинетики гидрирования ND можно объяснить тем, что он, подобно ацетиленам и сопряженным диенам, связывается с активным палладиевым центром значительно прочнее, чем NE и остальные компоненты реакции.
Рис. 5.
Расходование NE в зависимости от времени при его различных максимально накопленных концентрациях в ходе опытов; 76°С, н-гептан.
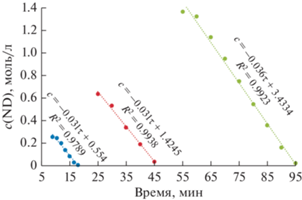
Следует отметить, что описанные выше закономерности гидрировании NE относятся к побывавшему в контакте с ND палладиевому катализатору. Очевидно, в будущем потребуется специальное исследование кинетики гидрирования чистого NE.
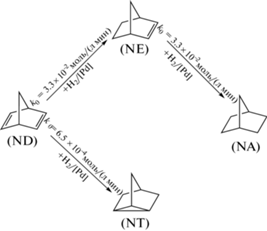
На основании анализа полученных экспериментальных, кинетических и теоретических данных (табл. 2) предложен механизм гидрирования ND (схема 2 ). Реакция имеет выраженный трехстадийный параллельно-последовательный характер. Термодинамически разрешенное превращение NT в конечный продукт гидрирования – NA – в условиях опыта практически не происходит, по-видимому, из-за его быстрой десорбции с поверхности палладиевого катализатора.
Схема 2 . Ключевые стадии механизма жидкофазного гидрирования ND.
Наличие минорного продукта – NT (до 2%) – является характерной особенностью механизма гидрирования. Он образуется непосредственно из ND и не расходуется на последующих этапах (схема 2 ). При 76°С скорость образования NT в 50 раз ниже скоростей гидрирования ND в NE и NE в NA соответственно. На выход минорного продукта NT влияет не только температура, как было показано в нашей предыдущей работе [26], но и наличие кислотных центров на катализаторе [22].
Характер кинетических кривых указывает на существенное торможение стадии гидрирования NE в присутствии ND. Это явление, вероятно, носит термодинамический характер из-за сильного связывания активного центра катализатора молекулой ND. Аналогичный эффект наблюдается при гидрировании ацетиленов и диенов [34] и подтверждается сравнительными расчетными данными об энергиях адсорбции для фенилацетилена и стирола на Pd/C [35, 36]. Из результатов проведенных кинетических исследований (рис. 1–3) следует, что ND и продукты его гидрирования сильно различаются по способности к адсорбции на поверхности ПК-25 (схема 3 , табл. 4):
Таблица 4.
Соотношения адсорбционных констант для субстратов на активном центре, полученные на основании предложенной математической модели кинетики реакции
| Параметр | $\frac{{{{K}_{1}}}}{{{{K}_{5}}}}$ | $\frac{{{{K}_{2}}}}{{{{K}_{5}}}}$ | $\frac{{{{K}_{3}}}}{{{{K}_{5}}}}$ | $\frac{{{{K}_{4}}}}{{{{K}_{5}}}}$ |
|---|---|---|---|---|
| Значение | 6.0 | 0.51 | 2.6 | 0.0079 |
| Погрешность, % | ±12 | ±12 | ±12 | ±130 |
Схема 3 . Способность ND и продуктов его гидрирования к адсорбции на поверхности катализатора ПК-25.
Построение математической модели кинетики реакции
Построение математической модели кинетики гетерогенно-каталитического гидрирования ND осуществляли с помощью программы “Кинетика”, которая была разработана одним из авторов настоящего исследования. Она позволяет решать прямые и обратные кинетические задачи, а также проводить численный анализ идентифицируемости параметров и вычисление погрешности полученных оценок [37, 38]. В представлении множественной адсорбции субстратов на одном активном центре гетерогенного катализатора предполагаемый механизм запишем в следующем виде:
Здесь C обозначает активный центр гетерогенного катализатора. Согласно модифицированной теории Ленгмюра (без постулата о составе адсорбционного комплекса 1 : 1) в предположении об адсорбционном равновесии и сравнительно малой концентрации активных центров получим:
Стадии реакции и их скорости:
| ${\text{С}} \cdot {\text{ND}} + {{{\text{H}}}_{2}} \to {\text{C}} + {\text{NE}};$ | ${{k}_{1}}\left[ {{\text{С}} \cdot {\text{ND}}} \right]$ |
| ${\text{С}} \cdot {\text{ND}} + 2{{{\text{H}}}_{2}} \to {\text{C}} + {\text{NA}};$ | ${{k}_{2}}\left[ {{\text{С}} \cdot {\text{ND}}} \right]$ |
| ${\text{С}} \cdot {\text{NE}} + {{{\text{H}}}_{2}} \to {\text{C}} + {\text{NA}};$ | ${{k}_{3}}\left[ {{\text{С}} \cdot {\text{NE}}} \right]$ |
| ${\text{С}} \cdot {{\left( {{\text{ND}}} \right)}_{2}} + {{{\text{H}}}_{2}} \to {\text{C}} \cdot {\text{ND}} + {\text{NE}};$ | ${{k}_{4}}\left[ {{\text{С}} \cdot {{{\left( {{\text{ND}}} \right)}}_{2}}} \right]$ |
| ${\text{С}} \cdot {{\left( {{\text{ND}}} \right)}_{2}} + 2{{{\text{H}}}_{2}} \to {\text{C}} \cdot {\text{ND}} + {\text{NA}};$ | ${{k}_{5}}\left[ {{\text{С}} \cdot {{{\left( {{\text{ND}}} \right)}}_{2}}} \right]$ |
| ${\text{С}} \cdot {{\left( {{\text{NE}}} \right)}_{2}} + {{{\text{H}}}_{2}} \to {\text{C}} \cdot {\text{NE}} + {\text{NA}};$ | ${{k}_{6}}\left[ {{\text{С}} \cdot {{{\left( {{\text{NE}}} \right)}}_{2}}} \right]$ |
| ${\text{С}} \cdot \left( {{\text{ND}}} \right) \cdot \left( {{\text{NE}}} \right) + {{{\text{H}}}_{2}} \to {\text{C}} \cdot {\text{NE}} + {\text{NE}};$ | ${{k}_{7}}\left[ {{\text{С}} \cdot \left( {{\text{ND}}} \right) \cdot \left( {{\text{NE}}} \right)} \right]$ |
| ${\text{С}} \cdot \left( {{\text{ND}}} \right) \cdot \left( {{\text{NE}}} \right) + 2{{{\text{H}}}_{2}} \to {\text{C}} \cdot {\text{NE}} + {\text{NA}};$ | ${{k}_{8}}\left[ {{\text{С}} \cdot \left( {{\text{ND}}} \right) \cdot \left( {{\text{NE}}} \right)} \right]$ |
| ${\text{С}} \cdot \left( {{\text{ND}}} \right) \cdot \left( {{\text{NE}}} \right) + {{{\text{H}}}_{2}} \to {\text{C}} \cdot {\text{ND}} + {\text{NA}};$ | ${{k}_{9}}\left[ {{\text{С}} \cdot \left( {{\text{ND}}} \right) \cdot \left( {{\text{NE}}} \right)} \right]$ |
| ${\text{С}} \cdot \left( {{\text{ND}}} \right) + {{{\text{H}}}_{2}} \to {\text{C}} + {\text{NT}}.$ | ${{k}_{{10}}}\left[ {{\text{С}} \cdot \left( {{\text{ND}}} \right)} \right]$ |
Поскольку эксперименты проводили при постоянном давлении водорода 1 атм, кинетическая модель реакции не включает давление водорода.
Математическая модель кинетики изучаемой реакции построена на основе подхода Ленгмюра–Хиншелвуда. Скорость стадии принята равной произведению константы скорости распада (k1–k10) адсорбционного комплекса на его концентрацию.
Визуально и по значениям стандартного критерия Фишера 0.8–1.2 предложенная кинетическая модель является адекватной, что подтверждает однородное распределение погрешности модель–эксперимент по измеренным откликам (4-м концентрациям) и по времени (рис. 6 и 7).
Рис. 6.
Результаты моделирования кинетики гидрирования ND при его начальной концентрации 0.38 моль/л; точки – экспериментальные данные, линии – расчетные значения.
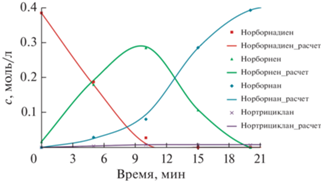
Рис. 7.
Результаты моделирования кинетики ND и NE при их начальных концентрациях 1.0 моль/л; точки – экспериментальные данные, линии – расчетные значения.
По кинетической модели процесса можно сделать следующие краткие выводы:
• равновесие адсорбции описано однозначно с достаточной точностью соотношениями констант, поскольку последние очень велики (табл. 4);
• константы скорости определены однозначно с хорошей точностью (табл. 5);
Таблица 5.
Значения констант скорости стадий гидрирования адсорбированных на активном центре субстратов
| Константа скорости |
k1 | k2 | k3 | k4 | k5 | k6 | k7 | k8 | k9 | k10 |
|---|---|---|---|---|---|---|---|---|---|---|
| Значение, мин–1 | 4.2 × 104 | 4.6 × 103 | 4.0 × 104 | 0 | 0 | 0 | 4.7 × 104 | 0 | 0 | 1.0 × 103 |
| Погрешность, % | ±2 | ±5 | ±2 | – | – | – | ±9 | – | – | ±2 |
• из модели нельзя исключить стадию гидрирования ND непосредственно в NA двумя молями водорода, так как это приводит к неадекватному описанию данных эксперимента, особенно в начальном периоде реакции;
• исключение адсорбции двух субстратов на одном каталитическом центре приводит к неадекватному описанию данных эксперимента;
• сокращение плана кинетических экспериментов, особенно за счет числа уровней начальной концентрации ND, крайне негативно сказывается на процессе дискриминации гипотез об участии возможных стадий в реальном механизме;
• осуществляются не все возможные по данному механизму стадии, а именно: – гидрирование ND до NE идет на С⋅ND и на С⋅ND⋅NE, но не происходит на С⋅ND⋅ND (возможна конкуренция с водородом за место на активном центре С) – гидрирование ND до NA двумя молями водорода идет на С⋅ND, но не происходит на С⋅ND⋅ND и С⋅ND⋅NE (то же) – гидрирование NE до NA идет на С⋅NE, но не происходит на С⋅NE⋅NE и С⋅ND⋅NE (то же);
• гидрирование ND до NT проходит, по-видимому, на С⋅ND.
Таким образом, достоверность идентификации механизма реакции полностью обоснована. При этом только стадия гидрирования ND до NE включает непосредственное участие смешанного комплекса, а влияние на кинетику остальных стадий гидрирования опосредованно осуществляется через адсорбционное равновесие образования остальных комплексов с координационным числом равным 2.
Отдельного обсуждения требует теоретическая возможность “коктейльного” механизма [39] протекания изучаемой реакции, то есть, соучастия в ней как растворимых, так и гетерогенных форм катализатора разной степени нуклеарности. Растворимые формы катализатора можно исключить из рассмотрения, поскольку в реакционной смеси во время реакции гравиметрическим и спектральными методами не обнаруживаются ни соединения палладия, ни высококипящие органические компоненты. Что касается нерастворимых форм катализатора, то независимость кинетики реакции от времени и состава раствора свидетельствует о том, что соотношение этих форм не подвержено изменению. В таком случае целесообразно опираться на общеизвестный принцип Оккама о выборе простейшей гипотезы, адекватно описывающей наблюдаемые закономерности. Она и представлена в настоящей статье.
Детали механизма гидрирования, связанные с характером участия в нем молекул водорода, следует уточнить в кинетическом исследовании с применением плана эксперимента, включающего варьирование его парциального давления. Такие исследования планируются в дальнейшем.
ЗАКЛЮЧЕНИЕ
Таким образом, на основании экспериментальных и теоретических исследований были установлены ключевые стадии механизма гидрирования ND. На основании модели Ленгмюра–Хиншелвуда с учетом множественной адсорбции субстратов на одном активном центре гетерогенного катализатора составлена подробная кинетическая модель. Исключение из модели стадии гидрирования ND непосредственно в NA двумя молями водорода приводит к неадекватному описанию данных эксперимента, особенно в начальном периоде реакции. Исключение адсорбции двух субстратов на одном каталитическом центре приводит к неадекватному описанию данных эксперимента. Был установлен нулевой кинетический временной порядок по ND и NE в широком диапазоне начальных концентраций, а также торможение гидрирования промежуточных продуктов в присутствии ND.
Список литературы
Tsai H., Luo M., Lin W., Chang C., Chen K. // Acta Crystallogr. Sect. E: Struct. Rep. Online. 2012. V. 68. P. o2945.
Fein K., Bousfield D.W., Gramlich W.M. // Carbohyd. Polym. 2020. V. 250. P. 117001.
Ravishankar P.S. // Rubber Chem. Technol. 2012. V. 85. P. 327.
Louie D.K. / Elastomers. Handbook of sulphuric acid manufacturing. Richmond Hill, Canada: DKL Engineering, Inc., 2005. P. 16.
Belov N.A., Gringolts M.L., Morontsev A.A., Starannikova L.E., Yampolskii Yu.P., Finkelstein E.Sh. // Polym. Sci. Series B. 2017. V. 59. P. 560.
Vintila I.S., Iovu H., Alcea A., Cucuruz A., Cristian M.A., Vasile B.S. // Polymers. 2020. V. 12. P. 1052.
Morontsev A.A., Denisova Yu.I., Gringolts M.L., Filatova M.P., Shandryuk G.A., Finkelshtein E.Sh., Kudryavtsev Ya.V. // Polym. Sci. Series B. 2018. V. 60. № 5. P. 688.
Флид В.Р., Грингольц М.Л., Шамсиев Р.С., Финкельштейн Е.Ш. // Усп. хим. 2018. Т. 87. С. 1169. [Flid V.R., Gringolts M.L., Shamsiev R.S., Finkelshtein E.Sh. // Russ. Chem. Rev. 2018. V. 87. P. 1169.]
Mansø M., Petersen A.U., Wang Z., Erhart P., Mogens Brøndsted Nielsen M.B., Moth-Poulsen K. // Nat. Commun. 2018. V. 9. P. 1945.
Orrego-Hernández J., Dreos A., Moth-Poulsen K. // Acc. Chem. Res. 2020. V. 53. № 8. P. 1478.
Kilde M.D., Mansø M., Ree N., Petersen A.U., Moth-Poulsen K., Mikkelsen K.V., Nielsen M.B. // Org. Biomol. Chem. 2019. V. 17. P. 7735.
Fiorino F., Perissutti E., Severino B., Santagada V., Cirillo D., Terracciano S., Massarelli P., Bruni G., Collavoli E., Renner C., Caliendo G. // J. Med. Chem. 2005. V. 48. № 17. P. 5495.
Rao V.N., Mane S.R., Abhinoy K., Sarma J.D., Shunmugam R. // Biomacromolecules. 2012. V. 13. № 1. P. 221.
Sundh U.B., Binderup M.-L., Bolognesi C., Brimer L., Castle L., Di Domenico A., Engel K.-H., Franz R., Gontard N., Gürtler R., Husøy T., Jany K.-D., Martine K.-C., Leclercq C., Lhuguenot J.-C., et al. // EFSA J. 2014. V. 12. № 6. P. 3714.
Carvalho V.P., Ferraz C.P., Lima-Neto B.S. // J. Mol. Catal. A: Chem. 2010. V. 333. P. 46.
Финкельштейн Е. Ш., Бермешев М. В., Грингольц М.Л., Старанникова Л. Э., Ямпольский Ю. П. // Успехи химии. 2011. Т. 80. С. 362. [Finkelshtein E.S., Bermeshev M.V., Gringolts M.L., Starannikova L.E., Yampolskii Y.P. // Russ. Chem. Rev. 2011. V. 80. P. 341.]
Pan Y., Zhang H., Zhang C., Wang H., Jing K., Wang L., Zhang X., Liu G. // Energy Fuels. 2020. V. 34. № 2. P. 1627.
Савоськин М.В., Капкан Л.М., Вайман Г.Е., Вдовиченко А.Н., Горкуненко О.А., Ярошенко А.П., Попова А.Ф., Мащенко А.Н., Ткачева В.А., Волошина М.Л., Потапова Ю.Ф. // Журн. прикладной химии. 2007. Т. 80. № 1. С. 32. [Savos’kin M.V., Kapkan L.M., Vaiman G.E., Vdovichenko A.N., Gorkunenko O.A., Yaroshenko A.P., Popov A.F., Mashchenko A.N., Tkachev V.A., Voloshin M.L., Potapov Yu.F. // Russ. J. Appl. Chem. 2007. V. 80. № 1. P. 32.]
Shorunov S.V, Zarezin D.P., Samoilov V.O., Rudakova M.A., Borisov R.S., Maximov A.L., Bermeshev M.V. // Fuel. 2021. V. 283. P. 118935.
Mikus M.S., Torker S., Hoveyda A.H. // Angew. Chem. Int. Ed. 2016. V. 55. P. 4997.
Кацман Е.А., Данюшевский В.Я., Шамсиев Р.С., Флид В.Р. Теория и практика гетерогенных катализаторов и адсорбентов. Под ред. Койфмана О.И. М.: URSS, 2020. С. 15.
Amir-Ebrahimi V., Rooney J.J. // Catal. Lett. 2009. V. 127. P. 20.
Беренблюм А.С., Аль-Вадхав Х.А., Кацман Е.А. // Нефтехимия. 2015. Т. 55. № 2. С. 125.
Силина И.С., Кацман Е.А., Трегер Ю.А., Розанов В.Н., Исхакова Л.Д., Ермаков Р.П., Колташев В.В., Брук Л.Г. // Тонкие химические технологии. 2017. Т. 12. № 2. С. 50.
Куттубаев С.Н., Рахимов М.Н., Павлов М.Л., Басимова Р.А., Кутепов Б.И. // Нефтегазовое дело. 2012. № 4. P. 165.
Замалютин В.В., Кацман Е.А., Данюшевский В.Я., Флид В.Р., Подольский В.В., Рябов А.В. // Координационная химия. 2021. Т. 46. № 10. (В печати).
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Petersson G.A., Nakatsuji H., Li X., Caricato M., Marenich A., Bloino J., Janesko B.G., et all. Gaussian 09, Revision A.02. / Gaussian, Inc., Wallingford CT, 2016.
Брунауэр С. Адсорбция газов и паров, Т. 1. Москва: ИЛ, 1948. 783 с.
Vessally E., Aryana S. // Russ. J. Phys. Chem. A. 2016. V. 90. № 1. P. 136.
Handzlik J., Stosur M., Kochel A., Szymańska-Buzar T. // Inorganica Chimica Acta. 2008. V. 361. № 2. P. 502.
Szabo R., Le K.N., Kowalczyk T. // Sustain. Energy Fuels. 2021. V. 5. P 2335.
Vessally E. // JICS. 2009. V. 6. P. 99.
Hall H.K., Jr., Smih C.D., Baldt J.H. // J. Am. Chem. Soc. 1973. V. 95. P. 3197.
Беренблюм А.С., Данюшевский В.Я., Кацман Е.А. // Кинетика и катализ. 2019. Т. 60. № 4. С. 411. [Berenblyum A.S., Danyushevsky V.Ya., Katsman E.A. // Kinet. Catal. 2019. V. 60. № 4. P. 381.]
Шамсиев Р.С., Данилов Ф.О., Морозова Т.А. // Изв. Акад. наук. Серия хим. 2017. Т. 66. № 3. С. 401. [Shamsiev R.S., Danilov F.O., Morozova T.A. // Russ. Chem. Bull. 2017. V. 66. № 3. P. 401.]
Шамсиев Р.С., Данилов Ф.О., Флид В.Р, Шмидт Е.Ю. // Изв. Акад. наук. Серия хим. 2017. Т. 66. № 12. С. 2234. [Shamsiev R.S., Danilov F.O., Flid V.R., Shmidt E.Yu. // Russ. Chem. Bull. 2017. V. 66. № 12. P. 2234.]
Беренблюм А.С., Аль-Вадхав Х.А., Кацман Е.А., Флид В.Р. // Кинетика и катализ. 2011. Т. 52. № 2. С. 305. [Berenblyum A.S., Al-Wadhaf H.A., Katsman E.A., Flid V.R. // Kinet. Catal. 2011. Т. 52. № 2. С. 296.]
Беренблюм А.С., Подоплелова Т.А., Кацман Е.А., Шамсиев Р.С., Данюшевский В.Я. // Кинетика и катализ. 2012. Т. 53. № 5. С. 634. [Berenblyum A.S., Podoplelova T.A., Katsman E.A., Shamsiev R.S., Danyushevsky V.Ya. // Kinet. Catal. 2012. V. 53. № 5. P. 595.]
Chernyshev V.M., Khazipov O.V., Eremin D.B., Denisova E.A., Ananikov V.P. // Coordin. Chem. Rev. 2021. V. 437. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ