Кинетика и катализ, 2022, T. 63, № 2, стр. 258-266
Сравнение активности Pd(0) И Pd(I) в низкотемпературном окислении монооксида углерода на катализаторе Pd/γ-Al2O3
А. В. Устюгов a, В. В. Корыпаева a, З. З. Обейдат a, А. Ю. Путин a, А. Л. Шварц a, Л. Г. Брук a, *
a ФГБОУ ВО МИРЭА – Российский технологический университет, Институт тонких химических технологий
им. М.В. Ломоносова
119571 Москва, просп. Вернадского, 86, Россия
* E-mail: lgbruk@mail.ru
Поступила в редакцию 06.08.2021
После доработки 13.09.2021
Принята к публикации 22.10.2021
- EDN: OJHWOD
- DOI: 10.31857/S0453881122020137
Аннотация
Низкотемпературное окисление монооксида углерода на катализаторе Pd/γ-Al2O3 изучено при комнатной температуре и атмосферном давлении воздуха, содержащего 100 мг/м3 СО. В ходе процесса наблюдается постепенная дезактивация катализатора. Выдержка частично дезактивированного катализатора на воздухе в течение 10–12 ч приводит к полному восстановлению активности. По данным РФЭС материал, полученный нанесением Pd3(OAc)6 на γ-Al2O3 до контакта с СО содержит соединения палладия в степени окисления I и 0. На основе корреляции между каталитической активностью и содержанием соединений Pd(I) и Pd(0) проведена оценка удельной каталитической активности соединений палладия в разной степени окисления, которая свидетельствует о более высокой активности соединений Pd(I) по сравнению с Pd(0).
ВВЕДЕНИЕ
Реакция окисления оксида углерода(II) кислородом представляет фундаментальный интерес, так как является одной из простейших реакций окисления и может использоваться в качестве модельной для выяснения общих закономерностей окислительных процессов. Кроме того, исследование ее интересно и с практической точки зрения, связанной с обезвреживанием газовых выбросов промышленных предприятий и транспорта и защитой людей от угарного газа. Среди катализаторов данной реакции принято выделять группу контактов, активных при температурах ниже 100°С (низкотемпературные катализаторы). Эти катализаторы используются в средствах индивидуальной защиты органов дыхания и установках санитарной очистки воздуха. Низкотемпературные гетерогенные катализаторы подразделяют на оксидные, металлические и нанесенные металлокомплексные [1, 2]. Их разработке и изучению посвящено большое число публикаций, однако до настоящего времени не выяснены природа активных центров и детальный механизм действия нанесенных металлических и оксидных катализаторов. Изучение механизма окисления монооксида углерода на палладиевых катализаторах осложняется многообразием возможных состояний палладия, имеющего лабильную координационную сферу и доступные степени окисления палладия: 0, I и II, а также способностью этих форм легко взаимопревращаться друг в друга при контакте катализатора с парами СО, воды и кислорода. Потенциально палладий в любой из перечисленных степеней окисления может проявлять каталитические свойства в окислении монооксида углерода. Информация об удельной активности различных состояний палладия в данной реакции представляет фундаментальный и практический интерес. В связи с вышесказанным изучение кинетики и механизма окисления CO остается актуальной проблемой.
Ранее нами были рассмотрены кинетические закономерности этой реакции и механизм действия катализатора PdCl2–CuCl2/γ-Al2O3, активные центры которого в условиях процесса содержат карбонильные комплексы палладия(I) и палладия(II) [3–5]. Следующей целью нашей работы является изучение механизма действия катализатора Pd/γ-Al2O3, который, судя по имеющимся данным [1, 6, 7], активен в низкотемпературном окислении монооксида углерода. Этот катализатор был объектом ряда исследований, но ясности с механизмом действия и распределением суммарной активности между различными формами палладия, присутствующими в условиях процесса окисления СО, нет.
Существуют различные методы получения наночастиц палладия на поверхности носителей [8]. Наиболее часто применяемые из них включают нанесение солей палладия, распадающихся при повышенных температурах, на поверхность носителя с последующим разложением соли и восстановлением палладия [8]. Мы использовали одну из таких методик, предусматривающих нанесение ацетата палладия(II) на поверхность γ-Al2O3 c последующим восстановлением [9]. Контроль распределения палладия между центрами, содержащими металл в различных степенях окисления, осуществляли с помощью рентгено-фотоэлектронной спектроскопии (РФЭС) (исследования были выполнены в ЦКП “Материаловедение и металлургия” Московского государственного института стали и сплавов).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методика приготовления катализатора 1.5 мас. % палладия на γ-Al2O3
Для получения катализатора использована методика пропитки носителя (γ-Al2O3) раствором ацетата палладия Pd3(CH3COO)6 в ацетоне с последующим испарением ацетона при комнатной температуре. Исходными веществами служили ацетат палладия Pd3(CH3COO)6 (методика приготовления приведена ниже), гранулированный γ-Al2O3 (г. Рязань, ЗАО “Промкатализ”, 2016 г., Sуд = 170 м2/г), ацетон C3H6O (ос. ч., партия № 8, ТУ 2633-012-29483781-2009).
Навеску 0.0194 г Pd3(CH3COO)6 и 1.1 мл ацетона помещали в бюкс и закрывали крышкой. Содержимое бюкса перемешивали до полного растворения ацетата палладия. Далее засыпали 1 мл (0.6134 г) носителя (γ-Al2O3, размер фракции 0.5–1 мм) и равномерно распределяли по дну бюкса таким образом, чтобы раствор полностью покрывал поверхность носителя. Закрывали бюкс крышкой и оставляли на сутки при комнатной температуре. По истечении указанного периода времени открывали крышку бюкса и оставляли образец сушиться до полного испарения ацетона при комнатной температуре. Полученный материал бледно-желтого цвета помещали в стеклянный реактор и выдерживали в течение 5 ч при комнатной температуре в токе воздуха (12 л/ч), содержащего 6 об. % монооксида углерода. При этом материал менял цвет на черный. Катализаторы хранили в бюксах в атмосфере воздуха.
Методика приготовления ацетата палладия
Синтез ацетата палладия Pd3(μ-CH3COO)6 осуществляли следующим образом. В термостойкий стакан емкостью 1000 мл наливали 100 мл царской водки (HCl : HNO3 = 1 : 1) и при нагревании порциями растворяли 5 г палладиевой черни. Полученный раствор доводили до объема в 600 мл дистиллированной водой, после чего нейтрализовали твердым КОН до выпадения бурого осадка гидроокиси палладия. К приготовленной смеси приливали еще 200 мл дистиллированной воды и восстанавливали NaBH4 до образования осадка палладиевой черни и обесцвечивания раствора. Палладиевую чернь промывали дистиллированной водой 8 × 1000 мл, а затем ледяной уксусной кислотой 3 × 300 мл. Полученную чернь переносили в круглодонную колбу емкостью 2000 мл с ~1000 мл ледяной уксусной кислоты, добавляли 4 мл концентрированной азотной кислоты и кипятили на воздушной бане с обратным холодильником в течение 3 ч (продувая воздухом каждые 10–15 мин до прекращения выделения бурого газа). Кипящий раствор отфильтровывали на фильтре Шотта 40 и оставляли остывать на 12 ч. Затем раствор упаривали на роторном испарителе до объема ~150 мл, полученный осадок темно-оранжевого цвета отфильтровывали на фильтре Шотта 40, промывали холодной ледяной уксусной кислотой (2 × 15 мл) и высушивали на воздухе в течение 1 ч, после чего помещали в эксикатор над щелочью на 2 сут. Выход продукта составлял 85% на введенный палладий.
Результаты элементного анализа ацетата палладия Pd3(μ-CH3COO)6
Найдено, мас. %: углерод (С) 21.62; водород (Н) 2.78.
Вычислено, мас. %: углерод (С) 21.39; водород (Н) 2.67.
Методика проведения экспериментов по испытанию катализаторов
Испытания нанесенных катализаторов на активность проводили в стеклянном проточном реакторе. Исходными веществами в экспериментах служили воздух и монооксид углерода. После загрузки восстановленного катализатора в реактор с определенной скоростью подавали газовоздушную смесь (ГВС), содержащую ~100 мг/м3 монооксида углерода, которую готовили путем смешения потоков атмосферного воздуха (подавали в установку при помощи компрессора) и потока воздух + монооксид углерода из газометра (концентрация монооксида углерода в газометре ~7 об. %). Контроль расхода газов осуществляли при помощи предварительно откалиброванных реометров. Необходимую влажность газовой смеси создавали сатуратором. Контроль влажности и температуры газовой смеси выполняли при помощи термогигрометра ИВТМ-7 (ЗАО “ЭКСИС”, Россия). Объемный расход газовой смеси определяли по газосчетчику ГСБ-400 (“ПромГазЭнерго”, Россия). Концентрацию монооксида углерода находили в исходном газе и газе после реактора с помощью сенсорного газоанализатора, снабженного электрохимическим датчиком ПГК-4 CO (ЗАО “ЭКСИС”, Россия). Исследования проводили при температуре ~25°C, объемной скорости ~12 000 ч–1 и влажности газовоздушной смеси ~14 г/м3.
Методика проведения РФЭС-анализа
Химический состав поверхности образцов катализаторов исследовали на рентгеновском фотоэлектронном спектрометре PHI5500VersaProbeII (“Physical Electronics”, США, ЦКП НИТУ МИСИС “Материаловедение и металлургия”). Использовали монохроматизированное AlKα-излучение (hν = 1486.6 эВ) мощностью 50 Вт, диаметр области анализа составлял 200 мкм. Атомные концентрации элементов определяли методом факторов относительной элементной чувствительности по обзорным спектрам. Спектры высокого разрешения снимали при энергии пропускания анализатора 23.5 эВ и плотности сбора данных 0.2 эВ/шаг. Калибровка шкалы энергии связи Есв проведена по фотоэлектронным линиям золота и меди: Au4f – 83.96 эВ, Cu2p3 – 932.62 эВ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На первом этапе по вышеприведенной методике были приготовлены катализаторы, характеристики которых приведены в табл. 1.
Таблица 1.
Характеристики образцов материалов, использованных в исследовании
| Обозначение образца | Характеристика образца |
|---|---|
| АП-8 Pd3(OAc)6/γ-Al2O3 |
Материал, полученный нанесением ацетата палладия на оксид алюминия, до восстановления монооксидом углерода |
| АП-8-1 | Материал, полученный восстановлением Pd3(OAc)6/γ-Al2O3 монооксидом углерода (катализатор) |
| АП-8-2 | Катализатор после определенного количества часов испытаний на каталитическую активность |
| АП-16 | Получен так же, как АП-8-1 |
| АП-16-10, АП-16-15, АП-16-17.5, АП-16-20.5, АП-16-25 | АП-16 после испытаний на каталитическую активность в течение 10, 15, 17.5, 20.5 и 25 ч соответственно |
Активность приготовленных катализаторов
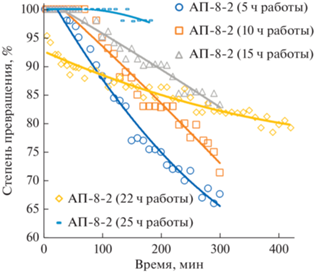
Катализаторы испытывали в сериях опытов длительностью 3–7 ч при ~25°C с использованием газовой смеси, содержавшей ~100 мг/м3 СО и ~14 г/м3 водяного пара в воздухе. После опыта реактор с катализатором продували воздухом и оставляли в реакторе на ночь. Иногда между экспериментами было 2–3 дня. Первая серия испытаний, проведенная с катализатором АП-8-1 (во всей серии использовали один и тот же образец), показала, что в ходе процесса степень превращения монооксида углерода понижается (рис. 1). Начальная степень превращения в каждом испытании была максимальна и в большинстве из них очень близка к 100%. Эти данные свидетельствуют о том, что процесс дезактивации, происходящий в ходе эксперимента, обратим. После пребывания на воздухе в течение 10–12 ч активность полностью восстанавливалась (рис. 1). Еще одна интересная особенность – каждый последующий опыт протекал более стационарно, т.е. с меньшей скоростью дезактивации.
Рис. 1.
Зависимость степени превращения монооксида углерода от времени опыта для катализатора АП-8-2. Условия проведения экспериментов: концентрация монооксида углерода на входе в реактор ~100 мг/м3, температура ~25°C, влажность ~14 г/м3, нагрузка на катализатор по газовоздушной смеси ~12 000 ч–1.
Наблюдаемые кинетические закономерности (рис. 1, рис. 2) нельзя, по нашему мнению, объяснить адсорбцией монооксида углерода на поверхности катализатора по следующим причинам.
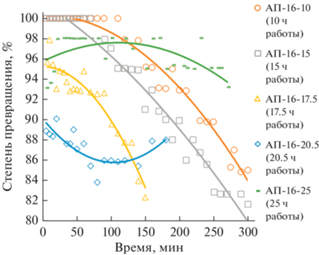
Рис. 2.
Зависимость степени превращения СО от времени опыта для катализатора АП-16. Условия проведения экспериментов: концентрация монооксида углерода на входе в реактор ~100 мг/м3, температура ~25°C, влажность ~14 г/м3, нагрузка на катализатор по газовоздушной смеси ~12 000 ч–1.
С начала XX в. известно, что монооксид углерода практически не адсорбируется на поверхности обычных сорбентов (активированных углей, силикагелей, оксидов алюминия). С этой проблемой столкнулись разработчики противогазов в первой четверти прошлого века и были вынуждены применять гопкалитовые патроны для защиты от угарного газа. Мы этот факт проверяли с использованием носителей до нанесения активных компонентов. Поэтому можно обсуждать только комплексообразование СО с палладием, находящимся на поверхности оксида алюминия.
Для приготовления 1 мл катализатора палладий/оксид алюминия использовано 0.0194 г ацетата палладия. Количество молей палладия, нанесенное на 1 мл оксида алюминия, равно 0.0194 : 224.42 = 8.6445 × 10–5 моль. Количество СО, пропущенное через катализатор за 6 ч при скорости подачи газа 12 л/ч и содержании СО в исходном газе 100 мг/м3, составляет 0.1 г × 0.012 м3 × × 6 = 7.2 × 10–3 г или 2.6 × 10–4 моль. Средняя за 6 ч степень превращения СО – примерно 90%. С учетом этого на моль палладия приходится 2.7 моль превращенного СО. Все более или менее устойчивые карбонильные комплексы палладия образуются при сравнительно высоких парциальных давлениях СО (а не при 10–3 мм рт. ст.) и содержат, как правило, не более одного моля монооксида углерода на моль палладия [10–13]. К тому же после 5–6 ч проведения процесса поглощение монооксида углерода не заканчивается, а лишь замедляется на 15–20%. Кроме того, надо учесть, что, по-видимому, не все атомы палладия доступны для взаимодействия с монооксидом углерода, т. к. часть из них находится в узких порах носителя.
Все перечисленное, по нашему мнению, позволяет считать, что в указанных условиях протекает каталитическое окисление монооксида углерода, а не адсорбция.
Для того чтобы выяснить, какие изменения в степени окисления палладия происходят на различных стадиях процесса, использовали метод РФЭС. Этим методом были изучены исходный ацетат палладия, образец, полученный нанесением ацетата палладия на оксид алюминия (АП-8), тот же образец после восстановления монооксидом углерода (АП-8-1) и образец того же катализатора после восстановления СО и испытаний каталитической активности в течение 25 ч (АП-8-2) (рис. 1, табл. 1, 2).
Результаты исследований методом РФЭС
Спектры Pd3d являются дублетами пиков Pd3d5/2 и Pd3d3/2, обусловленных спин-орбитальным расщеплением 3d-уровня. Отношение интегральных интенсивностей пиков Pd3d3/2и Pd3d5/2 равно 0.67, энергетическое расстояние между пиками меняется от 5.26 эВ для Pd(0) до 5.4 эВ для Pd(II) в Pd3(OAc)6. Коррекцию шкалы энергий связи (Есв) проводили по пику Pd3d5/2 дублета Pd(0) – 335.1 эВ. Для образца ацетата палладия коррекцию делали по пику спектра C1s от CH3-групп – 285.0 эВ, при этом получили справочное значение для основного дублета Pd3(OAc)6 – 338.6 эВ. В табл. 2 приведены значения Есв пиков Pd3d5/2 и относительные интенсивности отдельных дублетов.
В образце АП-8-2 после 25-часовых испытаний при контакте с газовой смесью воздух + + 100 мг/м3 СО с последующим пребыванием в атмосфере воздуха содержание Pd(0) составляет 65–80 ат. % (табл. 2). Это меньше, чем в образце АП-8-1, вероятно, вследствие окисления Pd(0) кислородом воздуха после окончания испытаний.
В следующей серии экспериментов (рис. 2) была предпринята попытка оценить относительную удельную активность центров, содержащих палладий(0) и палладий(I), на поверхности катализатора Pd/γ-Al2O3. Для этого был приготовлен новый образец катализатора того же состава – 1.5 мас. % Pd на γ-Al2O3 – по вышеприведенной методике (АП-16). С этим катализатором проведена серия опытов в тех же условиях, которые были использованы при испытаниях предыдущего образца (см. рис. 1), но в отличие от предыдущей серии после каждого опыта реактор продували азотом, в токе азота выгружали образец катализатора из реактора и снимали РФЭ-спектры. Результаты испытаний образца АП-16 приведены на рис. 2, а данные, полученные методом РФЭС – в табл. 3.
Таблица 3.
Результаты аппроксимации Pd3d5/2: Есв и относительная интенсивность отдельных пиков*
| Катализатор | Характеристика образцов | Распределение палладия между различными окислительными состояниями | ||
|---|---|---|---|---|
| Pd(0), Есв = 335.1 эВ |
Pd(I), Есв = 336.4–337.1 эВ |
Pd(II), Есв = 338.6 эВ |
||
| Pd3(OAc)6 | Ацетат палладия | – | 20–25 | 75–70 |
| АП-8 | Свежеприготовленный | 40 | 60 | – |
| AП-16-10 | После 10 ч работы | 90–85 | 10–15 | – |
| AП-16-15 | После 15 ч работы | 93–87 | 7–13 | – |
| AП-16-17.5 | После 17.5 ч работы | 82–75 | 18–25 | – |
| AП-16-20.5 | После 20.5 ч работы | 92–85 | 8–15 | – |
| AП-16-25 | После 25 ч работы | 87–77 | 13–23 | – |
Данные РФЭС свидетельствуют о том, что в ходе нанесения ацетата палладия происходит его разложение с образованием двух групп соединений палладия, отличающихся энергией связи электронов 3d5/2 и, по-видимому, степенью окисления. Значения Есв порядка 335 эВ характерны для соединений палладия(0). Величины Есв порядка 337 эВ, судя по данным базы NIST, могут соответствовать соединениям палладия(I) или оксиду палладия(II) PdO. Авторы предпочли отнесение этой энергии к соединениям палладия(I), поскольку ее значения отличаются от обычного диапазона значений, характерных для соединений палладия(II) (примерно 338 эВ). Таким образом, уже в ходе нанесения ацетата палладия происходит его восстановление с образованием указанных форм. Роль восстановителя, вероятно, выполняет ацетон. Ацетатные ионы, судя по данным ИК-спектроскопии, остаются на поверхности оксида алюминия (полосы с частотами 1416, 1468, 1568, 1620 см–1, близкие к частотам полос в спектре ацетата палладия [10]) и, возможно, играют определенную роль в регенерации активной формы катализатора между испытаниями.
Отнесение значений Есв для палладия в диапазоне 336.4–337.1 эВ к состоянию палладия в промежуточной степени окисления между Pd(0) и Pd(II) связано с существованием большого семейства хорошо изученных индивидуальных и полимерных соединений, состав которых соответствует формуле (PdX)nLm, а степень окисления палладия равна единице [11–14]. Очень часто лигандом L в них является монооксид углерода, а анионами – галогениды или ацетат. Известно немало комплексов, содержащих палладий в дробной степени окисления. В том же диапазоне значений находятся Есв для оксидов палладия (PdO), но поскольку изучаемый процесс протекает с участием монооксида углерода, кажется логичным предположить, что в данном случае мы имеем дело с карбонильными соединениями палладия в промежуточной (между 0 и II) степени окисления.
В целом, данные РФЭС показывают, что в образце, полученном нанесением ацетата палладия на оксид алюминия, до контакта с монооксидом углерода отсутствует палладий(II), и большая часть палладия (60%) находится в степени окисления, промежуточной между 0 и II, а в ходе опыта возрастает доля палладия(0) (табл. 2). Именно с этим мы связываем уменьшение степени превращения СО и снижение активности катализатора в ходе опыта.
Оценка относительной активности центров Pd(0) и Pd(I)
На основе данных РФЭС можно заключить, что в ходе процесса окисления CO в CO2 кислородом воздуха на поверхности катализатора палладий присутствует в двух степенях окисления: Pd(0) и Pd(I). Литературные и наши данные [2–7] дают основания предполагать, что палладий в этих степенях окисления активен в указанной реакции. Под активностью катализатора мы подразумеваем количество молей СО, превращающееся в единицу времени на единицу объема катализатора. Эта величина не является скоростью реакции, поскольку реактор из-за большой степени превращения СО не является безградиентным по концентрации монооксида углерода. Для количественной оценки активности палладия в разных степенях окисления было использовано понятие удельной активности Pd(0) и удельной активности Pd(I). Под удельной активностью палладия в данной степени окисления будем понимать активность, которую проявлял бы катализатор, если бы весь палладий, содержащийся в катализаторе, находился в этой степени окисления. Общую активность катализатора вычисляли как сумму произведений удельной активности палладия в данной степени окисления на долю этой формы в суммарном содержании палладия в катализаторе, определяемую по результатам РФЭС (при отсутствии соединений палладия в других степенях окисления):
Пример:
Рассчитаем активность на примере опыта № 118 (АП-16-10 после 10 ч испытаний). Исходные данные взяты из табл. 4.
Таблица 4.
Исходные данные для расчета удельной активности
| Параметры | АП-16-10 | АП-16-15 | АП-16-17.5 | АП-16-20.5 | АП-16-25 |
|---|---|---|---|---|---|
| $C_{{{\text{CO}}}}^{{{\text{вх}}}},$ мг/м3 | 100 | 98 | 102 | 100 | 103 |
| $C_{{{\text{CO}}}}^{{{\text{вых}}}},$ мг/м3 | 15 | 18 | 18 | 12 | 7 |
| ${{v}_{{{\text{ср}}}}},$ л/ч | 12.70 | 12.32 | 12.80 | 12.10 | 12.16 |
| Vкат, мл | 1 | ||||
| х, доли | 0.85 | 0.8163 | 0.8235 | 0.88 | 0.932 |
| A, мольCO${\text{л}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 | 0.03855 | 0.03520 | 0.03840 | 0.03803 | 0.04169 |
На основе экспериментальных данных была составлена система из 5 уравнений, которая в качестве неизвестных содержит удельные активности Pd(0) и Pd(I). Данная система была решена в программе Excel методом наименьших квадратов и были найдены удельные активности Pd(0) и Pd(I).
Система уравнений:
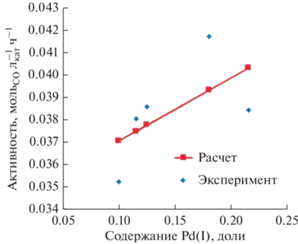
График зависимости активности катализатора от доли Pd(I) на поверхности катализатора с учетом всех полученных точек показан на рис. 3. Отношение значений А1 к А0 приводит к величине 1.8, т.е. Pd(I) примерно в два раза активнее Pd(0).
Необходимо отметить, что опыт АП-16-17.5 по характеру зависимости степени превращения монооксида углерода от времени (рис. 2) сильно отличается от предыдущего и последующего испытаний катализатора гораздо более резким падением активности. Причины этого не совсем понятны. Точка на графике (рис. 3), относящаяся этому опыту, заметно выпадает из линейной зависимости.
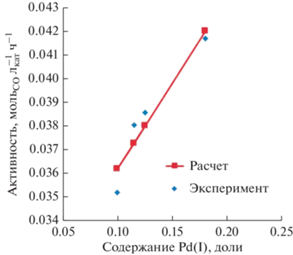
В связи со сказанным из вышеприведенной системы было исключено уравнение, соответствующее этому опыту. Решение оставшейся системы из четырех уравнений привело к следующим значениям удельной активности (рис. 4):
А0 – удельная активность центров, включающих Pd(0), составляет 0.0290 мольCO${\text{л}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1;
А1 – удельная активность центров, включающих Pd(I), составляет 0.102 мольCO${\text{л}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1.
Из этого следует, что удельная активность Pd(I) в 3.5 раза выше, чем удельная активность Pd(0).
Таким образом, полученные данные позволяют предположить, что в окислении CO в CO2 кислородом воздуха на катализаторе Pd3(CH3COO)6/γ-Al2O3 активность проявляют Pd(0) и Pd(I), при этом Pd(I) активнее, чем Pd(0).
ЗАКЛЮЧЕНИЕ
Из представленных в настоящей работе результатов следует, что при использовании в качестве прекурсора ацетата палладия, а в качестве носителя – γ-Al2O3 получен активный, но нестабильный в условиях процесса окисления монооксида углерода катализатор. Дезактивация этого катализатора – обратимый процесс. Активность может быть полностью восстановлена в результате контакта дезактивированного катализатора с воздухом. Это дает основания думать, что потеря активности связана с переходом палладия в низшую степень окисления, а не с укрупнением частиц, содержащих палладий, на поверхности катализатора.
Методом РФЭС показано, что на поверхности свежеприготовленного катализатора Pd3(OAc)6/γ-Al2O3 (до восстановления) отсутствует Pd(II), а основная часть металла находится в виде Pd(I). Обработка монооксидом углерода приводит к превращению основной части (до 80%) палладия в Pd(0). А при контакте с воздухом легко происходит обратный процесс.
Оценка относительной активности Pd(I) и Pd(0) проведена в предположении об отсутствии других каталитически активных форм на поверхности изучаемого катализатора и с использованием линейной корреляции между суммарной активностью в реакции низкотемпературного окисления монооксида углерода и распределением палладия между формами с указанными степенями окисления. Таким образом, показано, что поверхностные соединения Pd(I) в 2–3 раза активнее чем соединения Pd(0).
Полученная оценка носит приближенный характер. В нашем случае имеются, как минимум, два источника погрешности:
1) аппроксимационная процедура разложения суммарной полосы 3d5/2 РФЭС на полосы, соответствующие Pd(I) и Pd(0);
2) возможность окисления Pd(0) в Pd(I) и Pd(II) кислородом воздуха.
Очевидно, что на поверхности катализатора может присутствовать одновременно несколько разных форм, включающих Pd(I) и Pd(0) и обладающих различной каталитической активностью. Т.е., полученная оценка является групповой и позволяет сравнить усредненную активность различных соединений палладия в данных степенях окисления.
Первый источник ошибки неразрывно связан с применением метода РФЭС. Второй может быть устранен при использовании РФЭС или другого метода, способного решать ту же задачу in situ.
Для дальнейшего развития предложенного подхода необходимы методы, способные количественно фиксировать индивидуальные соединения палладия.
Список литературы
Ракитская Т.Л., Эннан А.А., Паина В.Я. Катализаторы низкотемпературного окисления монооксида углерода. Москва: ЦИНТИХИМНЕФТЕМАШ. 1991. 35 с.
Брук Л.Г., Ошанина И.В., Титов Д.Н., Темкин О.Н., Устюгов А.В., Калия О.Л., Голуб Ю.М. // Рос. хим. журн. 2013. Т. 57. № 2. С. 129.
Титов Д.Н., Устюгов А.В., Ткаченко О.П., Кустов Л.М., Зубавичус Я.В., Велигжанин А.А., Садовская Н.В., Ошанина И.В., Брук Л.Г., Темкин О.Н. // Кинетика и катализ. 2012. Т. 53. № 2. С. 272.
Устюгов А.В., Кацман Е.А., Исхакова Л.Д., Ошанина И.В., Ткаченко О.П., Кустов Л.М., Темкин О.Н., Брук Л.Г. // Кинетика и катализ. 2017. Т. 58. № 2. С. 196.
Titov D.N, Ustyugov A.V., Zubavichus Ya.V., Chernikova V.V., Tkachenko O.P., Kustov L.M., Oshanina I.V., Temkin O.N., Bruk L.G. // Nanomaterials. 2018. № 8. P. 4.
Кахниашвили Г.Н., Мищенко Ю.А., Дулин Д.А., Исаева Е.Г., Гельбштейн А.И. // Кинетика и катализ. 1985. Т. 26. Вып. 1. С. 134.
Иванова А.С., Корнеева Е.В., Славинская Е.М., Зюзин Д.А., Мороз Э.М., Данилова И.Г., Гуляев Р.В., Боронин А.И., Стонкус О.А., Зайковский В.И. // Кинетика и катализ. 2014. Т. 55. № 6. С. 767.
Пахомов Н.А. // Научные основы приготовления катализаторов. В кн.: Промышленный катализ в лекциях. 2005. Вып. 1. С. 86.
Беренблюм А.С., Аль-Вадхав Х.А., Кацман Е.А., Флид В.Р. // Кинетика и катализ. 2011. Т. 52. № 2. С. 305.
https://sdbs.db.aist.go.jp/sdbs/cgi-bin/direct_frame_ top.cgi
Темкин О.Н., Брук Л.Г. // Успехи химии. 1983. Т. 52. С. 206.
Стромнова Т.А., Моисеев И.И. // Успехи химии. 1998. Т. 67. С. 542.
Темкин О.Н., Брук Л.Г. // Кинетика и катализ. 2003. Т. 44. № 5. С. 661.
Moiseev I.I., Stromnova T.A., Vargaftik M.N., Mazo G.Ja., Kuz’mina L.G., Struchkov Yu.T. // J. Chem. Soc. Chem. Commun. 1978. P. 27.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ