Кинетика и катализ, 2022, T. 63, № 3, стр. 394-402
Термодинамический аспект конверсии диметоксиметана в водородсодержащий газ
С. Д. Бадмаев a, *, В. Д. Беляев a, b, В. А. Собянин a, b
a ФГБУН ФИЦ Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
b ФГБУН Институт химии твердого тела и механохимии СО РАН
630128 Новосибирск, ул. Кутателадзе, 18, Россия
* E-mail: sukhe@catalysis.ru
Поступила в редакцию 19.11.2021
После доработки 29.12.2021
Принята к публикации 20.01.2022
- EDN: BVHHDM
- DOI: 10.31857/S0453881122030030
Аннотация
Проведен термодинамический анализ превращения диметоксиметана путем паровой конверсии и парциального окисления в водородсодержащий газ для питания топливных элементов. Расчеты выполняли в интервале температур 100–1000°C при общем давлении 1 атм и мольных отношениях O2/ДММ = 0.5–3.5 и H2O/ДММ = 1–5. Установлено влияние температуры и состава реакционной смеси на равновесный состав продуктов реакции, а также на границы образования углерода (графит). Результаты расчетов сопоставлены с известными экспериментальными результатами.
ВВЕДЕНИЕ
В последнее время исследования в области разработки портативных и автономных энергоустановок на базе топливных элементов особенно актуальны в связи с интенсивным развитием современных технологий [1]. Топливом для таких энергоустановок служит водородсодержащий газ, который может быть получен, в частности, путем каталитической конверсии углеводородов или оксигенатов [2, 3]. Анализ литературы показывает, что кислородсодержащие органические соединения химии C1, такие как метанол, диметиловый эфир и диметоксиметан (ДММ), могут легко конвертироваться в водородсодержащий газ [2–11]. Относительно низкая температура их превращения по сравнению с традиционным углеводородным сырьем, а также отсутствие примесей (соединений серы), которые являются ядом для катализаторов, позволяют считать кислородсодержащие органические соединения химии C1 весьма перспективными источниками водорода для питания энергоустановок на базе топливных элементов. Среди этих соединений ДММ в последние 10 лет привлекает особое внимание в качестве сырья с целью получения водорода для питания топливных элементов [3–13]. ДММ в настоящее время получают по реакции конденсации метанола и формальдегида, ведутся разработки его синтеза прямым окислением метанола [14], а также из возобновляемого сырья [15, 16]. По физико-химическим свойствам ДММ представляет собой жидкость, и, следовательно, его можно легко хранить и транспортировать. Существенно, что ДММ, в отличие от метанола, является коррозионно-инертным нетоксичным соединением, которое находит много различных применений. В частности, добавка ДММ в дизельное топливо снижают дымность и выбросы CO, а также массу твердых частиц сажи в выхлопных газах [17].
Известны разные каталитические способы получения водородсодержащего газа из ДММ: разложение [12, 13], паровая конверсия (ПК) [3–10], парциальное окисление (ПО) [11]. Соответствующие брутто-уравнения приведены ниже:
(I)
$\begin{gathered} {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OC}}{{{\text{H}}}_{{\text{2}}}}{\text{OC}}{{{\text{H}}}_{{\text{3}}}} = 2{{{\text{H}}}_{2}} + 2{\text{CO}} + {\text{С}}{{{\text{Н}}}_{4}},~ \\ \Delta H = {\text{ }}82\,\,{\text{кДж/моль,\;}} \\ \end{gathered} $(II)
$\begin{gathered} {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OC}}{{{\text{H}}}_{{\text{2}}}}{\text{OC}}{{{\text{H}}}_{{\text{3}}}} + 4{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 8{{{\text{H}}}_{2}} + 3{\text{C}}{{{\text{O}}}_{2}},~ \\ ~\Delta H{\text{ }} = {\text{ }}140\,\,{\text{кДж/моль,}} \\ \end{gathered} $(III)
$\begin{gathered} {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OC}}{{{\text{H}}}_{{\text{2}}}}{\text{OC}}{{{\text{H}}}_{3}} + 0.5{{{\text{O}}}_{2}} = 4{{{\text{H}}}_{2}} + 3{\text{CO}},~ \\ \Delta H{\text{ }} = {\text{ }}46\,\,{\text{кДж/моль}}{\text{.}} \\ \end{gathered} $Разложение ДММ (I) исследовали для выяснения возможности получения водородсодержащего газа для его использования в двигателях внутреннего сгорания [12], а также для питания топливных элементов [13]. Однако экспериментальные результаты показали, что данная реакция недостаточно эффективна для таких целей. Это связано c низкой концентрацией водорода в образующейся газовой смеси, а также с проблемой зауглероживания катализаторов. Среди способов получения водородсодержащего газа из ДММ реакция ПК ДММ (II) обеспечивает наибольшее содержание водорода в продуктах, однако требует значительного подвода тепла для испарения воды и осуществления этого эндотермического процесса. По сравнению с ПК ДММ реакция ПО ДММ (III) кислородом воздуха в синтез-газ более целесообразна с точки зрения энергоэффективности, “водонезависимости” и быстроты запуска энергоустановки на базе твердооксидных топливных элементов (ТОТЭ). Кроме того, существенно упрощается технологическая схема энергоустановки, расширяются возможности ее применения при отрицательных температурах.
В настоящей работе проведен термодинамический анализ систем ДММ + Н2О и ДММ + О2 с точки зрения получения водородсодержащего газа. Представлены результаты расчетов равновесного состава продуктов реакций ПК и ПО ДММ и влияния на них температуры и состава исходной реакционной смеси. Кроме того, результаты расчетов сопоставлены с известными экспериментальными данными о протекании этих реакций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Равновесные значения концентрации продуктов ПК и ПО ДММ были рассчитаны методом минимизации потенциала Гиббса с помощью программы HSC 7.0. Расчеты проводили при давлении 1 атм, температуре 100–1000°C и мольных отношениях O2/ДММ = 0.5–3.5 и H2O/ДММ = = 1–5. Обратим внимание на то, что для обеих реакций:
• равновесная концентрация ДММ была близка к нулю, т.е. конверсия ДММ составляла ~100%;
• равновесные концентрации кислородсодержащих органических соединений (метанол, формальдегид, метилформиат, муравьиная кислота и т.д.) и С2+-углеводородов (этан, этилен, пропан, бутан и т.д.) были незначительны (≤10–5 об. %) и в дальнейшем не рассматриваются;
• выход углерода (YC) определяли как мольное отношение углерода (графита) в равновесной смеси к общему количеству углерода в смеси, т.е.
где ni – равновесное количество С, СО, СО2 и СН4, моль.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Паровая конверсия ДММ
На рис. 1 приведены температурные зависимости равновесных значений концентрации H2, CO, CO2, СН4, H2O и выход углерода для ПК ДММ при давлении 1 атм, в интервале температур 100–1000°С и мольном отношении H2O/ДММ = 4. Видно, что концентрация воды уменьшается c 56 до ~15 об. % с ростом температуры от 100 до ~700°С. При дальнейшем повышении температуры до 1000°С этот показатель практически не меняется. Зависимости концентраций CO2 и СН4 от температуры носят экстремальный характер и проходят через максимумы при ~300 и 500°С соответственно. При этом концентрация СН4 падает почти до 0 при температуре до 800°С. Выход углерода снижается с повышением температуры и уже при Т ≥ 400°С он не образуется. Отметим, что в расчетах использовали исходную смесь, содержащую азот (14 об. % ДММ, 56 об. % H2О, 30 об. % N2). Уменьшение концентрации N2 (рис. 1) с ростом температуры является следствием того, что реакция идет с увеличением объема. Образование водорода начинается при ~200°С, его концентрация возрастает с повышением температуры и достигает максимального значения ~45 об. % при 700–800°С. При дальнейшем повышении температуры до 1000°С этот показатель незначительно снижается (до ~43 об. %). Образование СО наблюдается при Т > 400°С, его концентрация увеличивается с ростом температуры и достигает 18 об. % при 1000°С.
Рис. 1.
Зависимости равновесных значений концентрации H2, CO, CO2, СН4, H2O, N2 и выхода углерода от температуры для ПК ДММ. P = 1 атм; состав исходной смеси (об. %): 14 ДММ, 56 H2О, 30 N2.

На рис. 2 показаны зависимости равновесного выхода углерода и границы образования углерода от температуры и мольного отношения Н2О/ДММ при протекании ПК ДММ. Расчеты проводили для смеси ДММ–H2О–N2 с постоянной концентрацией ДММ равной 14 об. %. Концентрацию H2О варьировали в интервале 14–70 об. % для обеспечения мольного отношения H2О/ДММ = 1–5, N2 (инертный газ) использовали в качестве баланса.
Рис. 2.
Влияние температуры и мольного отношения H2O/ДММ на равновесный выход углерода (а) и границу образования углерода (б) при паровой конверсии ДММ.
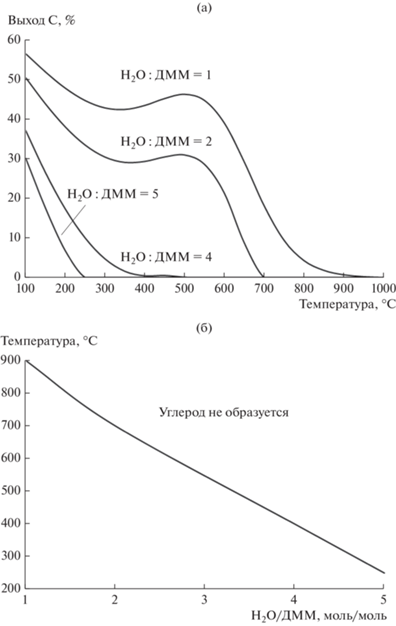
Видно (рис. 2а), что при Н2О/ДММ = 1 образования углерода не наблюдается при Т > 900°С, а при Н2О/ДММ = 5 – уже при Т > 250°С. С увеличением мольного отношения Н2О/ДММ от 1 до 5 выход углерода значительно уменьшается. Более того, “температурное окно” образования углерода смещается в область низких температур. Эти зависимости позволили определить границу образования углерода (рис. 2б). Видно, что при повышении мольного отношения Н2О/ДММ температурная область, свободная от образования углерода в ПК ДММ, расширяется от 900–1000°С при Н2О/ДММ = 1 до 250–1000°С при Н2О/ДММ = 5.
Анализ литературы [3–9] показал, что ПК ДММ идет с высокой эффективностью при температуре ~300°С на катализаторах, имеющих кислотные и медьсодержащие центры. Известно, что кислотные центры обеспечивают протекание гидролиза ДММ в метанол и формальдегид, медьсодержащие центры ответственны за паровую конверсию метанола и формальдегида в водородсодержащий газ [3]. Важно отметить, что в упомянутых работах реакцию исследовали с использованием реакционной смеси с мольным отношением Н2О/ДММ = 5, которая соответствует области, свободной от образования углерода при Т > 250°С (рис. 2). При этих условиях катализаторы СuO–ZnO/γ-Al2O3 и СuO–CeO2/γ-Al2O3 демонстрировали стабильную работу без зауглероживания и обеспечивали полную конверсию ДММ в водородсодержащий газ [6–9]. Экспериментальные результаты и соответствующие равновесные значения (конверсия ДММ и концентрации H2, CO, CO2, СН4) сопоставлены в табл. 1.
Таблица 1.
Экспериментальные результаты по ПК ДММ на катализаторах CuO–ZnO/γ-Al2O3 и CuO–CeO2/γ-Al2O3 и рассчитанные равновесные значения конверсии ДММ и концентрации продуктов H2, CO2, CO и CH4*
| Катализатор | Конверсия ДММ, % | Концентрация, об. % | Ссылки | |||
|---|---|---|---|---|---|---|
| H2 | CO2 | CO | CH4 | |||
| CuO–CeO2/γ-Al2O3 | 100 | 59.4 | 20.4 | 0.5 | 0 | [6] |
| CuO–ZnO/γ-Al2O3 | 100 | 60.5 | 21 | 0.9 | 0 | [7] |
| Равновесные значения с учетом образования CH4 | ~100 | 3.4 | 11.6 | 0.02 | 20.6 | Настоящая работа |
| Равновесные значения без учета образования С и CH4 | ~100 | 58.1 | 20.1 | 2.8 | 0 | |
Видно, что распределение продуктов реакции ПК ДММ в присутствии СuO–ZnO/γ-Al2O3 и СuO–CeO2/γ-Al2O3 значительно отличается от равновесных концентраций, рассчитанных с учетом образования CH4. В частности, в каталитических экспериментах в продуктах реакции отсутствует метан. По-видимому, на изученных катализаторах при температуре ~300°С реакции, приводящие к его появлению, не протекают. Это может быть связано с низкой гидрирующей способностью меди оксидов углерода.
Учитывая вышесказанное, представлялось целесообразным провести термодинамические расчеты, не учитывающие образование метана в ходе ПК ДММ. При сопоставлении экспериментальных значений конверсии ДММ и концентраций Н2, СО2 и СО при протекании ПК ДММ на катализаторе СuO–CeO2/γ-Al2O3 и соответствующих равновесных значений, рассчитанных без учета образования углерода и метана, оказалось, что они находятся в хорошем соответствии (табл. 1). Действительно, при 275–350°С конверсия ДММ на катализаторе CuO–CeO2/γ-Al2O3 составляет 100%. Концентрации Н2 и СО2 близки к своим равновесным значениям и лишь незначительно превышают их. Концентрация СО вплоть до 350°С не достигает равновесного значения и составляет ~1 об. %. Вышесказанное свидетельствует о том, что H2 и CO2 являются первичными продуктами ПК ДММ, тогда как СО образуется по реакции СО2 + Н2 = СО + Н2О, равновесие которой не достигается в ходе эксперимента.
Обратим внимание на то, что высокая концентрация водорода (60 об. %) и незначительное содержание СО в продуктах ПК ДММ позволяют считать такую газовую смесь пригодной для питания высокотемпературных топливных элементов с протоно-обменной мембраной и, конечно, твердооксидных топливных элементов. Более того, эту смесь после очистки от СО до уровня 10 ppm [18] можно использовать для питания низкотемпературных топливных элементов с протоно-обменной мембраной.
Согласно [6–9] при протекании ПК ДММ на катализаторах СuO–ZnO/γ-Al2O3 и СuO–CeO2/γ-Al2O3 при ~300°С производительность по водороду составляла ~15 ${{{\text{л}}}_{{{{{\text{H}}}_{{\text{2}}}}}}}$ ${\text{г}}_{{{\text{кат}}}}^{{ - {\text{1}}}}$ ч–1. Следовательно, для работы энергоустановки на базе топливных элементов мощностью 1 кВт при использовании в качестве топлива смеси ДММ + Н2О необходимо всего 40–45 г катализатора, что позволяет создать компактный топливный процессор получения водородсодержащего газа.
Парциальное окисление ДММ
В отличие от ПК ДММ исследования ПО ДММ (реакция (III)) в водородсодержащий газ находятся на начальном этапе. Известна лишь одна работа, выполненная в этой области [11]. Термодинамический анализ реакции (III) до сих пор не проводился.
На рис. 3 приведены температурные зависимости рассчитанных равновесных концентраций Н2, СО, СО2, СН4, Н2О и выхода углерода для ПО ДММ при давлении 1 атм в интервале температур 100–1000°С и составе исходной смеси (об. %): 28.6 ДММ, 14.3 О2, 57.1 N2, соответствующем тому, который получается при смешении потоков ДММ и воздуха в соотношении 2 : 5. Отметим, что в реакции ПО ДММ принципиально важно использование воздуха в качестве окислителя, так как применение чистого кислорода нецелесообразно из-за его высокой стоимости. В рассматриваемом температурном интервале равновесные конверсии ДММ и О2 составляют ~100% и на рис. 3 не показаны. Уменьшение концентрации азота (рис. 3) является следствием возрастания объема реакционной смеси при протекании реакции.
Рис. 3.
Зависимости равновесных значений концентрации H2, CO, CO2, СН4, H2O, N2 и выхода углерода от температуры для ПО ДММ. P = 1 атм; состав исходной смеси (об. %): 28.6 ДММ, 14.3 О2, 57.1 N2.

Из рис. 3 видно, что в низкотемпературной области до 400°С основными углеродсодержащими продуктами являются СН4, СО2 и углерод. Равновесные концентрации СН4 и СО2 увеличиваются с ростом температуры, проходят через максимумы при 300 и 500°С соответственно и при дальнейшем повышении температуры до 1000°С снижаются до ~0. Образование углерода возможно при температурах до ~900°С: равновесный выход углерода уменьшается от ~70 до ~0% при повышении температуры от 100 до 900°С. Концентрация Н2О составляет 47 об. % при 100°С и с ростом температуры до 1000°С падает почти до нуля. Н2 и СО, которые являются целевыми продуктами ПО ДММ, в заметных количествах наблюдаются при 250 и 500°С соответственно. С повышением температуры их концентрации возрастают и уже при 650–1000°С в сумме составляют 53–77 об. %.
На рис. 4 представлены зависимости равновесного выхода углерода и границы образования углерода от температуры и мольного отношения О2/ДММ при протекании ПО ДММ. Расчеты проводили для смеси ДММ–О2–N2 с постоянной концентрацией ДММ 14 об. %. Концентрацию О2 меняли в интервале 7–49 об. % для обеспечения О2/ДММ = 0.5–3.5, N2 (инерт) использовали в качестве баланса.
Рис. 4.
Влияние температуры и мольного отношения О2/ДММ на равновесный выход углерода (а) и границу образования углерода (б) при ПО ДММ.

Из рис. 4 видно, что с увеличением мольного отношения О2/ДММ от 0.5 до 3.5 равновесный выход углерода уменьшается, “температурное окно” образования углерода смещается в область низких температур. Так, при О2/ДММ = 0.5 углерод не формируется при Т > 900°С, а при О2/ДММ = 3.5 – при Т > 200°С. Эти зависимости позволили установить границу образования углерода для ПО ДММ (рис. 4б). По мере повышения мольного отношения О2/ДММ от 0.5 до 3.5 температурная область, в которой появление углерода не наблюдается, смещается в сторону низких значений – от 900 до 200°С.
Согласно экспериментальным данным [11] катализатор Pt/CeO2–ZrO2 демонстрирует стабильную и эффективную работу при протекании ПО ДММ. При 400°С и мольном отношении О2/ДММ = 0.5 он не зауглероживается и обеспечивает высокие выходы H2 и СО. Учитывая это, представляется целесообразным рассчитать равновесные концентрации продуктов в предположении, что в ходе реакции углерод не образуется.
На рис. 5 приведены температурные зависимости равновесных концентраций продуктов ПО ДММ, полученные без учета образования углерода при тех же самых условиях (общее давление, состав исходной смеси), что в расчетах, результаты которых представлены на рис. 3. Конверсии ДММ и О2 составляют ~100% (на рис. 5 не показаны).
Рис. 5.
Зависимости равновесных значений концентрации H2, CO, CO2, СН4, H2O, N2 от температуры при ПО ДММ. Расчет выполнен без учета образования углерода. P = 1 атм; состав исходной смеси (об. %): 28.6 ДММ, 14.3 О2, 57.1 N2.

Сопоставление зависимостей, приведенных на рис. 3 и 5, свидетельствуют о том, что равновесные распределения газообразных продуктов значительно различаются при Т < ~700°С и практически совпадают при более высокой температуре, когда равновесный выход углерода близок к 0. Вместе с тем, в низкотемпературной области ~400°С, когда катализатор Pt/CeO2–ZrO2 обеспечивает высокую эффективность в ПО ДММ в синтез-газ, основными продуктами, согласно термодинамическим расчетам (рис. 3 и 5), являются CO2, СН4 и H2O. При этом равновесные значения концентрации целевых продуктов реакции ПО ДММ – Н2 и СО – крайне низкие и в сумме не превышают 10 об. %.
Экспериментальные результаты, полученные по ПО ДММ на катализаторе Pt/CeO2–ZrO2, и соответствующие рассчитанные равновесные значения – конверсия ДММ, концентрации продуктов H2, CO, CO2, H2O, CH4 и выход углерода – приведены в табл. 2. Видно, что экспериментальные концентрации Н2 и СО существенно превышают равновесные значения, тогда как концентрации CH4, CO2 и H2O значительно (в пределах порядка) меньше равновесных величин. Такое положение дел обусловлено тем, что катализатор Pt/CeO2–ZrO2 обеспечивает избирательное протекание реакций образования синтез-газа, и, по-видимому, не ускоряет побочные реакции, приводящие к появлению углерода, метана и воды. Другими словами, кинетический контроль реакции ПО ДММ на катализаторе Pt/CeO2–ZrO2 ответственен за наблюдаемое распределение продуктов реакции.
Таблица 2.
Экспериментальные результаты по ПО ДММ на катализаторе Pt/CeO2–ZrO2 и рассчитанные равновесные значения конверсии ДММ, концентраций продуктов H2, CO, CO2, H2O, CH4 и выхода углерода*
| Катализатор | Конверсия ДММ, % | Концентрация, об. % | Выход С, % | Ссылки | ||||
|---|---|---|---|---|---|---|---|---|
| H2 | CO | CO2 | H2O | CH4 | C | |||
| Pt/CeO2–ZrO2 | 97 | 36 | 26 | 6.5 | 0.7 | 3 | 0 | [11] |
| Равновесные значения с учетом образования С | ~100 | 9.7 | 0.3 | 10.7 | 30.2 | 14.6 | 50.6 | Настоящая работа |
| Равновесные значения без учета образования С | ~100 | 4.7 | 1.2 | 22.3 | 7.1 | 29.4 | 0 | |
Катализатор Pt/CeO2–ZrO2 является весьма эффективным в реакции ПО ДММ и перспективным для разработки компактных топливных процессоров получения синтез-газа, пригодного для питания твердооксидных топливных элементов (ТОТЭ). В его присутствии (табл. 2) при атмосферном давлении, температуре ~400°С и составе исходной смеси с ДММ/воздух = 2 : 5 (мольное отношение О2/ДММ = 0.5) наблюдается почти полная конверсия ДММ и суммарная концентрация Н2 + СО более 60 об. %. Производительность катализатора Pt/CeO2–ZrO2 по синтез-газу в ПО ДММ при 400°С составляет ~14 ${{{\text{л}}}_{{\text{(}}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{ + CO)}}}}$ ${\text{г}}_{{{\text{кат}}}}^{{ - {\text{1}}}}$ ч–1 [11], 45–50 г катализатора достаточно для обеспечения работы энергоустановки на базе ТОТЭ мощностью 1 кВт.
ЗАКЛЮЧЕНИЕ
Проведен термодинамический анализ протекания реакций паровой конверсии и парциального окисления ДММ при общем давлении 1 атм в интервале температур 100–1000°С и мольных отношениях Н2О/ДММ = 1–5 и О2/ДММ = 0.5–3.5. Установлено влияние температуры и мольного отношения реагентов на распределение продуктов реакций и границу образования углерода.
Результаты расчетов сопоставлены с известными экспериментальными данными по каталитическим реакциям ПК и ПО ДММ. Оказалось, что при относительно низкой температуре предложенные катализаторы более эффективны с точки зрения получения водорода или синтез-газа, чем это предсказывает термодинамика. Такое положение дел обусловлено тем, что катализаторы обеспечивают избирательное протекание реакций, приводящих к образованию водородсодержащего газа и, по-видимому, по кинетическим причинам не обеспечивают протекание побочных реакций, ведущих к появлению метана и углерода. Это позволяет создать компактные топливные процессоры получения водородсодержащего газа из ДММ для питания энергоустановок на базе топливных элементов.
Список литературы
Sharaf O.Z., Orhan M.F. // Renew. Sust. Energ. Rev. 2014. V. 32. P. 810.
Navarro R.M., Pena M.A., Fierro J.L.G. // Chem. Rev. 2007. V. 107. P. 3952.
Pechenkin A.A., Badmaev S.D., Belyaev V.D., Sobyanin V.A. // Appl. Catal. B: Env. 2015. V. 166–167. P. 535.
Sun Q., Auroux A., Shen J. // J. Catal. 2006. V. 244. P. 1.
Fu Y., Shen J. // J. Catal. 2007. V. 248. P. 101.
Бадмаев С.Д., Печенкин А.А., Беляев В.Д., Веньяминов С.А., Снытников П.В., Собянин В.А., Пармон В.Н. // Докл. Акад. наук. 2013. Т. 452. № 6. С. 631.
Badmaev S.D., Pechenkin A.A., Belyaev V.D., Sobyanin V.A. // Int. J. Hydrogen Energy. 2015. V. 40. № 40. P. 14052.
Печенкин А.А., Бадмаев С.Д., Беляев В.Д., Паукштис Е.А., Стонкус О.А., Собянин В.А. // Кинетика и катализ. 2017. Т. 58. № 5. С. 589. (Pechenkin A.A., Badmaev S.D., Belyaev V.D., Paukshtis E.A., Stonkus O.A., Sobyanin V.A. // Kinetics and Catalysis. 2017. V. 58. № 5. P. 577.)
Badmaev S.D., Sobyanin V.A. // Catal. Today. 2020. V. 348. P. 9.
Thattarathody R., Katheria S., Sheintuch M. // Ind. Eng. Chem. Res. 2019. V. 58. № 47. P. 21382.
Badmaev S.D., Akhmetov N.O., Sobyanin V.A. // Top. Catal. 2020. V. 63. № 1–2. P. 196.
Thattarathody R., Sheintuch M. // Ind. Eng. Chem. Res. 2019. V. 58. P. 11902.
Badmaev S.D., Pinigina A.E., Belyaev V.D., Sobyanin V.A. // Kimya Problemləri (Chemical Problems). 2020. V. 18. № 4. P. 436.
Kaichev V.V., Popova G.Y., Chesalov Y.A., Saraev A.A., Zemlyanov D.Y., Beloshapkin S.A., Knop-Gericke A., Schlцgl R., Andrushkevich T.V., Bukhtiyarov V.I. // J. Catal. 2014. V. 311. P. 59.
Sturt N.R.M., Terra J.C.S., Lara Sangiorge D., Oliveira L.C.A., Moura F.C.C. // Fuel 2020. V. 262. P. 116417.
Sun R., Delidovich I., Palkovits R. // ACS Catal. 2019. V. 9. P. 1298.
Zhu R., Wang X., Miao H., Yang X., Huang Z. // Fuel. 2011. V. 90. P. 1731.
Snytnikov P.V., Zyryanova M.M., Sobyanin V.A. // Top. Catal. 2016. V. 59. № 15. P. 1394.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


