Кинетика и катализ, 2022, T. 63, № 3, стр. 279-287
Катализаторы разложения гидразина и их получение
Е. А. Богданова a, *, И. Ю. Пономарев a, А. В. Наседкин a
a АО ОКБ “Факел”
236001 Калининград, Московский просп., 181, Россия
* E-mail: bogdanovaea@fakel-russia.com
Поступила в редакцию 06.04.2021
После доработки 12.07.2021
Принята к публикации 11.09.2021
- EDN: LXAUNA
- DOI: 10.31857/S0453881122030042
Аннотация
Настоящая работа представляет собой обзор на ряд основополагающих и современных исследований в области каталитического разложения гидразина. Рассмотрен механизм разложения гидразина и вероятные пути протекания реакции с различными металлическими катализаторами, требования, предъявляемые к катализаторам, их получение на пористых носителях. Кратко описаны результаты иностранных и отечественных работ по получению и изучению би- и триметаллических катализаторов, а также разных систем для селективного по водороду разложения гидразина.
ВВЕДЕНИЕ
Жидкостные ракетные двигатели на однокомпонентном топливе представляют собой наиболее простые и надежные в применении устройства коррекции орбиты и ориентации спутников и космических аппаратов. Гидразин является жидким ракетным топливом и контролируемо разлагается с выделением тепла при контакте с металлическим катализатором [1, 2]. Кроме того, гидразин – это перспективное электрохимическое горючее для водородных топливных элементов. В связи с вышесказанным современные исследования нацелены на получение катализаторов разложения гидразина, селективных по отношению к водороду [3].
Первые работы по каталитическому разложению гидразина проводил Танатар (Tanatar) [4] в 1901–1902 гг. на поверхности платины. В течение следующих сорока лет научными группами были исследованы различные массивные катализаторы: никель, железо и другие металлы [5]. Широкое применение гидразина в качестве однокомпонентного топлива стало возможно только после создания коммерческого катализатора, который представлял собой нанесенный на оксид алюминия иридий. За этим последовало большое число работ, посвященных разработке нанесенных каталитических систем разложения гидразина – переходных металлов на различных носителях.
Коммерчески доступные катализаторы получают на основе оксида алюминия с нанесенным иридием. Актуальными являются поиск и исследования в части альтернативных катализаторов разложения гидразина, так как иридий остается редким и дорогостоящим металлом. С начала 2021 г. его стоимость выросла на 131% и составила 6 тыс. долларов США за унцию [6].
Много исследований посвящено разработке селективных по водороду катализаторов разложения гидразина, представляющих, как правило, наночастицы или нанолисты, для использования в водородных топливных элементах [7, 8].
На сегодняшний день существует производственная потребность в отечественном катализаторе разложения гидразина с низкой температурой запуска двигателя, высокими прочностными характеристиками и термостабильностью. Целью настоящего обзора является исследование современного состояния проблемы технологии получения нанесенных катализаторов разложения гидразина, в частности иридиевых, а также поиска альтернативных, менее дорогостоящих, металлов.
МЕХАНИЗМ РАЗЛОЖЕНИЯ ГИДРАЗИНА
Рассмотрим механизм разложения гидразина. Наиболее термодинамически выгодной является реакция
(I)
$3{{{\text{N}}}_{{\text{2}}}}{{{\text{H}}}_{4}} \to 4{\text{N}}{{{\text{H}}}_{3}} + {{{\text{N}}}_{2}}\left( {3500{\text{ кДж/кг}}} \right),$Кроме того, разложение гидразина может осуществляться по реакции (III):
Как правило в условиях термического разложения, при температуре выше 710°С, реакция идет в соответствии с уравнением (IV):
(IV)
$2{{{\text{N}}}_{{\text{2}}}}{{{\text{H}}}_{4}} \to 2{\text{N}}{{{\text{H}}}_{3}} + {{{\text{N}}}_{2}} + {{{\text{H}}}_{2}}\left( {3020{\text{ кДж/кг}}} \right).$В общем виде разложение гидразина описывают следующим образом:
(V)
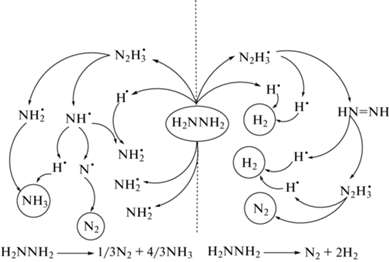
$3{{{\text{N}}}_{{\text{2}}}}{{{\text{H}}}_{4}} \to 4\left( {1--x} \right){\text{N}}{{{\text{H}}}_{3}} + \left( {1 + 2x} \right){{{\text{N}}}_{2}} + \left( {6x} \right){{{\text{H}}}_{2}},$1) связь N–N разрывается с образованием радикалов ${\text{NH}}_{2}^{ \bullet }$ на поверхности с последующим возникновением радикалов N• и H•; при термической активации адсорбированные частицы рекомбинируют с образованием N2 и H2;
2) адсорбированные с поверхностности радикалы ${\text{NH}}_{2}^{ \bullet }$ реагируют с частицами H• с десорбцией NH3;
3) гидразин подвергается последовательному внутримолекулярному дегидрированию, что в конечном итоге приводит к образованию N2 и H2;
4) гидразин гидрируется с образованием NH3.
На схеме 1 показаны описанные выше пути разложения гидразина.
Схема 1 . Пути разложения гидразина.
Разложение, протекающее по второму и четвертому вариантам, соответствует реакциям (I) и (II), тогда как по первому и третьему – реакции (III) [10], схема 1 .
Путь разложения гидразина зависит от условий реакции, свойств топлива, природы катализатора и носителя [11]. В гетерогенном катализе, где большинство реакций происходит на поверхности, наибольшее влияние оказывают электронные свойства и структура поверхности, в том числе кристаллографическая плоскость металла или степень развитости поверхности диспергированных металлических частиц [12].
Теоретические расчеты были проведены для моделирования механизма разложения гидразина на поверхностях благородных и неблагородных металлов [12]. Так, по первому варианту механизма гидразин разлагается на поверхностях Pd(100), Fe(111), Ni(111), диспергированного иридия при низких температурах. По второму варианту – на поверхности Rh(111) при низких температурах, Ir(111), а также диспергированного иридия при высоких температурах, по третьему – на поверхностях Ni(100) и Pt (111), по четвертому – на пленке вольфрама, поликристаллическом алюминии и др. Тем не менее, каталитические механизмы разложения гидразина все еще остаются спорными по причине сложности исследования, особенно это касается влияния условий протекания реакций [11, 13–22].
Путь, по которому идет разложение, определяется последовательностью разрывов связей N–N и N–H [3]. Высокая каталитическая активность характерна для катализаторов на основе никеля, палладия, платины и обусловлена низким энергетическим барьером для разрыва связи N–H, что может быть следствием высокой прочности связи металла с водородом. В соответствии с периодической таблицей прочность указанной связи увеличивается справа налево по периоду и сверху вниз по группе. С учетом энергии хемосорбции N2 и H2, потенциально эффективными катализаторами являются иридий, родий, рутений, никель, платина, палладий, что согласуется с данными авторов [8–10, 12].
Водородные топливные элементы эксплуатируются в мягких условиях – гидразин должен разлагаться при температуре не выше 120°С, поэтому появление Н2 и N2 из аммиака, образовавшегося по реакции (I), происходить не может. В этом случае понимание механизма разложения гидразина принципиально важно, так как приоритетными являются пути с выделением водорода (по реакции (III)) [23].
КОММЕРЧЕСКИЕ КАТАЛИЗАТОРЫ РАЗЛОЖЕНИЯ ГИДРАЗИНА
В качестве однокомпонентного топлива гидразин впервые был использован в США в 1958 г. Каталитическое разложение инициировалось при нагревании до 500°С на массивном катализаторе Fe–Ni–Co. Отсутствие эффективного катализатора, который можно было бы применять без предварительного нагрева, ограничивало использование двигательных установок, работающих на гидразине [24].
В 1960-х гг. компанией “Shell Chemical Corporation” был разработан иридиевый катализатор разложения гидразина и его производных Shell 405. В соответствующем патенте отмечено, что кроме иридия в качестве активной металлической фазы может выступать и его комбинация с рутением. Критичным является осаждение иридия или его смеси с рутением в виде агломератов металла (или металлов) диаметром от 10 до 100 Å, достаточно разнесенных по поверхности, чтобы не происходило их спекание по достижении температур порядка 1000–1100°С [25]. Содержание иридия в катализаторе Shell 405 было чрезвычайно высоким в сравнении с большинством промышленных катализаторов того времени и составляло от 31 до 33 мас. %. Кроме того, Shell 405 был термостойким: его создавали для эксплуатации при температурах реакций до 1150°C в связи с необходимостью поддержания требуемых характеристик двигателя. В настоящее время катализатор Shell 405 известен под названием S 405 и производится компанией “Aerojet Inc.” [26].
В конце 1960-х гг. в европейской компании “SEP”, специализирующейся на космической технике, начали разработку катализатора разложения гидразина. Конечный продукт под названием CNESRO прошел аттестацию в 1972 г. В рамках работы с небольшими (несколько граммов) партиями катализатора были определены активный компонент – иридий, а также оптимальное по активности и затратам на реактивы содержание металла – 36 мас. % [27].
Бельгийской химической компанией “Solvay” также был создан иридиевый катализатор разложения гидразина под торговым названием H-KC 12 GA. На сегодняшний день он производится немецкой компанией “W.C. Heraeus of Hanau” [1, 28]. Сравнение морфологии поверхности и среза гранул катализаторов Shell 405 и H-KC 12 GA свидетельствует о меньшем количестве пор в последнем, что может влиять на диффузию топлива и газообразных продуктов его разложения [33].
Перечисленные каталитические системы являются основными в мире для разложения однокомпонентного топлива – гидразина – и представляют собой гранулы γ-фазы оксида алюминия с диспергированным металлическим иридием.
Отечественный катализатор разложения гидразина К-201 был разработан в 1965–1967 гг. в ГИПХ и содержал 29–32 мас. % иридия на алюмооксидном носителе. Модификации катализатора получены на других носителях с различным массовым содержанием иридия или рутения. Для двигателей с малой тягой были созданы каталитические системы на основе молибден- и вольфрам-рениевых сплавов [24].
ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К КАТАЛИЗАТОРАМ РАЗЛОЖЕНИЯ ГИДРАЗИНА
Известно, что срок службы двигателя зависит от количества топлива и срока службы катализатора. В соответствии с этим к катализаторам предъявляют ряд требований. Важные показатели – значение потери массы и механическая прочность [29, 30]. Гранулы катализатора повреждаются в результате ударных взаимодействий, столкновений с другими гранулами и износа. Общая масса гранул уменьшается, поскольку часть их вымывается, и образуются пустоты в слое, что делает разложение гидразина нестабильным и ведет к ухудшению работы двигателя [28].
Критичными являются способность инициировать разложение гидразина при низких температурах (примерно при 2°С), способность многократно перезапускаться, кроме этого важны термостойкость (не менее 1100°С), значительная удельная поверхность и способность сохранять ее по достижении высоких температур [25, 31].
При применении гидразина в качестве источника водорода требуется реализовать каталитическое разложение селективно по водороду.
ИСПОЛЬЗОВАНИЕ НОСИТЕЛЯ ДЛЯ КАТАЛИЗАТОРА РАЗЛОЖЕНИЯ ГИДРАЗИНА
Использование носителей позволяет получать катализаторы с низким содержанием благородных металлов при сохранении эффективности, что выгодно по сравнению с массивными металлическими катализаторами [32]. Катализаторы на носителе демонстрируют стабильность термических и механических свойств, которые зависят от характеристик носителя и взаимодействия металл–носитель. Природа и развитость поверхности материала носителя могут значительно улучшить дисперсию металла и минимизировать агломерацию частиц.
В качестве носителей широко применяют Al2O3 [33], SiС [34], MgO [35], SiO2, CeO2 [36], TiO2, ZrO2 [12] и углеродные материалы [37]. Для получения катализаторов разложения гидразина часто выбирают γ-Al2O3 благодаря большой площади поверхности, узкому распределению пор по размерам и термической стабильности [38]. Адсорбционные и механические свойства γ-Al2O3 могут быть улучшены в случае использования гранул сферической формы: авторами [39] отмечается значительное проникновение гидразина в поры, повышение скорости реакции, а также уменьшение потерь массы. Но чаще гранулы носителя имеют близкую к цилиндрической форму [39].
Предъявляемые требования к носителю включают термическую, химическую и механическую стабильность, равномерное распределения пор по размерам, высокую площадь удельной поверхности, высокое сопротивление раздавливанию [31, 40, 41].
Металлические катализаторы на носителе имеют следующие преимущества: требуется нанесение небольшого количества активного металла (меньше, чем для изготовления массивного металлического катализатора); осуществляется равномерное распределение активного металла без спекания; реализуется проникновение топлива глубоко внутрь пор; возможно продолжение каталитической реакции даже после эрозии металла с внешней поверхности; доступны извлечение драгоценного металла и переработка катализаторов [25, 39, 42, 43].
ПОЛУЧЕНИЕ КАТАЛИЗАТОРОВ РАЗЛОЖЕНИЯ ГИДРАЗИНА
В зависимости от способа получения катализаторы классифицируют на массивные и нанесенные [44]. В исследованиях встречаются катализаторы, представляющие собой нанолисты или сетки из драгоценных металлов, для приготовления которых используют реактивы высокой чистоты; такие методики не имеют промышленных применений. В настоящей работе подробно описана технология промышленного получения нанесенных катализаторов разложения гидразина, а также приведены примеры методик синтеза катализаторов, разработанных в научных лабораториях.
Для приготовления гетерогенных катализаторов разложения гидразина частицы активного металла осаждают на поверхности твердого носителя, массивные катализаторы получают методом химического восстановления. Смачивание носителя раствором или суспензией прекурсора активной фазы может осуществляться многократной пропиткой, ионным обменом, осаждением или соосаждением [45]. Равномерное распределение металла по поверхности, в том числе внутренней, достигается посредством многократной пропитки, в результате чего металл диффундирует в поры носителя [25]. Пропитка может проводиться двумя способами: в избытке раствора окунанием с последующим отделением пропитанного носителя от объема раствора и выдержкой для стекания невпитавшегося, или в недостатке – добавлением раствора порциями к твердому носителю при перемешивании.
При получении катализаторов разложения гидразина в качестве растворимого компонента для пропитки носителя используют водные или спиртовые растворы хлоридов или нитратов металлов. Например, для синтеза иридиевых катализаторов применяют гексахлороиридат(IV) водорода, тригидрат трихлорида иридия или гексахлороиридат(IV) аммония, для никелевых – гексагидрат нитрата никеля и т.д. В ряде работ в водный раствор для пропитки добавляют 0.1–0.6 н. соляную кислоту с целью улучшения дисперсии металла. Предпочтительный уровень pH составляет 2–3 [25, 46, 47].
По мере концентрирования раствора ионы агломерируются на поверхности носителя, поэтому перед каждым последующим этапом пропитки необходима обработка: в теплом воздухе при температуре порядка 120°С, выдержка в вакууме или при комнатной температуре в течение 12–24 ч. Указанная обработка способствует сорбции ионов на еще не покрытых раствором участках носителя. После каждого этапа проводят прокаливание: сначала при постепенном нагревании до 250°С, затем до 450–550°С, и выдерживают при указанной температуре обычно в течение 1–4 ч [25, 33, 47]. Далее стадии пропитки, обработки и высушивания повторяют. Так, в технологии производства катализатора Shell 405 пропитку проводят в 20 стадий [25, 48], в ряде примеров в указанном патенте достаточно 5–7 пропиток, тогда как для получения французского катализатора CNESRO необходимо 3 стадии [27, 40, 49]. Количество стадий пропитки влияет на размер осажденных частиц металла, а также их распределение по поверхности и порам. В [27] отмечается, что методом соосаждения можно получать иридиевый катализатор, но имеются трудности с восстановлением продукта для следующего запуска.
После завершения вышеуказанных стадий в потоке водорода (или смеси водорода и азота) при температуре 450–550°С проводят восстановление прекурсора длительностью от 30 мин до 6 ч [39, 50]. В ряде случае процесс продолжают пассивацией поверхности путем продувки азотом [51].
Например, в [46] авторы готовили катализаторы Ir/Al2O3 методом многостадийной пропитки, используя водный раствор хлорида иридия с 0.6 н HCl. Для доведения содержания металла до требуемого значения выполняли 6 стадий пропитки: первую – до содержания металла 12 мас. % иридия, две последующие – до 22 мас. %, и затем три – до 30 мас. %. После каждой стадии пропитки прекурсоры сушили в вакууме (10–2 мбар) при комнатной температуре в течение 1 ч, а затем помещали в печь и выдерживали при температуре 220°С в течение 12 ч. Затем продукт восстанавливали в потоке водорода (60 см3/мин) при 400°С в течение 4 ч. Несмотря на то, что методика приготовления отличается от коммерческого продукта Shell 405, авторами [46] отмечается схожесть значений дисперсии и размеров металлических частиц. Кроме того, было показано, что катализаторы, содержащие 30 мас. % иридия, имеют близкие значения удельной поверхности (около 30 м2/г) независимо от различий в величинах объема пор и их распределения.
В работе [52] получали катализаторы с различным содержанием иридия – 10, 20 и 30% и исследовали зависимость их свойств от массовой доли активного металла. Удельная поверхность образцов уменьшалась с увеличением содержания иридия и составляла 126 м2/г для образца, в состав которого входило 10% иридия, и 88 м2/г для образца с 30% металла. Вероятно, это связано с закупориванием пор. Для катализатора с массовой долей иридия 30%, стабилизированного ацетилацетоном во избежание агломерации частиц (для реализации контролируемого осаждения иридия на носитель), значение площади поверхности было равно 98 м2/г. Картирование образцов показало оптимальную дисперсию при различном содержании металла, но за счет покрытия большей поверхности отмечалась повышенная эффективность катализаторов с массовой долей иридия 30%, в частности стабилизированного. Наиболее активными в разложении гидрата гидразина были катализаторы, в состав которых входило 30% иридия, причем активность стабилизированного образца была выше, чем аналогичного, но приготовленного без ацетилацетона.
В работе [53] иридиевый катализатор получали методом пропитки носителя из углеродных нановолокон. По результатам испытаний в двигателе было показано, что значение тяги выше для катализаторов на углеродных нановолокнах, чем на γ-Al2O3, несмотря на то, что удельная поверхность углеродного носителя (85 м2/г) ниже, чем оксида алюминия (115 м2/г). Лучшие характеристики обусловлены развитой поверхностью катализатора, а также значительной теплопроводностью носителя, которая позволяет гомогенизировать выделяемое тепло. Последнее критично, так как высокие температуры на соответствующих участках носителя препятствуют дисперсии активной фазы.
Известно, что нитриды, карбиды, оксинитриды и оксикарбиды ряда металлов (титана, ванадия, ниобия, молибдена, вольфрама) способны заменять благородные металлы (иридий, платину, палладий), и могут быть выбраны как экономически выгодная альтернатива иридию [54]. В работах [55, 56] получены образцы массивных катализаторов карбидов и нитридов вольфрама и молибдена и проведено сравнение с коммерческим иридиевым катализатором в рамках испытаний в двигателе. Образцы α-Mo2C, Mo2N, W2N, NbN и W2C по эффективности разложения гидразина и механической прочности не уступали коммерческим иридиевым катализаторам. Авторами отмечено пониженное пылеобразование разработанных катализаторов, что связано с их тугоплавкостью.
В [57] биметаллические катализаторы с платиной и рутением готовили методом пропитки носителя SiO2, используя водные растворы RuCl3 и H2PtCl6. Продукт высушивали при 300°С и восстанавливали в смеси аргона и водорода при 400°С. В условиях разложения гидразина активность Pt–Ru-катализаторов с содержанием платины не менее 50% от общего количества активного компонента была значительно выше по сравнению с монометаллическими образцами и биметаллическими с различным соотношением Pt и Ru.
Ряд работ посвящен каталитическому разложению гидразина на поверхности двумерных материалов. Так, авторы [58] изучали разложение гидразина на слое графена с внедренным никелем. Расчет электронной структуры показал, что активация связи Ni–N происходит легче, чем связи Ni–H, что приводит к разложению гидразина преимущественно с образованием аммиака, а не водорода. Тем не менее, системы графена с металлами являются перспективными материалами для дегидрирования гидразина и могут быть усовершенствованы для более эффективного распределения заряда.
Авторы [33] синтезировали катализаторы на графене с активными фазами родия и никеля. В работе отмечена высокая эффективность полученных продуктов в реакции разложения гидразина. В качестве промотора был использован раствор NaOH. Применение двумерного носителя, вероятно, обусловило облегченный перенос электронов в процессе протекания реакции.
КАТАЛИЗАТОРЫ ДЛЯ СЕЛЕКТИВНОГО ПО ВОДОРОДУ РАЗЛОЖЕНИЯ ГИДРАЗИНА
Иридий считается наиболее активным металлом для разложения гидразина, но его селективность по водороду при низких температурах незначительна [12]. В исследованиях отмечается, что оптимальными для селективного по водороду разложения гидразина являются биметаллические катализаторы, что, возможно, связано с образованием твердых растворов с синергетическими характеристиками. После публикации работы [59] многочисленные научные группы легировали иридий, родий, рутений или другие благородные металлы никелем, медью, кобальтом и др. для увеличения выхода водорода за счет разложения гидразина по реакции (III). Включение в поверхностный слой иридия атомов никеля, по-видимому, способствует ослаблению поверхностных связей иридия с NH• и N•. При этом отмечалось, что эффект влияния никеля не связан с его объемной концентрацией. На основе никеля также были приготовлены и исследованы следующие комбинации: Pt–Ni/графен, Rh–Ni/графен [11], Rh–Ni/Ce(OH)CO3, Ni–Pt/Al2O3, Ni–Ir/Al2O3, Ni–Ir/CeO2, Ni–Pt/La2O3 [37], однако авторы отмечали их малый срок службы.
В работе [37] получали биметаллические катализаторы кобальта с рутением, платиной или палладием на γ-Al2O3 для разложения гидразина селективно по водороду при комнатной температуре. Концентрация кобальта составляла порядка 20 мас. %, концентрации промоторов (рутения, платины или палладия) – до 5 мас. %. Гранулы носителя согласно методике пропитывали раствором ацетата кобальта (CH3COO)2Co, затем хлоридом металла, сушили, отжигали и восстанавливали в атмосфере водорода. При разложении гидразин гидрата в присутствии биметаллических катализаторов, содержащих рутений, платину или палладий, селективность по водороду была в 12 раз выше по сравнению с такой Co/γ-Al2O3. Оптимальными характеристиками обладали образцы биметаллических катализаторов Co–Pt/γ-Al2O3, содержащие платину и кобальт в соотношении 0.034. Высокую селективность по водороду авторы связывают с синергизмом каталитического действия металлов, дисперсией металлических частиц на поверхности носителя и наличием большого количества активных центров хемосорбции водорода.
В рамках исследования [60] был разработан новый каталитический материал – Ni–Ru–Pt (1.27 мас. % Pt, 1.04 мас. % Ru, 0.36 мас. % Ni), диспергированный на SiO2, показавший высокую эффективность в селективном по водороду разложении гидразин гидрата при 60°С. Кроме того, никель отмечен авторами как критически важный компонент, без добавления которого образцы Pt/SiO2, Ru/SiO2 и Ru–Pt/SiO2 проявляют значительно более низкую активность. Также были приготовлены катализаторы на других носителях – Ni–Pt–Ru/TiO2, Ni–Pt–Ru/Al2O3, Ni–Pt–Ru/C, но они отличались меньшей селективностью по водороду при полном разложении гидразин гидрата.
Триметаллические системы также были исследованы в работах [61–63]. Так, авторы [64] получали моно- (Ag, Ni, Fe, Cu и Pd), би- (Ag–Ni, Pd–Ag, Ni–Fe) и триметаллические (Ni–Fe–Pd, Ni–Fe–Ag, Ni–Fe–Cu) катализаторы и сравнивали их каталитическую активность, селективность в образовании водорода, долговечность и т.д. Образцы синтезировали методом химического восстановления с использованием бромида центримониума в качестве стабилизатора; при приготовлении катализаторов Ni–Fe–Pd, Ni–Fe–Ag и Ni–Fe–Cu на наночастицы Ni–Fe, полученные методом совместного восстановления, были осаждены Pd, Ag и Cu, соответственно. Результаты исследования каталитической активности вышеуказанных катализаторов свидетельствуют о высоких характеристиках триметаллических систем по сравнению с моно- и биметаллическими. В работе проанализированы зависимости объема образующихся газов от времени на различных катализаторах, которые были найдены по результатам серии кинетических опытов дегидрирования гидразина. Было установлено, что наночастицы Ni–Fe эффективнее других биметаллических систем для получения водорода. Ni–Fe–Pd демонстрирует наиболее высокую селективность по водороду среди приготовленных триметаллических нанокатализаторов с различным составом.
ЗАКЛЮЧЕНИЕ
Настоящая работа представляет собой обзор на ряд основополагающих и современных исследований в области каталитического разложения гидразина. В первой части статьи был рассмотрен механизм разложения гидразина; отмечено, что последовательность разрыва связей N–N и N–H зависит от природы катализатора и условий протекания реакции. Как правило, наиболее эффективны для разложения гидразина переходные металлы с незаполненной d-орбиталью.
Катализаторы с иридием в качестве активной фазы являются основными, в том числе коммерческими, для разложения гидразина. Промышленные иридиевые катализаторы получают методом многостадийной пропитки водными или спиртовыми растворами соли иридия с последующими сушкой, восстановлением и, в ряде работ, пассивацией. Изменение условий синтеза, содержания активной компоненты, носителя и прочих параметров влияет на конечные характеристики катализаторов. Часто используется биметаллическая каталитическая система иридия с рутением, реже – другие благородные металлы (палладий, платина, родий) и карбиды и нитриды вольфрама, ниобия и молибдена. Большая часть исследований направлена на разработку технологий получения и изучение катализаторов, селективных по водороду при разложении гидразина. Перспективными для применения в водородных топливных элементах являются би- и триметаллические комбинации никеля с железом и благородными металлами.
Данные иностранных и отечественных исследований, приведенные в представленном обзоре, использовались на предприятии АО “ОКБ “Факел” для разработки технологии получения иридиевого катализатора разложения гидразина. Тем не менее, вызывают интерес исследовательские работы, направленные на получение би- или триметаллических катализаторов с целью повышения их механической прочности и удешевления при сохранении каталитической активности.
Список литературы
Ley W., Wittmann K., Hallmann W. // Handbook of space technology. Munich: GmbH & Co. KG, 2009. V. 22.
Lee S. // J. Korea Soc. Propuls. Eng. 1999. V. 3. P. 72.
Batonneau Y., Kappenstein C.J., Keim W. // Handbook of Heterogeneous Catalysis. Weinheim: VCh-Wiley, 2008. P. 2647.
Tanatar S. // 2.phys. Chem. 1902. V. 40A. P. 475.
Gutbier A., Neundlinger K. // 2. phys. Chem. 1913. V. 84. P. 203.
Bode K.S. Optimization of iridium and ruthenium catalysts in the CH oxidation of alkanes. Diss., Kent State University, 2021.
Singh S.K., Iizuka Y., Xu Q. // Int. J. Hydrogen Energy. 2011. V. 36. № 18. P. 11794.
Pakdehi S.G., Rasoolzadeh M. // Proc. Mater. Sci. 2015. V. 11. P. 749.
Zhang P.X., Wang Y.G., Huang Y.Q., Zhang T., Wu G.S., Li J. // Catal. Today. 2011. V. 165. № 1. P. 80.
Singh S.K., Xu Q. // Catal. Sci. Technol. 2013. V. 3. № 8. P. 1889.
Koshkin B.Y., Bunev V.A., Babkin V.S., Laevsky Y.M. // Combust. Flame. 1995. V. 103. № 3. P. 143.
He L., Liang B., Huang Y., Zhang T. // Natl Sci. Rev. 2018. V. 5. № 3. P. 356.
Dopheide R., Schröter L., Zacharias H. // Surf. Sci. 1991. V. 257. № 1–3. P. 86.
Grunze M. // Surf. Sci. 1979. V. 81. № 2. P. 603.
Gland J.L., Fisher G.B., Mitchell G.E. // Chem. Phys. Lett. 1985. V. 119. № 1. P. 89.
Wagner M.L., Schmidt L.D. // Surf. Sci. 1991. V. 257. № 1–3. P. 113.
Huang S.X., Rufael T.S., Gland J.L. // Surf. Sci. 1993. V. 290. № 1–2. P. L673.
Alberas D.J. Kiss J., Liu Z.M., White J.M. // Surf. Sci. 1992. V. 278. № 1–2. P. 51.
Cosser R.C., Tompkins F.C. // Trans. Faraday Soc. 1971. V. 67. P. 526.
Johnson D.W., Roberts M.W. // J. Electron Spectroscopy and Related Phenomena. 1980. V. 19. № 2. P. 185.
Крылов О.В. // Докл. АН СССР. 1960. Т. 130. №. 5. С. 1063.
Contour J.P., Pannetier G. // J. Catal. 1972. V. 24. №. 3. P. 434.
Pakdehi S.G., Salimi M., Rasoolzadeh M. // Res. Appl. Mech. Eng. 2014. V. 3. P. 21.
Гайдей Т.П., Дидык В.А., Пименова Т.Ф., Здухова Т.В. / Физико-химические аспекты предельных состояний и структурных превращений в сплошных средах, материалах и технических системах. Под ред. Петрова Ю.В. Санкт-Петербург: Политехника, 2019. С. 46.
Armstrong W.E., Ryland L.B., Voge H.H. Patent USA № 4124538, 1978.
Wucherer E.J., Cook T., Stiefel M., Humphries R., Parker J. // Abstracts. 39th Joint Propulsion Conference and Exhibit. American Institute of Aeronautic and Astronautics, 2003. P. 5079.
Portejoie B., Valentini R. // Abstracts. 11th Propulsion Conference. Societe Europeenne de Propulsion Blanquefort, 1975. P. 1243.
Goto D., Kagawa H., Kajiwara K., Fumihiro U., Joji U., Shigeyasu I. // Abstracts. Proceedings of the Korean Society of Propulsion Engineers Conference. The Korean Society of Propulsion Engineers, 2004. P. 137.
Lee K.H., Yu M.J., Kim S.K., Ki-Won J., Sung-June C. // J. Korean Society of Propulsion Engineers. 2006. V. 10. № 3. P. 109.
McRight P., Popp C., Pierce C., Turpin A., Urbanchock W., Wilson M. // Abstracts. 41st Joint Propulsion Conference and Exhibit. American Institute of Aeronautics and Astronautics, 2005. P. 3952.
Williams P.H. // Shell Development Company in Emeryville, California, 1972.
Chen S.F., Li J.P., Qian K., Xu W.P., Lu Y., Huang W.X., Yu S.H. // Nano Res. 2010. V. 3. № 4. P. 244.
Jang I.J., Shin H.S., Shin N.R., Kim S.H., Kim S.K., Yu M.J., Cho S.J. // Catal. Today. 2012. V. 185. № 1. P. 198.
Карабанов А.В., Иваненко С.С., Якуба Э.С. // Тез. докл. Современные проблемы и перспективные направления инновационного развития науки. Уфа: Аэтерна, 2016. С. 67.
Argo A.M., Odzak J.F., Lai F.S., Gates B.C. // Nature. 2002. V. 415. № 6872. P. 623.
Norooz O.S. Catalyst Development and the Structure-Dependent Properties for Hydrazine Decomposition. Diss., University of Akron, 2016.
Firdous N., Janjua N.K., Wattoo M.H. // Int. J. Hydrogen Energy. 2020. V. 45. № 41. P. 21573.
Chuah G.K., Jaenicke S., Xu T.H.S. // Micropor. Mesopor. Mater. 2000. V. 37. № 3. P. 345.
Janjua N.K., Firdous N., Bhatti A.S., Khan Z.S. // Appl. Catal. A: General. 2014. V. 479. P. 9.
Karim M.R., Rahman M.A., Miah M.A.J., Ahmad H., Yanagisawa M., Ito M. // Open Colloid Sci. J. 2011. V. 4. № 1.
Tang B., Ge J., Zhuo L., Wang G., Niu J., Shi Z., Dong Y. // Wiley-VCH Verlag GmbH & Co. KGaA. 2005. V. 21. P. 4366.
Schmidt E.W. Hydrazine and Its Derivatives: Preparation, Properties, Applications. John Wiley & Sons. 2001.
Valentini R. // ESA Attitude and Orbit Control Systems. 1977. P. 435.
Poncelet G., Jacobs P.A., Grange P. Preparation of catalysts III. Elsevier. 1983.
Томас Д., Лемберт Р. Методы исследования катализаторов. М.: Мир, 1983.
Neto T.G.S., Cobo A.J.G., Cruz G.M. // Appl. Surf. Sci. 2005. V. 240. № 1–4. P. 355.
Jofre J.B.F., Neto T.G.S., Dias F.F., Cruz G.M. // Acta Astronautica. 2013. V. 85. P. 41.
Armstrong W.E., Ryland L.B., Voge H.H. Patent GB № 2027357, 1980.
Pfeffer H. // 11th Propulsion Conference. 1976. P. 1227.
Jang Y.B., Jang Y.B., Kim T.H., Sun M.H., Lee J., Cho S.J. // Catal. Today. 2009. V. 146. № 1–2. P. 196.
Назирмадов Д.А., Сафаров М.М., Мирзомамадов А.Г., Абдуназаров С.С. // Политехнический вестник. Серия: Инженерные исследования. 2019. № 3. С.74.
Amirsardari Z., Dourani A., Amirifar M.A., Massoom N.G. // Int. J. Min. Met. Mater. 2021. V. 28. P. 1.
Vieira R., Netto D.B., Bernhardt P., Ledoux M., Pham-Huu C. // Química Nova. 2005. V. 28. № 1. P. 42.
Levy R.B., Boudart M. // Science. 1973. V. 181. № 4099. P. 547.
Rodrigues J.A.J., Cruz G.M., Bugli G., Boudart M., Djéga-Mariadassou G. // Catal. Lett. 1997. V. 45. № 1. P. 1.
Chen X., Zhang T., Zheng M., Xia L., Li T., Wu W., Wang X., Li C. // Ind. Eng. Chem. Res. 2004. V. 43. № 19. P. 6040.
Тюменцев М.С., Ананьев А.В., Ширяев А.А., Пуряева Т.П., Зубавичус Я.В., Ершов Б.Г. // Докл. АH. 2013. Т. 450. № 5. С. 557.
Genç A.E., Küçük H., Alp I.O., Akça A. // Int. J. Hydrogen Energy. 2020. V. 45. № 58. P. 33407.
Rewick R.T., Wood B.J., Wise H. // J. Phys. Chem. 1979. V. 83. № 19. P. 2480.
Karatas Y., Gülcan M., Zahmakiran M. // Int. J. Hydrogen Energy. 2020. V. 45. № 51. P. 27098.
Wang J., Li Y., Zhang Y. // Adv. Funct. Mater. 2014. V. 24. № 45. P. 7073.
Zhang J., Kang Q., Yang Z., Dai H., Zhuang D., Wang P. // J. Mater. Chem. A. 2013. V. 1. № 38. P. 11623.
He L., Liang B., Li L., Yang X., Huang Y., Wang Zhang T. // ACS Catal. 2015. V. 5. № 3. P. 1623.
Al-Thubaiti K.S., Khan Z. // Int. J. Hydrogen Energy. 2020. V. 45. № 27. P. 13960.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ