Кинетика и катализ, 2022, T. 63, № 3, стр. 288-293
Пиролиз этана и пропана в диапазоне температур 773–1023 K
А. С. Паланкоева a, b, *, Я. С. Зимин a, c, А. А. Захаров a, В. С. Арутюнов a, b, c
a ФГБУН Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
119991 Москва, ул. Косыгина, 4, корп. 1, Россия
b ФГБОУ ВО Московский государственный университет им. М.В. Ломоносова, Факультет фундаментальной физико-химической инженерии
119234 Москва, Ленинские горы, 1, стр. 51, Россия
c ФГБУН Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. Акад. Семенова, 1, Россия
* E-mail: anitadmitruk@gmail.com
Поступила в редакцию 11.10.2021
После доработки 07.12.2021
Принята к публикации 16.01.2022
- EDN: AILIRX
- DOI: 10.31857/S045388112203011X
Аннотация
В условиях проточного реактора экспериментально исследован термический пиролиз этана и пропана при давлении 1–3 атм. Кинетическое моделирование процесса в этом интервале давлений показало хорошее согласие с экспериментальными результатами и по конверсии алканов, и по выходу продуктов пиролиза, что позволяет нам расширить область моделирования по давлению. Полученные результаты показывают, что изменение давления в диапазоне 1–15 атм не оказывает заметного влияния на пиролиз легких алканов. На основании этого можно сделать вывод о том, что установленное ранее влияние давления на окислительный крекинг этана связано с его воздействием на окислительные стадии процесса.
ВВЕДЕНИЕ
В настоящее время растет роль природного газа как сырья для получения различных газохимических продуктов. Соответственно, увеличивается число исследований, посвященных этой альтернативе использованию газа в качестве топлива [1]. Однако подавляющая часть этих работ относится к изучению каталитических процессов. В то же время высокая температура, необходимая даже для каталитической конверсии метана, требует учета практически всегда параллельно протекающих газофазных реакций, которые, кроме того, имеют большой самостоятельный интерес, открывая перспективы создания принципиально новых технологий [2].
Одним из таких перспективных процессов может стать окислительный крекинг легких алканов непосредственно в среде метана – основного компонента природного газа. Возможность его осуществления была показана в [3]. Окислительная конверсия гомологов метана непосредственно в среде метана, минуя сложные и энергоемкие технологии их выделения из природного газа, может протекать благодаря большому различию в реакционной способности метана и его гомологов.
Ранее был выполнен ряд экспериментальных исследований по оксикрекингу этана и пропана в области умеренных температур и давлений до 5 атм [4]. В работе [5] было высказано предположение, что отмеченное влияние давления на оксикрекинг легких алканов связано с его ролью в окислительных процессах, в то время как на процессы термического крекинга его воздействие незначительно или отсутствует. Для проверки этого предположения, крайне важного для практической реализации технологий на основе оксикрекинга, в настоящей работе было проведено экспериментальное исследование пиролиза легких алканов С2–С3 и кинетическое моделирование этого процесса.
Необходимо отметить, что, несмотря на наличие литературных кинетических моделей, достаточно хорошо описывающих процессы оксикрекинга легких алканов, ни одна из них не учитывает реакции на поверхности реактора, которые, как было показано нами в [6], играют существенную роль при окислительных процессах в реакторах лабораторного масштаба в диапазоне температур, характерных для крекинга и оксикрекинга легких алканов. В работе [6] нам удалось так дополнить кинетическую модель [7] блоком гетерогенных реакций, что это позволило достаточно точно описать процесс окислительного крекинга этана в области давлений 1–2 атм и умеренных температур. Но поскольку роль гетерогенных реакций при оксикрекинге, как это было показано в [6], в основном связана с взаимодействием кислородсодержащих молекул и радикалов с поверхностью, можно ожидать, что при термическом пиролизе их влияние будет значительно ниже.
Продемонстрированная в работе [6] возможность количественного описания парциального окисления (окислительного пиролиза) этана в лабораторном реакторе позволяет нам в данной работе на основе экспериментального исследования термического пиролиза этана и пропана и его сравнения с результатами кинетического моделирования сделать вывод о влиянии давления на процессы окислительного и термического пиролиза легких алканов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты по пиролизу этана и пропана проводили на лабораторной установке проточного типа с цилиндрическим кварцевым реактором в диапазоне температур 773–1023 K и давлений 1–3 атм. Длина реактора – 350 мм, внутренний диаметр – 14 мм. Отношение площади внутренней поверхности реактора к его объему S/V в рабочей части с учетом поверхности карманов для термопар составляло 5.4 см–1. Реактор нагревали тремя независимыми электронагревателями, что позволяло поддерживать постоянный профиль температуры в высокотемпературной зоне реактора, длина которой была 200 мм. Лабораторная установка подробно описана в работах [3, 5, 8–10], продолжением которых является настоящее исследование.
В экспериментах использовали следующие газы: азот особой чистоты первого сорта (99.999%), гелий марки “А” (99.995%), этан чистый (99.99%), пропан чистый (99.99%). Газом-носителем служил азот. Анализ газовых смесей на входе и выходе реактора осуществляли с помощью газового хроматографа марки Кристалл 5000 (Фирма, Россия).
Кинетическое моделирование проводили с применением модели окисления легких углеводородов в области умеренных температур NUIGMech1.1 [7], которая хорошо зарекомендовала себя при описании сложных процессов такого типа, в том числе процесса оксикрекинга этана в данной области температур [6]. Моделирование проводили в программной среде российского программного комплекса CWB 4.3 [11] на модели изотермического реактора идеального вытеснения (Plug-flow Reactor).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
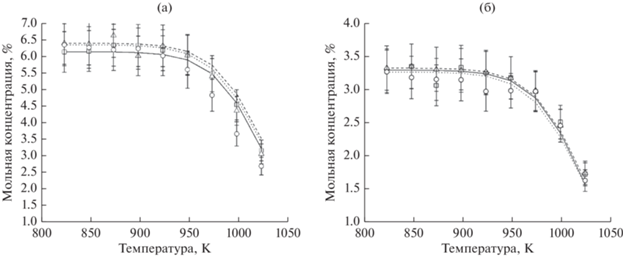
На рис. 1 представлена зависимость мольной концентрации этана на выходе из реактора от температуры пиролиза. Видно, что снижение концентрации этана начинается примерно при 925 К, близкой температуре начала конверсии, наблюдавшейся при его окислительном крекинге. При этом изменение давления в диапазоне 1–3 атм не оказывает значительного влияния на процесс пиролиза. Двукратное увеличение начальной концентрации этана (рис. 1а, 1б) также практически не влияло на температурную зависимость пиролиза. Представленные на рис. 1 результаты кинетического моделирования находятся в хорошем соответствии с экспериментальными данными.
Рис. 1.
Зависимость мольной концентрации этана от температуры его пиролиза при давлениях 1, 2 и 3 атм: а – [C2H6]0 = 3.3 мол. %, остальное – азот, t = 2 с; б – [C2H6]0 = 6.1–6.4 мол. %, остальное – азот, t = 2 с. Точки – экспериментальные результаты для этана: ◻ – p = 1 атм; Δ – p = 2 атм; ⚪ – p = 3 атм. Линии – результаты моделирования: сплошная – p = 1 атм; штриховая – p = 2 атм; пунктирная – p = 3 атм.
Аналогичные эксперименты были проведены и по пиролизу пропана. Из рис. 2а и 2б видно, что температура начала быстрого снижения концентрации пропана немного ниже, ~900 К, что хорошо согласуется с результатами, полученными в [5]. Как и в случае этана, давление существенно не влияет на скорость пиролиза пропана. Однако необходимо отметить, что используемая кинетическая модель менее точно описывает пиролиз пропана по сравнению с пиролизом этана.
Рис. 2.
Зависимость мольной концентрации пропана от температуры его пиролиза при давлениях 1, 2 и 3 атм: а – [C3H8]0 = 2.3–2.4 мол. %, остальное – азот, t = 2 с; б – [C3H8]0 = 5.0–5.7 мол. %, остальное – азот, t = 2 с. Точки – экспериментальные результаты: ◻ – p = 1 атм; Δ – p = 2 атм; ⚪ – p = 3 атм. Линии – результаты моделирования: сплошная – p = 1 атм; штриховая – p = 2 атм; пунктирная – p = 3 атм.
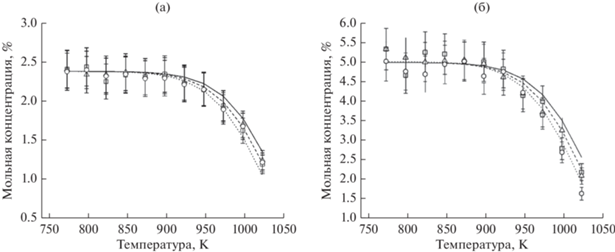
На рис. 3 и 4 приведены температурные зависимости образования основных продуктов пиролиза этана и пропана. Видно, что изменение давления в диапазоне 1–3 атм не оказывает заметного воздействия на выход непредельных углеводородов и водорода в этом процессе. Расчеты хорошо описывают выход продуктов при пиролизе этана, а концентрации образующихся этилена и водорода практически совпадают между собой как в экспериментах, так и в расчетах. При пиролизе пропана такого совпадения концентраций пропилена и водорода, естественно, нет, так как образующийся пропилен также частично подвергается дальнейшему пиролизу с появлением этилена и других продуктов. Однако если расчеты достаточно хорошо описывают выход водорода при пиролизе пропана, то расчетный выход пропилена явно завышен, что, видимо, можно отнести к недостаткам модели, требующим ее доработки.
Рис. 3.
Температурная зависимость образования основных продуктов пиролиза этана – этилена
и водорода: а – [C2H6]0 = 2.78 мол. %, остальное – азот, р = 1 и 2 атм; (б) – [C2H6]0 = 6.4 мол. %, остальное – азот, р = 1, 2 и 3 атм, t = 2 с. Точки – экспериментальные результаты: ◻ – Н2, р = 1 атм; Δ – Н2, р = 2 атм; ◇ – Н2, р = 3 атм; ⚪ – С2Н4, р = 1 атм; ▽ – С2Н4, р = 2 атм;  – С2Н4, р = 3 атм. Линии – результаты моделирования: сплошная линия – Н2, р = 1 атм; штриховая линия – Н2, р = 2 атм; штрихпунктирная линия с двумя точками – Н2, р = 3 атм; пунктирная линия – С2Н4, р = 1 атм; штрихпунктирная линия – С2Н4, р = 2 атм; штриховая линия с короткими штрихами – С2Н4, р = 3 атм.
– С2Н4, р = 3 атм. Линии – результаты моделирования: сплошная линия – Н2, р = 1 атм; штриховая линия – Н2, р = 2 атм; штрихпунктирная линия с двумя точками – Н2, р = 3 атм; пунктирная линия – С2Н4, р = 1 атм; штрихпунктирная линия – С2Н4, р = 2 атм; штриховая линия с короткими штрихами – С2Н4, р = 3 атм.

Рис. 4.
Температурная зависимость образования основных продуктов пиролиза пропана – пропилена
и водорода при давлении 1, 2 и 3 атм: а – [C3H8]0 = 5.38 мол. %, остальное – азот, t = 2 с; б – [C3H8]0 = 2.3÷2.4 мол. %, остальное – азот, t = 2 с. Точки – экспериментальные результаты: ◻ – Н2, р = 1 атм; Δ – Н2, р = 2 атм; ◇ – Н2, р = 3 атм; ⚪ – С3Н6, р = 1 атм; ▽ – С3Н6, р = 2 атм;  – С3Н6, р = 3 атм. Линии – результаты моделирования: сплошная линия – Н2, р = 1 атм; штриховая линия – Н2, р = 2 атм; штрихпунктирная линия с двумя точками – Н2, р = 3 атм; пунктирная линия – С3Н6, р = 1 атм; штрихпунктирная линия – С3Н6, р = 2 атм; штриховая линия с короткими штрихами – С3Н6, р = 3 атм.
– С3Н6, р = 3 атм. Линии – результаты моделирования: сплошная линия – Н2, р = 1 атм; штриховая линия – Н2, р = 2 атм; штрихпунктирная линия с двумя точками – Н2, р = 3 атм; пунктирная линия – С3Н6, р = 1 атм; штрихпунктирная линия – С3Н6, р = 2 атм; штриховая линия с короткими штрихами – С3Н6, р = 3 атм.

Хорошее согласие экспериментальных результатов и кинетических расчетов по термическому пиролизу легких алканов позволяет нам расширить диапазон исследуемых давлений за пределы экспериментальных возможностей используемого оборудования. С тем, чтобы более надежно установить влияние давления на пиролиз легких алканов, был проведен кинетический расчет при значительно более высоких давлениях – 10 и 15 атм (рис. 5 и 6).
Рис. 5.
Расчетная температурная зависимость конверсии этана при его термическом пиролизе при давлениях 1, 10 и 15 атм: [C2H6]0 = 3.29 мол. %, остальное – азот, t = 2 с; ◻ – экспериментальные результаты для C2H6 при р = 1 атм. Линии – результаты моделирования: сплошная линия – р = 1 атм; штриховая линия – р = 10 атм; пунктирная линия – р = 15 атм.
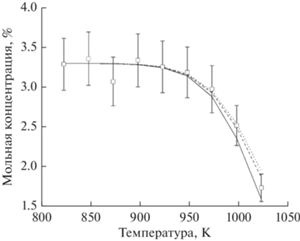
Рис. 6.
Расчетная температурная зависимость образования водорода при термическом пиролизе этана при давлениях 1, 10 и 15 атм: [C2H6]0 = 3.29 мол. %, остальное – азот, t = 2 с; ◻ – экспериментальные результаты для H2 при р = 1 атм. Линии – результаты моделирования: сплошная линия – р = 1 атм; штриховая линия – р = 10 атм; пунктирная линия – р = 15 атм.
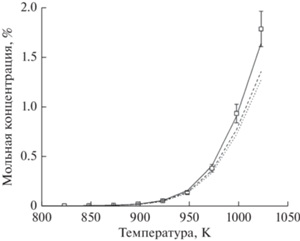
Как видно из рис. 5 и 6, повышение давления вплоть до 15 атм практически не оказывает влияния на термический пиролиз. Аналогичные результаты были получены при увеличении начальной концентрации этана примерно в два раза, а также для пиролиза пропана. Небольшое различие расчетных кривых для разных давлений, видимо, связано с тем, что все же имеет место незначительное перераспределение каких-то второстепенных маршрутов в схеме процесса. Таким образом, экспериментальные данные и результаты кинетического моделирования позволяют сделать вполне однозначный вывод, что давление не играет существенной роли в процессе пиролиза этана и пропана, а, следовательно, наблюдаемое влияние давления на оксикрекинг легких алканов следует отнести к окислительным, а не к термическим стадиям процесса, как и предполагалось в работе [5].
ЗАКЛЮЧЕНИЕ
Проведенное в настоящей работе комбинированное экспериментальное и теоретическое исследование термического пиролиза этана и пропана в условиях проточного реактора подтвердило возможность количественного описания процессов конверсии легких алканов на базе современных кинетических моделей. Полученные результаты показывают незначительную роль гетерогенных реакций на поверхности реактора в пиролизе этана и пропана. Важный практический вывод состоит в том, что изменение давления, по крайней мере в пределах 1–15 атм, не оказывает заметного влияния на процесс пиролиза. Таким образом, подтвержден практически важный вывод, сделанный в [5], что влияние давления на окислительный крекинг этана связано с его воздействием на окислительные стадии процесса.
Список литературы
Арутюнов В.С. Окислительная конверсия природного газа. М.: КРАСАНД, 2011. 640 с. (Arutyunov V.S., Okislitel’naya konversiya prirodnogo gaza (Oxidative Conversion of Natural Gas), M.: KRASAND, 2011.)
Арутюнов В.С., Голубева И.А., Елисеев О.Л., Жагфаров Ф.Г. Технология переработки углеводородных газов: учебник для вузов. М.: Юрайт, 2020. 723 с. (Arutyunov V.S., Golubeva I.A., Eliseev O.L., Zhagfarov F.G., Tekhnologiya pererabotki uglevodorodnykh gazov: uchebnik dlya vuzov (Technology of Processing of Hydrocarbon Gases: Textbook for Universities), M.: Yurait, 2020.)
Arutyunov V.S., Magomedov R.N., Proshina A.Yu., Strekova L.N. // Chem. Eng. J. 2014. V. 238. P. 9.
Арутюнов В.С., Савченко В.И., Седов И.В., Никитин А.В., Магомедов Р.Н, Прошина А.Ю. // Успехи химии. 2017. Т. 86. № 1. С. 47. (Arutyunov V.S., Savchenko V.I., Sedov I.V., Nikitin A.V., Magomedov R.N., Proshina A.Yu. Russ. Chem. Rev. 2017. V. 86. № 1. P. 47.)
Арутюнов В.С., Дмитрук А.С., Никитин А.В. // Изв. Акад. Наук. Сер. хим. 2016. № 10. С. 2405. (Nikitin A.V., Arutyunov V.S., Dmitruk A.S. Russ. Chem. Bull. 2016. № 10. P. 2405.)
Брюков М.Г., Паланкоева А.С., Беляев А.А., Арутюнов В.С. // Кинетика и катализ. 2021. Т. 62. № 6. С. 666. (Bryukov M.G., Palankoeva A.S., Belyaev A.A., Arutyunov V.S. Kinet. Catal. 2021. V. 62. № 6. P. 703.) https://doi.org/10.31857/S0453881121060022
NUIGMech1.1 [электронный ресурс]. National University of Ireland Galway. 2020. URL: http://c3.nuigalway.ie/combustionchemistrycentre/ mechanismdownloads/
Магомедов Р.Н., Прошина А.Ю., Арутюнов В.С. // Кинетика и катализ. 2013. Т. 54. № 4. С. 401. (Magomedov R.N., Proshina A.Yu., Arutyunov V.S. Kinet. Catal. 2013. V. 54. № 4. P. 383.)
Магомедов Р.Н., Прошина А.Ю., Пешнев Б.В., Арутюнов В.С. // Кинетика и катализ. 2013. Т. 54. № 4. С. 413. (Magomedov R.N., Proshina A.Yu., Peshnev B.V., Arutyunov V.S. Kinet. Catal. 2013. V. 54. № 4. P. 394.)
Дмитрук А.С., Никитин А.В., Стрекова Л.Н., Арутюнов В.С. // Горение и взрыв. 2016. Т. 9. № 3. С. 21. (Dmitruk A.S., Nikitin A.V., Strekova L.N., Arutyunov V.S. Gorenie i Vzryv. 2016 V. 9. № 3. P. 21.)
Chemical Workbench 4.3 [электронный ресурс]. Kintech Laboratory. 2021. URL: http://www.kintechlab.com/products/chemical-workbench/
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


