Кинетика и катализ, 2022, T. 63, № 3, стр. 322-330
Катализ иодидами платины(II) электрофильного С(sp2)–C(sp2)-сочетания
Т. В. Краснякова a, *, Д. В. Никитенко a, В. В. Моренко a, С. А. Митченко a, b
a Институт физико-органической химии и углехимии
283111 Донецк, ул. Р. Люксембург, 70, Украина
b Южно-российский государственный политехнический университет (НПИ) им. М.И. Платова
346428 Новочеркасск, ул. Просвещения, 132, Россия
* E-mail: ktv_@list.ru
Поступила в редакцию 17.09.2021
После доработки 08.11.2021
Принята к публикации 10.11.2021
- EDN: DGRFYG
- DOI: 10.31857/S0453881122030091
Аннотация
В системе PtII–NaI–С2Н3I–ацетон-D6 при 40°С осуществлена каталитическая реакция C(sp2)–C(sp2)-сочетания винилиодида с образованием 1,3-бутадиена. Выход бутадиена в расчете на прореагировавший винилиодид близок к количественному. Механизм реакции включает окислительное присоединение С2Н3I к иодидному комплексу PtII с промежуточным образованием винильного комплекса PtIV. Восстановление последнего до винильного производного PtII и дальнейшее окислительное присоединение второй молекулы С2Н3I дает дивинильный комплекс PtIV. Восстановительное элиминирование двух винильных лигандов из бис-органильного производного PtIV приводит к конечному продукту бутадиену. Стадии восстановления винилплатины(IV) способствует сольвентоспецифичное связывание выделяющегося иода ацетоном и избытком иодида натрия.
ВВЕДЕНИЕ
Катализируемые комплексами переходных металлов реакции С–С-сочетания, позволяющие конструировать сложные органические молекулы из доступных реагентов, стали одним из важнейших инструментов органической химии [1–6]. Многие биологически активные соединения, фармацевтические препараты, пестициды, оптические материалы и т.п. получают, в том числе и в промышленных масштабах [7, 8], с помощью этого синтетического приема. Стадийный механизм реакции кросс-сочетания обычно включает окислительное присоединение органического электрофила RX (X = Cl, Br, I, OTf и т.п.) к комплексу переходного металла в низкой степени окисления (М0) с образованием интермедиата R–M2+–Х, последующее переметаллирование которого элементоорганическим нуклеофилом R’EYn (E = Zn, B, Mg, Sn и т.п.) приводит к образованию бис-органильного соединения R–M+2–R'. Распад последнего путем восстановительного элиминирования дает продукт R–R'-кросс-сочетания и регенерирует катализатор, замыкая каталитический цикл.
Концептуально иной подход представляет собой реакция С–С-сочетания непосредственно двух С-электрофилов, например, галогенорганических соединений [9–11], что позволяет исключить синтез зачастую опасных и непростых в обращении элементоорганических реагентов, необходимых в традиционном кросс-сочетании. Стадийный механизм таких реакций кросс-электрофильного сочетания включает стадию восстановления, например, промежуточного продукта первого окислительного присоединения электрофильного реагента. В качестве восстановителя обычно используют металлы (Zn0, Mn0) [9–11].
Ацидокомплексы PtII легко вступают в реакции окислительного присоединения алкилиодидов RI и их производных с образованием соответствующих металлоорганических соединений RPtIV [12]. Для получения ключевых интермедиатов С–С-сочетания – бис-органильных производных металла – необходимо восстановление продукта окислительного присоединения первого электрофила, моноорганильного комплекса RPtIV до RPtII.
В качестве мягкого восстановителя можно применять иодид-ионы: иодидные комплексы PtIV восстанавливаются легче хлоридных или бромидных, но даже в этом случае равновесие RPtIV + + I– $ \rightleftarrows $ RPtII + ${\text{I}}_{3}^{ - }$ сильно сдвинуто в сторону алкильного производного платины(IV) [13]. Как показано в работах [14, 15], данную ситуацию можно изменить при осуществлении реакции в растворе ацетона, который в присутствии избытка иодида натрия связывает иод в малорастворимый полимерный комплекс [Na(C3H6O)3]n(I2)n [16].
Использование такого сольвентоспецифичного восстановления PtIV до PtII позволяет легко генерировать in situ бис-органильные комплексы R–PtIV–R путем последовательного алкилирования платины(II) иодалкильными производными RI [17]. Хотя образующиеся платинаорганические соединения содержат органические лиганды R во взаимном цис-положении, что необходимо для дальнейшего осуществления восстановительного С–С-сочетания, реакция с заметной скоростью не идет [17]. Для реализации C–C-сочетания целесообразно применять винилиодиды в качестве органических электрофилов: восстановительное сочетание C(sp2)–C(sp2) протекает легче, чем C(sp3)–C(sp3) [18, 19]. Проверка этой гипотезы составила цель настоящей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления растворов использовали коммерческие реактивы NaI (“х. ч.”) и дейтерированный ацетон-D6 (“Merсk”) без дополнительной очистки. Соль Na2PtCl4 синтезировали по известной методике [20]. Иодидные комплексы платины получали in situ путем замещения хлорид-лигандов в присутствии избытка NaI в растворе ацетона-D6. Соль Na2PtCl4 растворяли в 0.9 мл раствора NaI (1.5 М) в ацетоне-D6 и оставляли на сутки при комнатной температуре. Затем центрифугированием отделяли выпавший осадок хлорида натрия, надосадочную жидкость переносили в ампулу ЯМР и добавляли аликвоту раствора винилиодида и NaI той же концентрации в ацетоне-D6. Ампулу герметично запаивали.
Винилиодид синтезировали гидроиодированием ацетилена при катализе иодидными комплексами платины(IV) [21]. Ацетилен медленно барботировали при температуре 80°С через водный раствор NaI (3.7 M), HClO4 (3 М) и PtIV (0.025 М), помещенный в снабженную обратным холодильником двугорлую колбу. Винилиодид в токе выходящего из обратного холодильника газа конденсировали в ловушке, охлаждаемой парами азота до –50 ± 10°С. Сконденсировавшуюся маслянистую жидкость соломенного цвета хранили при температуре –18°С. Чистоту винилиодида контролировали методом 1Н-ЯМР (δ, м. д.; ацетон-D6): 6.78–6.65 (м, 2H), 6.29 (дд, 3JHH(транс) = = 15.3, 2JHH = 0.8 Гц, 1H). 13C{1H} ЯМР-спектр (δ, м. д.; ацетон-D6): 87.6 (=CHI), 131.6 (=CH2). Полученный таким путем винилиодид не содержал в детектируемых количествах примеси ацетилена.
Реакции проводили при 40°С, их протекание контролировали по изменению интенсивности сигналов реагентов и образующихся продуктов в спектре 1Н-ЯМР. Спектры ЯМР записывали с использованием ЯМР-спектрометра AVANCE II 400 (“Bruker”, Германия). Концентрации определяли относительно внутреннего стандарта (бензол) путем интегрирования соответствующих сигналов в 1Н-ЯМР-спектре. При записи 195Pt-ЯМР спектров внешним стандартом служил раствор Na2PtCl6 в D2O.
Масс-спектры высокого разрешения (HRMS) регистрировали на приборе Bruker maXis (“Bruker”, Германия) с ионизацией методом электрораспыления (ESI). Измерения выполняли на отрицательных ионах при напряжении на капилляре 3200 В. Диапазон сканирования масс m/z = 50–1200, калибровка – внешняя и внутренняя (low-concentration tuning mix solution, “Agilent Technologies”, США). При измерениях применяли прямой ввод вещества для растворов в ацетонитриле. Скорость потока составляла 3 мкл/мин. В качестве газа-распылителя использовали азот со скоростью подачи 4 л/мин. Эксперименты поводили при температуре интерфейса 180°С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
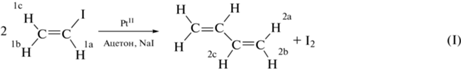
Мы нашли, что при 40°С в растворе NaI (1.5 М) в ацетоне-D6 иодидные комплексы PtII катализируют C(sp2)–C(sp2)-сочетание винилиодида с образованием 1,3-бутадиена; в отсутствие катализатора реакция (I) с заметной скоростью не протекает:
Идентификацию продукта осуществляли методом ЯМР-спектроскопии. 1Н-ЯМР-спектр С4Н6 (рис. 1) представлен двумя сложными мультиплетами в винильной области: 6.43–6.31 и 5.29‑5.06 м. д.; отнесение сигналов бутадиена согласуется с данными [22]. В 13C{1H} ЯМР-спектре сигналы с химическими сдвигами 118.4 и 138.6 м. д. отвечают атомам углерода метилиденовой группы (=CH2) и метинового мостика (–СH=) соответственно.
Рис. 1.
1Н-ЯМР-спектр реакционной смеси в системе PtII–NaI–С2Н3I–ацетон-D6 при 40°С; нумерация атомов водорода дана в уравнении (I).

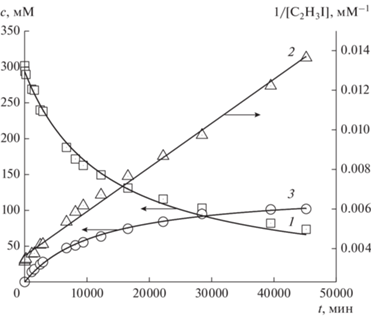
Селективность Sbd реакции по бутадиену (выход бутадиена в расчете на израсходованный субстрат) составляет около 90% (табл. 1). Расходование винилиодида отвечает кинетическому уравнению второго порядка (рис. 2). Реакция протекает в каталитическом режиме: на одном комплексе платины было реализовано до 38 каталитических циклов (табл. 1) без заметного снижения константы скорости расходования субстрата (рис. 2).
Таблица 1.
Селективность Sbd реакции по бутадиену, число каталитических циклов TON и наблюдаемая константа k скорости второго порядка расходования винилиодида при разных загрузках катализатора [PtII]0 и субстрата [С2Н3I]0
| [PtII]0, M | [С2Н3I]0, М | Sbd, % | TON | k × 103, л моль–1мин–1 |
|---|---|---|---|---|
| 0.007 | 0.3 | 92 ± 3 | 38 | 0.27 ± 0.02 |
| 0.017 | 0.23 | 86 ± 3 | 13.5 | 1.31 ± 0.02 |
| 0.036 | 0.5 | 89 ± 5 | 14 | 1.67 ± 0.08 |
| 0.086 | 0.3 | 83 ± 1 | 3.5 | 4.1 ± 0.2 |
Рис. 2.
Типичная кинетика расходования винилиодида (1), ее линейная анаморфоза (2) и кинетика образования бутадиена (3) в системе PtII–NaI–С2Н3I–ацетон-D6; Т = 40°С, исходная концентрация катализатора [PtII]0 = 0.007 M.
Отметим, что в соответствии со стехиометрией реакции (I) количество выделившегося в 38 каталитических циклах иода в 19 раз превышает количество загруженного катализатора. Такой громадный избыток свободного иода должен был полностью отравить катализатор путем окисления платины(II). Однако этого не произошло: в реакционном растворе наблюдается небольшое понижение концентрации PtII в ходе реакции – в 195Pt-ЯМР-спектре интегральная интенсивность сигнала ${\text{Pt}}_{4}^{{{\text{II}}}}$ после проведения реакции примерно на 20% уменьшилась по сравнению с исходным раствором (рис. 3). При этом в ЯМР-спектре на ядрах 195Pt появления сигналов PtIV не зафиксировано. Выделяющийся в реакции (I) иод связывается в полимерный комплекс [Na(C3H6O)3]n(I2)n [16], выпадающий в виде темного кристаллического осадка. Зарегистрированное небольшое уменьшение концентрации платины в растворе может быть связано с ее адсорбцией на поверхности осадка.
Рис. 3.
Зависимость интегральной интенсивности сигнала PtII (δ = –5035 м. д.) IPt в спектре 195Pt-ЯМР (измерена относительно внешнего стандарта) в реакционном растворе до (1) и после (2) реакции от количества загруженной платины(II) [PtII]0.
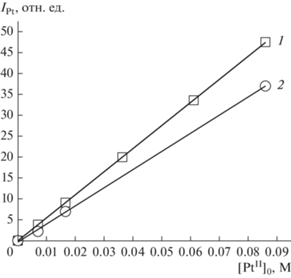
Константа скорости второго порядка расходования винилиодида линейно зависит от исходной концентрации платины в реакционной смеси (рис. 4).
Рис. 4.
Зависимость наблюдаемой константы скорости второго порядка расходования винилиодида в системе PtII–NaI–С2Н3I–ацетон-D6 от исходной концентрации катализатора.

Винилбромид в таких же условиях тоже дает бутадиен. В этом случае в 1Н-ЯМР-спектре помимо бутадиена, концентрация которого монотонно растет во времени, зафиксирован винилиодид. Концентрация последнего быстро нарастает, достигая максимума, после чего монотонно убывает. Промежуточное образование винилиодида согласуется с обнаруженным ранее фактом [23] катализа иодидами платины(II) нуклеофильного замещения у неактивированного sp2-атома углерода в мягких условиях.
Наблюдение интермедиатов реакции
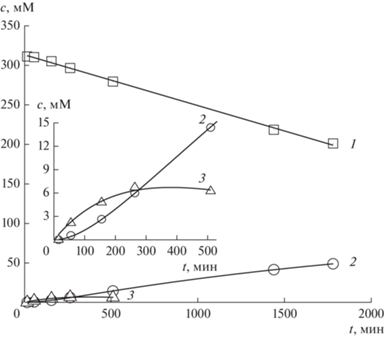
При проведении реакции при температуре 23°С в кинетике накопления бутадиена проявляется индукционный период (рис. 5), на протяжении которого накапливается и достигает максимальной концентрации промежуточный платинавинильный комплекс.
Рис. 5.
Кинетика расходования винилиодида (1), накопления бутадиена (2) и образования промежуточного винильного комплекса платины (3) в системе PtII–NaI–С2Н3I–ацетон-D6; Т = 23ºС, исходная концентрация катализатора [PtII]0 = 0.1 M.
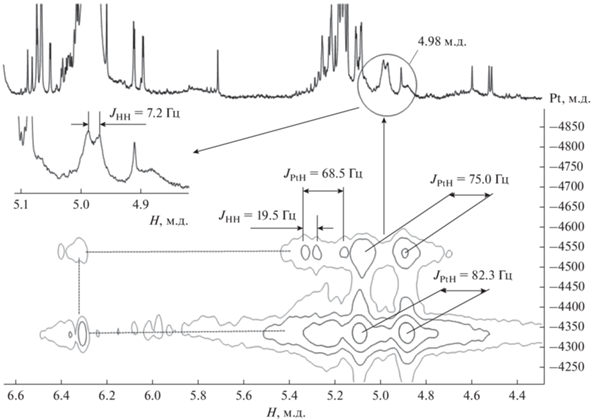
В силу наложения в 1Н-ЯМР-спектре ряда сигналов этого комплекса с сигналами субстрата и продуктов его строение подтверждено гетероядерной 1Н-195Pt HMQC ЯМР-спектроскопией (рис. 6). Сигнал 195Pt с химическим сдвигом –4334 м. д. имеет кросс-пики с сигналами протонов при 4.98 м. д., а также в диапазонах 5.2–5.3 и 6.3–6.4 м. д. Положение сигналов в 1Н-спектре позволяет отнести их к атомам водорода винильного лиганда.
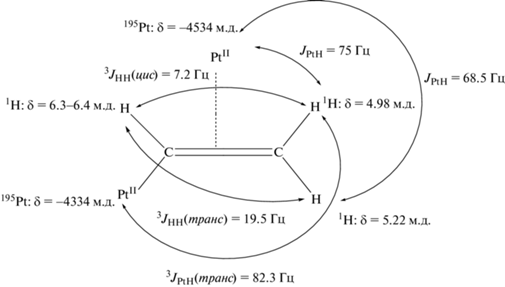
Сигнал с химическим сдвигом 4.98 м. д. не накладывается на другие сигналы, что дало возможность его проинтегрировать. Он проявляется в виде дублета с JHH = 7.2 Гц и сопровождается платиновыми сателлитами с высоким значением константы спин-спинового взаимодействия (КССВ) JPtH = 82.3 Гц. Значение гомоядерной КССВ этого сигнала характерно для вицинальной константы 3JНН(цис) в олефинах [24, 25], что позволяет отнести этот сигнал к винильному протону, находящемуся у β-атома углерода в транс-положении к платине (cхема 1). Соответственно, гетероядерная константа спин-спинового взаимодействия отвечает константе 3JPtН(транс). Высокое значение вицинальной гетероядерной КССВ указывает на σ-связь металлического центра с винильной группой. Платина обычно сдвигает ЯМР-сигналы протонов, находящихся у α-атома углерода, в слабое поле (ср. [26–29]). Поэтому самый слабопольный в 1Н-спектре сигнал кросс-пика (6.3–6.4 м. д.) следует отнести к винильному протону, связанному с α-атомом углерода.
Схема 1 . Интерпретация параметров ЯМР-спектров биядерного винильного комплекса PtII(η2-(H2C=C(H)‑PtII)).
Все рассмотренные сигналы в 1Н-ЯМР-спектре имеют кросс-пики также с более сильнопольным сигналом 195Pt (δ = –4534 м. д.), положение которого близко к исходным иодидным комплексам PtII (–5035 м. д.). Дублет 4.98 м. д. за счет спин-спинового взаимодействия с ядрами 195Pt этой платины обладает второй парой сателлитов JPtН = 75 Гц. В кросс-пике сигналов 1H (δ = 5.2–5.3 м. д.) и 195Pt (δ = –4534 м. д.) видно, что протонный сигнал представляет собой дублет JHH = 19.5 Гц с центром при δ = 5.22 м. д. и тоже сопровождается платиновыми сателлитами JPtH = = 68.5 Гц. Значение гомоядерной КССВ сигнала этого протона характерно для вицинальной константы 3JНН(транс) в олефинах [24, 25], что в совокупности с его положением позволяет отнести данный сигнал к винильному протону, связанному с β-атомом углерода и находящемуся в цис-положении к платине, образующей σ-связь с винильным лигандом. Близкие по величине значения гетероядерных КССВ JPtH и несколько меньшее их значение по сравнению с 3JPtН(транс) очевидно объясняются π-координацией двойной связи винильного лиганда к комплексу PtII с δ = –4534 м. д.
Таким образом, данные ЯМР-спектроскопии позволили идентифицировать биядерный винильный комплекс, в котором винильный лиганд связан одновременно с двумя комплексами платины – с одним σ-, а с другим – π-связью. Окислительные состояния комплексов платины в нем удалось установить методом ESI-HRMS. В масс-спектре реакционной смеси имеются сигналы с экспериментальным значением m/z = 924.5727 и характерным для платины изотопным распределением, отвечающие иону [PtII(η2-(H2C=C(H)‑PtIII2))I2]– с зарядом –1. Такое возможно, если оба атома платины в обнаруженном биядерном винильном комплексе имеют координационное число 4, т.е. находятся в степени окисления +2. Подобные полиядерные комплексы переходных металлов (в том числе PtII), cодержащие лиганды с кратной связью, описаны в литературе (см., например, обзоры [30, 31]).
Помимо этого в реакционной смеси методом ESI-HRMS зафиксированы моно- и дивинильный моноядерные комплексы PtIV, а также биядерный дивинильный комплекс платины(IV), в котором один из винильных лигандов дополнительно π-координирован к PtII: в масс-спектре обнаружены сигналы с экспериментальными значениями m/z = 729.6074, 629.7220 и 1078.4899 и характерным для платины изотопным распределением, отвечающие однозарядным ионам [Pt(С2H3)I4]–, [Pt(С2H3)2I3]– и [PtII(η2-(H2C=C(H)‑PtIV(C2H3)I2))I3]– соответственно.
Механизм реакции
Приведенные экспериментальные данные согласуются со следующим стадийным механизмом C(sp2)–C(sp2)-сочетания в системе PtII–NaI–С2Н3I–ацетон-D6 (схема 2 ).
Схема. 2. Стадийный механизм каталитического C(sp2)–C(sp2)-сочетания в системе PtII–NaI–С2Н3I–ацетон.
Реакция начинается (стадия I) с окислительного присоединения винилиодида к иодидным комплексам PtII с образованием винильного комплекса A (зафиксирован масс-спектрально). Связывание винилиодида в металлоорганический комплекс происходит обратимо. Косвенным подтверждением последнего является факт протекания в этих условиях реакции нуклеофильного замещения в винилбромиде.
Дальнейшее восстановление винильного комплекса PtIV иодид-ионами (стадия II) генерирует σ-винильное производное PtII. Осуществлению этой стадии благоприятствует сольвентоспецифичное связывание выделяющегося иода ацетоном и избытком иодида натрия в малорастворимый полимерный комплекс [Na(C3H6O)3]n(I2)n [16], который наблюдается в виде темного игольчатого осадка. Эта реакция записана как обратимая, поскольку в растворе присутствует свободный иод в небольшой концентрации, определяемой произведением растворимости полимерного комплекса [Na(C3H6O)3]n(I2)n.
Равновесная π-координация двойной связи винильного лиганда к иодидному комплексу платины(II) (стадия III) дает наблюдаемый в спектрах ЯМР биядерный комплекс B. Равновесие (III) смещено в сторону биядерного комплекса платины: методами ЯМР или ESI-HRMS моноядерное винильное производное PtII в регистрируемых количествах не обнаружено.
Винильное производное платины(II) окислительно присоединяет вторую молекулу винилиодида, формируя бис-винильный комплекс С (стадия IV), обнаруженный масс-спектрально. Завершает каталитический цикл восстановительное элиминирование двух винильных лигандов с образованием продукта С–С-сочетания – бутадиена (стадия V). Ранее было экспериментально показано [32] и подтверждено DFT-расчетами [18], что подобная реакция для иодидных комплексов платины(IV), содержащих β-иодвинильные лиганды в цис-положении друг к другу, протекает быстро.
Согласно стадийному механизму (схема 2 ) винилиодид поглощается в двух последовательных стадиях I и IV. Выполнение кинетического уравнения второго порядка по субстрату (рис. 2) означает, что стадии I–II окислительного присоединения первой молекулы винилиодида и восстановления винильного комплекса платины(IV) до винильного производного платины(II) являются равновесными, а реакцию лимитирует окислительное присоединение второй молекулы электрофила (стадия IV).
ЗАКЛЮЧЕНИЕ
На примере восстановительной димеризации винилиодида с образованием 1,3-бутадиена в системе PtII–NaI–ацетон реализовано прямое C(sp2)–C(sp2)-сочетание двух электрофильных реагентов, включающее последовательность стадий:
– окислительное присоединение первой молекулы органического электрофила к иодидным комплексам PtII с образованием винильного комплекса платины(IV);
– восстановление продукта окислительного присоединения иодид-ионами до винильного производного платины(II), которому содействует сольвентоспецифичное связывание иода ацетоном и избытком иодида натрия в малорастворимый полимерный комплекс;
– окислительное присоединение к винилплатине(II) второй молекулы винилиодида с образованием дивинильного комплекса PtIV;
– восстановительное элиминирование двух винильных лигандов, приводящее к конечному продукту С–С-сочетания.
Распространение описанного подхода на реакции кросс-электрофильного С(sp2)–С(sp3) сочетания и изучение их механизмов являются предметами дальнейшего исследования нашей лаборатории.
Список литературы
Negishi E. Handbook of Organopalladium Chemistry for Organic Synthesis. N.Y.: Wiley-Interscience, 2002. 3279 p.
Beletskaya I.P., Cherpakov A.V. Comprehensive Coordination Chemistry II. In, Elsevier Pergamon, 2004. P. 305.
Meijere A., Bräse S., Oestreich M. Metal-catalyzed cross-coupling reactions and more. Weinheim (Germany): Wiley-VCH, 2014. 1576 p.
Матышак В.А., Сильченкова О.Н. // Кинетика и катализ. 2019. Т. 60. № 5. С. 578.
Курохтина А.А., Ярош Е.В., Ларина Е.В., Лагода Н.А., Шмидт А.Ф. // Кинетика и катализ. 2018. Т. 59. № 5. С. 551.
Темкин О.Н. // Кинетика и катализ. 2019. Т. 60. № 6. С. 683.
Zapf A., Beller M. // Top. Catal. 2002. V. 19. № 1. P. 101.
Афанасьев В.В., Беспалова Н.Б., Белецкая И.П. // Российский химический журн. 2006. Т. 9. № 4. P. 81.
Everson D.A., Weix D.J. // J. Org. Chem. 2014. V. 79. № 11. P. 4793.
Knappke C., Grupe S., Gaertner D., Corpet M., Gosmini C., Wangelin A. // Chemistry. 2014. V. 20. № 23. P. 6828.
Weix D.J. // Acc. Chem. Res. 2015. V. 48. № 6. P. 1767.
Замащиков В.В., Литвиненко С.Л., Митченко С.А., Прядко О.Н. // Металлооганическая химия. 1992. Т. 5. № 6. С. 1272.
Митченко С.А., Замащиков В.В., Прядко О.Н., Костенко Е.Л., Шубин А.А. // Кинетика и катализ. 1993. Т. 34. № 1. С. 78. (Mitchenko S.A., Zamashikov V.V., Pryadko O.N., Kostenko E.L., Shubin A.A. // Kinet. Catal. 1993. V. 34. № 1. P. 79.)
Митченко С.А., Хазипов О.В., Краснякова Т.В. // Изв. Акад. наук. Сер. хим. 2013. № 4. С. 984. (Mitchenko S.A., Khazipov O.V., Krasnyakova T.V. // Russ. Chem. Bull. 2013. V. 62. № 4. P. 984.)
Хазипов О.В., Мерзликина М.А., Никитенко Д.В., Хомутова Е.В., Краснякова Т.В., Митченко С.А. // Журн. общей химии. 2017. Т. 87. № 1. С. 134. (Khazipov O.V., Merzlikina M.A., Nikitenko D.V., Khomutova E.V., Krasnyakova T.V., Mitchenko S.A. // Russian Journal of General Chemistry. 2017. V. 87. № 1. Р. 128.)
Howie R.A., Wardell J.L. // Acta Cryst. 2003. V. C59. P. m184.
Khazipov O.V., Krasnyakova T.V., Nikitenko D.V., Merzlikina M.A., Khomutova E.V., Mitchenko S.A. // J. Organometal. Chem. 2018. V. 867. P. 333.
Ananikov V.P., Musaev D.G., Morokuma K. // Organometallics. 2005. V. 24. № 4. P. 715.
Ariafard A., Ejehi Z., Sadrara H., Mehrabi T., Etaati S., Moradzadeh A., Moshtaghi M., Nosrati H., Brookes N.J., Yates B.F. // Organometallics. 2011. V. 30. № 3. P. 422.
Черняев И.Н. Синтез комплексных соединений металлов платиновой группы. Справочник. Mосква: Наука, 1964. 239 с.
Замащиков В.В., Митченко С.А., Шубин А.А. // Кинетика и катализ. 1993. Т. 34. № 3. С. 479. (Zamashikov V.V., Mitchenko S.A., Shubin A.A. // Kinet. Catal. 1993. V. 34. № 3. P. 479.)
SDBSWeb: https://sdbs.db.aist.go.jp (National Institute of Advanced Industrial Science and Technology, date of access 30.08.2021.
Митченко С.А., Замащиков В.В., Шубин А.А. // Кинетика и катализ. 1991. Т. 32. № 2. С. 343. (Mitchenko S.A., Zamashikov V.V., Shubin A.A. // Kinet. Catal. 1991. V. 32. № 2. P. 302.)
Гюнтер Х. Введение в курс спектроскопии ЯМР. Mосква: Мир, 1984. 478 с. (Günter H. NMR Spectroscopy: An Introduction. Wiley, 1980. 436 p.)
Вилков Л.В., Пентин Ю.А. Физические методы исследования в химии. Резонансные и электрооптические методы. Москва: Высшая школа, 1989. 288 с.
Замащиков В.В., Митченко С.А., Прядко О.Н., Вдовиченко А.Н. // Журн. общей химии. 1995. Т. 65. № 2. С. 346. (Zamashikov V.V., Mitchenko S.A., Pryadko O.N., Vdovichenko A.N. // Russian J. General Chemistry. 1995. V. 65. № 2. P. 346.)
Митченко С.А., Анаников В.П., Замащиков В.В. // Теорет. и эксперим. химия. 1996. Т. 32. № 4. С. 234. (Mitchenko S.A., Ananikov V.P., Zamashchikov V.V. // Theoretical and Experimental Chemistry. 1996. V. 32. № 4. P. 205.)
Ananikov V., Mitchenko S.A., Beletskaya I.P., Nefedov S.E., Eremenko I.L. // Inorg. Chem. Commun. 1998. V. 1. № 11. P. 411.
Mitchenko S.A., Khazipov O.V., Krasnyakova T.V. // J. Organomet. Chem. 2015. V. 793. P. 145.
Jain V.K., Jain L. // Coordin. Chem. Rev. 2010. V. 254. № 23. P. 2848.
Bayrakdar T., Scattolin T., Ma X., Nolan S.P. // Chem. Soc. Rev. 2020. V. 49. № 19. P. 7044.
Митченко С.А. // Кинетика и катализ. 1999. Т. 40. № 2. С. 278. (Mitchenko S.A. // Kinetics and Catalysis. 1999. V. 40. № 2. P. 253.)
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ