Кинетика и катализ, 2022, T. 63, № 4, стр. 433-445
Фотокаталитическая инактивация бактерий в присутствии диоксида титана, модифицированного вольфрамом при облучении видимым светом
М. Л. Беликов a, *, Н. В. Фокина b, В. В. Редькина b, С. А. Сафарян a
a ФГБУН ФИЦ Кольский научный центр РАН, Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева
184209 Мурманская область, Апатиты, Академгородок, 26а, Россия
b ФГБУН ФИЦ Кольский научный центр РАН, Институт проблем промышленной экологии
184209 Мурманская область, Апатиты, Академгородок, 14, Россия
* E-mail: masim-bek@mail.ru
Поступила в редакцию 28.12.2021
После доработки 04.03.2022
Принята к публикации 07.03.2022
- EDN: DCEIKL
- DOI: 10.31857/S0453881122040037
Аннотация
Синтезированы фотокаталитически активные материалы на основе диоксида титана, модифицированного вольфрамом (от 5 до 30 мас. %). Приведены особенности формирования этих материалов, их физико-химические и фотокаталитические свойства. Обнаружено, что модифицирование диоксида титана вольфрамом обеспечивает получение нанодисперсных порошков (7.2–96.7 нм) со свободной удельной поверхностью от 6.4 до 215 м2/г. Показана высокая эффективность фотокатализаторов на основе диоксида титана, модифицированных вольфрамом (от 10 до 30 мас. %) и прокаленных при 600°С, при фотокаталитической инактивации микробиоты на примере грамотрицательных бактерий Pseudomonas fluorescens. Максимальные значения фотокаталитической антибактериальной активности наблюдаются для образца 600-W-20. Основная масса бактерий инактивируется при облучении видимым светом естественного происхождения при освещенности (Е) 14500 лк в течение первых 20–45 мин. При введении в качестве фотокатализатора немодифицированного диоксида титана, образца 600-W-5 и коммерческого фотокатализатора Р-25 фирмы “Degussa” ингибирования бактериального роста не обнаружено.
ВВЕДЕНИЕ
Несколько десятилетий активно развивается фотокатализ, как перспективный метод очистки воды и воздуха [1–4]. В качестве фотокатализаторов (ФК) применяются различные металлоксидные полупроводники: ZnO [5–7], WO3 [8, 9], Fe2O3 [10], CdSe [11] и SrTiO3 [12].
Особого внимания заслуживает диоксид титана. Интерес к TiO2 как к ФК вырос после открытия фотокаталитического расщепления воды с его применением [13]. Сообщения об использованиии TiO2 для фотокатализа появились еще в 20-е гг. двадцатого столетия [14, 15], когда обнаружилось, что устойчивые к свету красители разлагаются в контакте с TiO2.
TiO2 обладает рядом свойств, таких как нетоксичность, фотостабильность, доступность, химическая и биологическая устойчивость [16], благодаря чему является наиболее распространенным ФК. Важно отметить, что производство диоксида титана осуществляется в промышленности в больших объемах.
Несмотря на указанные выше достоинства, TiO2 вследствие значительной величины запрещенной зоны (Eg составляет 3.2 эВ для анатаза и 3.0 эВ для рутила) фотокаталитически активен лишь при облучении ультрафиолетовым (УФ) светом, на который приходится всего 3–7% спектра солнечного света [17–19]. Этот факт существенно ограничивает применение TiO2 как ФК при облучении светом с длиной волны λ > 400 нм. Расширение спектрального диапазона фотовосприимчивости TiO2 в видимую и ближнюю инфракрасную области может быть достигнуто введением модифицирующих добавок. Модифицирование диоксида титана проводят как неметаллическими элементами (фтор, азот, углерод, сера) [20], так и катионами металлов [21–32]. В результате модифицирования край фотокаталитической восприимчивости TiO2 смещается в более длинноволновую область спектра, что наглядно показано во многих исследованиях на примере разложения различных органических соединений при облучении не только УФ, но и видимым светом.
Ранее в ряде работ была оценена возможность фотокаталитической деструкции различной микрофлоры фотокаталитически активными материалами на основе диоксида титана. Так, например, в работе [33] при облучении УФ-светом изучена бактерицидная активность ФК на основе диоксида титана, полученных золь–гель-методом путем изменения условий реакций, кислот и содержания модифицирующих примесей (Al, B). Все полученные образцы были аморфными с небольшими примесями анатаза и/или рутила. Они продемонстрировали инактивирующее действие в отношении бактерий, причем два из них – более высокое, чем диоксид титана P-25 фирмы “Degussa” (Германия). Была обнаружена фотокаталитическая деструкция бактериальных клеток (Escherichia coli) на поверхности, покрытой диоксидом титана Р-25, при облучении УФ-светом (λ = 254–356 нм) в течение 75 ч [34]. L. Caballero и др. [35] на примере Escherichia coli показали бактериальную инактивацию на TiO2 (100% анатаз с размером кристаллитов 15–25 нм) при облучении люминесцентными лампами (диапазон длин волн – 290–700 нм). Сообщалось, что увеличение степени контакта частиц ФК с бактериями усиливает процесс дезинфекции, поэтому избыток TiO2 не усиливает антибактериальный эффект после достижения максимального контакта ФК с клеткой. Продемонстрирована фотокаталитическая инактивация бактериальных клеток (Escherichia coli и Lactobacillus helveticus) в присутствии TiO2 при облучении УФ-светом [36].
Помимо исследований, подтвердивших эффективную фотокаталитическую деструкцию микрофлоры с помощью материалов на основе диоксида титана, встречаются работы, в которых описан схожий эффект при применении в качестве фотокатализатора WO3, обладающего по сравнению с диоксидом титана меньшей шириной запрещенной зоны (Eg = 2.8 эВ). Так, в [37] показано увеличение токсичности WO3 в отношении бактериальных клеток при облучении УФ-светом. В работах [38–40] показано повышенное фотокаталитическое и антибактериальное действие различных материалов на основе оксида вольфрама (нанотрубки, пленки, вольфрамовая фольга с напылением наночастиц оксида вольфрама) при облучении УФ- и видимым светом.
В последнее время фотокаталитические материалы состава TiO2/WO3 привлекают внимание при создании новых фотокатализаторов, эффективных не только в УФ-, но и в видимом свете [41–44].
Ранее авторами были синтезированы композиты на основе диоксида титана и оксида вольфрама [45–49], фотокаталитическая активность (ФКА) которых при облучении видимым светом (λ > 400 нм) существенно превышала ФКА TiO2 схожего генезиса и коммерческого диоксида титана Р-25 фирмы “Degussa” по отношению к различным органическим красителям. Максимальные значения ФКА наблюдались для образцов диоксида титана, содержащего 20–30 мас. % W и термообработанных при температуре 600°С [49].
Мы предположили, что разработанные ранее материалы на основе диоксида титана, модифицированного вольфрамом, окажутся эффективными при осуществлении фотокаталитической инактивации различных микроорганизмов, что существенно расширит области их применения. Целью настоящей работы являлась проверка этого предположения на примере бактерий Pseudomonas fluorescens.
1. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1.1. Материалы
Основные используемые реагенты: тетрахлорид титана TiCl4 (99.9%, Соликамский магниевый завод, Россия), вольфрамат натрия (99%, “Нева-Реактив”, Россия), гидроксид аммония (25%, “Нева-Реактив”, Россия), диоксид титана P-25 фирмы “Degussa” (Франкфурт, Германия), дистиллированная вода (Институт химии и технологии редкоземельных элементов и минерального сырья им. И.В. Тананаева, Апатиты, Россия). Грамотрицательные бактерии Pseudomonas fluorescens были получены из лабораторного фонда лаборатории экологии микроорганизмов Института проблем промышленной экологии севера (ИППЭС КНЦ РАН).
1.2. Синтез диоксида титана, модифицированного вольфрамом
ФКА-композиты синтезировали в процессе совместного щелочного гидролиза TiCl4 и водорастворимой соли вольфрама аналогично авторским методикам [45–48]. Степень модифицирования диоксида титана варьировали в интервале 5–30 мас. % в пересчете на вольфрам. Термообработку проводили в течение 60 мин в температурном диапазоне 400–800°С при скорости нагрева/охлаждения 15°С/мин (муфельная печь, МИУС, Россия). В результате формировались композиты из двух оксидов системы TiO2–WО3 эвтектического типа [50]. Выбранные диапазоны степени модифицирования и температуры обработки обусловлены задачей получения композитов разных составов, в том числе высокомодифицированных.
1.3. Методы исследования образцов
Полученные композиты на основе диоксида титана и оксида вольфрама охарактеризованы методами химического анализа, рентгенофазового анализа (РФА) на приборе ДРОН-2 (Россия, излучение CuKα), низкотемпературной адсорбции азота (БЭТ) с помощью анализаторов FlowSorb II 2300 и TriStar 3020 V1.03 (Micromeritics, США). Термический анализ синтезированных порошков проводили на приборе NETZSCH STA 409 PC/PG (“Selb”, Германия) в атмосфере аргона при скорости нагрева 10°C/мин.
1.4. Культура микроорганизмов
Подготовка бактериальной культуры. Штамм бактерии Pseudomonas fluorescens из Музея бактерий и микроскопических грибов Кольского полуострова (гербарий ИППЭС КНЦ РАН) использовали в экспериментах в качестве модельного. Для постановки опытов штамм пересевали на свежеприготовленную агаризованную питательную среду (мясопептонный агар) и инкубировали в термостате при температуре 27°С в течение трех суток. Для приготовления бактериальной суспензии делали смыв культуры стерильным физиологическим раствором.
1.5. Изучение фотокаталитической антибактериальной активности
При изучении ФКА диоксида титана, модифицированного вольфрамом, на примере деструкции различных органических красителей было определено, что максимальной ФКА ко всем органическим агентам обладают материалы, прокаленные при 600°С [49]. Поэтому основные эксперименты по изучению фотокаталитического ингибирования бактериального роста проводили в присутствии образцов, обработанных при температуре 600°С.
Предварительная проверка фотокаталитических материалов на микробную обсемененность показала, что они не содержат жизнеспособных культивируемых клеток микроорганизмов.
Эффективность фотокаталитических материалов оценивали по степени ингибирования роста клеток Pseudomonas fluorescens при облучении бактериальной суспензии, содержащей ФК, видимым светом (λ > 400 нм). Эксперименты вели при комнатной температуре. Навеску ФК (от 2 до 25 мг/мл) помещали в стеклянную пробирку, содержащую 19 мл физраствора, затем вносили 1 мл бактериальной суспензии. Пробирку плотно закрывали крышкой, закрепляли на перемешивающем устройстве – шейкере орбитальном LOIP LS-110 (ЛАБ-ПУ-01) (АО “LOIP”, Россия) и выдерживали на свету или в темноте в течение определенного времени (от 5 мин до 48 ч). Частота вращения составляла 200 об/мин. Контрольные эксперименты проводили со светом, но в отсутствие ФК. рH суспензий была 6.8–7. В качестве источника искусственного освещения использовали лампы накаливания (100 Вт), светодиодные лампы (18 Вт), источником естественного освещения выступал солнечный свет, проходящий через окно из стекла. Освещенность (параметр, измеряемый в видимой области спектра 380–760 нм) в ходе экспериментов контролировали с применением люксметра ТКА-ПКМ 06 (АО “ЭКСИС”, Россия), величину освещенности (Е) варьировали от 0 до 14500 лк. В ряде случаев перед изучением фотокаталитического ингибирования роста бактериальных клеток фотокатализатор, помещенный в физраствор, гомогенизировали в течение 3 мин ультразвуком c использованием ультразвукового аппарата серии “Алена” УЗТА-0.1/28-0 (“U-SONIC”, Россия) при мощности 30 Вт.
Изменение численности бактерий после контакта с ФК и облучения светом фиксировали с помощью посева бактериальной суспензии на плотную питательную среду – мясопептонный агар в чашках Петри. Посев проводили через определенные промежутки времени. Колонии бактерий подсчитывали после инкубации при 27°С в течение 72 ч по методике, описанной в работе [51]:
где N – КОЕ в 1 мл исходного инокулята; P – разведение, из которого сделан высев, P = 10n, где 10 – коэффициент разведения, n – порядковый номер разведения; М – среднее количество КОЕ, выросших на чашке Петри в разведении P; V – объем инокулята, взятого для посева в чашку Петри из разведения P.Образцами сравнения служили TiO2 аналогичного с модифицированным вольфрамом TiO2 генезиса и промышленный диоксид титана P-25 фирмы “Degussa”, предложенный ранее в качестве стандарта сравнения [52].
Маркировка образцов модифицированного TiO2, например, 600-W-20, содержит данные о температуре термообработки (600°С), модифицирующем металле (W) и его содержании в композите (20 мас. %).
Относительную активность ФК оценивали по формуле [53]:
где R – относительная активность ФК, %; с – исходная численность бактериальных клеток, КОЕ/мл; а – численность бактериальных клеток после контакта с ФК при облучении видимым светом, КОЕ/мл.Антибактериальную активность (АА) ФК рассчитывали по формуле [35]:
где АА – антибактериальная активность; с – исходная численность бактериальных клеток, КОЕ/мл; а – численность бактериальных клеток после контакта с ФК, КОЕ/мл.2. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
2.1. Физико-химические свойства композитов на основе TiO2 и WО3
В табл. 1 суммированы экспериментальные данные о содержании основных компонентов и примесных ионов (С, мас. %), изменении фазового состава (рис. 1), удельной поверхности (S, м2/г) и средней крупности частиц (d, нм) в зависимости от условий термообработки (Т, °C) в синтезированных образцах диоксида титана, модифицированного вольфрамом, полученные ранее [46, 47, 49].
Таблица 1.
Фазовый состав и физико-химические свойства TiO2 и W-модифицированных образцов диоксида титана [41, 42, 44]
| Образец | Т, °C | С, мас. % | Фазовый состав по данным РФА |
S, м2/г | d, нм | |||
|---|---|---|---|---|---|---|---|---|
| TiO2 | Cl– | ${\text{NH}}_{4}^{ + }$ | W6+ | по данным ВЕТ | ||||
| 80-W-0 | 80 | 79.8 | 1.06 | 2.84 | – | ам | 270 | 9 |
| 300-W-0 | 300 | – | – | – | – | ам | 259 | 9 |
| 400-W-0 | 400 | 98.5 | 0.06 | 0.42 | – | а | 155 | 10 |
| 500-W-0 | 500 | – | – | – | – | а | 52 | 29 |
| 600-W-0 | 600 | 99.8 | н/о | 0.02 | – | а | 34 | 45 |
| 800-W-0 | 800 | – | – | – | – | а, р | 3 | 484 |
| 80-W-5 | 80 | 75.0 | – | 3.59 | 3.97 | ам | 308 | 5 |
| 300-W-5 | 300 | – | – | 0.52 | – | ам | 206 | 8 |
| 400-W-5 | 400 | 93.7 | н/о | 0.20 | 4.95 | а, ам | 118 | 16 |
| 500-W-5 | 500 | – | – | 0.03 | – | а | 69 | 23 |
| 600-W-5 | 600 | 93.7 | – | н/о | 4.98 | а | 63 | 24 |
| 800-W-5 | 800 | 93.7 | – | – | 4.98 | а, WO3 | 18 | 69 |
| 80-W-10 | 80 | – | – | 3.98 | 8.68 | ам | 215 | 7 |
| 300-W-10 | 300 | – | – | 0.48 | – | ам | 162 | 14 |
| 400-W-10 | 400 | 88.1 | н/о | 0.18 | 9.18 | ам | 150 | 15 |
| 500-W-10 | 500 | – | – | 0.02 | – | а, ам | 70 | 22 |
| 600-W-10 | 600 | 87.7 | – | н/о | 9.7 | а | 60 | 26 |
| 800-W-10 | 800 | 87.9 | – | – | 9.6 | а, WO3 | 25 | 44 |
| 80-W-20 | 80 | – | – | 3.61 | 16.9 | ам | 298 | 8 |
| 300-W-20 | 300 | – | – | 0.42 | 17.4 | ам | 237 | 10 |
| 400-W-20 | 400 | 76.7 | н/о | 0.16 | 18,5 | а | 148 | 10 |
| 500-W-20 | 500 | – | – | 0.01 | – | а | – | – |
| 600-W-20 | 600 | – | – | н/о | 19.1 | а | 47 | 33 |
| 800-W-20 | 800 | 76.8 | – | – | 18,4 | а, WO3 | 16 | 51 |
| 80-W-30 | 80 | – | – | 3.29 | – | ам | 208 | – |
| 300-W-30 | 300 | – | – | 0.38 | – | ам | – | – |
| 400-W-30 | 400 | 65.4 | н/о | 0.16 | 27.4 | ам | 113 | 21 |
| 500-W-30 | 500 | – | – | 0.01 | – | – | – | – |
| 600-W-30 | 600 | 62.5 | – | н/о | 29.8 | а, ам | 60 | 31 |
| 800-W-30 | 800 | 62.7 | – | – | 29.6 | а, р, WO3 | 6 | 97 |
Рис. 1.
Рентгенограммы W-модифицированного TiO2 с различной степенью модифицирования, обработанного при разных температурах (предел допускаемой аппаратурной погрешности измерения скорости счета импульсов рентгеновского излучения не более ± 0.5%).
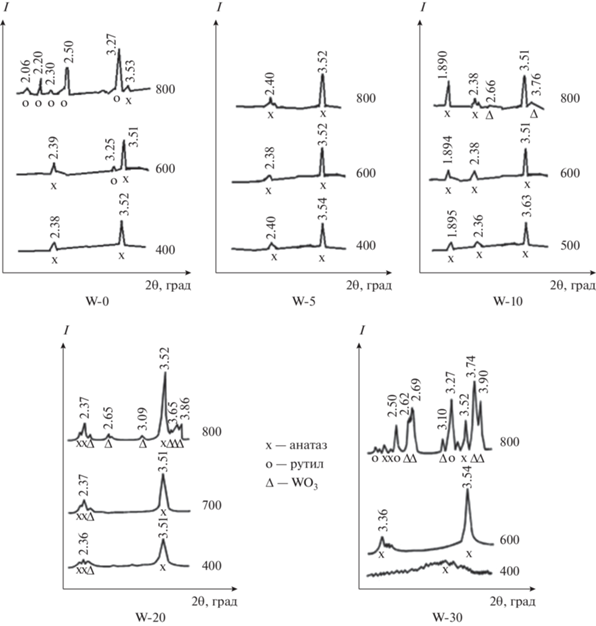
В процессе гидролиза во всех случаях формируется осадок, сохраняющий рентгеноаморфность до 400–500°С. Первый фазовый переход оксогидроксид титана–анатаз по данным РФА связан с формированием первоначально метастабильной фазы TiO2 – анатаза – во всем диапазоне степени модифицирования вольфрамом. С увеличением содержания вольфрама температура начала кристаллизации анатаза смещается от 300 до 600°С.
С повышением температуры кристаллохимическая трансформация анатаза в фазу рутила протекает постепенно в широком интервале температур и существенно зависит от степени модифицирования диоксида титана вольфрамом. Так, с ростом содержания вольфрама от 0 до 20 мас. % температура перехода анатаза в рутил повышается от 600 до 900°С. Дальнейшее увеличение содержания W приводит к снижению температуры образования рутила. Появление кристаллической фазы WO3 заметно лишь при температуре 800°С и степени модифицирования ≥ 10 мас. % (табл. 1). В [54, 55] авторы полагают, что вольфрам внедряется в структуру диоксида титана в широком диапазоне концентраций, формируя шпинели типа TiO2·WO3·nH2O. Подобные вольфраматы титана подвергаются дегидратации при температурах от 25 до 340°С и сохраняют рентгеноаморфность до 600°С, что подтверждается данными работы [49].
Трансформация TiO2 из рентгеноаморфного состояния в анатаз и частично рутил при повышении температуры сопровождается плавным сокращением удельной поверхности порошков (табл. 1) и, как следствие, возрастанием размеров частиц. Однако значения удельной поверхности всех модифицированных образцов остаются довольно высокими во всем интервале температур обработки (от 400 до 800°С), что должно благоприятно сказываться на их ФКА.
2.2. Оценка антибактериальной активности ФК при инактивации бактериальных клеток
В табл. 2 и на рис. 2 показано, как изменяется численность бактериальных клеток при облучении видимым светом искусственного происхождения (Е = 4300 лк) в присутствии различных ФК. Концентрация ФК для всех образцов составила 2 мг/мл.
Таблица 2.
Изменение численности бактериальных клеток в зависимости от времени облучения в присутствии ФК в концентрации 2 мг/мл
| Образец | Численность бактериальных клеток, ×106 кл мл–1 | |||
|---|---|---|---|---|
| исходная | через 3 ч | через 6 ч | через 24 ч | |
| Контроль | 1.0 ± 0.09 | 10 ± 1.2 | 60 ± 12 | 171 ± 21 |
| Р-25 | 3.0 ± 0.7 | 8.0 ± 1.5 | 40 ± 5 | 110 ± 8 |
| ТiO2 | 1.4 ± 0.08 | 1.1 ± 0.2 | 2.0 ± 0.3 | 1.2 ± 0.07 |
| 600-W-20 | 2.0 ± 0.2 | 1.5 ± 0.09 | 0.65 ± 0.05 | 0 |
Рис. 2.
Изображения колоний Pseudomonas fluorescens (Ps. fl.) на чашке Петри с агаром спустя 3 (а) и 6 (б) ч облучения видимым светом искусственного происхождения (Е = 4300 лк) в присутствии ФК: А – Ps. fl.; Б – Ps. fl. + Р-25; В – Ps. fl. + TiO2; Г – Ps. fl. + 600-W-20.
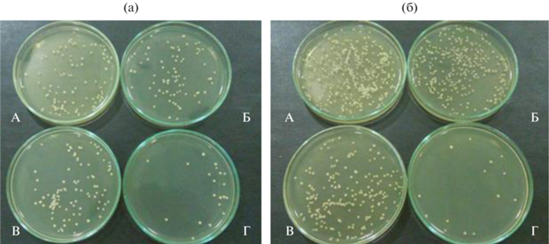
Видно, что применение коммерческого ФК (Р-25) фирмы “Degussa” не приводит к снижению численности бактериальных клеток, напротив, наблюдается активный рост клеток во времени. Использование немодифицированного TiO2 схожего генезиса с диоксидом титана, модифицированным вольфрамом, не способствует уменьшению численности бактериальных клеток.
В присутствии образца 600-W-20 в качестве ФК достигнуто существенное сокращение численности бактериальных клеток, заметное уже через 6 ч облучения (рис. 2). Через 24 ч облучения бактериальной суспензии с образцом 600-W-20 колониеобразующих бактериальных клеток не обнаружено.
При увеличении исходной концентрации бактериальных клеток на порядок концентрации ФК, равной 2 мг/мл, недостаточно для фотокаталитической инактивации бактерий при облучении светом искусственного происхождения (Е = = 4300 лк) в течение 24 ч. В этом случае повышение концентрации ФК в суспензии до 10 мг/мл приводит к практически полной инактивации бактериальных клеток (табл. 3).
Таблица 3.
Изменение численности бактериальных клеток в зависимости от времени облучения в присутствии ФК в концентрации 10 мг/мл
| Образец | Численность бактериальных клеток, ×107 кл мл–1 | |
|---|---|---|
| Исходная | Через 24 ч | |
| Контроль | 6.7 ± 1.1 | 367 ± 34 |
| Р-25 | 2.2 ± 0.4 | 136 ± 16 |
| ТiO2 | 1.5 ± 0.2 | 130 ± 9 |
| 600-W-20 | 1.4 ± 0.1 | 0.001 ± 0.0001 |
В табл. 4 представленны данные о том, как изменяется численность бактериальных клеток в зависимости от степени модифицирования диоксида титана вольфрамом и концентрации ФК в суспензии. Время выдержки при облучении видимым светом искусственного происхождения (Е = 4300 лк) составило 3 ч.
Таблица 4.
Изменение численности бактериальных клеток в зависимости от степени модифицирования вольфрамом и концентрации ФК
| Образец | Концентрация ФК, мг/мл | ||||||
|---|---|---|---|---|---|---|---|
| 12.5 | 17.5 | 25 | |||||
| численность бактериальных клеток, ×106 кл/мл | |||||||
| исходная | конечная | исходная | конечная | исходная | конечная | ||
| TiO2 | – | – | – | – | 20 ± 3 | 200 ± 7 | |
| 600-W-5 | – | – | – | – | 13 ± 0.7 | 302 ± 13 | |
| 600-W-10 | – | – | 100 ± 8 | 80 ± 2 | – | – | |
| 600-W-20 | 61 ± 6 | 21 ± 0.9 | 50 ± 3 | 0.03 ± 0.002 | 30 ± 5 | 0 | |
| 600-W-30 | 51 ± 1 | 1.7 ± 0.06 | 90 ± 11 | 0.006 ± 0.0001 | 20 ± 3 | 0 | |
Из табл. 4 видно, что увеличение концентрации ФК способствует уменьшению численности бактерий. Степень модифицирования диоксида титана вольфрамом также существенно влияет на конечную численность бактерий. Наибольшая степень фотокаталитической деструкции бактериальных клеток наблюдается при использовании образцов 600-W-20 и 600-W-30. В случае образца 600-W-10 наблюдается незначительное снижение численности бактерий.
Предварительная ультразвуковая гомогенизация ФК в физрастворе, как видно из табл. 5, способствует существенному росту эффективности ФК и сокращению времени (до 2 ч) фотокаталитической инактивации бактериальных клеток при облучении видимым светом искусственного происхождения (Е = 4300 лк).
Таблица 5.
Изменение численности бактериальных клеток в зависимости от степени модифицирования вольфрамом и концентрации ФК после ультразвуковой гомогенизации
| Образец | Концентрация ФК, мг/мл | |||||
|---|---|---|---|---|---|---|
| 5 | 10 | 25 | ||||
| численность бактериальных клеток, 106, кл/мл | ||||||
| исходная | конечная | исходная | конечная | исходная | конечная | |
| 600-W-20 | 2.00 ± 0.3 | 1.45 ± 0.2 | 2.00 ± 0.3 | 0.01 ± 0.0002 | 6.25 ± 0.5 | 0.0028 ± 0.0003 |
| 600-W-30 | 1.85 ± 0.3 | 1.20 ± 0.2 | – | – | 6.50 ± 1.1 | 0.00003 ± 0.000001 |
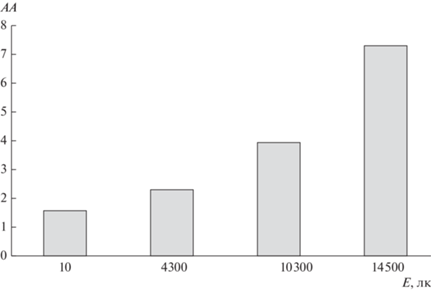
Так, после ультразвуковой гомогенизации ФК уменьшение численности бактериальных клеток отмечается уже при концентрации ФК в суспензии 5 мг/мл. При дальнейшем увеличении концентрации ФК от 5 до 25 мг/мл этот показатель стремится к нулю. В качестве примера рассчитана антибактериальная активность образца 600-W-20 (рис. 3), растущая с повышением содержания ФК в суспензии.
Рис. 3.
Антибактериальная активность (АА) образца 600-W-20 при различных концентрациях его в бактериальных суспензиях, подвергнутых облучению (Е = 4300 лк). Пределы допускаемой основной относительной погрешности при измерении освещенности в видимой области спектра составляют ± 8%.
Исследована кинетика фотокаталитической инактивации бактериальных клеток с использованием образца 600-W-20, гомогенизированного ультразвуком, при облучении светом естественного происхождения (Е = 14500 лк). Результаты представлены на рис. 4 и 5. Видно, что в первые 45 мин облучения численность бактериальных клеток существенно снижается. Спустя 120 мин колониеобразующих бактериальных клеток при концентрации ФК 10 мг/мл не обнаруживается. При концентрации ФК 7.5 мг/мл наблюдается значительное сокращение численности бактериальных клеток в течение первых 45 мин облучения, через 120 мин этот показатель практически не меняется.
Рис. 4.
Изменение численности бактериальных клеток в присутствии ФК 600-W-20 в единицу времени (t). Исходная численность бактерий составляет 2.0 × 106 кл/мл.
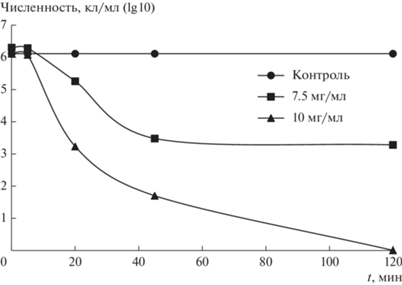
Рис. 5.
Изображения колоний Pseudomonas fluorescens на чашке с агаром после облучения видимым светом (Е = 14500 лк) в присутствии ФК 600-W-20 (10 мг/мл). Исходная численность бактерий составляет 2.0 × 106 кл/мл.

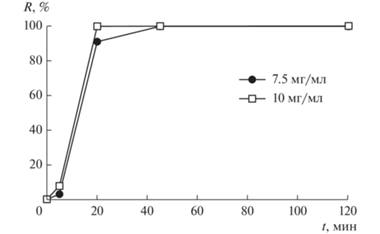
Изменение относительной активности ФК на примере образца 600-W-20 в зависимости от его концентрации в суспензии и времени облучения видимым светом естественного происхождения (Е = 14500 лк) показано на рис. 6. Видно, что относительная активность ФК в инактивации бактериальных клеток достигает высоких значений (90–99%) при облучении видимым светом естественного происхождения (Е = 14500 лк) в течение первых 20–45 мин.
Рис. 6.
Относительная активность (R) ФК 600-W-20 в зависимости от времени облучения и его концентрации в суспензии.
Таким образом, увеличение степени освещенности (Е) на порядок приводит к существенному ускорению деструкции бактериальных клеток в присутствии ФК.
В табл. 6 приведены данные об эффективности ФК (на примере 600-W-20) при различной исходной численности бактериальных клеток (кл/мл) при облучении светом естественного происхождения (Е = 10500 лк).
Таблица 6.
Эффективность ФК при различной исходной численности бактериальных клеток
| Численность бактериальных клеток, кл/мл | ||
|---|---|---|
| исходная | контроль, через 4 ч | 600-W-20, через 4 ч |
| 5.4 × 108 | 7.6 × 108 ± 2 × 105 | 9.8 × 106 ± 4.5 × 104 |
| 4.1 × 105 | 6.9 × 105 ± 1.6 × 103 | 60 ± 2 |
| 3.2 × 104 | 6.1 × 104 ± 7.2 × 102 | 30 ± 0.8 |
| 2.7 × 103 | 5.8 × 103 ± 82 | 0 |
| 5.1 × 102 | 6.4 × 102 ± 23 | 0 |
Изменение исходной численности бактериальных клеток в суспензии в пределах нескольких порядков (от 102 до 108 кл/мл) требует корректировки концентрации ФК в определенных диапазонах. Так, при фиксированной концентрации ФК равной10 мг/мл при облучении светом естественного происхождения (Е = 10500 лк) в течение 4 ч численность бактериальных клеток снижается на два-три порядка от исходной (табл. 6). Причем при исходной численности 5.1 × 102–2.7 × × 103 кл/мл через 4 ч облучения в присутствии ФК колониеобразующих бактерий не обнаруживается. В остальных случаях численность бактериальных клеток сокращается, хотя для достижения полной деструкции необходимо увеличивать время облучения, концентрацию ФК или степень освещенности. Комбинированное повышение значений этих параметров позволило найти следующие закономерности: возрастание концентрации ФК и/или степени освещенности способствует уменьшению времени деструкции бактерий; бóльшие значения времени облучения и/или степени освещенности позволяют снизить концентрацию ФК; увеличение времени облучения и/или концентрации ФК не требует повышения степени освещенности. Это позволяет варьировать условия процессов деструкции бактериальной флоры в зависимости от решаемых задач в конкретных условиях окружающей среды.
В ходе экспериментов было выявлено, что гомогенизированный ультразвуком образец 600-W-20 без облучения светом естественного происхождения также проявляет антибактериальную активность в отношении Pseudomonas fluorescens. Так, в первые 45 мин происходит постепенное снижение численности бактериальных клеток в опытах как с облучением светом, так и без него. Численность бактерий в обоих случаях существенно не меняется со временем вплоть до 90 мин, однако через 100–120 мин количество бактериальных клеток в опыте при облучении светом резко уменьшается до 150 кл/мл. Напротив, в опыте без освещения численность бактерий возрастает, достигая 4.8 × 104 кл/мл (рис. 7 и 8).
Рис. 7.
Изображения колоний Pseudomonas fluorescens на чашке с агаром после облучения (Е = 10300 лк) и без облучения (Е = 0 лк), в присутствии ФК 600-W-20 (7.5 мг/мл). Исходная численность бактериальных клеток – 1.3 × 106 кл/мл.
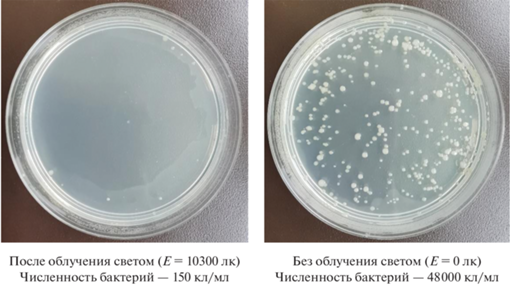
Рис. 8.
Антибактериальная активность (АА) образца 600-W-20 (7.5 мг/мл) в деструкции бактериальных клеток при облучении и без облучения светом. Исходная численность бактериальных клеток 1.3 × 106 кл/мл. Пределы допускаемой основной относительной погрешности при измерении освещенности в видимой области спектра составляют ±8%.
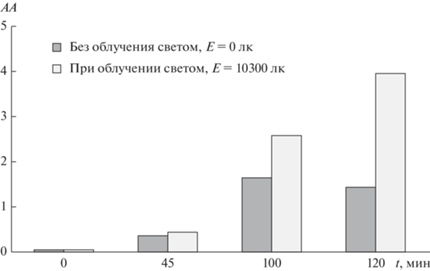
При облучении светом естественного происхождения (Е = 10300 лк) отмечается повышение антибактериальной активности ФК с увеличением времени облучения (рис. 8). Антибактериальная активность ФК, хоть и в меньшей степени, проявляется и без облучения светом, сначала возрастая, а затем снижаясь во времени (рис. 8). Подобные наблюдения были описаны в работах [37, 56] по изучению фотокаталитической деструкции бактериальных клеток с помощью ФК. Приводились различные объяснения наличия антибактериальной активности ФК в отсутствие облучения светом. Авторы настоящей работы считают, что в первые десятки минут это может быть связано с так называемым фактором предварительной активации ФК светом на воздухе при хранении в стеклянных сосудах, а также проникновением инфракрасного излучения, например, от встряхивающего устройства, при работе которого образуется теплота. Так, в работе [46] авторами показана высокая ФКА W-модифицированного диоксида титана в процессах разложения красителей при облучении светом с длиной волны >900 нм.
На примере образца 600-W-20 изучено изменение антибактериальной активности ФК в зависимости от степени освещенности (рис. 9). Показано, что увеличение степени освещенности существенно повышает антибактериальную активность ФК и позволяет уменьшить время облучения, необходимое для полной деструкции бактериальной флоры.
3. ЗАКЛЮЧЕНИЕ
Показано, что исследованные ФК эффективны при инактивации микробиоты (на примере грамотрицательных бактерий Pseudomonas fluorescens) при облучении видимым светом.
Антибактериальная активность исследованных ФК на основе диоксида титана зависит от степени модифицирования их вольфрамом. Максимальная степень фотокаталитической инактивации бактерий наблюдается при использовании образцов, содержащих 20 и 30 мас. % вольфрама.
Увеличение продолжительности фотокаталитической обработки и степени освещенности способствуют улучшению антибактериальной активности ФК.
Повышение концентрации ФК до 25 мг/мл ведет к уменьшению конечной концентрации бактериальных клеток.
Предварительная ультразвуковая гомогенизация ФК способствует существенному возрастанию его эффективности за счет увеличения степени контакта частиц ФК с бактериальной клеткой.
Показано, что при повышении исходной численности бактериальных клеток в суспензии на несколько порядков (от 102 до 108 кл/мл) для проведения эффективной инактивации бактерий требуется бóльшая концентрация ФК.
Список литературы
Legrini O., Oliveros E., Braun A.M. // Chem. Rev. 1993. V. 93. P. 671. https://doi.org/10.1021/cr00018a003
Mills A., Hunte L.S. // J. Photochem. Photobiol. A: Chem. 1997. V. 108. P. 1. https://doi.org/10.1016/S1010-6030(97)00118-4
Jacoby W.A., Maness P.C., Wolfrum E.J., Blake D.M., Fennell J.A. // Environ. Sci. Technol. 1998. V. 32. P. 2650. https://doi.org/10.1021/es980036f
Lin C.Y., Li C.S. // Aerosol Sci. Technol. 2003. V. 37. P. 939. https://doi.org/10.1080/02786820300900
Burton P., Peterson E., Boyle T., Datye A. // Catal. Lett. 2010. V. 139. № 1–2. P. 26. https://doi.org/10.1007/s10562-010-0405-1
Vaiano V., Iervolino G. // Appl. Sci. 2019. V. 9. № 13. P. 2741. https://doi.org/10.3390/app9132741
Ума Р., Равичандран К. // Кинетика и катализ. 2018. Т. 59. № 1. С. 69. http://doi.org/. (Uma R., Ravichandran K. // Kinetics and Catalysis. 2017. V. 58. № 6. P. 701. https://doi.org/10.1134/S0023158418010135)
Bignozzi C.A., Caramori S., Cristino V., Argazzi R., Meda L., Tacca A. // Chem. Soc. Rev. 2013. V. 42. № 6. P. 2228. https://doi.org/10.1039/c2cs35373c
Tian L., Ye L., Liu J., Zan L. // Catal. Commun. 2012. V. 17. P. 99. https://doi.org/10.1016/j.catcom.2011.10.023
Franking R., Li L., Lukowski M.A., Meng F., Tan Y., Hamers R., Jin S. // Energy Environ. Sci. 2013. V. 6. № 2. P. 500. https://doi.org/10.1039/C2EE23837C
Bang J.U., Lee S.J., Jang J.S., Choi W., Song H. // J. Phys. Chem. Lett. 2012. V. 3. № 24. P. 3781. https://doi.org/10.1021/jz301732n
Wang J., Yin S., Zhang Q., Saito F., Sato T. // Chem. Lett. 2003. V. 32. № 6. P. 540. https://doi.org/10.1246/cl.2003.540
Fujishima A., Honda K. // Nature. 1972. V. 238. P. 37. https://doi.org/10.1038/238037a0
Renz C. // Helvetica Chim. Acta. 1921. V. 4. P. 961. https://doi.org/10.1002/hlca.192100401101
Keidel E. // Farben-Zeitung. 1929. V. 34. P. 1242.
Bhatkhande D.S., Pangarkar V.G., Beenackers A.C.M. // J. Chem. Technol. Biotechnol. 2002. V. 77. № 1. P. 102. https://doi.org/10.1002/jctb.532
Yu J.C., Ho W., Yu J., Yip H., Wong P.K., Zhao J. // Environ. Sci. Technol. 2005. V. 39. № 4. P. 1175. https://doi.org/10.1021/es035374h
Wang W., Huang G., Yu J.C., Wong P.K. // J. Environ. Sci. 2015. V. 34. P. 232. https://doi.org/10.1016/j.jes.2015.05.003
Karvinen S.M. // Ind. Eng. Chem. Res. 2003. V. 42. № 5. P. 1035. https://doi.org/10.1021/ie020358z
Nowotny M.K., Sheppard L.R., Bak T., Nowotny J. // J. Phys. Chem. C. 2008. V. 112. P. 5275. https://doi.org/10.1021/jp077275m
Teh C.M., Mohamed A.R. // J. Alloys and Compounds. 2011. V. 509. P. 1648. https://doi.org/10.1016/j.jallcom.2010.10.181
Yalcin Y., Kilic M., Cina Z. // Appl. Catal. B: Env. 2010. V. 99. P. 469. https://doi.org/10.1016/j.apcatb.2010.05.013
Carp O., Huisman C.L., Reller A. // Prog. Solid State Chem. 2004. V. 32. P. 33. https://doi.org/10.1016/j.progsolidstchem.2004.08.001
Bally A.R., Korobeinikova E.N., Schmid P.E., L vy F., Bussy F. // J. Phys. D: Appl. Phys. 1998. V. 31. P. 1149. https://doi.org/10.1088/0022-3727/31/10/004
Furubayashi Y., Hitosugi T., Yamamoto Y., Inaba K., Kinoda G., Hirose Y., Shimada T., Hasegawa T. // Appl. Phys. Lett. 2005. V. 86. № 22. P. 252101. https://doi.org/10.1063/1.1949728
Fan C., Xue P., Sun Y. // J. Rare Earths. 2006. V. 24. P. 309. https://doi.org/10.1016/S1002-0721(06)60115-4
El-Bahy Z.M., Ismail A.A., Mohamed R.M. // J. Hazar. Mater. 2009. V. 166. P. 138. https://doi.org/10.1016/j.jhazmat.2008.11.022
Stengl V., Bakardjieva S., Murafa N. // Mater. Chem. Phys. 2009. V. 114. P. 217. https://doi.org/10.1016/j.matchemphys.2008.09.025
Shi J.W., Zheng J.T., Wu P. // J. Hazar. Mater. 2009. V. 161. P. 416. https://doi.org/10.1016/j.jhazmat.2008.03.114
Куренкова А.Ю., Козлова Е.А., Каичев В.В. // Кинетика и катализ. 2020. Т. 61. № 6. С. 812. https://doi.org/10.31857/S0453881120060052
Lakhera S.K., Neppolian B. // Int. J. Hydrogen Energy. 2020. V. 45. № 13. P. 7627. https://doi.org/10.1016/j.ijhydene.2019.10.142
Марковская Д.В., Люлюкин М.Н., Журенок А.В., Козлова Е.А. // Кинетика и катализ. 2021. Т. 62. № 4. С. 437. http://doi.org/. (Markovskaya D.V., Lyulyukin M.N., Zhurenok A.V., Kozlova E.A. // Kinetics and Catalysis. 2021. V. 62. № 4. P. 488. https://doi.org/10.1134/S002315842104008X10.1134/S002315842104008X.)https://doi.org/10.31857/S0453881121040109
Sirimahachai U., Phongpaichit S., Wongnawa S. // Songklanakarin J. Sci. Technol. 2009. V. 31. № 5. P. 517.
Jacoby W.A., Maness P.C., Wolfrum E.J., Blake D.M., Fennell J.A. // Environ. Sci. Technol. 1998. V. 32. № 17. P. 2650. https://doi.org/10.1021/es980036f
Caballero L., Whitehead K.A., Allen N.S., Verran J. // J. Photochem. Photobiol. A: Chem. 2009. V. 202. P. 92. https://doi.org/10.1016/j.jphotochem.2008.11.005
Liu H.-L., Yang. T.C.-K. // Proc. Biochem. 2003. V. 39. P. 475. https://doi.org/10.1016/S0032-9592(03)00084-0
Popov A.L., Zholobak N.M., Balko O.I., Balko O.B., Shcherbakov A.B., Popova N.R., Ivanova O.S., Baranchikov A.E., Ivanov V.K. // J. Photochem. Photobiol. B: Biol. 2018. V. 178. P. 395. https://doi.org/10.1016/j.jphotobiol.2017.11.021
Sayama K., Hayashi H., Konishi Y., Gunji T., Sugihara H. // Chem. Lett. 2010. V. 39. № 8. P. 884. https://doi.org/10.1246/cl.2010.884
Ghasempour F., Azimirad R., Amini A., Akhavan O. // Appl. Surf. Sci. 2015. V. 338. P. 55. https://doi.org/10.1016/j.apsusc.2015.01.217
Scott-Emuakpor E., Paton G.I., Todd M.J., Macphee D.E. // Environ. Eng. Manag. J. 2016. V. 15. № 5. P. 899. https://doi.org/10.30638/eemj.2016.097
Lin C.F., Wu C.H., Onn Z.N. // J. Hazar. Mater. 2008. V. 154. № 1–3. P. 1033. https://doi.org/10.1016/j.jhazmat.2007.11.010
Chai S.Y., Kim Y.J., Lee W.I. // J. Electroceram. 2006. V. 17. № 2. P. 909. https://doi.org/10.1007/s10832-006-9073-3
Song K.Y., Park M.K., Kwon Y.T., Lee H.W., Chung W.J., Lee W.I. // Chem. Mater. 2001. V. 13. № 7. P. 2349. https://doi.org/10.1021/cm000858n
Riboni F., Bettini L.G., Bahnemann D.W., Selli E. // Catal. Today. 2013. V. 209. P. 28. https://doi.org/10.1016/j.cattod.2013.01.008
Пaт. 2435733 PФ, 2011.
Седнева Т.А., Локшин Э.П., Беликов М.Л., Калинников В.Т. // Докл. Акад. наук. 2012. Т. 443. № 2. С. 195. (Sedneva T.A., Lokshin E.P., Kalinnikov V.T., Belikov M.L. // Dokl. Phys. Chem. 2012. V. 443. Part 1. P. 57. )https://doi.org/10.1134/S0012501612030037
Седнева Т.А., Локшин Э.П., Беликов М.Л. // Неорганические материалы. 2012. Т. 48. № 5. С. 562. (Sedneva T.A., Lokshin E.P., Belikov M.L. // Inorganic Materials. 2012. V. 48. № 5. P. 480. )https://doi.org/10.1134/S0020168512050160
Беликов М.Л., Седнева Т.А., Локшин Э.П. // Неорганические материалы. 2020. Т. 56. № 6. С. 762. (Belikov M.L., Sedneva T.A., Lokshin E.P. // Inorg. Mater. 2020. V. 56. № 7. P. 723. https://doi.org/10.1134/S002016852006002310.1134/S0020168520060023.)https://doi.org/10.31857/S0002337X20060020
Беликов М.Л., Седнева Т.А., Локшин Э.П. // Неорганические материалы. 2021. Т. 57. № 2. С.154. (Belikov M.L., Sedneva T.A., Lokshin E.P. // Inorg. Mater. 2021. V. 57. № 2. P. 154. )https://doi.org/10.1134/S0020168521020023
Диаграммы состояния систем тугоплавких оксидов / Под ред. Галахова Ф.Я. Справочник. Ленинград: Наука, 1988. В. 5. Ч. 4. 348 с.
Аристовская В.В., Владимирская М.Е., Голлербах М.М. Большой практикум по микробиологии: Учебное пособие. Москва: Высшая школа, 1962. 491 с.
Matthews R.W., McEvoy S.R. // Solar Energy. 1992. V. 49. P. 507. https://doi.org/10.1016/0038-092X(92)90159-8
Meng D., Liu X., Xie Y., Du Y., Yang Y., Xiao C. // Adv. Mater. Sci. Eng. 2019. V. 2019. № 1. P. 1. https://doi.org/10.1155/2019/5819805
Михосоев М.В., Базарова Ж.Г. Сложные оксиды молибдена и вольфрама с элементами I–IV групп. Москва: Наука, 1990. 224 с.
Казенас К.Е., Цветков Ю.В. Испарение оксидов. Москва: Наука, 1997. 543 с.
Verdier T., Coutand M., Bertron A., Roques C. // Coatings. 2014. V. 4. № 3. P. 670. https://doi.org/10.3390/coatings4030670
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ