Кинетика и катализ, 2022, T. 63, № 4, стр. 456-464
Синтез Al-SBA-15 и его применение в синтезе Фишера–Тропша на кобальтовых катализаторах
Shifang Mu a, *, Rujing Shang b, **, Jianli Zhang c, Wentao Ji a, Yan Wang a, Jiangang Chen d
a School of Safety science and Engineering, Henan Polytechnic University
454000 Jiaozuo, PR China
b School of Physics&Electronic Information Engineering, Henan Polytechnic University
454000 Jiaozuo, PR China
c State Key Laboratory of High-efficiency Utilization of Coal and Green Chemical Engineering, Ningxia University
750021 Yinchuan, PR China
d State Key Laboratory of Coal Conversion, Institute of Coal Chemistry of Chinese Academy Sciences
030001 Taiyuan, PR China
* E-mail: shifangmu@126.com
** E-mail: Shrujing@163.com
Поступила в редакцию 05.07.2021
После доработки 12.12.2021
Принята к публикации 06.03.2022
- EDN: JCHLDI
- DOI: 10.31857/S0453881122040086
Аннотация
Три типа Al-SBA-15 получены введением Al методами индуцированного паром внутреннего гидролиза, пропитки и темплатного синтеза и затем использованы в качестве носителей для катализаторов Фишера–Тропша с содержанием Co 15 мас. %. Свойства носителей и катализаторов изучены методами физической сорбции N2, РФА, ТПД NH3, ПЭМ и ТПВ. Введение Al способствовало повышению кислотности. Использование методов пропитки и темплатного синтеза приводило к снижению степени восстановления и более высокой степени диспергирования. Более того, в результате синтеза носителя методом особенно заметно увеличивалась селективность катализатора по C12–C18. Введение алюминия путем индуцированного паром внутреннего гидролиза приводило к закупорке мезоструктуры, более глубокому восстановлению и более низкой степени дисперсности; доступ к мезоструктуре SBA-15 затруднялся, что повышало селективность образования ${\text{C}}_{{18}}^{ + }$.
1. ВВЕДЕНИЕ
Кобальтовые катализаторы синтеза Фишера–Тропша (ФТ) широко исследовались из-за их высокой активности и селективности в отношении тяжелых углеводородов [1–3]. Активность этих катализаторов зависит в основном от плотности поверхностного слоя металлического кобальта, которая обычно коррелирует с его дисперсностью и восстанавливаемостью [4–6].
Синтез ФТ дает широкий набор углеводородов в соответствии с кинетикой полимеризации Андерсона–Шульца–Флори (AШФ) [7], которая накладывает ограничения на максимальную селективность по определенному углеводородному продукту, например, по парафинам С5–С18 (средние дистилляты) [8]. Чтобы обойти это ограничение, были разработаны кобальтовые катализаторы с регулируемой структурой, позволяющие проводить синтез ФТ с отклонением от распределения АШФ для увеличения выхода средних дистиллятов. Например, Цубаки (Tsubaki) и др. синтезировали цеолитные мембраны H-ZSM-5 на катализаторах Co/SiO2 и получили превосходную селективность по средним изопарафинам благодаря определенным условиям реакции, которые создавали цеолитные капсулы [9]. Лю (Liu) и др. обнаружили, что кобальтовые катализаторы, нанесенные на мезопористый диоксид циркония, проявляют более высокую селективность по парафинам С12–С18 в синтезе ФТ за счет упорядоченной мезопористой структуры носителей [10]. Ван (Wang) и др. обнаружили, что катализаторы Co/SiO2, приготовленные контролируемым золь–гель-методом в присутствии этилендиамина, обеспечивают высокую селективность по средним дистиллятам благодаря наличию высокой микропористости [11]. Эти результаты позволяют предположить, что свойства носителя, например кислотность поверхности и структура пор, могут быть ключевыми факторами для эффективного производства средних дистиллятов.
SBA-15 является одним из наиболее привлекательных носителей катализатора с высокой гидротермальной стабильностью и большой площадью поверхности (600–1000 м2/г). Он также имеет гексагональный массив однородных трубчатых каналов с диаметром пор от 5 до 30 нм [12]. Эти характеристики делают SBA-15 пригодным для использования как носителя для катализаторов синтеза ФТ. Работы [13–18] посвящены его изучению в этом качестве. На катализаторе Co/SBA-15 была достигнута 30–40% селективность по C10–C20 [19]. Это означает, что мезопористые каналы SBA-15 могут ингибировать образование длинноцепочечных углеводородов, то есть AШФ-распределение продуктов не реализуется. Известны некоторые исследования по влиянию добавок Al [20–22] и Ti [23] в SBA-15, однако информация о применении Al-SBA-15 в качестве носителя для кобальта весьма ограничена. В то же время катализаторы синтеза ФТ Со/Al-SBA-15, несмотря на мезоструктуру SBA-15 и кислотность соединений Al, могут повышать селективность по средним дистиллятам.
Каталитические характеристики Co/Al-SBA-15 для синтеза ФТ сильно зависят от многих факторов [24–27], например, от способа введения Al, метода получения, содержания Al, прекурсора Al, поэтому трудно прийти к окончательным выводам. Введение Al в SBA-15 может осуществляться прямым синтезом и пост-синтезом. Вообще говоря, сильнокислая среда при приготовлении SBA-15 неблагоприятна для однореакторного синтеза Al-SBA-15. По этой причине были исследованы различные методы пост-синтеза для введения оксида алюминия в SBA-15 [21, 22]. Настоящая работа направлена на изучение влияния методов пост-синтеза Al-SBA-15 на структуру и каталитическую эффективность Co/Al-SBA-15 в реакции ФТ.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Получение Al-SBA-15
Кремнийсодержащий мезопористый материал SBA-15 был приобретен в Фуданьском университете Китая. Подробную информацию о приготовлении SBA-15 можно найти в [28]. В качестве источника оксида алюминия использовали Al(NO3)3 · 9H2O (99.9%, Kemiou, Китай). Al-SBA-15 получали тремя методами: паровым внутренним гидролизом (VIH) [29], пропиткой (I) и темплатным методом (TM) [22]. Приготовленные образцы Al-SBA-15 были обозначены как Z1, Z2 и Z3 соответственно, а чистый SBA-15 – как Z0.
VIH. Необходимое количество Al-прекурсора растворяли в воде и пропитывали этим раствором SBA-15 (Университет Фудань) при перемешивании при 60°С до высыхания. Затем полученный продукт обрабатывали при 100°С в течение 6 ч в воздушной печи. В автоклав с тефлоновым покрытием вместимостью 200 мл наливали смесь 10 мл 14% раствора NH3 и 10 мл H2O. В открытую стеклянную пробирку загружали 5 г с прекурсором и помещали ее в автоклав так, чтобы SBA-15 не контактировал с раствором NH3/вода. Затем плотно закрытый автоклав выдерживали при 80°С в течение 12 ч. После обработки полученный материал сушили при комнатной температуре в течение 6 ч, а затем при 100°С в течение 12 ч. Высушенный материал окончательно прокаливали при 500°С в течение 5 ч на воздухе.
I. Необходимое количество прокаленного чистого SBA-15 добавляли к 20 мл водного раствора, содержащего растворенный Al(NO3)3⋅9H2O. Смесь перемешивали при температуре окружающей среды в течение 24 ч. Затем образец сушили на воздухе при 100°С в течение 12 ч и окончательно прокаливали при 500°С в течение 5 ч.
ТМ. 10 мл водного раствора Al(NO3)3⋅9H2O (молярная концентрация раствора зависела от необходимого количества алюминия) и соответствующее количество 10% раствора гидроксида тетраметиламмония (мольное соотношение ТМАОН/Al = 2) смешивали и нагревали при перемешивании до 70°С. После получения прозрачного раствора при перемешивании добавляли 1 г чистого SBA-15. Смесь перемешивали в течение 2 ч при той же температуре. После фильтрации, промывки и сушки при 80°С продукт прокаливали при 500°С в течение 5 ч в токе воздуха.
2.2. Приготовление катализаторов
Четыре нанесенных катализатора, содержащих 15 мас. % Со, были приготовлены путем пропитки по влагоемкости SBA-15 и трех носителей Al-SBA-15 водным раствором Co(NO3)2·6H2O (AR, Shanghai Hengxin Chemical Reagent Co). Затем пропитанные носители сушили при 80°С в течение 12 ч и прокаливали на воздухе при 400°С в течение 5 ч. Катализаторы были обозначены как S0, S1, S2 и S3 соответственно.
2.3. Методы характеризации
Площадь поверхности по БЭТ, общий объем пор (Vпор) и средний диаметр пор измеряли с помощью физической сорбции N2 с применением автоматической системы ASAP-2000 (“Micromeritics”, США) при –196°C. Удельную поверхность оценивали методом БЭТ. Средний диаметр пор и общий объем пор определяли методом BJH [8].
Рентгенофазовые исследования выполняли на рентгеновском спектрометре D8 Аdvance (“Bruker”, Германия) при 40 кВ и 100 мА с использованием монохроматического Cu-Kα-излучения. Микрофотографии ПЭМ были получены на микроскопе JEM 2010 (“JEOL”, Япония), работающем при 200 кВ. Для измерений с помощью ПЭМ твердые вещества диспергировали в этаноле и наносили на медную микросетку, покрытую перфорированной углеродной пленкой.
Эксперименты ТПВ проводили на самодельном оборудовании. Около 100 мг прокаленного катализатора продували Ar (40 мл/мин) при 300°C в течение 1 ч и затем охлаждали до 50°C. После этого включали поток газовой смеси 7 об. % H2–Ar (45 мл/мин) и нагревали образец до 900°С (скорость нагрева 5°С/мин). На том же оборудовании была выполнена другая серия экспериментов для определения степени восстановления оксидов кобальта. Около 100 мг прокаленного катализатора загружали в U-образную кварцевую ячейку и восстанавливали in situ при 400°С в течение 6 ч при скорости нагрева 1°С/мин в потоке 7 об. % H2–Ar (40 мл/мин). Количество поглощенного H2 контролировали с помощью детектора по теплопроводности (ДТП). Степень восстановления рассчитывали путем деления количества H2, израсходованного во время восстановительной обработки при 400°C, на стехиометрическое количество H2, необходимое для полного восстановления оксидов кобальта.
ТПД NH3 проводили на самодельном оборудовании. Образцы предварительно обрабатывали при 600°С в течение 0.5 ч в токе аргона для удаления адсорбированных примесей, а затем при 100°С адсорбировали NH3. Температуру повышали со скоростью 10°С/мин. Количество десорбированного NH3 контролировали с помощью ДТП.
ТПД H2 осуществляли в U-образном кварцевом реакторе на установке Zeton Altamira AMI-200 (“Altamira Instruments”, США). Масса образца составляла около 0.2 г. Катализатор восстанавливали при 400°С в течение 6 ч с использованием потока водорода высокой чистоты, а затем охлаждали до 100°С в потоке водорода. Образец находился при 100°С в течение 1 ч в токе аргона для удаления слабосвязанных физически адсорбированных частиц, а затем температуру медленно повышали до 400°С. При этой температуре катализатор выдерживали в токе аргона для десорбции оставшегося хемосорбированного водорода, и начинали регистрировать сигнал ДТП до тех пор, пока он не возвращался к базовой линии. Профиль ТПД интегрировали и определяли количество десорбированного водорода путем сравнения со средними площадями калиброванных импульсов водорода. Расчеты дисперсности были основаны на предположении стехиометрического соотношения H : Co = 1 : 1 и сферической морфологии кластера кобальта.
2.4. Каталитические тесты
Оценку активности катализаторов проводили в реакторе с неподвижным слоем под давлением с загрузкой катализатора 2 мл. Перед каталитическими экспериментами образцы предварительно восстанавливали в токе водорода при 400°С в течение 6 ч. Реакцию осуществляли при 2.0 МПа, 1000 ч–1, Н2/СО = 2.0 и 240°С. Продукты собирали с помощью последовательно расположенных горячей и холодной ловушек. Газообразный поток на выходе анализировали с использованием online хроматографии. Анализ жидкости и парафина проводили на хроматографе GC-920 с капиллярными колонками OV-101. Углеродный и массовый балансы реакции выполнялись в пределах 100 ± 5%. Все данные регистрировали через 24 ч после того, как реакция достигала стационарного состояния. Эксперимент вели непрерывно в течение 120 ч. В ходе оценки было обнаружено, что на 72-м часу реакции конверсия СО была наиболее стабильной. Поэтому для сравнения были выбраны данные, зарегистрированные на 72-м часу реакции.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1. Характеристика носителей и катализаторов
3.1.1. Текстурные свойства носителей и катализаторов. На рис. 1 представлены изотермы адсорбции–десорбции N2 для носителей и катализатор. Изотермы адсорбции–десорбции N2 для прокаленного SBA-15 имеют резкий перегиб при относительном давлении в диапазоне 0.7–0.8. Это подтверждает, что SBA-15 представляет собой материал хорошего качества с однородными мезопорами [30]. Форма изотерм адсорбции–десорбции N2 образцов носителей Z2 и Z3, S2 и S3 аналогична таковой для SBA-15. Это свидетельствует о том, что мезопористая структура SBA-15 в основном сохраняется при добавлении Al и Co. Перегиб адсорбционной ветви изотермы для S0, S2 и S3 происходит при более низком относительном давлении по сравнению с носителями, что говорит об уменьшении среднего диаметра пор после пропитки кобальтом. Однако форма изотерм адсорбции–десорбции N2 носителей Z1 отличается от таковой для SBA-15. Это означает, что мезопористая структура SBA-15 в значительной степени разрушается при введении Al методом VIH. Текстурные свойства носителей и катализаторов приведены в табл. 1. По сравнению с соответствующими носителями площадь поверхности по БЭТ и общий объем пор катализаторов значительно уменьшаются при пропитке Со, что может быть вызвано частичной закупоркой пор кластерами оксида кобальта и/или частичным коллапсом пористой структуры.
Таблица 1.
Физико-химические свойства носителей и катализаторов
| Образец | Площадь поверхности по БЭТ, м2/г | Общий объем пор, см3/г | Диаметр пор, нм | Размер кристаллитов Co3O4а, нм | Дисперсность Cob, % | Степень восстановления Coc, % (<400°C) |
|---|---|---|---|---|---|---|
| Z0 | 622.4 | 0.99 | 6.37 | – | – | – |
| Z1 | 65.0 | 0.38 | 23.6 | – | – | – |
| Z2 | 534.89 | 0.91 | 6.83 | – | – | – |
| Z3 | 505.5 | 0.89 | 7.07 | – | – | – |
| S0 | 411.35 | 0.73 | 7.06 | 15.7 | 8.2 | 66.3 |
| S1 | 55.9 | 0.32 | 22.6 | 20.3 | 6.3 | 80.5 |
| S2 | 365.2 | 0.63 | 6.85 | 14.6 | 8.8 | 59.1 |
| S3 | 382.3 | 0.67 | 7.01 | 13.9 | 9.2 | 52.5 |
3.1.2. Кислотные свойства подложек. На рис. 2 показаны профили ТПД NH3 носителей, свидетельствующие о том, что в SBA-15 отсутствуют в заметных количествах кислотные центры, которые могли бы связываться с NH3. Введение Al значительно повышает кислотность поверхности катализаторов, что согласуется с результатами Огура (Ogura) [29]. Два пика на кривых ТПД NH3 с максимумами при ~200 и ~300°С соответствуют слабым и умеренно сильным кислотным центрам Al-SBA-15. Эти результаты показывают, что введение Al в SBA-15 вызывает повышение кислотности и, следовательно, влияет на каталитические характеристики.
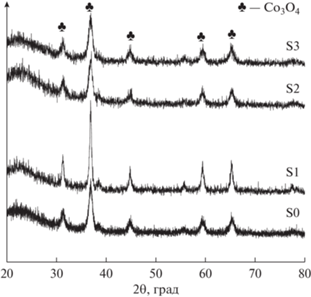
3.1.3. РФА. Рентгенограммы катализаторов представлены на рис. 3. Все образцы имеют идентичные рентгенограммы. Дифракционные пики 2θ при 31.3°, 36.9°, 45.1°, 59.4° и 65.4° указывают на то, что после прокаливания кобальт существует в виде кристаллической шпинели Co3O4. С помощью РФА не обнаружено пиков Al2O3 или каких-либо других соединений Al, что говорит о присутствии Al в высокодисперсной форме. В табл. 1 приведены оценки размеров кристаллитов Co3O4 по формуле Шеррера и дисперсность Co [31]. Средние размеры кристаллитов в предположении сферических однородных кристаллитов с плотностью центров 14.6 атомов/нм2 можно рассчитать по дисперсности кобальта (D, %), используя формулу: D = 96/d [31, 32]. Коэффициент пересчета диаметра (d, нм) для частицы Co3O4, восстанавливаемой до металлического кобальта, составляет: d(Co0) = 0.75d(Co3O4) [32]. Ранее в литературе сообщалось о разумном соответствии между дисперсностью металлического Со и размерами кристаллитов, рассчитанными по данным РФА и ТПД-H2 на кобальтовых катализаторах на основе диоксида кремния [32]. Как видно, методы введения Al сильно влияют на размер кристаллитов Co3O4 и степень дисперсности. Для S2 и S3 размер кристаллитов Co3O4 уменьшается, а степень дисперсности увеличивается, хотя их площадь поверхности по БЭТ сокращается. Однако образец S1 имеет самый большой размер кристаллитов Co3O4 из-за низкой площади поверхности по БЭТ и деградации мезопористой структуры.
3.1.4. ТЭМ. Микрофотографии ТЭМ различных катализаторов показаны на рис. 4. Наблюдается контраст из-за симметрии SBA-15, а также более темный контраст, соответствующий частицам кобальта. На изображениях видно высокоупорядоченное гексагональное расположение каналов по двум направлениям – параллельному (рис. 4а и 4в) и перпендикулярному (рис. 4б). Структура типа SBA-15 отчетливо различима после пропитки кобальтом и прокалки, за исключением S1. Это согласуется с результатами физической сорбции N2. Определить размер частиц кобальта по микрограммам ТЭМ достаточно трудно из-за недостаточно четкого контраста между металлом и подложкой [33–35].
3.1.5. ТПВ-Н2. Профили ТПВ катализаторов приведены на рис. 5. На кривых видны три основных участка восстановления. Согласно литературным данным [15] первый пик восстановления при 220–320°С можно отнести к первой стадии восстановления: Co3O4 → CoO. Вторая область восстановления при 320–550°С связана с восстановлением промежуточной фазы СоО (СоО → Со). Пик высокотемпературного восстановления обусловлен восстановлением соединения (Co2SiO4), хотя фаза Co2SiO4 методом РФА в настоящем исследовании не наблюдалась. Способы введения Al заметно влияют на процессы восстановления катализаторов. Во-первых, как в S2, так и в S3 имеет место восстановление соединения Co2SiO4, особенно заметное в S3. Кроме того, положение пиков восстановления (CoO → Co) смещается в сторону более высокой температуры по сравнению с катализатором S0. Во-вторых, для катализатора S1 пики восстановления (СоО → Со) становятся более резкими и смещаются в область более низких температур. И то, и другое свидетельствует о том, что катализатор при введении Al методом пропитки и темплатного синтеза восстанавливается труднее, а образец, приготовленный методом VIH – легче. Считается, что первая стадия восстановления Co3O4 до CoO проходит быстро (с резким низкотемпературным пиком), в то время как стадия восстановления CoO происходит медленно, что приводит к широкому профилю, и что уширение зависит от взаимодействия CoO с подложкой, а профиль ТПВ определяется размером кластера. Также есть мнение, что более мелкие кластеры СоО сильнее взаимодействуют с подложкой, чем крупные [36]. В настоящем исследовании размер частиц Co3O4 катализатора S1 оказался самым большим, что привело к исчезновению соединения Co2SiO4 и сужению температурного интервала второй стадии восстановления (CoO → Co).
3.2. Синтез Фишера–Тропша
Данные по активности катализаторов в синтезе ФТ и селективности продуктов для катализаторов приведены в табл. 2. Видно, что S0 имеет самую высокую конверсию СО (58.7%), а введение Al приводит к снижению конверсии СО, что согласуется с результатами Гонзалес (Gonzalez) [37], Хао (Hao) [27] и др. В присутствии катализатора S1 конверси СО составляет 39.4%, тогда как для образца S3 этот показатель самый низкий – 28.3%. Полученные данные могут быть объяснены затрудненным доступом к мезопористой структуре S1 или уменьшением степени восстановления Со в катализаторах S2 и S3, легированных алюминием.
Таблица 2.
Результаты испытания катализаторов
| Катализатор | Конверсия CO, % | Производитель-ность по ${\text{C}}_{5}^{ + }$a , г мл–1 ч–1 | Распределение углеводородов, вес. % | |||||
|---|---|---|---|---|---|---|---|---|
| C1 | C2–4 | ${\text{C}}_{5}^{ + }$ | C5–11 | C12–18 | ${\text{C}}_{{18}}^{ + }$ | |||
| S0 | 58.7 | 0.09 | 13.6 | 4.05 | 82.4 | 30.6 | 33.5 | 18.5 |
| S1 | 39.4 | 0.05 | 16.9 | 4.5 | 78.6 | 22.3 | 27.6 | 28.7 |
| S2 | 31.9 | 0.03 | 26.2 | 10.7 | 63.2 | 15.5 | 34.5 | 13.2 |
| S3 | 28.3 | 0.02 | 28.7 | 12.3 | 59.0 | 17.5 | 36.5 | 5.03 |
Каталитическая активность в синтезе ФТ в основном зависит от двух факторов: дисперсности Со и степени восстановления [39]. Химические и текстурные свойства носителей влияют на каталитическую активность и селективность продуктов синтеза ФТ на Со-катализаторах, так как носители имеют различную способность к восстановлению и диспергированию кобальта или образованию мелкодисперсных фаз [40]. Взаимодействие между Co и носителями усиливается при введении Al методом пропитки и темплатного синтеза, что приводит к пониженной степени восстановления и повышенной степени дисперсности. Введение алюминия путем индуцированного паром внутреннего гидролиза способствует более глубокому восстановлению и более низкой степени дисперсности, но площадь поверхности кобальта значительно сокращается (табл. 1). Это может быть причиной снижения каталитической активности полученных катализаторов в синтезе ФТ.
Анализируя данные по селективности образования углеводородов, можно заметить, что селективность по CH4 увеличивается при введении Al, особенно в случае метода пропитки и темплатного синтеза. Co/SBA-15 имеет самую низкую селективность по CH4 (13.6%) и самую высокую – по углеводородам C5–C11 (30.6%), что хорошо согласуется с результатами Ходакова (Khodakov) и др. [38]. Все катализаторы с добавкой Al показывают снижение селективности по ${\text{C}}_{5}^{ + }$ при одновременном отчетливо выраженном увеличении селективности по легким углеводородам (С1 и С2–С4) за счет подавления вторичной реакции олефинов с образованием тяжелых углеводородов. В этой серии катализаторов S3 демонстрирует наибольшую селективность по C12–C18 (36.5%) и наименьшую – по ${\text{C}}_{{18}}^{ + }$ (5.03%). В то же время наблюдается повышенная селективность по углеводородам с более длинной цепью $({{{\text{S}}}_{{{\text{C}}_{{18}}^{ + }}}})$ для катализатора S1 по сравнению с катализатором S0, даже несмотря на то, что степень конверсии для S0 выше, что, как известно, положительно влияет на селективность по тяжелым углеводородам.
Контроль избирательности — одна из самых важных и сложных задач в синтезе ФТ. В рамках механизма полимеризации распределение продуктов синтеза ФТ обычно следует статистическому распределению углеводородов, известному как AШФ. Оно не является избирательным для целевого диапазона углеводородов. Например, максимальная селективность по углеводородам C5–C11 и C12–C20 составляет примерно 45 и 30% соответственно [41]. Ранее Оцука (Ohtsuka) и др. [42] предположили, что мезопористые каналы катализатора Co/SBA-15 могут ингибировать образование длинноцепочечных углеводородов. Таким образом, распределение продуктов изменяется и может отклоняться от закона AШФ.
Данные табл. 2 показывают, что селективность S0, S2 и S3 по углеводородам С12–С18 составляет 33.5, 34.5 и 36.5% соответственно, что выше максимальной селективности по этим продуктам согласно АШФ. Следовательно, распределение продуктов этих катализаторов не соответствует распределению АШФ. Кроме того, предполагается, что из-за малого размера частиц кобальта селективность по CH4 может возрастать [38]. В настоящем исследовании показано, что при введение Al методом пропитки и темплатного синтеза размер частиц Co3O4 сокращается, приводя к более высокой селективности по CH4.
После введения Al в SBA-15 селективность в отношении ${\text{C}}_{{18}}^{ + }$ снижается, что согласуется с результатами Кэ (Cai) и др. [24]. Кислотные центры в двух образцах (S2, S3) способствуют уменьшению селективности по ${\text{C}}_{{18}}^{ + }$. Катализатор Co/Al-SBA-15 с Al, введенным методом темплатного синтеза, имеет самую низкую селективность по ${\text{C}}_{{18}}^{ + }$ (5.03%). Однако при использовании метода внутреннего гидролиза, индуцированного паром (рис. 1) мезоструктура SBA-15 нарушается: площадь поверхности по БЭТ и общий объем пор сокращается, а размер пор резко возрастает. Ограничения на массоперенос увеличивают концентрацию CO в порах катализатора и, следовательно, повышают вероятность роста цепи. В результате S1 демонстрирует более высокую селективность по ${\text{C}}_{{18}}^{ + }$.
Введение Al повышает кислотность катализатора, влияет на взаимодействие между активными центрами и носителем и, таким образом, воздействует и на реакционную способность катализатора. В результате конверсия СО снижается с 58.7% для S0 до 28.3% для S3. Что касается селективности по продуктам, реакция крекинга тяжелых продуктов на кислотных центрах протекает гораздо интенсивнее. В результате значительно увеличивается количество светлых продуктов, селективность по ${\text{C}}_{{18}}^{ + }$ падает с 18.5% для S0 до 5.03% для S3, селективность по СН4 возрастает с 13.6% для S0 до 28.7% для S3, а селективность по С12–С18 повышается с 33.5% для S0 до 36.5% для S3.
4. ЗАКЛЮЧЕНИЕ
Таким образом, показано, что пост-синтетические методы получения носителей Al-SBA-15 влияют на структуру и каталитическую эффективность кобальтовых катализаторов синтеза ФТ. Введение Al снижает каталитическую активность и изменяет селективность катализаторов. При использовании методов пропитки и темплатного синтеза усиливается взаимодействие между кобальтом и носителем, что приводит к более высокой селективности по CH4. Кроме того, введение Al темплатным методом увеличивает селективность катализатора по C12–C18. При применении метода внутреннего гидролиза, индуцированного паром, доступ к мезоструктуре SBA-15 становится затруднен, что приводит к возрастанию селективности образования углеводородов ${\text{C}}_{{18}}^{ + }$.
Список литературы
Lin T.J., Gong K., Wang C.Q., An Y.L., Wang X.X., Qi X.Z., Li S.G., Lu Y.W., Zhong L.S., Sun Y. // ACS Catal. 2019. V. 9. P. 9554.
Zacho S.L., Gajdek D., Mielby J., Kegnæs S. // Top. Catal. 2019. V. 62. P. 621.
Jacobs G., Das T.K., Zhang Y.Q., Li J., Racoillet G., Davis B.H. // Appl. Catal. A: Gen. 2002. V. 233. P. 263.
Guo S.P., Wang Q., Wang M., Li D. // Fuel. 2019. V. 256. P. 115911.
Barbier A., Tuel A., Arcon I., Kodre A., Martin G. // J. Catal. 2001. V. 200. P. 106.
Iglesia E., Soled S.L., Fiato R.A. // J. Catal. 1992. V. 37. P. 212.
Liu Z.W., Li X., Asami K., Fujimoto K. // Catal. Today. 2005. V. 104. P. 41.
Liu B., Li W.P., Xu Y.B., Lin Q., Jiang F., Liu X.H. // ACS Catal. 2019. V. 9. P. 7073.
Yang G., He J., Yoneyama Y., Tan Y.S., Tsubaki N. // Appl. Catal. A: Gen. 2007. V. 329. P. 99.
Liu Y.C., Chen J.G., Fang K.G., Sun Y.H. // Green Chem. 2007. V. 9. P. 611.
Wang Y.L., Hou B., Chen J.G., Jia L.T. // Catal. Commun. V. 10. P. 747.
Zhao D.Y., Jiao F., Huo Q., Melosh N.W. // Science. 1998. V. 279. P. 548.
Martinez A., Lopez C., Marquez F., Díaz I. // J. Catal. 2003. V. 220. P. 486.
Wang Y., Noguchi M., Takahashi Y., Ohtsuka Y. // Catal. Today. 2001. V. 68. P. 3.
Xiong H., Zhang Y., Liew K., Li J. // J. Mol. Catal. A: Chem. 2008. V. 295. P. 68.
Xiong H., Zhang Y., Wang S., Liew K., Li J. // J. Phys. Chem. C. 2008. V. 112. P. 9706.
Cai Q., Li J.L. // Catal. Commun. 2008. V. 9. P. 2003.
Xiong H., Zhang Y., Liew K., Li J.L. // Fuel. Process. Technol. 2009. V. 90. P. 237.
Ohtsuka Y., Takahashi Y., Noguchi M., Arai T., Takasaki S., Tsubouchi N., Wang Y. // Catal. Today. 2004. V. 89. P. 419.
Kao H.M., Ting C.C., Chao S.W. // J. Mol. Catal. A: Chem. 2005. V. 235. P. 200.
Sumiya S., Oumi Y., Uozumi T., Sano T. // J. Mater. Chem. 2001. V. 11. P. 1111.
Dragoi B., Dumitriu E., Guimon C., Auroux A. // Micropor. Mesopor. Mater. 2009. V. 121. P. 7.
Morey M.S., Brien S.O., Schwarz S., Stucky G.D. // Chem. Mater. 2000. V. 12. P. 898.
Cai Y., Xu X.F., Wang H., Wang L., Chen L., Li R., Ding J., Wan H., Guan G.F. // Ind. Eng. Chem. Res. 2018. V. 57. P. 3844.
Jae Min Cho, Chang Ahn, Changhyun Pang, Jong Wook Bae // Catal. Sci. Technol. 2015. V. 5. P. 3525.
Lualdi M., di Carlo G., Lögdberg S., Järås S., Boutonnet M., la Parola V., Liotta L.F., Ingo G.M., Venezia A.M. // Appl. Catal. A: Gen. 2012. V. 443–444. P. 76.
Hao Q.Q., Zhao Y.H., Yang H.H., Liu Z.T., Liu Z.W. // Energy and Fuels. 2012. V. 26. P. 6567.
Zhao D.Y., Feng J.L., Huo Q.S., Melosh N., Fredrickson G.H., Chmelka B.F., Stucky G.D. // Science. 1998. V. 279. P. 548.
Cheralathan K.K., Hayashi T., Ogura M. // Micropor. Mesopor. Mater. 2008. V. 116. P. 406.
Luan Z., Hartmann M., Zhao D., Zhou W., Kevan L. // Chem. Mater. 1999. V. 11. P. 1621.
Schanke D., Vada S., Blekkan A.E., Hilmen A.M., Hoff A., Holmen A. // J. Catal. 1995. V. 156. P. 85.
Sun S., Tsubaki N., Fujimoto K. // Appl. Catal. A: Gen. 2000. V. 202. P. 121.
Storsater S., Totdal B., Walmsley J.C., Tanem B.S., Holmen A. // J. Catal. 2005. V. 236. P. 139.
Li P., Liu J., Nag N., Crozier P. // Appl. Catal. A: Gen. 2006. V. 307. P. 212.
Shannon M.D., Lok C.M., Casci J.L. // J. Catal. 2007. V. 249. P. 41.
Jacobs G., Chaney J.A., Patterson P.M., Das T.K., Maillot J., Davis B. // Appl. Catal. A: Gen. 2004. V. 264. P. 203.
Gonzalez O., Pérez H., Navarro P., Almeida L.C., Pacheco J., Montes M. // Catal. Today. 2009. V. 148. P. 140.
Khodakov A.Y., Griboval-Constant A., Bechara R., Zholobenko V.L. // J. Catal. 2002. V. 206. P. 230.
Song S.-H., Lee S.-B., Bae J., Prasad P.S., Jun K. // Catal. Commun. 2008. V. 9. P. 2282.
Tsubaki N., Sun S., Fujimoto K. // J. Catal. 2001. V. 199. P. 236.
Zhang Q.H., Kang J.C., Wang Y. // ChemCatChem. 2010. V. 2. P. 1030.
Ohtsuka Y., Arai T., Takasaki S., Tsubouchi N. // Energy and Fuels. 2003. V. 17. P. 804.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ