Кинетика и катализ, 2022, T. 63, № 4, стр. 465-469
Кинетика реакции 2-метилпропена с формальдегидом в присутствии синтетических цеолитов
Г. А. Овчинников a, В. С. Тухватшин a, *, Р. С. Илибаев b, Р. Ф. Талипов a
a ФГБОУ ВО Башкирский государственный университет
450076 Башкортостан, Уфа, ул. З. Валиди, 32, Россия
b ООО Ишимбайский специализированный химический завод катализаторов
453203 Башкортостан, Ишимбай, ул. Левый берег, 6, Россия
* E-mail: vadimtukhvatshin@yandex.ru
Поступила в редакцию 14.01.2022
После доработки 02.03.2022
Принята к публикации 15.03.2022
- EDN: QXCYVB
- DOI: 10.31857/S0453881122040104
Аннотация
Известно, что цеолиты проявляют каталитическую активность в реакции Принса. Установлено, что их использование позволяет повысить селективность реакции Принса с 2-метилпропеном, а зависимость эффективных констант скоростей расходования формальдегида и накопления 4,4-диметил-1,3-диоксана от диаметра пор цеолитов носит экстремальный характер. Актуальность представленной работы обусловлена тем, что знание кинетических закономерностей протекания реакции Принса в присутствии цеолитов типов А и Х может способствовать регулированию селективности образования кислородсодержащих соединений, в частности, имеющего промышленную ценность 4,4-диметил-1,3-диоксана, при взаимодействии формальдегида и 2-метилпропена.
ВВЕДЕНИЕ
Основной промышленный метод получения изопрена основан на термокаталитическом разложении 4,4-диметил-1,3-диоксана (ДМД), синтезируемого по реакции Принса из 2-метилпропена и водного формальдегида [1]. Значительным недостатком описанного способа является низкая селективность по ДМД, обусловленная появлением побочных продуктов (гидрированных пиранов, 1,3-диолов и т.д.), что связано, по-видимому, с многоканальностью реакции Принса [2].
Существующие на сегодняшний день способы увеличения селективности образования ДМД по вышеуказанной реакции [3–6] позволили повысить ее лишь до 70%.
Известно, что цеолиты проявляют каталитическую активность и широко применяются в органическом синтезе [7–12]. Имеется немалое количество данных [13–15] об использовании цеолитов как катализаторов в реакции Принса. Также есть единичные примеры улучшения селективности по ДМД при взаимодействии формальдегида с 2-метилпропеном или трет-бутанолом в условиях катализа ZSM-5, ZSM-11, REY, H-ZSM-5, H-Boralite, Fe(ZSM)-5, Al(ZSM)-5, H(Fe)ZSM-5, H(Al)ZSM-5 [16–19].
В работах [16–18] отмечается, что при взаимодействии 2-метилпропена с формальдегидом в присутствии цеолита ZSM-5 (диаметр пор ~ 5.6 Å) выход ДМД ниже, чем в условиях катализа цеолитом REY (диаметр пор ~ 12.4 Å). Однако наряду с увеличением выхода ДМД при использовании цеолита REY в сравнении с ZSM-5, наблюдается образование серии побочных продуктов, ненасыщенных спиртов и диолов, что указывает на невысокую селективность реакций.
Представленные литературные данные свидетельствуют о том, что выбор цеолита в качестве катализатора для реакции Принса осуществляется случайным образом. Это не гарантирует использования наиболее эффективного пористого материала в изучаемой реакции.
Ранее с применением принципов селективности по форме переходного состояния (transition state shape selectivity) [20, 21] была теоретически обоснована возможность увеличения селективности образования 1,3-диоксанов в присутствии пористых материалов [22, 23]. На примере ряда алкенов, в том числе 2-метилпропена, квантово-химическими расчетами показаны взаимодействия переходных состояний реакций образования 4-алкилдиоксанов-1,3 с цеолитами структурного типа Cax[Al2xSiyОz] ⋅ nH2O, содержащими полости различного диаметра. Оно носит экстремальный характер с максимумом при размере пор 5.1–5.4 Å [23].
Целью настоящей работы является систематическое экспериментальное исследование возможности использования принципа shape selectivity (на примере катализа синтетическими цеолитами) для повышения селективности реакции Принса с 2-метилпропеном с применением метода формальной кинетики.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали синтетические цеолиты марок KA, NaA, CaA, CaX, NaX (ООО “Ишимбайский специализированный химический завод катализаторов”, г. Ишимбай). Газохроматографический анализ проводили на хроматографе Кристалл-5000 (“Хроматэк”, Россия) с пламенно-ионизационным детектором на стеклянной колонке длиной 3.0 м, неподвижная фаза – силикон SE-30 (5%), рабочая температура колонки – 50–220°С. В качестве газа-носителя применяли азот (30 мл/мин). Анализ выполняли при температуре испарителя 160°С, температуре детектора 220°С и температуре колонки 120°С. Растворители сушили по стандартным методикам [24].
Методика проведения кинетических экспериментов
В колбу, снабженную термометром, обратным холодильником, пробоотборником и механической мешалкой, добавляли водный раствор формальдегида концентрацией 6–8 моль/л, 2.65 г синтетических цеолитов (5 мас. %) и 3.3 мл 1,4-диоксана как гомогенизатора. Затем в реакционную смесь барботировали 2-метилпропен (2 л/ч) при заданной температуре и приливали 2.0 мл 81%-ной ортофосфорной кислоты (5 мас. %). Этот момент принимали за начало отчета времени реакции. Пробы объемом по 0.7 мл для анализа формальдегида и ДМД отбирали раздельно. Все эксперименты проводили в кинетической области при скорости вращения мешалки 16.5 об/c.
Определение концентрации формальдегида
Пробу взвешивали, нейтрализовывали расчетным количеством 0.1 М NaOH, разбавляли 2.0 мл дистиллированной воды и осуществляли определение формальдегида сульфитным методом [25].
Определение концентрации ДМД
Пробу взвешивали, нейтрализовывали 2.0 мл концентрированного аммиака, добавляли точно взвешенное количество 4,4,5-триметил-1,3-диоксана (внутренний стандарт) и проводили хроматографическое определение ДМД [26].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакцию вели в присутствии 5 мас. % фосфорной кислоты и 5 мас. % синтетических цеолитов при 75°C в избытке 2-метилпропена.
На рис. 1 и 2 приведены экспериментальные кинетические кривые расхода формальдегида и образования ДМД в реакции Принса с участием 2-метилпропена в присутствии фосфорной кислоты и синтетических цеолитов.
Рис. 1.
Кинетические кривые расхода формальдегида в реакции с 2-метилпропеном в присутствии фосфорной кислоты и синтетических цеолитов типов А и Х при 75°С.
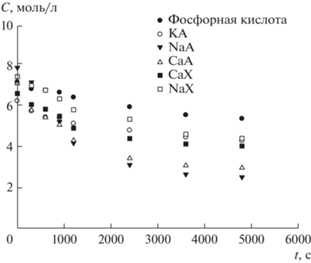
Рис. 2.
Кинетические кривые накопления ДМД по реакции 2-метилпропена с формальдегидом в присутствии фосфорной кислоты и синтетических цеолитов типов А и Х при 75°С.

На рис. 3 и 4 представлены полулогарифмические анаморфозы кинетических кривых расхода формальдегида и накопления ДМД в реакции Принса с участием 2-метилпропена в присутствии фосфорной кислоты и в отсутствие синтетических цеолитов.
Рис. 3.
Полулогарифмическая анаморфоза кинетической кривой расхода формальдегида в реакции с 2-метилпропеном в присутствии фосфорной кислоты при 75°С.
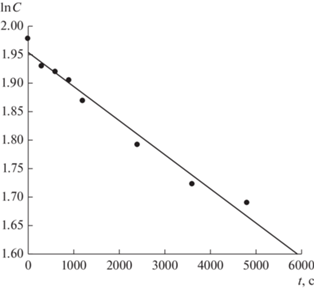
Рис. 4.
Полулогарифмическая анаморфоза кинетической кривой накопления ДМД в реакции с 2-метилпропеном в присутствии фосфорной кислоты при 75°С.

Установлено [27], что кинетические кривые расходования формальдегида и образования ДМД в реакции Принса с 2-метилпропеном в присутствии фосфорной кислоты (в отсутствие добавок цеолитов) (рис. 1 и 2) удовлетворительно (R = 0.962–0.980) линеаризуется в координатах lnC–t (рис. 3 и 4), что свидетельствует о первом порядке реакции по формальдегиду и ДМД. По тангенсу угла наклона рассчитаны значения эффективных констант скоростей расхода формальдегида (kэфф = (1.51 ± 0.02) × 10–5 с–1) и образования ДМД (kэфф = (3.11 ± 0.14) × 10–4 с–1).
При проведении реакции формальдегида с 2‑метилпропеном в присутствии синтетических цеолитов кинетические кривые расходования формальдегида и образования ДМД приобретают S-образный вид (рис. 1 и 2), а полулогарифмические анаморфозы кинетических кривых имеют два выраженных участка (рис. 5 и 6).
Рис. 5.
Полулогарифмические анаморфозы кинетических кривых расхода формальдегида в реакции с 2‑метилпропеном в присутствии синтетических цеолитов при 75°С.
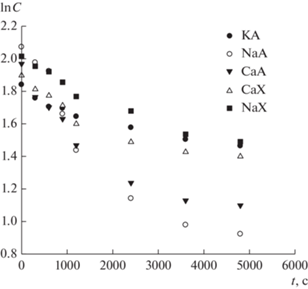
Рис. 6.
Полулогарифмические анаморфозы кинетических кривых накопления ДМД по реакции 2-метилпропена с формальдегидом в присутствии синтетических цеолитов типов А и Х при 75°С.

Сложный характер кинетических кривых обусловлен одновременным протеканием нескольких процессов − адсорбцией ДМД и формальдегида на цеолитах, взаимодействием формальдегида и 2-метилпропеном как в объеме, так и на поверхности цеолита.
На рис. 5 и 6 представлены полулогарифмические анаморфозы кинетических кривых расхода формальдегида и накопления ДМД в реакции Принса с участием 2-метилпропена в присутствии фосфорной кислоты и синтетических цеолитов.
На первом участке полулогарифмических анаморфоз (рис. 5) (в области до 1200 с) скорость расходования формальдегида определяется адсорбцией формальдегида на цеолите и реакцией формальдегида с 2-метилпропеном в объеме. Излом полулогарифмических анаморфоз кинетических кривых (рис. 5) формальдегида в области 1200 с, по-видимому, можно объяснить тем, что скорость расходования формальдегида в большей степени обусловлена процессом равновесной адсорбции формальдегида [28], а не скоростью реакции формальдегида с 2-метилпропеном в объеме.
В области после 1200 с полулогарифмических анаморфоз кинетических кривых (рис. 5) скорость расходования формальдегида уже в большей степени определяется скоростью реакции формальдегида с 2-метилпропеном на поверхности цеолита, а не скоростью реакции в объеме.
На первом участке полулогарифмических анаморфоз (в области до 1200 с) (рис. 6) скорость образования ДМД обусловлена взаимодействием формальдегида и 2-метилпропена в объеме и его последующей адсорбцией на цеолите. Причем выраженный S-образный характер кинетических кривых (рис. 3), а также излом на соответствующих им полулогарифмических анаморфозах (рис. 6), вероятно, вызван тем, что скорость адсорбции ДМД на порядок выше [29] скорости его образования в объеме.
На втором участке кривых (рис. 6) после установления сорбционного равновесия (в области после 1200 с) скорость процесса образования ДМД в большей степени определяется скоростью конденсации формальдегида и 2-метилпропена на поверхности цеолита и в меньшей – в объеме.
Следовательно, на первом участке кинетических кривых (рис. 1 и 2) значителен вклад адсорбции формальдегида или ДМД, на втором же – реакции Принса с участием 2-метилпропена на поверхности цеолита. В связи с этим расчет эффективных констант скоростей расходования формальдегида и образования ДМД (табл. 1) проводили по тангенсу угла наклона второго участка (в области после 1200 с) полулогарифмических анаморфоз (рис. 5 и 6).
Таблица 1.
Зависимости эффективных констант скоростей расходования формальдегида и накопления ДМД от диаметра пор синтетических цеолитов (5 мас. %, 75°С)
| Цеолит | dпор, Å | Величина эффективной константы скорости реакции расходования CH2O, k × 105, с–1 | Величина эффективной константы скорости реакции накопления ДМД, k × 105, с–1 |
|---|---|---|---|
| KA | 3 | 0.51 ± 0.02 | 1.71 ± 0.09 |
| NaA | 4 | 1.42 ± 0.07 | 6.05 ± 0.32 |
| CaA | 5 | 1.01 ± 0.07 | 6.17 ± 0.41 |
| CaX | 8 | 0.55 ± 0.03 | 4.34 ± 0.22 |
| NaX | 9 | 0.81 ± 0.06 | 4.65 ± 0.24 |
ЗАКЛЮЧЕНИЕ
Показано, что реакция формальдегида с 2-метилпропеном на поверхности цеолита (рис. 5 и 6) удовлетворительно (R = 0.982–0.997) описывается уравнением кинетики первого порядка (рис. 3) по формальдегиду для всех используемых синтетических цеолитов. Это согласуется с тем, что в объеме ДМД преимущественно образуется из мономера и олигомеров формальдегида, а на поверхности – исключительно из олигомеров [30, 31].
Из представленных данных следует, что наибольшая скорость расходования формальдегида и накопления ДМД наблюдается в случае использования синтетических цеолитов NaA и СаА.
Установленный нами факт высокой активности синтетических цеолитов NaA (диаметр пор – 4 Å) и СаА (диаметр пор – 5 Å) может быть объяснен близостью величин диаметров пор указанных цеолитов и переходного состояния ДМД, что согласуется с принципом shape selectivity [20, 21] и расчетными данными [22].
Список литературы
Платэ Н.А., Сливинский Е.В. Основы химии и технологии мономеров. Москва: Наука, 2002. 696 с.
Талипов Р.Ф., Сафаров М.Г. // Башкирский химический журнал. 1997. Т. 4. № 3. С. 10.
Пaт. 2255936 RU, 2005.
Пaт. 991715 RU, 1999.
Пaт. 2330848 RU, 2008.
Сафарова И.И. Дисс. … канд. хим. наук. Казань: КНИТУ, 2009.
Hui L., Dong P., Ji D., Zhao X., Li Ch., Li G. // Кинетика и катализ. 2021. Т. 62. № 3. С. 368.
Григорьева Н.Г., Аглиуллин М.Р., Костылева С.А., Бубеннов С.В., Бикбаева В.Р., Гатауллин А.Р., Филлипова Н.А., Кутепов Б.И., Нарендер Н. // Кинетика и катализ. 2019. Т. 60. № 1. С. 62.
Пань Ф., Люй С., Янь Я., Ван Т. // Кинетика и катализ. 2017. Т. 58. № 15. С. 559.
Gjylia S., Korpa A. // Кинетика и катализ. 2021. Т. 62. № 2. С. 214.
Li C., Li G., Dong P., Li H., Meng W., Zhang D. // Кинетика и катализ. 2021. Т. 62. № 2. С. 224.
Мурзин Д.Ю. // Кинетика и катализ. 2020. Т. 61. № 1. С. 85.
Dimitriu E., Gongescu D., Hulea V. // Stud. Surf. Sci. Catal. 1993. V. 78. P. 669.
Dimitriu E., Trong O.D., Kaliaguine S. // J. Catal. 1997. V. 170. P. 150.
Dimitriu E., Hulea V., Chelaru C., Hulea T., Kaliaguine S. // Zeolites and Related Microporous Materials: State of the Art. 1994. V. 84. P. 1997.
Dumitriu E., Hulea V., Fechete I., Catrinescu C., Auroux A., Lacaze J.F., Guimon C. // Appl. Catal. A: Gen. 1999. V. 181. P. 15.
Venito P.B. // Micropor. Mater. 1994. V. 2. P. 297.
Chang C.D., Lang W.H., Bell W.K. Catalysis of Organic Reactions. New York: Basel, 1981. P. 74.
Hoelderuch W.F., Hesse M., Naumann F. // Angew. Chem. Int. Ed. Engl. 1988. V. 27. P. 226.
Smit B., Maesen L.M. // Nature. 2008. V. 451. № 7. P. 671.
Лисичкин Г.В., Крутяков Ю.А. // Успехи химии. 2006. Т. 75. № 10. С. 998.
Вакулин И.В., Пасько П.А., Талипов Р.Ф., Талипова Г.Р., Купова О.Ю. // Кинетика и катализ. 2019. Т. 60. № 3. С. 340.
Вакулин И.В. Дис. … докт. хим. наук. Уфа: БашГУ, 2013.
Титце Л., Айхер Т. Препаративная органическая химия. Москва: Мир, 2012. 704 с.
Фадеева В., Шеховцова Т., Иванов В. Основы аналитической химии. Практическое руководство. Москва: Высшая школа, 2003. 463 с.
Айвазов Б. Основы газовой хроматографии. Москва: Высшая школа, 1977. 182 с.
Морозов А.А., Сагитуллина Г.П., Сагитуллин Р.С. // Вестник Омского университета. 2009. № 2. С. 164.
Овчинников Г.А., Горских В.А., Тухватшин В.С., Талипов Р.Ф. // Изв. высших учебных заведений. Серия: Химия и химическая технология. 2016. Т. 59. № 12. С. 71.
Ovchinnikov G.A., Gorskikh V.A., Fassalova I.I., Tukhvatshin V.S., Talipov R.F. // ChemChemTech. 2018. V. 61. № 12. P. 81.
Купова О.Ю., Вакулин И.В., Талипова Г.Р., Талипов Р.Ф. // Бутлеровские сообщения. 2012. Т. 32. № 13. С. 123.
Talipov R.F., Mustafin A.M., Talipova G.R., Safarov M.G. // Zhurnal obshchey khimii. 1996. V. 66. № 8. P. 1382.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


