Кинетика и катализ, 2022, T. 63, № 5, стр. 559-571
Формирование полигидроксиуретанов в реакции диоксида углерода с диэпоксидами и диаминами в присутствии комплекса хрома
О. М. Чуканова a, *, О. Г. Шеверденкина a, А. Т. Капашаров a, А. В. Черняк a, И. В. Седов a, b
a ФГБУН Институт проблем химической физики РАН
142432 Черноголовка, просп. Акад. Семенова, 1, Россия
b ФГБОУ ВПО Московский государственный университет им. М.В. Ломоносова, Факультет фундаментальной физико-химической инженерии
119991 Москва, ГСП-1, Ленинские горы, 1, стр. 51, Россия
* E-mail: olchukan@icp.ac.ru
Поступила в редакцию 04.04.2022
После доработки 26.04.2022
Принята к публикации 28.04.2022
- EDN: HCPHPT
- DOI: 10.31857/S0453881122050021
Аннотация
Синтез циклических бис-карбонатов из СО2 и диэпоксидов проведен в присутствии саленового комплекса хрома(III). Впервые исследовано влияние условий реакции на кинетику процесса, которую регистрировали по поглощению СО2 в ходе реакции. После полной конверсии диэпоксидов в циклический бис-карбонат с использованием той же каталитической системы была проведена реакция бис-карбонатов с диаминами с формированием полигидроксиуретанов. Термические характеристики синтезированных полимеров определяются в основном строением диэпоксида и в меньшей степени – природой амина, применяемого на второй стадии процесса.
ВВЕДЕНИЕ
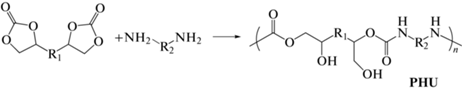
Полигидроксиуретаны (PHU) являются новыми полимерами, содержащими в своем составе карбонильные группы, амино-группы и гидроксильные группы. Это термостойкие материалы, обладающие хорошими адгезионными свойствами и характеризующиеся гидрофильностью, что позволяет использовать их как связующие, добавки в водно-эмульсионных красках, защитных покрытиях или как биосовместимые полимеры [1–3]. В последние 15 лет растет количество публикаций с описанием наиболее популярного метода синтеза PHU, включающего взаимодействие циклических бис-карбонатов с диаминами (схема 1 ).
Схема 1 . Формирование полигидроксиуретанов при взаимодействии бис-карбонатов с диаминами.
Эффективность процесса аминирования зависит от многих факторов: состава исходных реагентов или условий реакции (состав и концентрация катализатора, температура, соотношение реагентов, тип растворителя) [1, 2]. В качестве катализаторов этих процессов применяют различные органические основания, соли аминов, соли металлов или их комплексы [2]. Реакцию часто проводят длительное время при температурах выше 70°С, однако условия достижения полной конверсии циклических карбонатов определяются в первую очередь составом реагентов.
Циклические карбонаты могут быть получены при взаимодействии эпоксидов с СО2. Реакции моноэпоксидов с СО2 в присутствии различных каталитических систем достаточно подробно изучены [4, 5]. В то же время лишь в немногих работах можно найти данные об условиях формирования циклических бис-карбонатов из диэпоксидов и СО2 (схема 2 ).
Схема 2 . Образование бис-карбонатов из диэпоксидов и СО2.
Например, при использовании LiBr в качестве катализатора при концентрации соли лития 5 мол. % реакция протекала при 80°C в течение 24 ч (давление СО2 – 1 МПа) [6]. Применяли также органические катализаторы метил(трифенилфосфоний) иодид и тетрабутиламмоний иодид при довольно высокой их концентрации – 2–5 мол. %. При температуре 25–70°C, давлении СО2 0.1 МПа были получены циклические бис-карбонаты с конверсией 80–99% по эпоксиду за 24–48 ч [7].
Комплексы саленового (N2O2) типа известны как активные катализаторы в реакции моноэпоксидов с СО2 [4]. Однако они не использовались в синтезе циклических бис-карбонатов. В одной из первых работ при изучении реакции СО2 с эпоксидами было показано, что в присутствии каталитической системы 1,2-дифенил-1,2-этилендиамин-N,N'-бис(3,5-ди-третбутилсалицилиден) хром(III) хлорид/диметиламинопиридин полная конверсия пропиленоксида достигается при 75°C, давлении СО2 0.34 МПа за 1.5 ч [8]. При применении моноэпоксидов с объемными заместителями реакция протекала медленнее, и для полной конверсии требовались более высокие температуры и увеличение времени реакции. Бинарные каталитические системы, включающие металлокомплексы (кислоты Льюиса) и соли аммония как нуклеофильные сокатализаторы, характеризуются наибольшей активностью в реакции СО2 с эпоксидами [5]. Как первый, так и второй компонент каталитической системы можно использовать в синтезе циклических карбонатов, однако лучшие результаты были получены при их сочетании. Например, соли тетрабутиламмония катализируют эту реакцию, однако в присутствии металлокомплексов она протекает быстрее. Влияние нуклеофилов на процесс формирования циклических карбонатов схематически рассмотрено в [5]. Внедрение СО2 в металл-алкоксидную связь, формирующуюся при раскрытии эпоксидного цикла, ускоряется в присутствии нуклеофила.
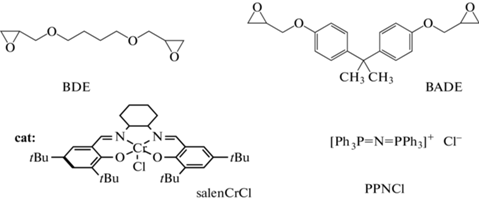
В настоящей работе исследована бинарная каталитическая система (R,R)-N,N'-бис(3,5-дитретбутилсалицилиден)-1,2-диаминоциклогексан хром(III) хлорид (salenCrCl)/бис(трифенилфосфин)иминия хлорид (PPNCl). Одной из главных задач было изучение кинетики реакции СО2 с диэпоксидами. В качестве диэпоксидов использовали 1,4-бутандиол диглицидиловый эфир (BDE) и диглицидиловый эфир бисфенола A (BADE) как наиболее часто применяемые реагенты, чтобы провести сопоставление полученных нами данных с ранее опубликованными. Задачей следующего этапа было проведение реакции синтезированных циклических бис-карбонатов (СС) с диаминами в присутствии той же каталитической системы без выделения промежуточного продукта. Полноту протекания процессов формирования циклических бис-карбонатов и затем полигидроксиуретанов контролировали по ИК-спектрам, синтезированные полигидроксиуретаны (PHU) характеризовали с применением ИК-, ЯМР-спектроскопии, ГПХ-хроматографии, термические характеристики исследовали методами ДСК и ТГА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и методы исследования
(R,R)-N,N’-бис(3,5-дитретбутилсалицилиден)-1,2-диаминоциклогексан хром(III) хлорид (salenCrCl) готовили по методике [8] из CrCl2 (“Sigma-Aldrich”) и (R,R)-N,N'-бис(3,5-дитретбутилсалицилиден)-1,2-циклогександиамина (“Sigma-Aldrich”). Сокатализатор бис-(трифенилфосфин)иминия хлорид, 97% (PPNCl) предоставлен фирмой “Strem Chemicals”. CO2 (99.8%) получен от фирмы “Линде Газ”. Диэпоксиды 1,4-бутандиол диглицидиловый эфир, 95% (BDE) и диглицидиловый эфир бисфенола A, 96% (BADE); амины этилендиамин, 99.5% (EDA), гексаметилендиамин, 98% (HMDA), мета-ксилилендиамин, 99% (XDA), трис(2-аминоэтил)амин, 96% (TAEA) (“Sigma-Aldrich”) использовали без дополнительной очистки. Диметилсульфоксид (ДМСО) осушали над CaH2.
ЯМР-спектры регистрировали на приборе AVANCE III (“Bruker”, Германия), растворяя образцы в ДМСО-d6, при температуре 25°С. ИК-спектры пропускания с использованием окошек из KBr и спектры нарушенного полного внутреннего отражения (НПВО) получали с помощью прибора ALPHA (“Bruker Optics”, Германия). ИК-спектр НПВО salenCrCl, см–1: 748 ср., 785 сл., 836 ср., 1008 ср., 1171 ср., 1201 сл., 1255 ср., 1318 ср., 1360 ср., 1409 сл., 1435 ср., 1461 сл., 1535 ср., 1622 с., 2867 сл., 2951 ср.
Анализ молекулярно-массового распределения полимеров выполняли с использованием хроматографа Agilent 1260 Infinity II (“Agilent”, США), снабженного рефрактометрическим детектором, колонкой Waters Styragel HR 5E 7.8 × × 300 мм. Калибровку колонки проводили по полиэтиленгликолю (стандарты “Agilent”). В качестве элюента применяли диметилформамид, скорость элюирования – 1 мл/мин, температура – 50°C.
Термический анализ осуществляли с помощью дифференциального сканирующего калориметра DSC822e (“METTLER TOLEDO”, Швейцария), откалиброванного с использованием сверхчистых индия и олова. Исследования выполняли на образцах массой 5–10 мг, помещенных в стандартные алюминиевые тигли объемом 40 мкл с перфорированными крышками, в атмосфере азота (скорость продувки – 20 см3/мин) при скорости нагрева 20 град/мин в диапазоне температур от –40°С до 100°С. Из температурных зависимостей W = f(Т) с применением программного обеспечения STARe находили температуры стеклования образцов во втором цикле нагревания–охлаждения.
Термогравиметрический анализ и определение потери массы в результате разложения при нагреве проводили с помощью устройства термогравиметрического и дифференциального термического анализа TGA/SDTA851E, мод. SF/1100°C (“METTLER TOLEDO”, Швейцария), откалиброванного с использованием сверхчистых индия, олова и алюминия. Исследовали образцы массой 4–6 мг, помещенные в стандартные корундовые тигли объемом 70 мкл с крышками, в атмосфере азота (скорость продувки – 80 см3/мин) при скорости нагрева 10 град/мин в диапазоне температур от 0 до 550°С.
Реакция СО2 с диэпоксидами
Катализатор SalenCrCl и сокатализатор PPNCl растворяли в смеси диэпоксида и ДМСО в объемном соотношении 1 : 1 в атмосфере аргона и перемешивали в течение 15 мин при 30–40°С. Концентрацию [salenCrCl] изменяли в диапазоне (6–8) × 10–3 моль/л. Раствор переливали в предварительно откачанный металлический реактор объемом 0.1 л, снабженный магнитной мешалкой, в атмосфере СО2. В реакторе поднимали давление подачей СО2 и подключали к термостату, нагретому до необходимой температуры. В ходе реакции поддерживали постоянное давление. Кинетику регистрировали, измеряя давление СО2 в калиброванной мерной емкости, соединенной с реактором. Количество СО2 рассчитывали по градуировочной кривой, выражающей зависимость массы СО2 от давления в мерной емкости. Реакцию заканчивали, охлаждая реактор до комнатной температуры и сбрасывая давление. Расход СО2 в реакции сопоставляли с количеством диэпоксидов и рассчитывали конверсию. Небольшое количество раствора отбирали из реактора и регистрировали ИК-спектр. Превращение диэпоксида в циклический бис-карбонат сопровождалось уменьшением интенсивности полосы поглощения в области 910 см–1 (С–О-колебания эпоксидных групп) и ростом полосы поглощения при 1800 см–1 (С=О-колебания в циклическом бис-карбонате).
Реакция синтезированных циклических бис-карбонатов с аминами
После завершения первой стадии процесса и полной конверсии диэпоксидов в циклический бис-карбонат в реактор вводили раствор амина в ДМСО (объемное соотношение 1 : 1) в атмосфере аргона. Мольное соотношение амина к циклическому карбонату составляло 1.3–1.4. Реагенты перемешивали при 25°С в течение 4 ч. Небольшую часть раствора отбирали для регистрации ИК-спектра. При формировании полигидроксиуретана полоса поглощения С=О-групп смещалась в область 1700 см–1. Очистку синтезированных образцов PHU от катализатора проводили 10-кратной промывкой хлористым метиленом (150 мл) при температуре 40–50°С, растворяя предварительно образцы в небольшом количестве ДМСО (5 мл). Образцы высушивали в вакуумном шкафу при 150°С в течение 4 ч, после чего регистрировали ЯМР-спектры, измеряли температуру стеклования методом дифференциальной сканирующей калориметрии (ДСК) и получали данные о термораспаде с использованием термогравиметрического анализа (ТГА).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакция диэпоксидов с СО2
Задачей первого этапа работы было изучение влияния условий реакции СО2 с диэпоксидами на кинетику процесса образования циклических бис-карбонатов с целью достижения полной конверсии эпоксидов. В качестве диэпоксидов использовали BDE и BADE, реакцию проводили в присутствии известной каталитической системы salenCrCl/PPNCl (cat, схема 3 ).
Схема 3 . Диэпоксиды и каталитическая система для реакции СО2 с диэпоксидами.
Для анализа влияния условий реакции на скорость процесса варьировали соотношение [PPNCl]/[salenCrCl] и температуру при постоянном давлении СО2 равном 0.9 МПа. Известно, что скорость реакции СО2 с моноэпоксидами значительно зависит от соотношения сокатализатор/катализатор [4, 8], в реакции с диэпоксидами такие исследования не проводились. В настоящей работе мольное соотношение сокатализатор/катализатор изменяли в диапазоне от 1 до 3, кинетику изучали по поглощению СО2 в ходе реакции, а количество израсходованного в реакцию СО2 сопоставляли с количеством эпоксидных групп. На рис. 1 представлены рассчитанные кинетические кривые для конверсии диэпоксида BDE в циклический бис-карбонат.
Рис. 1.
Зависимость конверсии BDE от времени реакции при различном соотношении [PPNCl]/[salenCrCl]: 1 (1), 2 (2), 3 (3). Другие условия: 90°C, 0.9 МПа СО2, [salenCrCl] = (6–8) × 10–3 моль/л.

Скорость реакции возрастает при увеличении соотношения сокатализатор/катализатор до 2, и далее с его повышением практически не меняется. В дальнейшем реакцию проводили при выявленном оптимальном соотношении, равном 2.2. За 4 ч протекания процесса конверсия BDE составляет 0.9–0.93 в относительно мягких условиях, а полная конверсия диэпоксида достигается за 8 ч.
Зависимость скорости реакции от температуры определяется как изменением константы скорости с температурой, так и влиянием температуры на растворимость СО2 в реакционной среде. Варьирование температуры от 75 до 90°С сопровождается небольшим ростом скорости реакции (~ в 1.2 раза). Вероятно, увеличение константы скорости с температурой компенсируется уменьшением растворимости СО2 в среде, в результате чего температура слабо влияет на скорость реакции в диапазоне высоких температур. Далее реакцию проводили при 90°С.
В одинаковых условиях реакции сопоставлены скорости формирования циклических бис-карбонатов при использовании различных диэпоксидов. Полученные данные представлены на рис. 2.
Рис. 2.
Зависимость конверсии диэпоксидов от времени реакции: BDE (1), BADE (2). Условия реакции: [PPNCl]/[salenCrCl] = 2.2, 90°C, 0.9 МПа СО2, [salenCrCl] = (6–8) × 10–3 моль/л.
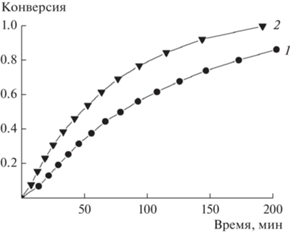
При применении BADE скорость выше, и за одинаковое время реакции достигается более высокая конверсия. Для объяснения наблюдаемых закономерностей нужны дополнительные исследования, в частности, необходим анализ изменения растворимости СО2 в применяемых диэпоксидах, а также определение значения энергии активации процесса в случае разных эпоксидов. Далее для достижения полной конверсии диэпоксидов реакцию вели в течение 8 ч.
Полноту протекания реакции можно контролировать, используя ИК-спектроскопию. Для эпоксидов характерна полоса валентных колебаний С–О в области 910 см–1, для циклических карбонатов – полоса С=О валентных колебаний в области 1800 см–1 [9]. ИК-спектры исходных диэпоксидов и синтезированных циклических бис-карбонатов (СС) представлены на рис. 3а, 3б и рис. 4а, 4б.
Рис. 3.
ИК-спектры BDE (а), CCBDE в ДМСО (б) и PHUBDE/EDA в ДМСО (в). Значком “*” обозначено положение полос поглощения ДМСО.
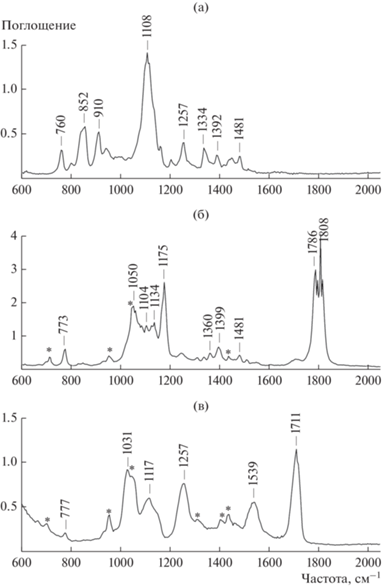
Рис. 4.
ИК-спектры BADE в ДМСО (а), CCBADE в ДМСО (б) и PHUBADE/EDA в ДМСО (в). Значком “*” обозначено положение полос поглощения ДМСО.

В спектрах диэпоксидов присутствуют полосы колебаний С–О-групп при 910 см–1 в случае BDE (спектр на рис. 3а) и 915 см–1 в случае BADE (спектр на рис. 4а). Превращение эпоксидов в циклические карбонаты сопровождается появлением интенсивных полос поглощения С=О-групп в области 1800 см–1 (спектры на рис. 3б и рис. 4б).
Реакция циклических бис-карбонатов с диаминами
Взаимодействие синтезированных циклических бис-карбонатов с диаминами для получения полигидроксиуретанов проводили в присутствии той же каталитической системы, вводя диамины в реактор на второй стадии процесса. Реагенты перемешивали при комнатной температуре в течение 4 ч. Для формирования полигидроксиуретанов с различными свойствами использовали следующие амины (схема 4 ):
Схема 4 . Амины, использованные в синтезе PHU.
Сравнение полигидроксиуретанов, синтезированных с применением EDA и HMDA, позволяет выявить влияние длины углеводородной цепи в аминах на свойства продукта, а полученных с использованием XDA – влияние наличия в цепи амина ароматических углеводородных фрагментов. Взаимодействие диаминов с циклическими бис-карбонатами приводит к формированию линейных PHU. Для синтеза сшитых полимерных структур можно применять полиамины. В настоящей работе для формирования сшитых PHU использован TAEA.
Анализ синтезированных PHU проводили с помощью методов ИК- и ЯМР-спектроскопии, ГПХ, ДСК и ТГА. Реакция циклических карбонатов с аминогруппами сопровождается смещением валентных колебаний С=О-групп из области 1800 см–1 в область 1700 см–1, что свидетельствует о формировании полигидроксиуретана [9]. ИК-спектры синтезированного PHU с применением реагентов BDE/EDA и BADE/EDA представлены на рис. 3в и 4в. Полосы валентных колебаний С=О в полигидроксиуретанах расположены в области 1711 см–1 в первом случае и 1720 см–1 во втором. ЯМР-спектры продуктов реакции также подтверждают образование полигидроксиуретанов. Описание 1Н ЯМР-спектров и двумерных спектров 1Н-13С HSQC (гетероядерная одноквантовая корреляционная спектроскопия) полигидроксиуретанов, полученных при использовании реагентов BDE/EDA и BADE/EDA, дано на рис. 5, 6.
Рис. 5.
Спектр 1Н ЯМР (а) и двумерный спектр 1Н-13С HSQC (б) полигидроксиуретана, синтезированного с использованием BDE/EDA, в ДМСО-d6. Значком “*” обозначены сигналы остаточных протонов в ДМСО.

Рис. 6.
Спектр 1Н ЯМР (а) и двумерный спектр 1Н-13С HSQC (б) полигидроксиуретана, синтезированного с использованием BADE/EDA, в ДМСО-d6. Значком “*” обозначены сигналы остаточных протонов в ДМСО.

Реакцию циклических бис-карбонатов (СС) с диаминами проводили при небольшом избытке диаминов (мольное соотношение – 1.3–1.4), в этих условиях синтеза все концевые группы в полимере содержат аминогруппы. При взаимодействии циклических бис-карбонатов с EDA образуются низкомолекулярные PHU, и в спектрах ЯМР видны сигналы концевых групп (протоны 11, 12 на рис. 5 и 6). Гидроксильные группы в полигидроксиуретане могут быть первичными и вторичными [1, 2]. Их относительное количество в синтезированных PHU можно оценить по данным ЯМР-спектроскопии. В образце PHUBDE/EDA (рис. 5) мольная доля вторичных ОН-групп составляет 0.6, в случае PHUBADE/BDA (рис. 6) она равна 0.5. Эти значения близки, и можно отметить высокое содержание как первичных, так и вторичных ОН-групп в полигидроксиуретанах.
Строение циклического бис-карбоната или диамина оказывает значительное влияние на свойства PHU [1, 2]. В табл. 1 перечислены образцы полигидроксиуретанов, синтезированных с применением различных аминов. Для их характеристики регистрировали ИК-спектры НПВО, которые представлены на рис. 7.
Таблица 1.
Влияние состава реагентов на свойства синтезированных полигидроксиуретанов
| № | Эпоксид | Амины (мольная доля TAEA) |
Mn, кг/моль |
MW/Mn | Tс, °С | Tд, °С | T5%, °С |
|---|---|---|---|---|---|---|---|
| 1 | BDE | EDA | 2.05 | 3.44 | 0.6 | 214.9 | 233.8 |
| 2 | BADE | EDA | 2.48 | 4.63 | 54.2 | 205.6 | 233.4 |
| 3 | BADE | HMDA | 22.12 | 2.35 | 57.2 | 249.5 | 278.2 |
| 4 | BADE | XDA | 12.70 | 2.10 | 52.8 | 288.3 | 316.8 |
| 5 | BADE | TAEA | – | – | 52.5 | 309.5 | 321.3 |
| 6 | BDE | TAEA | – | – | 8.5 | 206.1 | 233.5 |
| 7 | BDE | TAEA/EDA (0.31) | – | – | 0.9 | 210.1 | 234.4 |
| 8 | BDE | TAEA/HMDA (0.75) | – | – | 3.9 | 232.7 | 257.8 |
Примечание. MW и Mn – среднемассовая и среднечисленная молекулярные массы полимера соответственно; Tс – температура стеклования; Tд – начальная температура разложения по данным ТГА; T5% – температура, соответствующая потере массы 5% после начала разложения по данным ТГА. Прочерки означают, что молекулярные массы не определяли, так как образуются нерастворимые сшитые полимеры.
При использовании разных аминов положение полос в ИК-спектрах PHU меняется, хотя общий характер спектра сохраняется. Во всех случаях присутствует интенсивная полоса поглощения в области 1690–1700 см–1, относящаяся к колебаниям С=О-групп в полигидроксиуретанах, полосы колебаний ОН-групп расположены в области 3280–3320 см–1, их положение варьируется при изменении типа амина.
Молекулярные массы PHU, синтезированных с применением EDA, ниже, чем при использовании других аминов (табл. 1, № 1–4). С увеличением длины углеводородной цепи в линейных диаминах молекулярная масса возрастает почти в 10 раз (табл. 1, № 2, 3). Полученные данные можно сопоставить с литературными. Например, молекулярные массы PHU, образовавшихся в реакции CCBPDE, с 1,12-додекандиамином в присутствии различных солей металлов при 70°C, 6 ч, изменялись в диапазоне от 14 до 37 кг/моль [10]. Авторы этой работы связывают изменение значений молекулярных масс при применении разных солей с варьированием электрофильности активированного циклического карбоната, что сопровождается изменением скоростей внедрения диамина. Однако наблюдаемый нами эффект влияния природы амина на молекулярные массы PHU сложно объяснить на данном этапе исследований, для этого необходимо проведение серии дополнительных экспериментов.
Для выявления зависимости свойств PHU от природы диэпоксида и диамина были изучены термические характеристики синтезированных полимеров. Все полигидроксиуретаны, полученные с применением BADE, характеризуются более высокой температурой стеклования, чем образовавшиеся при использовании диэпоксида BDE (табл. 1, № 1–4). Для ряда PHU, синтезированных с одним и тем же диэпоксидом BADE, но с разными диаминами, не наблюдалось больших изменений в значениях температуры стеклования, которая варьировалась в диапазоне 53–57°С (табл. 1, № 2–4). С другой стороны, применение диэпоксида BDE позволяет получать полигидроксиуретаны с температурами стеклования ниже 10°С (табл. 1, № 1, 6–8).
При взаимодействии циклических бис-карбонатов с диаминами были синтезированы линейные PHU. Использование полиаминов дает возможность создавать сшитые полимерные материалы [11]. В настоящей работе для формирования сшитых PHU применяли TAEA (схема 5 ).
Схема 5 . Формирование сшитых структур PHU при взаимодействии циклических бис-карбонатов с TAEA.
Полигидроксиуретаны, синтезированные с использованием TAEA, набухали в среде ДМСО, но не растворялись. Термические характеристики этих образцов определялись в основном типом диэпоксида. Как температура стеклования, так и температура термораспада выше в случае PHUBADE, чем PHUBDE (табл. 1, № 5, 6). Для сшитого PHU, сформированного с применением TAEA, температура начала термораспада высока и составляет 309.5°С (табл. 1, № 5). Она выше, чем для образцов линейных PHU (табл. 1, № 2–4), термораспад которых начинается в диапазоне 205–288°С и зависит от типа диамина. Таким образом, сшитые PHU, полученные с использованием TAEA, характеризуются высокой термостойкостью. Количество сшивок в полимере можно изменять путем сочетания TAEA с линейными диаминами. Термические характеристики образцов, образовавшихся при применении смесей диаминов TAEA/EDA и TAEA/HMDA, представлены в табл. 1, № 7, 8. Температура стеклования этих PHU несколько выше, чем для полимера, синтезированного с использованием только диамина EDA (табл. 1, № 1), но ниже, чем в случае только триамина TAEA (табл. 1, № 6). Промежуточные значения температуры термораспада и стеклования образцов были получены при сочетании TAEA/EDA и TAEA/HMDA (табл. 1, № 7, 8). Таким образом, свойства полигидроксиуретанов можно изменять в довольно широком диапазоне, применяя диэпоксиды или амины различного строения и состава.
ЗАКЛЮЧЕНИЕ
Реакция диоксида углерода с диэпоксидами эффективно протекает при температурах 70–90°С, давлении СО2 0.9 МПа в присутствии каталитической системы salenCrCl/PPNCl. Изучение кинетики поглощения СО2 в ходе реакции позволило выявить оптимальные условия синтеза циклических бис-карбонатов, полная конверсия диэпоксидов достигается за 8 ч проведения процесса. Скорость реакции на начальном участке процесса определяется строением диэпоксида, она выше при использовании BADE. Превращение диэпоксидов в циклические бис-карбонаты сопровождается появлением интенсивных полос поглощения С=О-групп в ИК-спектрах продуктов в области 1800 см–1.
Реакция синтезированных циклических бис-карбонатов с диаминами в присутствии той же каталитической системы приводит к формированию полигидроксиуретанов в мягких условиях: при комнатной температуре за 4 ч. Полноту превращения циклических бис-карбонатов контролировали по ИК-спектрам продуктов. В образцах синтезированных полигидроксиуретанов наблюдалась полоса поглощения С=О-групп в полимерной цепи в области 1700 см–1. ЯМР-спектры PHU подтверждают предполагаемое строение продуктов и свидетельствуют о наличии в полимере первичных и вторичных ОН-групп, соотношение которых варьируется при изменении строения эпоксида.
Проведен синтез полигидроксиуретанов с использованием ряда аминов с целью выяснения влияния строения эпоксидов или аминов на свойства PHU. Молекулярные массы PHU в значительной степени зависят от природы амина. Термические характеристики полигидроксиуретанов определяются в основном строением диэпоксида. При применении BDE получены образцы с низкой температурой стеклования, с диэпоксидом BADE были синтезированы термостойкие PHU с температурами стеклования в диапазоне 53–57°С, начало термораспада наблюдалось при 206–310°С. Использование триамина TAEA позволяет синтезировать сшитые PHU, характеризующиеся наибольшей термостойкостью. Количество сшивок в полимерной структуре и термические характеристики образцов регулируются путем изменения состава применяемых аминов.
Список литературы
Ecochard Y., Caillol S. // Eur. Pol. J. 2020. V. 137. P. 109915.
Maisonneuve L., Lamarzelle O., Rix E., Grau E., Cramail H. // Chem. Rev. 2015. V. 115. P. 12407.
Lambeth R. // Polym. Int. 2020. https://doi.org/10.1002/pi.6078
Decortes A., Castilla A.M., Kleij A.W. // Angew. Chem. Int. Ed. 2010. V. 49. P. 9822.
Rintjema J., Pena Carrodeguas L., Laserna V., Sopena S., Kleij A.W. // Top. Organomet. Chem. 2016. V. 53. P. 39.
Camara F., Benyahya S., Besse V., Boutevin G., Auvergne R., Boutevin B., Caillol S. // Eur. Pol. J. 2014. V. 55. P. 17.
Asemani H., Zareanshahraki F., Mannari V. // J. Appl. Polym. Sci. 2019. App. 47266. https://doi.org/10.1002/app.47266
Paddock R.L., Nguyen S.T. // J. Am. Chem. Soc. 2001. V. 123. P. 11498.
Asemani H.R., Mannari V. // Prog. Org. Coat. 2019. V. 131. P. 247.
Ochiai B., Inoue S., Endo T. // J. Polym. Sci. Part A: Polym. Chem. 2005. V. 43. P. 6282.
Bizet B., Grau E., Cramail H., Asua J.M. // Polym. Chem. 2020. V. 11. P. 3786.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ