Кинетика и катализ, 2022, T. 63, № 5, стр. 552-558
Кинетическое обоснование низкой активности катализаторов на основе изопропанольных сольватов хлорида гадолиния в полимеризации изопрена
Д. В. Стяжкин a, *, Н. В. Плотникова a, В. М. Янборисов b, Е. М. Захарова a, В. З. Мингалеев a, С. В. Колесов a, В. П. Захаров a
a Уфимский институт химии УФИЦ РАН
450054 Уфа, просп. Октября, 71, Россия
b ФГБОУ ВО Башкирский государственный университет
450076 Уфа, ул. Заки Валиди, 32, Россия
* E-mail: styazhkin.dv@yandex.ru
Поступила в редакцию 01.02.2022
После доработки 01.04.2022
Принята к публикации 16.04.2022
- EDN: HEOGEB
- DOI: 10.31857/S0453881122050136
Аннотация
Исследована кинетика полимеризации изопрена под действием катализатора на основе изопропанольного сольвата хлорида гадолиния и триизобутилалюминия (ТИБА). Показано, что катализатор менее активен в полимеризации изопрена по сравнению с неодимовым, приготовленным таким же способом, а кинетические кривые выхода полиизопрена имеют s-образный вид. Обнаружено, что низкая активность каталитических систем на основе изопропанольного сольвата хлорида гадолиния обусловлена чрезвычайно низкой константой скорости внедрения первой молекулы мономера. Решена обратная задача определения кинетических параметров элементарных стадий; определены константы скоростей реакций инициирования и роста цепей, а также начальная концентрация предреакционных центров. Продемонстрировано совпадение модельных кривых с экспериментальными конверсионными зависимостями с высоким коэффициентом корреляции.
ВВЕДЕНИЕ
В настоящее время полимеризация диенов под действием лантанидных каталитических систем типа Циглера–Натта находит применение как способ получения полимеров, характеризующихся высокой стереорегулярностью, хорошими молекулярно-массовыми и физико-химическими характеристиками. Практическое использование среди лантанидных систем нашли катализаторы на основе соединений неодима, в частности, сольватных комплексов хлорида неодима [1, 2]. В полимеризации изопрена (ИП) на неодимовых каталитических системах быстро достигается 100% конверсии мономера. Синтезированный полимер характеризуется содержанием цис-звеньев до 97–98.5% [3]. Уровень требований к полидиенам и материалам на их основе постоянно растет, в связи с чем проблема разработки технологичных катализаторов для полимеризации диенов остается актуальной. Применение каталитических систем на основе соединений гадолиния является перспективным направлением в получении полимеров, характеризующихся более высокими значениями 1,4-цис-стереорегулярности по сравнению с полимерами, образующимися под действием катализаторов на основе соединений неодима [4–8]. Однако в литературе часто отмечается, что в сравнении с неодимовыми системами гадолиниевые системы имеют низкую активность [9, 10]. Повышение активности лантанидных каталитических систем, в том числе и гадолиниевых, достигается использованием известного для циглеровских систем приема – приготовления катализатора в присутствии диенового мономера, преимущественно пиперилена [11, 12]. Однако это не дает ответа о причинах низкой каталитической активности гадолиниевых каталитических систем самих по себе. Представляется, что исследование кинетических закономерностей полимеризации ИП в присутствии каталитических систем на основе изопропанольного сольвата хлорида гадолиния, приготовленного в отсутствие мономера, с этой точки зрения будет весьма полезно, что и составило цель настоящей работы. В качестве основного подхода использован метод математического моделирования кинетики процесса полимеризации, который, как показано в [13–16], оказался исключительно плодотворным в развитии доказательной базы сложных механизмов каталитической полимеризации. В представленной работе нами предложено кинетическое обоснование низкой активности катализатора на основе сольвата хлорида гадолиния в полимеризации изопрена.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все процедуры проводили в атмосфере аргона. Растворитель для катализатора и полимеризации (толуол) очищали кипячением над металлическим натрием с последующей перегонкой в присутствии триизобутилалюминия (ТИБА). Изопрен очищали перегонкой в присутствии ТИБА, затем – в присутствии небольших количеств гадолиниевого катализатора. Растворитель и мономер хранили в сосудах Шленка. Изопропиловый спирт абсолютизировали с последующей перегонкой. Хлорид гадолиния синтезировали путем кипячения оксида гадолиния в насыщенном HCl изопропиловом спирте. Полученный гексагидрат сушили согласно методике [17]. Содержание воды в осушенном хлориде гадолиния GdCl3⋅yH2O, определенное методом термогравиметрического анализа (ТГА) на приборе TG 209 F1 (“NETZSCH”, Германия), составляло y = 0.8–1.2.
Приготовление сольватного комплекса GdCl3· ·n(i-С3Н7ОН)·yH2O осуществляли аналогично методике синтеза сольватного комплекса хлорида неодима [17]: в колбу, снабженную магнитной мешалкой, загружали расчетное количество осушенного хлорида гадолиния и жидкого парафина. Изопропиловый спирт прикапывали в течение 30 мин к образовавшейся суспензии GdCl3 в парафине. Время перемешивания составляло 24 ч. Полученный продукт представляет собой суспензию с размером частиц порядка 112–170 нм. Размер частиц определен методом лазерного светорассеяния на приборе SALD-7101 (“SHIMADZU”, Япония). Анализ вошедшего в сольватный комплекс изопропилового спирта и лантаноида проводили методами трилонометрического и иодометрического титрования. Степень вхождения спирта за 24 ч составила n = 1.65–1.7.
Приготовление катализатора GdCl3 · n(i-С3Н7ОН) · ⋅ yH2O–ТИБА проводили путем загрузки в колбу, снабженную магнитной мешалкой и подвергнутую процедуре тренировки на вакуумной установке, расчетных количеств растворителя (толуол), ТИБА и сольватного комплекса. Катализатор выдерживали 1 ч при температуре –20°С, далее – 24 ч при комнатной температуре. При этом согласно общеизвестным литературным данным протекают реакции гидролиза ТИБА, содержащейся в сольвате водой, алкоголиза ТИБА координированным изопропанолом и реакции взаимодействия ТИБА с сольватным комплексом хлорида Gd с образованием связи углерод–лантаноид, что обеспечивает снижение положительного заряда на ионе лантаноида и увеличение степени ковалентности связи галоген–лантаноид вследствие электронодонорных свойств лиганда [18]:
В ампулы, снабженные резиновой крышкой, накидной гайкой и мешалкой, вводили при помощи шприцев расчетные количества раствора ИП в толуоле и катализатора. С момента введения катализатора начинали отсчет времени полимеризации. С целью определения конверсии осуществляли отбор проб полимера последовательно в ходе полимеризации. Остановку полимеризации в отобранных пробах проводили путем ввода в реакционную массу метанола, содержащего 0.1% ионола и 0.1% соляной кислоты. Выпавший полимер несколько раз промывали метанолом. Выход полимера находили гравиметрическим методом. Образцы сушили в вакууме при комнатной температуре до постоянной массы, после чего взвешивали с точностью до 1 × 10–4 г.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кинетика полимеризации ИП под влиянием ряда двухкомпонентных каталитических систем на основе соединения неодима и алюминийорганического соединения (АОС) подчиняется ряду общих закономерностей, которые в основном аналогичны закономерностям полимеризации этого мономера под действием хорошо изученных каталитических систем ионно-координационной полимеризации, например, цис-регулирующей титановой системы TiCl4‒АОС (Al(i-C4H9)3‒ТИБА). Когда титановые каталитические системы приготовлены смешением компонентов каталитического комплекса отдельно от мономера с последующей экспозицией в течение времени, необходимого для формирования активных центров (АЦ) роста цепей, полимеризация изопрена начинается сразу при введении катализаторов в раствор мономера, характеризуется высокой начальной скоростью и общим видом конверсионной кривой расходования мономера по кинетическому закону первого порядка [9]. Типичного вида конверсионные кривые представлены в работе [19]. Это общепризнано за свидетельство очень быстрой стадии инициирования роста цепей, не лимитирующей общую скорость процесса. Как следствие в кинетических описаниях и кинетическом моделировании [20, 21] стадия инициирования не учитывается. Уравнение скорости полимеризации (Wп) записывается как:
где Wр – скорость роста цепи, [M] – концентрация мономера, [а] – концентрация активных центров.Согласно данным ряда публикаций [21‒24] возможность описания кинетики ионно-координационной полимеризации диенов уравнением (1) сохраняется и в отношении лантанидных каталитических систем полимеризации диенов. В частности, по данным [22] для систем Nd(C17H35COO3)2‒ТИБА, NdCl3 · 3ТБФ‒ТИБА (где ТБФ – ((C4H9)3)P=O) [23], NdCl3 · ⋅ 3(С8H18O)‒Al(C2H5)3 [22] и NdCl3·n(i-С3Н7ОН)‒ТИБА [25], приготовленных in situ или отдельно от мономера, кривые полимеризации ИП отвечают кинетике с быстрым инициированием (рис. 1a, 1б).
Рис. 1.
Конверсионные кривые полимеризации изопрена на неодимовых каталитических системах: а ‒ Nd(C17H35COO3)2‒Al(i-C4H9)3‒Al(C2H5)2Cl по данным работы [22]; б ‒ NdCl3·3((C4H9)3)P=O)‒Al(i-C4H9)3 по данным работы [23]; NdCl3·3(С8H18O)‒Al(C2H5)3 по данным работы [24]; NdCl3·3(i-C3H7OH)‒Al(i-C4H9)3 по данным работы [25]. Условия полимеризации: а ‒ соотношение Al/Nd = 20, [M]0 = 1.15 М, [NdX3] = 7.5 × 10‒4 М, толуол, 50°С, время выдержки катализатора без мономера при Ткомн ‒ 1‒2 ч (1), 2‒20 ч (2); б ‒ соотношение Al/Nd = 30, [M]0 = = 1.5 М, [NdX3] = 5.5 × 10‒6 моль/г мономера, гексан, 30°С, приготовление катализатора in situ (1); соотношение = Al/Nd = 20, [M]0 = 1.5 моль/л, [NdX3] = 10-4 моль/л, время выдержки катализатора без мономера ‒ 1 ч (2); [M]0 = = 0.8 моль/л, [NdX3] = 0.8 × 10–4 моль/л, 70°С, время выдержки катализатора ‒ 24 ч (3).
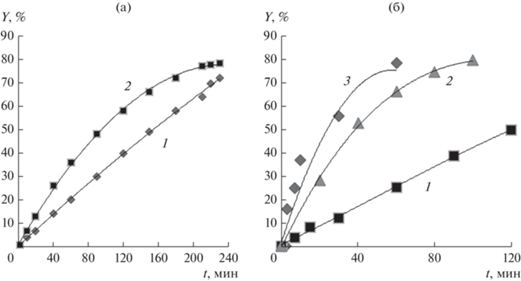
В тоже время в экспериментах, в которых каталитическая система TiCl4‒ТИБА готовится in situ в среде мономера, кинетические кривые полимеризации имеют s-образный вид с низкой начальной скоростью (рис. 2), не характерный для стереоспецифической полимеризации диенов на циглеровских катализаторах, предварительно приготовленных и выдержанных в течение определенного времени, необходимого для формирования ионно-координационных центров полимеризации [9, 26]. При разграничении процессов формирования потенциальных активных центров (ПЦ) титанового катализатора отдельно от мономера и взаимодействия с мономером в процессе полимеризации s-образная кривая вырождается в характерную для случая быстрого инициирования.
Рис. 2.
Конверсионные кривые полимеризации бутадиена в присутствии TiCl4‒ТИБА по данным работы [26]: приготовление катализатора in situ в среде мономера (1); приготовление катализатора отдельно от мономера и выдержка при 0°С в течение 30 мин (2). Условия эксперимента: Al/Ti = 1.4; [M]0 = 1.5 М; [Ti] = 10‒2 M; толуол; 25°С.

Оценка кинетических закономерностей полимеризации ИП в присутствии каталитической системы GdCl3·n(i-С3Н7ОН)–ТИБА, приготовленной аналогично неодимовой системе, демонстрирует более низкую начальную скорость полимеризации и иной, s-образный вид кинетических кривых (рис. 3). Начальная скорость полимеризации мала и на начальном участке постепенно возрастает. При повышении мольной концентрации сольвата GdCl3 или соотношения Al/Gd этот показатель увеличивается, однако общий вид кинетических зависимостей сохраняется. Если полагать по аналогии с титановыми и неодимовыми системами, что за время выдержки каталитического комплекса ПЦ полностью сформировались, низкую начальную скорость полимеризации и нестационарный участок кинетической кривой можно связать с низкой скоростью инициирования, т.е. внедрения первой молекулы мономера.
Рис. 3.
Конверсионные кривые полимеризации изопрена на гадолиниевом катализаторе GdCl3·n(i-С3Н7ОН)–ТИБА. Номера кривых и условия полимеризации соответствуют номерам образцов в табл. 1, точки ‒ экспериментальные значения, линии ‒ аппроксимация зависимости решением системы ДУ.

S-образный вид кинетических кривых не позволяет определить кинетические параметры по стандартному уравнению (1), в котором концентрация АЦ постоянна. Поэтому приняли, что в начальный момент полимеризации все предреакционные центры уже сформированы в процессе предшествующего приготовления каталитической системы в некоторой неизвестной концентрации [x]0. В реакции инициирования (присоединения молекул мономера к ПЦ) появляются АЦ (растущие живые цепи), концентрация которых постепенно увеличивается в течение полимеризации, а при возможной передаче цепи на мономер и сокатализатор образуются мертвые цепи:
Соответствующая система дифференциальных уравнений (ДУ) выглядит следующим образом:
Систему ДУ решали численно по оригинальному алгоритму, описанному в [27], конверсию мономера рассчитывали по формуле:
где [M] – текущая концентрация мономера, полученная при численном решении системы ДУ.Обратную задачу определения кинетических параметров элементарных стадий решили для случаев полимеризации изопрена в присутствии гадолиниевых катализаторов, приготовленных одинаковым способом, при варьировании соотношения Al/Gd и концентрации катализатора в полимеризационной системе. Константы скоростей реакций инициирования и роста цепей, а также начальную концентрацию ПЦ находили следующим образом.
Во-первых, провели аппроксимацию экспериментальных зависимостей конверсии изопрена от времени полимеризации непосредственно численным решением системы ДУ. Методами Ньютона–Гаусса и случайного спуска решили обратную задачу в моноцентровом приближении с полной оптимизацией параметров (варьированием всех параметров) kи, kp, [x]0 для 7-ми кривых U(t) (рис. 3, табл. 1). При аппроксимации получены очень высокие значения коэффициента корреляции R, а также небольшие значения среднеквадратического отклонения S экспериментальных точек от расчетных (табл. 1), не превышающие погрешность экспериментального определения конверсии, что свидетельствует об адекватности модели.
Таблица 1.
Кинетические параметры полимеризации ИП в присутствии гадолиниевой каталитической системы*
| № | [Gd]0, моль/л | [АОС]0, моль/л | Аl/Gd | kp, M ̶ 1 мин‒1 |
kи × 104, M‒1 мин‒1 |
[x]0 × 105, М | S | R |
|---|---|---|---|---|---|---|---|---|
| 1** | 0.005 | 0.06 | 12 | 66 429 | 2.94 | 0.65 | 3.52 | 0.9961 |
| 2 | 0.005 | 0.10 | 20 | 66 384 | 2.98 | 0.93 | 6.42 | 0.9847 |
| 3 | 0.005 | 0.10 | 20 | 49 880 | 6.62 | 2.08 | 1.34 | 0.9997 |
| 4 | 0.010 | 0.12 | 12 | 50 344 | 1.17 | 4.46 | 4.50 | 0.9968 |
| 5 | 0.010 | 0.12 | 12 | 74 538 | 2.37 | 4.46 | 2.86 | 0.9976 |
| 6 | 0.010 | 0.20 | 20 | 46 383 | 5.36 | 8.16 | 1.09 | 0.9999 |
| 7 | 0.010 | 0.20 | 20 | 37 084 | 1.01 | 4.19 | 1.40 | 0.9995 |
| Среднее значение | 56 000 | 4.5 | – | 3.02 | 0.9963 | |||
| Стандартное отклонение | 13 400 | 3.1 | – | 1.97 | 0.0053 | |||
| Стандартное отклонение, % | 24 | 68 | – | 65 | 0.5 | |||
Обращает на себя внимание тот факт, что на рис. 3 в порядке следования конверсионных кривых в направлении увеличения скорости полимеризации прослеживается зависимость не от мольного соотношения Al/Gd, а от содержания АОС в каталитической системе. В [28] отмечается, что в продукте алкилирования хлорида гадолиния стабильность связи Gd–C поддерживается избытком свободного ТИБА, необходимым для стабилизации активного центра, и максимальная активность катализатора проявляется при большом содержании АОС.
Отличное совпадение модельных конверсионных кривых с экспериментальными данными с высоким коэффициентом корреляции позволяет с хорошей долей вероятности предположить, что моноцентрового приближения для описания кинетики полимеризации ИП в присутствии гадолиниевой каталитической системы достаточно.
Определенные при полной оптимизации константы скоростей реакций оказались довольно близки: стандартное отклонение усреднения составило 24% для kp и 68% для kи (табл. 1). Затем усреднили значения kp и kи. Далее с использованием средних значений констант скоростей реакций kp = 56000 M‒1 мин‒1 и kи = 4.5 × 10‒4 M‒1 мин‒1 провели аппроксимацию с частичной оптимизацией, варьируя только значения x0 (табл. 1). Частичная оптимизация незначительно ухудшила коэффициенты корреляции (в среднем с 0.9963 до 0.9961) и среднеквадратическое отклонение (в среднем с 3.02 до 3.09).
Данные табл. 1 позволяют выделить особенности гадолиниевой каталитической системы полимеризации ИП в сравнении с аналогичной неодимовой системой. Во-первых, среднее содержание ПЦ [x]0 ≈ 3.5 × 10‒5 М в гадолиниевой каталитической системе оказывается сопоставимым с содержанием АЦ в аналогичной неодимовой каталитической системе полимеризации бутадиена [a] ≈ 3.4 × 10‒5 М [27]. Во-вторых, константа скорости роста цепи в случае гадолиниевой системы kp = 5.6 × 104 M‒1 мин‒1 на порядок выше величины константы для неодимовой системы kp = 1.5 × 103 M‒1 мин‒1 [29]. В третьих, если для неодимовой каталитической системы полагают, что kи $ \gg $ kp, то для гадолиниевой системы kи практически на 9 порядков величины меньше kp. Обратим внимание, что начальная концентрация ПЦ в гадолиниевой каталитической системе гораздо ниже содержания GdCl3 в составе катализатора, что характерно для каталитических систем ионно-координационной полимеризации.
ЗАКЛЮЧЕНИЕ
Таким образом, по результатам экспериментального исследования и кинетического моделирования полученных зависимостей конверсии ИП можно заключить, что низкая активность каталитических систем ионно-координационной полимеризации на основе изопропанольного сольвата GdCl3·n(i-C3H7OH)–ТИБА обусловлена чрезвычайно низкой константой скорости внедрения первой молекулы мономера, т.е. образования активных центров роста цепи. При этом хорошее соответствие экспериментальной и расчетной кинетики полимеризации достигается в моноцентровом приближении.
Список литературы
Захаров В.П., Мингалеев В.З., Берлин А.А., Насыров И.Ш., Жаворонков Д.А., Захарова Е.М. // Хим. физика. 2015. Т. 34. № 3. С. 69.
Мингалеев В.З., Захаров В.П., Морозов Ю.В., Насыров И.Ш., Берлин А.А. Способ получения сольвата хлорида неодима с изопропиловым спиртом для неодимового катализатора полимеризации изопрена. Пат. РФ № 2526981, 2012.
Улитин Н.В., Широких Е.Б., Терещенко К.А., Перухин Ю.В., Захаров В.П. // Вестник Казанского технологического университета. 2014. Т. 17. № 18. С. 137.
Kobayashi E., Shouzaki J., Aoshima D., Furukawa J. // Kobunshi Ronbunshu. 1992. V. 49. № 6. P. 535.
Kobayashi E., Kaita S., Aoshima S., Furukawa J. // J. Polym. Sci., Part A: Polym. Chem. 1995. V. 33. P. 2175.
Kobayashi E., Kaita S., Aoshima S., Furukawa J. // J. Polym. Sci., Part A: Polym. Chem. 1998. V. 36. P. 2283.
Jia T., Xu S., Huang L., Gao W. // Polyhedron. 2018. V. 145. № 1. P. 182.
Стяжкин Д.В., Колесов С.В. // Вестник Башкирского университета. 2020. Т. 25. № 4. С. 737.
Монаков Ю.Б., Толстиков Г.А. Каталитическая полимеризация 1,3-диенов. Москва: Наука, 1990. 211 с.
Lv K., Cui D. // Organometallics. 2008. V. 27. № 21. P. 5438.
Насыров И.Ш., Жаворонков Д.А., Фаизова В.Ю., Шурупов О.К., Васильев В.А., Левковская Е.И. Способ получения каталитического комплекса и цис-1,4-полиизопрен, полученный с использованием этого катализатора. Пат. РФ № 2668977, 2018.
Левковская Е.И., Новикова Е.С., Сендерская Е.Е., Чернявский Г.Г., Пассова С.С. Способ получения катализатора полимеризации изопрена. Пат. РФ № 2684280, 2019.
Улитин Н.В., Терещенко К.А. // Кинетика и катализ. 2016. Т. 57. № 2. С. 176.
Улитин Н.В., Терещенко К.А. // Кинетика и катализ. 2016. Т. 57. № 2. С. 183.
Улитин Н.В., Терещенко К.А., Фризен А.К., Буракова А.О., Колесов С.В., Шиян Д.А., Темникова Н.Е. // Кинетика и катализ. 2017. Т. 58. № 2. С. 133.
Улитин Н.В., Терещенко К.А., Темникова Н.Е., Шиян Д.А., Колесов С.В. // Кинетика и катализ. 2018. Т. 59. № 3. С. 271.
Жаворонков Д.А., Морозов Ю.В., Насыров И.Ш., Петрунина А.В., Фаизова В.Ю., Хайруллин И.И. Способ получения спиртового сольвата хлорида неодима. Пат. РФ № 2468995, 2012.
Yang J., Hu J., Pan S., Xie D., Zhong C., Ouyang J. // Sci. Sin. 1980. V. 23. P. 734.
Минскер К.С., Захаров В.П., Берлин Ал. Ал., Монаков Ю.Б. // Вестник Башкирского Университета. Т. 9. № 2. 2004. С. 8.
Зак А.В., Перлин Б.А., Брейтман В.М., Гурари В.Э., Лавров В.А., Подвальный С.Л. // Журн. прикл. химии. 1975. Т. 48. № 8. С. 1878.
Максютова Э.Р., Усманов Т.С., Спивак С.И., Саитова Ф.Ф., Монаков Ю.Б. // Обозрение прикладной и промышленной математики. 2001. Т. 8. № 2. С. 642.
Монаков Ю.Б., Биешев Я.Х., Берг А.А. // Докл. Акад. Наук. 1977. Т. 25. № 5. С. 1125.
Iovu H., Hubca G., Simonescu E., Badea E.G., Dimonie M. // Die Angew. Macromol. Chem. 1997. V. 249. P. 59.
Ren C., Li G., Dong W., Jiang L., Zhang X., Wang F. // Polymer. 2007. V. 48. № 9. P. 2470.
Ахметов И.Г., Вагизов А.М. // Вестник Казанского технологического университета. 2011. Т. 19. С. 12.
Мингалеев В.З., Захаров В.П., Янборисов В.М., Глухов Е.А., Монаков Ю.Б. // Журн. прикл. химии. 2008. Т. 81. № 9. С. 1537.
Янборисов Э.В., Янборисов В.М., Спивак С.И. // Мат. моделирование. 2010. Т. 22. № 3. С. 15.
Левковская Е.И., Бубнова С.В., Найден С.В., Меньшиков И.Н., Васильев В.А. // Молодой ученый. 2015. № 13(2). С. 67.
Захаров В.П., Мингалеев В.З., Морозов Ю.В., Насыров И.Ш., Захарова Е.М. // Журн. прикл. химии. 2012. Т. 85. № 6. С. 965.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ



