Кинетика и катализ, 2023, T. 64, № 2, стр. 173-180
Кинетические закономерности окисления тетрагидрофурана, инициированного 2,2'-азо-бис-изобутиронитрилом
Л. Р. Якупова a, *, Р. А. Насибуллина a, Р. Л. Сафиуллин a
a Уфимский Институт химии – обособленное структурное подразделение ФГБУН УФИЦ РАН
450054 Уфа, просп. Октября, 69, Республика Башкортостан, Россия
* E-mail: stargar@inbox.ru
Поступила в редакцию 07.10.2022
После доработки 09.11.2022
Принята к публикации 16.11.2022
- EDN: GNVPHO
- DOI: 10.31857/S0453881123020107
Аннотация
В интервале температур 303–323 K изучены кинетические закономерности окисления тетрагидрофурана, инициированного 2,2'-азо-бис-изобутиронитрилом. За скоростью процесса следили по поглощению кислорода. Показано, что скорость окисления тетрагидрофурана линейно зависит от его концентрации и пропорциональна корню квадратному из концентрации инициатора. Найдены параметр окисляемости тетрагидрофурана и константа скорости инициирования окисления тетрагидрофурана 2,2'-азо-бис-изобутиронитрилом: lg(k2(2k6)–0.5) = 4.3 – 44.1/θ [л0.5 моль–0.5 с–0.5], lg ki = = 13.9 − 120.4/θ [с–1], (где θ = 2.303 × 10–3RT Дж/моль). Константа скорости (k7) реакции пероксильного радикала тетрагидрофурана с α-токоферолом при температуре 303 К составляет (4.0 ± 1.1) × 105 л моль–1 с–1.
ВВЕДЕНИЕ
Антиоксиданты делятся на два больших класса в зависимости от того, растворимы ли они в воде (гидрофильные) или в липидах (липофильные). Природные антиоксиданты в больших количествах содержатся в свежих овощах, ягодах, фруктах, растениях и многие из них являются водорастворимыми. Для измерения константы скорости реакции алкилпероксильных радикалов с такими соединениями трудно применять хорошо зарекомендовавший себя метод, основанный на радикально-цепном окислении гидрофобных углеводородов. Использование спиртов в роли модельного субстрата затрудняется тем, что радикально-цепное окисление в них поддерживается пероксильным и гидропероксильным радикалами, соотношение которых с глубиной процесса меняется [1]. Один из способов количественной оценки антиоксидантной активности водорастворимых ингибиторов основан на модельной реакции радикально-цепного окисления 1,4-диоксана. В этом случае субстрат выполняет роль растворителя и источника пероксильных радикалов, что позволило исследовать широкий круг соединений [2–6]. Тестирование соединений также проводилось в водном растворе 1,4-диоксана [7]. Но у этого метода имеется один недостаток – короткие цепи окисления, в следствие чего его нельзя применять при физиологической температуре (36°C). Родственный 1,4-диоксану циклический эфир ТГФ как окисляемый субстрат подвергается быстрому окислению в присутствии воздуха, смешивается с водой в любом соотношении, легко очищается путем перегонки при 339 К. Окисление ТГФ было впервые проведено Говардом и Ингольдом в 1969 г. [8]. При [ТГФ] = 9.8 моль/л, wi = (1.38–20.0) × × 10–8 моль л–1с–1 и температуре 303 К были измерены константа скорости продолжения цепи (k2) и константа скорости обрыва цепи (k6). Авторами этого исследования установлено, что, несмотря на относительно высокую скорость окисления ТГФ, накапливающийся гидропероксид не влияет на кинетику процесса. Модельная система, основанная на окислении данного субстрата в водном растворе, была применена для измерения константы скорости реакции пероксильного радикала с водорастворимыми антиоксидантами при температуре 303 К [9]. В настоящей работе в интервале 303–323 К измерен параметр окисляемости тетрагидрофурана (k2(2k6)–0.5 л0.5моль–0.5с–0.5), а также константа скорости реакции пероксильных радикалов ТГФ с α-токоферолом при 303 К.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тетрагидрофуран (ТГФ) перегоняли над гидроксидом калия в атмосфере аргона. Хранили под аргоном при пониженной температуре не более трех дней. Для 2,2'-азо-бис-изобутиронитрила (АИБН) фирмы “Реахим” и хлорбензола (ХБ) использовали традиционный метод очистки [10]. Окисление тетрагидрофурана кислородом воздуха осуществляли при температуре 303–323 К. Кинетические опыты проводили в стеклянном реакторе, в который загружали тетрагидрофуран, перемешивали, насыщая кислородом воздуха, и затем добавляли раствор инициатора в хлорбензоле. В опытах с ингибитором α-токоферол в растворе хлорбензола вносили через ~10 мин после начала реакции. За поглощением кислорода следили с помощью универсальной манометрической дифференциальной установки [11]. Скорость поглощения кислорода в жидкой фазе находили по методике, описанной в работе [12]. Объем газовой фазы составлял 33 мл, объем реакционной смеси – 3.2 мл. Концентрацию кислорода в жидкой фазе вычисляли с учетом коэффициента Генри для 1,4-диоксана (6.28 × 10–3 моль л–1 атм–1 [13]).
В качестве инициатора окисления использовали 2,2'-азо-бис-изобутиронитрил (АИБН). Скорость инициирования (wi) рассчитывали исходя из значения длины индукционного периода, наблюдаемого на кинетической зависимости поглощения кислорода, по уравнению:
здесь f = 2, что соответствует гибели двух пероксильных радикалов на молекуле α-токоферола, [InH] – концентрация α-токоферола.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Радикально-цепное окисление углеводородов протекает по схеме [14]:
(i)
${\text{АИБН}}\xrightarrow{{{{k}_{{\mathbf{i}}}}}}{{{\text{r}}}^{ \bullet }}\xrightarrow{{{\text{RH}}}}{{{\text{R}}}^{ \bullet }},$(I)
${{{\text{R}}}^{ \bullet }} + {{{\text{O}}}_{2}}\xrightarrow{{{{k}_{1}}}}{\text{RO}}_{2}^{ \bullet },$(II)
${\text{RO}}_{2}^{ \bullet }{\text{ + RH}}\xrightarrow{{{{k}_{2}}}}{\text{ROOH + }}{{{\text{R}}}^{\centerdot }},$(VI)
${\text{RO}}_{2}^{ \bullet }{\text{ + RO}}_{2}^{ \bullet }\xrightarrow{{{{k}_{6}}}}{{{\text{P}}}_{6}}.$Схема 1 . Механизм жидкофазного радикально-цепного окисления углеводородов.
Согласно схеме 1 скорость окисления углеводородов должна подчиняться уравнению:
(1)
$w = {\text{d}}[{{{\text{O}}}_{2}}]{\text{/d}}t = {{k}_{2}}{{(2{{k}_{6}})}^{{ - 0.5}}}[{\text{RH}}]{{\left( {{{k}_{i}}\left[ {{\text{АИБН}}} \right]} \right)}^{{0.5}}},$На рис. 1 представлены типичные кинетические зависимости поглощения кислорода в ходе окисления ТГФ, по тангенсу угла наклона которых находили скорость окисления (w = d[O2]/dt). Для того чтобы найти оптимальные условия для проведения радикально-цепного окисления ТГФ, было изучено, как влияет концентрация инициатора на скорость окисления тетрагидрофурана. На рис. 2 показано, что зависимость w от корня квадратного из концентрации инициатора при температуре 309 К имеет линейный характер. Такая же закономерность наблюдалась и при Т = 303 и 323 К (табл. 1). Следовательно, одно из требуемых условий уравнения (1) выполняется.
Рис. 1.
Типичные кинетические зависимости поглощения кислорода в ходе окисления ТГФ. Условия реакции: 309 К, [АИБН] = 4.9 × 10–2 моль/л, [ТГФ] = 10.3 (1), 6.1 (2), 2.8 моль/л (3).
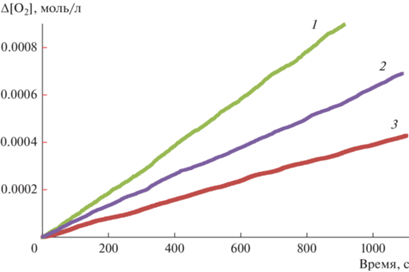
Рис. 2.
Зависимость начальной скорости окисления ТГФ от концентрации инициатора. Условия реакции: [ТГФ] = = 6.1 моль/л, 309 К.

Таблица 1.
Зависимость скорости окисления ТГФ от его концентрации, от концентрации АИБН, температуры и зависимость длительности индукционного периода от концентрации α-токоферола
| [ТГФ], моль/л |
[АИБН] × 10–2, моль/л | w × 10–7, моль л–1с–1 |
[InH] × 10–6, моль/л | τ, c | wi × 10–8 *, моль л–1с–1 |
|---|---|---|---|---|---|
| 303 К | |||||
| 2.7 | 3.3 | 1.0 | 4.4 | 1520 | 0.5 ± 0.1 |
| 4.1 | 1.6 | 4.4 | 1670 | ||
| 6.8 | 2.2 | 3.3 | 1500 | ||
| 9.6 | 3.1 | 3.3 | 1398 | ||
| 10.9 | 3.8 | 3.3 | 1930 | ||
| 8.2 | 3.7 | 3.0 | 19.6 | 6000 | 0.59 |
| 10.9 | 0.3 | 1.2 | 1.1 | 4400 | 0.05 |
| 0.7 | 1.3 | 0.7 | 930 | 0.11 | |
| 1.1 | 2.1 | 4.9 | 4272 | 0.18 | |
| 1.8 | 2.1 | 3.6 | 2642 | 0.29 | |
| 2.5 | 3.3 | 2.1 | 1450 | 0.40 | |
| 3.6 | 3.7 | 3.6 | 1560 | 0.58 | |
| 309 К | |||||
| 2.8 | 4.9 | 3.2 | 19.1 | 1957 | 1.8 ± 0.1 |
| 6.0 | 5.8 | 2160 | |||
| 8.1 | 8.2 | 2150 | |||
| 10.3 | 10.0 | 2318 | |||
| 10.3 | 10.4** | 2080 | |||
| 6.1 | 0.3 | 1.2 | *** | *** | 0.12 |
| 1.0 | 2.7 | 19.6 | 10 000 | 0.39 | |
| 2.1 | 3.8 | 29.0 | 7000 | 0.82 | |
| 3.4 | 5.6 | 29.0 | 4315 | 1.33 | |
| 4.4 | 6.1 | 29.2 | 3452 | 1.72 | |
| 4.9 | 6.2 | 19.9 | 2160 | 1.91 | |
| 323 К | |||||
| 8.0 | 0.3 | 10.8 | 6.4 | 2470 | 0.92 |
| 1.4 | 23.1 | 76.6 | 3618 | 4.28 | |
| 2.9 | 32.6 | 38.4 | 897 | 8.87 | |
| 4.4 | 37.5 | 38.4 | 681 | 13.16 | |
| 4.5 | 39.6** | 38.9 | 90 | 13.77 | |
| 9.1 | 57.2 | *** | *** | 27.85 | |
| 3.0 | 0.3 | 3.9 | 4.9 | 1020 | 1.1 ± 0.2 |
| 6.0 | 7.7 | 1080 | |||
| 8.0 | 11.3 | 712 | |||
| 11.2 | 16.7 | 823 | |||
| 11.2 | 16.7 | 1020 | |||
| 11.6 | 16.6 | 1010 | |||
* Рассчитывали по уравнению (3). ** Окисление ТГФ проводили в атмосфере кислорода. *** Опыт проводили без α-токоферола.
Влияние концентрации субстрата на скорость окисления исследовали, разбавляя его хлорбензолом. Из рис. 3 видно, что при температуре 309 К скорость окисления ТГФ (w) прямо пропорциональна его концентрации ([RH]). Этот факт также подтверждает следование процесса окисления ТГФ традиционной схеме радикально-цепного окисления углеводородов. Аналогичные зависимости w от [RH] наблюдались и при температуре 303 и 323 К (табл. 1).
Рис. 3.
Зависимость начальной скорости окисления от концентрации ТГФ. Условия реакции: 309 К, [АИБН] = 4.9 × × 10–2 моль/л. Желтой точкой показан результат опыта, проведенного в атмосфере кислорода.

Для проверки возможного влияния концентрации кислорода на скорость окисления ТГФ проводили опыты в атмосфере кислорода. Было установлено отсутствие такой зависимости (табл. 1 и рис. 3), следовательно, окисление протекает в кинетическом режиме.
Из экспериментальных данных установлено, что скорость окисления тетрагидрофурана пропорциональна концентрации субстрата и корню квадратному из концентрации инициатора (табл. 1). Таким образом, в интервале температуры 303–323 К (табл. 2) жидкофазное окисление тетрагидрофурана кислородом воздуха протекает по радикально-цепному механизму с квадратичным обрывом цепи (схема 1 ).
Таблица 2.
Зависимость параметра окисляемости, константы скорости инициирования от температуры
| Т, К | [ТГФ] | [АИБН] × 10–2 | k2(2k6)–0.5, л0.5 моль–0.5 с–0.5 |
ki × 10–7, с–1 |
|---|---|---|---|---|
| моль/л | ||||
| 303 | 10.8 | 0.3–3.6 | 4.7 × 10–4 | 1.6 |
| 2.7–10.9 | 3.3 | 4.6 × 10–4 | ||
| 309 | 6.1 | 0.3–4.9 | 8.9 × 10–4 | 3.9 |
| 2.8–10.3 | 4.9 | 7.4 × 10–4 | ||
| 323 | 8.0 | 0.3–4.5 | 13.4 × 10–4 | 30.6 |
| 3.0–11.6 | 3.0 | 15.1 × 10–4 | ||
Скорость инициирования при окислении тетрагидрофурана, инициируемом 2,2'-азо-бис-изобутиронитрилом
Для определения скорости инициирования (wi) проводили окисление ТГФ в присутствии ингибитора α-токоферола. Как видно из рис. 4, окисление ТГФ в таком случае протекает с индукционным периодом. Это связано с тем, что появляется дополнительный канал расходования пероксильных радикалов по реакции с α-токоферолом:
(VII)
${\text{RO}}_{2}^{ \bullet }{\text{ + InH}}\xrightarrow{{{{k}_{7}}}}{\text{ROOH + I}}{{{\text{n}}}^{\centerdot }},$(VIII)
${\text{RO}}_{2}^{ \bullet }{\text{ + I}}{{{\text{n}}}^{\centerdot }}\xrightarrow{{{{k}_{8}}}}{\text{ROOIn}}{\text{.}}$Рис. 4.
Кинетические зависимости поглощения кислорода при инициированном АИБН окислении тетрагидрофурана без ингибитора (1) и с α-токоферолом (2.0 × 10–5 моль/л) (2). Условия реакции: [ТГФ] = 8.2 моль/л, [АИБН] = 3.7 × × 10–2 моль/л, 303 К. Касательные: (а) – к начальной скорости поглощения кислорода; (b) – к кинетической кривой поглощения кислорода после прекращения ингибирования.

По мере расходования α-токоферола скорость поглощения кислорода увеличивается. После индукционного периода скорость окисления ТГФ становится такой же, как в отсутствие токоферола. Длительность индукционного периода (τ) определяли графическим методом как точку пересечения двух касательных: к начальной скорости поглощения кислорода (а) и к кинетической кривой поглощения кислорода после прекращения ингибирования (b) (рис. 4).
Скорость инициирования wi рассчитывали из уравнения (2):
В табл. 1 приведены значения индукционного периода и вычисленные значения скорости инициирования.
Из экспериментальных данных следует, что при температуре 303 К константа скорости инициирования (ki) при распаде АИБН в тетрагидрофуране равна (1.6 ± 0.2) × 10–7 с–1. В соответствии с уравнением (3) найдена скорость инициирования при окислении ТГФ:
Из зависимости скорости окисления тетрагидрофурана от (wi)0.5 определен параметр окисляемости тетрагидрофурана (4.4 ± 0.3) × × 10–4 л0.5 моль–0.5 с–0.5 (303 К), что удовлетворительно согласуется с результатами работы [9] – при окислении ТГФ в водном растворе было найдено k2(2k6)–0.5 = 5.9 × 10–4 л0.5 моль–0.5 с–0.5. С учетом того, что при переходе от чистых субстратов к их водным растворам параметр окисляемости практически не изменяется [7, 15], можно заключить, что полученное значение окисляемости тетрагидрофурана удовлетворительно согласуется с литературными данными.
Для расчета wi при температурах 309 и 323 К использовали определенные экспериментально ki (табл. 2). Из зависимостей скорости окисления тетрагидрофурана от (wi)0.5 и от концентрации ТГФ при Т = 309 и 323 К найдены значения k2(2k6)–0.5, которые представлены в табл. 2.
Константа скорости взаимодействия α-токоферола с пероксильным радикалом тетрагидрофурана
Для расчета константы скорости реакции пероксильного радикала ТГФ с ингибитором (k7) кинетические зависимости поглощения кислорода (рис. 4, кривая 2) обрабатывали в координатах уравнения (4) [16]:
(4)
$\Delta [{{{\text{O}}}_{2}}] = - {{k}_{2}}{{({{k}_{7}})}^{{ - 1}}}\left[ {{\text{RH}}} \right]{\text{ln}}(1--t{\text{/}}\tau ),$Константу скорости ингибирования находили по тангенсу угла наклона участка зависимости (рис. 5, участок а), соответствующего ∼80% продолжительности индукционного периода (в интервале t от 0 до 0.8τ). Для расчета константы скорости k7 использовали значение k2 = 4.3 л моль–1 с–1 [9], результаты представлены в табл. 3.
Рис. 5.
Результаты обработки кинетической зависимости поглощения кислорода (рис. 4, кривая 2) в координатах уравнения (4). Выделен участок а, из тангенса угла наклона которого рассчитывали константу скорости k7. Условия реакции: [ТГФ] = 8.2 моль/л, [АИБН] = 3.7 × 10–2 моль/л, 303 К.

Таблица 3.
Зависимость скорости окисления ТГФ от концентрации α-токоферола и константа скорости ингибирования k7 (303 К)
| [ТГФ], моль/л | wi × 10–8*, моль л–1с–1 |
[InH] × 10–6, моль/л | wинг × 10–8 , моль л–1 с–1 |
k7 × 105, л моль–1 с–1 |
|---|---|---|---|---|
| 2.7 | 0.53 | 4.4 | 2.8 | 3.1 |
| 4.1 | 4.4 | 5.3 | 2.7 | |
| 6.8 | 3.3 | 5.0 | 5.6 | |
| 9.6 | 3.3 | 18.5 | 3.6 | |
| 10.9 | 3.3 | 11.4 | 2.4 | |
| 8.2 | 0.59 | 19.6 | 2.9 | 4.2 |
| 10.9 | 0.05 | 1.1 | 6.9 | 5.2 |
| 0.18 | 4.9 | 4.1 | 4.5 | |
| 0.29 | 3.6 | 10.9 | 2.1 | |
| 0.40 | 2.1 | 11.1 | 4.7 | |
| 0.58 | 3.6 | 8.3 | 5.6 |
* Рассчитывали по уравнению (3).
Из экспериментальных данных следует, что константа скорости (k7) реакции пероксильного радикала тетрагидрофурана с α-токоферолом при температуре 303 К составляет (4.0 ± 1.1) × × 105 л моль–1 с–1. Для сравнения можно привести значение константы скорости реакции пероксильного радикала тетрагидрофурана с тролоксом в водном растворе k7 = 4.1 × 105 л моль–1 с–1 (303 К) [9].
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе показано, что окисление ТГФ (2.7–10.9 моль/л), инициированное 2,2'-азо-бис-изобутиронитрилом (0.3–4.9 моль/л), в интервале температур 303–323 К протекает по радикально-цепному механизму с квадратичным обрывом цепи. Найдены зависимость параметра окисляемости ТГФ и константы скорости инициирования (ki) от температуры:
Константа скорости (k7) реакции пероксильного радикала тетрагидрофурана с α-токоферолом при температуре 303 К составляет (4.0 ± 1.1) × × 105 л моль–1с–1.
Модельная система, основанная на радикально-цепном окисление ТГФ, может быть использована для количественного измерения антиоксидантной активности соединений.
Список литературы
Денисов Е.Т., Денисова Т.Г. // Нефтехимия. Т. 2006. 46. № 5. С. 333.
Якупова Л.Р. Иванова А.В., Сафиуллин Р.Л., Гимадиева А.Р., Чернышенко Ю.Н., Мустафин А.Г., Абдрахманов И.Б. // Изв. АН. Сер. хим. 2010. № 3. С. 507.
Якупова Л.Р., Баева Л.А., Сафиуллин Р.Л. // Кинетика и катализ. 2021. Т. 62. № 1. С. 21.
Якупова Л.Р., Насибуллина Р.А., Петрова С.Ф., Абдуллин М.Ф., Салихов Ш.М., Гимадиева А.Р., Сафиуллин Р.Л. // Химия гетероциклических соединений. 2015. Т. 51. № 2. С. 162.
Якупова Л.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2020. Т. 61. № 6. С. 797.
Якупова Л.Р., Сахаутдинова Р.А., Панкратьев Е.Ю., Сафиуллин Р.Л. // Кинетика и катализ. 2012. Т. 53. № 6. С. 708.
Якупова Л.Р., Сафарова Д.И., Мурзагулова Э.И., Сафиуллин Р.Л. // Бутлеровские сообщения. 2018. Т. 54. № 5. С. 68.
Howard J.A., Ingold K.U. // Can. J. Chem. 1969. V. 20. № 20. P. 3809.
Amorati R., Baschieri A., Morroni G., Gambino R., Valgimigli L. // Chem. Eur. J. 2016. V. 22. № 23. P. 7924.
Якупова Л.Р., Диниахметова Д.Р., Сахаутдинов И.М., Сафиуллин Р.Л. // Кинетика и катализ. 2022. Т. 63. № 5. С. 543.
Якупова Л.Р., Проскуряков С.Г., Зарипов Р.Н., Рамеев Ш.Р., Сафиуллин Р.Л. // Бутлеровские сообщения. 2011. Т. 28. № 19. С. 71.
Зарипов Р.Н., Сафиуллин Р.Л., Рамеев Ш.Р., Ахунов И.Р., Комиссаров В.Д. // Кинетика и катализ. 1990. Т. 31. № 5. С. 1086.
Denisov E.T., Afanas’ev I.B. Oxidation and Antioxdants in Organic Chemistry and Biology. Boca Raton: CRC Press, Taylor and Francis Group, 2005. 981 p.
Эмануэль Н.М., Денисов Е.Т., Майзус З.К. Цепные реакции окисления углеводородов в жидкой фазе. Москва: Наука, 1965. 376 с.
Семикашева О.В., Насибуллина Р.А., Якупова Л.Р., Сафиуллин Р.Л. // Кинетика и катализ. 2021. Т. 62. № 5. С. 527.
Денисов Е.Т., Азатян В.В. Ингибирование цепных реакций. Черноголовка: Изд-во РАН, 1997. 266 с.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


