Коллоидный журнал, 2019, T. 81, № 1, стр. 3-9
Адсорбция природных 3-фенилпропеновых кислот на поверхности диоксида церия
В. Н. Барвинченко 1, *, Н. А. Липковская 1, Т. В. Кулик 1, Н. Т. Картель 1
1 Институт химии поверхности им. А.А. Чуйко Национальной академии наук Украины
,
03164 Киев-164, ул. Генерала Наумова, 17, Украина
* E-mail: vbarvinchenko@gmail.com
Поступила в редакцию 26.06.2018
Аннотация
Показано, что адсорбция природных антиоксидантов 3-фенилпропеновой (коричной), 3-(4-гидроксифенил)пропеновой (кумаровой) и 3-(3-метокси-4-гидроксифенил)пропеновой (феруловой) кислот на поверхности диоксида церия характеризуется S-изотермой, а 3-(3,4-дигидроксифенил)пропеновой (кофейной) кислоты – изотермой Н-типа. Найдена линейная корреляция величин адсорбции на начальных участках S-изотерм с параметром гидрофобности (lg P), что характерно для параллельной ориентации адсорбированных молекул относительно поверхности сорбента. Величины максимальной адсорбции (≈2.9 × 10–4 моль/г), так же как и константы диссоциации (pKCOOH = 4.4−4.6) практически одинаковы для всех кислот, что предполагает связывание молекул адсорбата с поверхностью сорбента преимущественно через карбоксильные группы. Наличие гидроксильных групп в молекулах кумаровой, феруловой и кофейной кислот приводит к расширению интервала рН их адсорбции по сравнению с коричной кислотой, а также обусловливает их окисление на поверхности диоксида церия.
ВВЕДЕНИЕ
Нанодисперсный диоксид церия (НДЦ) является перспективным для биомедицинских применений [1], поскольку проявляет антибактериальные, кардио-, гепато-, геро-, гено- и радиопротекторные свойства, способен выступать в качестве мощного ультрафиолетового фильтра. НДЦ с адсорбированными биологически активными веществами различной терапевтической направленности может являться эффективным носителем лекарственных средств и использоваться для их адресной доставки в поврежденные клетки и органы. Эффективность действия таких комплексных препаратов будет зависеть от стабильности связывания наночастиц НДЦ с биоактивными соединениями, которая, в свою очередь, определяется их активными реакционными группами. Взаимодействие CeO2 с биологически активными соединениями в живых системах определяется такими его физико-химическими характеристиками как размер частиц, заряд поверхности, наличие поверхностных групп [2]. В работах [3, 4] представлены диаграммы распределения поверхностных групп диоксида церия в зависимости от кислотности водного раствора и показано, что в области pH 2−9 содержание нейтральных групп ≡CeOH составляет 85−95%, в то время, как доля протонированных $ \equiv {\kern 1pt} {\text{CeО Н }}_{2}^{ + }$ и ионизированных ≡CeO− групп невелика.
Важнейшую роль в жизнедеятельности клеток и живых организмов играют органические кислоты, поэтому исследование их адсорбции на поверхности НДЦ представляет значительный интерес для прогнозирования взаимодействий с биообъектами, молекулы которых содержат карбоксильные группы. В последнее десятилетие повышенное внимание исследователей привлекают природные соединения, способные эффективно защищать живые системы от окислительного стресса, в частности, фенилпропеновые кислоты (ФПК) растительного происхождения, которые в настоящее время используются в медицине, фармакологии [5] и пищевой промышленности [6, 7].
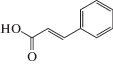
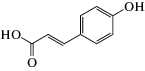
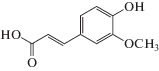
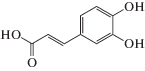
Объектами исследования нами были выбраны структурно однотипные ФПК, а именно, 3-фенилпропеновая (коричная, ФПК-1) кислота и ее производные – 3-(4-гидроксифенил)пропеновая (кумаровая, ФПК-2), 3-(3-метокси-4-гидроксифенил)пропеновая (феруловая, ФПК-3) и 3-(3,4-дигидроксифенил)пропеновая (кофейная, ФПК-4) кислоты. Широкий спектр фармакологических свойств этих соединений [8] обусловлен, в основном, их антиоксидантной активностью – способностью тормозить перекисное окисление липидов и подавлять свободнорадикальные стадии синтеза простагландинов. Кроме того, следует отметить, что данные ФПК являются структурными звеньями лигнина и используются как модельные соединения при изучении процессов глубокой переработки растительной биомассы и лигнинсодержащих материалов с целью получения биотоплива и других продуктов с заданными потребительскими свойствами [9].
Реакционные центры исследуемых ФПК включают изолированные карбоксильные и гидроксильные группы, способные выступать в роли доноров или акцепторов протонов в межмолекулярных взаимодействиях, а также “узлы” с внутримолекулярной водородной связью. Не менее важную роль в формировании физико-химических свойств ФПК играют процессы сольватации, особенно, полярными протоактивными растворителями, поскольку в полярной среде (воде) за счет сольватации происходит поляризация химических связей с последующей диссоциацией, что обусловливает протолитические свойства и реакционную способность растворенных молекул кислот [10]. Ранее нами была исследована адсорбция ФПК на поверхности нанодисперсного диоксида кремния [11–13] и показано, что она имеет место за счет образования поверхностных комплексов с участием как карбоксильной группы, так и фенольных гидроксилов.
Целью данной работы было установление закономерностей адсорбции на поверхности НДЦ 3-фенилпропеновых кислот – коричной, кумаровой, феруловой и кофейной – в зависимости от их химической структуры и кислотности водных растворов в диапазоне физиологических значений рН.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе был исследован нанодисперсный порошок диоксида церия производства Alfa Aesar (удельная поверхность, определенная по низкотемпературной адсорбции аргона, SAr = 71 м2/г, размер частиц 15−30 нм), который предварительно прокаливали при 500°С в течение 2 ч для удаления примесей органических веществ. НДЦ использовали в форме 0.05%-ной водной дисперсии (ионная сила 0.01 н), которую получали перемешиванием навесок сорбента (0.25 г) и NaCl (0.29 г) с водой (500 мл) магнитной мешалкой в течение 2 ч.
Исходные растворы коричной (≥98%, Sigma-Aldrich), кумаровой (≥98%, Alfa Aesar), феруловой (≥99%, Alfa Aesar) и кофейной кислот (≥98%, Sigma-Aldrich) готовили растворением точных навесок в горячей дистиллированной воде. Рабочие растворы готовили непосредственно перед экспериментом. Растворы хлористоводородной кислоты и щелочи получали из концентрированных HCl и NaOH марки “ч. д. а.”. Кислотность растворов до и после адсорбции контролировали с помощью стеклянного электрода универсального иономера Hanna Instruments HI 221.
Электронные спектры регистрировали с помощью спектрофотометра Specord M-40 (Karl Zeiss Jena, Германия). Спектры отражения твердых образцов, измеренные с помощью специальной приставки для данного спектрофотометра, автоматически конвертировались в спектры поглощения. С целью устранения влияния фона на аналитический сигнал, полученный при измерении спектров поглощения исследуемых растворов, использовали метод гетерохроматической экстраполяции при двух длинах волн [14].
Адсорбциию (a, моль/г) 3-фенилпропеновых кислот из водных растворов на поверхности диоксида церия изучали в статических условиях, для чего 10 мл раствора кислоты различной концентрации смешивали с 10 мл 0.05%-ной водной дисперсии сорбента, устанавливали необходимое значение pH раствора и перемешивали до установления равновесия (2 ч при 20°C). Затем сорбент отделяли с помощью центрифугирования (8000 об./мин, 15 мин) и высушивали на воздухе. В центрифугат добавляли раствор HCl для установления значения рН <2.5−3.0 (при котором светопоглощение ФПК практически не зависит от рН), измеряли оптическую плотность и рассчитывали равновесную концентрацию кислот на основании соответствующих молярных коэффициентов поглощения (ε), найденных экспериментально при этих условиях. Для этого предварительно были исследованы зависимости оптической плотности растворов ФПК от их концентрации, которые были линеаризованы методом наименьших квадратов с коэффициентами корреляции r 2 ≥ 0.9997. Найденные величины ε составили (М–1 см–1): ε278 нм = 2.06 × 104 (коричная кислота), ε310 нм = 1.97 × 104 (кумаровая), ε324 нм = = 1.78 × 104 (феруловая), ε324 нм = 1.63 × 104 (кофейная).
Степень извлечения (E, %) и величину адсорбции (a, моль/г) 3-фенилпропеновых кислот рассчитывали по формулам
где C и [C] – соответственно исходная и равновесная концентрации ФПК (М), V – объем раствора (л), m – масса сорбента (г).РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В водных растворах ФПК существуют в молекулярной и депротонированных формах, причем в области физиологических значений рН, как следует из анализа величин термодинамических констант диссоциации карбоксильной и гидроксильных групп (табл. 1), доминируют их молекулярные и монодепротонированные формы.
На первом этапе была изучена зависимость адсорбции коричной (рис. 1а) кумаровой (рис. 1б), феруловой (рис. 1в) и кофейной (рис. 1г) кислот от рН водных растворов. На этих рисунках приведены также диаграммы распределения соответствующих кислотно-основных форм исследуемых ФПК в растворах, построенные исходя из величин констант диссоциации соответствующих функциональных групп (табл. 1).
Рис. 1.
Степень адсорбции Е (1) и распределения молекулярной (2), монодепротонированной (3) и дидепротонированной (4) форм коричной (а), кумаровой (б) феруловой (в) и кофейной (г) кислот в зависимости от рН водного раствора. C0 = 2.5 × 10–5 М.
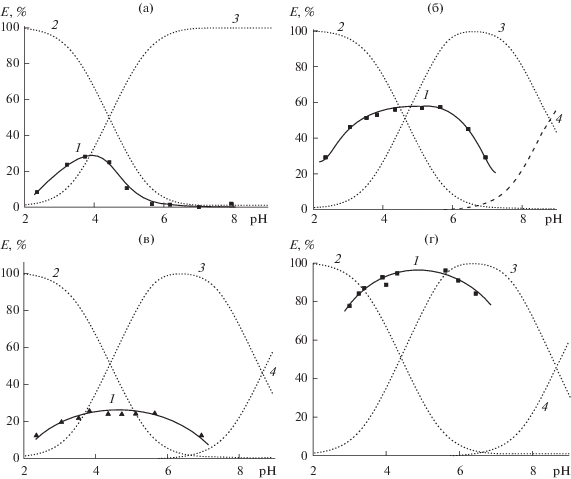
Адсорбция коричной кислоты на поверхности НДЦ увеличивается до максимальной величины при рН ≈ 4 за счет образования водородных связей между карбоксильной группой и нейтральными группами ≡СеОН поверхности оксида и затем постепенно уменьшается до нуля при рН ≈ 7, одновременно с депротонированием карбоксильной группы (рис. 1а). Положение максимума адсорбционной кривой на шкале рН примерно соответствует константе диссоциации карбоксильной группы коричной кислоты (pKCOOH = = 4.44).
Зависимости адсорбции кумаровой, феруловой и кофейной кислот от рН описываются похожими куполообразными кривыми, которые, однако, имеют значительно более широкий интервал рН максимальной адсорбции по сравнению с коричной кислотой.
Поскольку величины рKСООН всех исследуемых ФПК практически одинаковы, то расширение интервала рН адсорбции гидроксифенилпропеновых кислот в щелочную область может быть связано с наличием недиссоциированных гидроксильных групп в их моноанионах, что создает условия для образовании и других типов адсорбционных комплексов.
Зависимости адсорбции ФПК от их концентрации в водных растворах исследовали при значении рН 4.5, которое соответствует области их термодинамических констант диссоциации рKСООН. На рис. 2 приведены полученные изотермы адсорбции коричной (кривая 1), кумаровой (2), феруловой (3) и кофейной (4) кислот.
Рис. 2.
Изотермы адсорбции на диоксиде церия коричной (1), кумаровой (2), феруловой (3) и кофейной (4) кислот (а) и их начальные участки при [C] < 6 × 10–5 М (б).
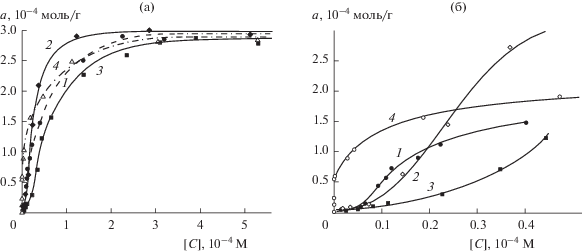
Как видно на рис. 2а, величины максимальной адсорбции для всех исследованных кислот близки и составляют ≈2.9 × 10–4 моль/г несмотря на различия в реакционных центрах их молекул. В то же время, начальные участки изотерм существенно различаются (рис. 2б), что позволяет установить их тип по классификации Джайлса [20]. Изотермы коричной, кумаровой и феруловой кислот являются S-образными, что свидетельствует о том, что при малой степени заполнения поверхности НДЦ адсорбированные молекулы этих ФПК располагаются параллельно ей, а с увеличением концентрации их ориентация постепенно меняется на перпендикулярную. Изотерма кофейной кислоты имеет Н-форму (рис. 2б, кривая 4), которая иллюстрирует полную адсорбцию (a > 0 при [C] = 0) в определенном интервале начальных концентраций и характерна для хемосорбции.
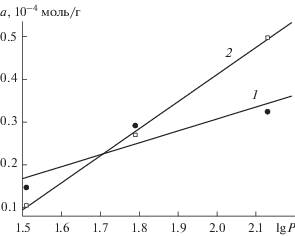
Коричная кислота и ее гидроксипроизводные характеризуются наличием в их молекулах как гидрофобных (этиленовые и фенильные радикалы), так и гидрофильных (карбоксильные группы и фенильные гидроксилы) фрагментов. Поэтому их взаимодействие с поверхностью диоксида церия может быть обусловлено как электростатическими и водородными связями между группами ≡СеОН и СООН и –ОН (гидрофильный вклад), так и поляризационными и дисперсионными силами, действующими на арильные фрагменты (гидрофобный вклад). Поскольку для начальних участков изотерм коричной, кумаровой и феруловой кислот предполагается параллельная ориентации их молекул относительно поверхности НДЦ, можно ожидать, что в этих условиях величины адсорбции должны зависеть от степени гидрофобности кислот. Общепринятым параметром гидрофобности, характеризующим лиофильные свойства вещества, является величина логарифма коэффициента его распределения в системе вода–н-октанол (lg P). Приведенные в литературе [21] значения lg P коричной (2.13), кумаровой (1.79) и феруловой (1.51) кислот свидетельствуют о том, что данные ФПК относятся к умеренно гидрофобным соединениям (1 < lg P < 3). На рис. 3 представлены зависимости от lg P величин адсорбции коричной, кумаровой и феруловой кислот, которые были рассчитаны для их одинаковых начальных (кривая 1) и равновесных (кривая 2) концентраций. Построенные зависимости линеаризуются с высокими коэффициентами корреляции: R = 0.918 (1) и R = 0.999 (2), что свидетельствует о вкладе гидрофобных взаимодействий в адсорбцию и подтверждает параллельную ориентацию молекул этих ФПК в данных концентрационных условиях.
Рис. 3.
Зависимости величин адсорбции коричной, кумаровой и феруловой кислот на диоксиде церия от значений их lg P. C0 = 1.5 × 10–5 М (1), [C] = 1.0 × × 10–5 М (2).
Экспериментальные данные указывают на то, что ФПК взаимодействуют с поверхностными реакционными центрами НДЦ как по гидрофильному, так и по гидрофобному механизму, но соотношение вкладов этих механизмов диктуется ориентацией молекул на поверхности и определяется химическим строением адсорбата. В случае кофейной кислоты, в молекуле которой есть орто-дигидроксильная группировка, возможно также и координационное связывание с СеО2, за счет чего происходит хемосорбция, которая проявляется в Н-типе изотермы. Следует отметить, что гидрофобные взаимодействия значительно слабее водородных, электростатических и координационных; они действуют только в водной среде и обусловлены особенностями структуры воды, кроме того, имеют не энтальпийную, а энтропийную природу, которая очень важна в биологических процессах.
При увеличении концентрации ФПК происходит изменение ориентации адсорбированных молекул относительно поверхности сорбента, и в области плато изотермы они занимают вертикальное положение на поверхности оксида церия в виде цепей или кластеров. Найденные экспериментально величины максимальной адсорбции всех кислот практически совпадают, что указывает на их однотипные взаимодействия с поверхностью НДЦ. Это возможно лишь при условии связывания ФПК с поверхностью через карбоксильные группы, константы диссоциации которых практически одинаковы (табл. 1). Кроме того, только при вертикальном расположении молекул ФПК возможно максимальное удаление от поверхности остальных функциональных групп, которые могли бы влиять на адсорбцию.
Дополнительная информация о взаимодействиях в этих системах была получена на основании изучения спектров поглощения диоксида церия в отсутствие и в присутствии адсорбированной ФПК (НДЦ/ФПК) – рис. 4. Спектр поглощения НДЦ/ФПК-1 (рис. 4а, кривая 2) практически совпадает со спектром самого НДЦ (рис. 4а, кривая 1), который характеризуется максимумами при 260 и 310 нм. Адсорбционное взаимодействие кумаровой, феруловой и кофейной кислот с НДЦ, в отличие от коричной кислоты, сопровождается изменением окраски сорбента, которая определяется структурой ФПК, в частности наличием ОН-групп, и ее поверхностной концентрацией. При адсорбции кумаровой кислоты (рис. 4б), в отличие от коричной, происходит расширение спектра модифицированного сорбента НДЦ/ФПК-2 в длинноволновую область за счет появления новой полосы с максимумом в области 420−440 нм (кривые 2, 2 '), интенсивность которой растет с увеличением поверхностной концентрации адсорбата (кривые 3, 3 '). Такое же изменение спектра наблюдается и для феруловой кислоты (рис. 4в, кривые 2, 2 ' и 3, 3 '). В случае НДЦ/ФПК-4 (рис. 4г) кроме полосы поглощения, которая наблюдалась для кумаровой и феруловой кислот (кривые 2, 2 '), с увеличением поверхностной концентрации кислоты в спектре появляется также широкая полоса с максимумом в области 650−700 нм (кривые 3, 3 ').
Рис. 4.
Нормированные спектры поглощения образцов НДЦ (1), НДЦ/ФПК (2, 3) и разностные спектры 2 – 1 (2 ') и 3 – 1 (3 ') для коричной (а), кумаровой (б), феруловой (в) и кофейной (г) кислот. C0 = 2 × 10–5 М (2) и C0 = 6 × 10–4 М (3); рН 4.5.
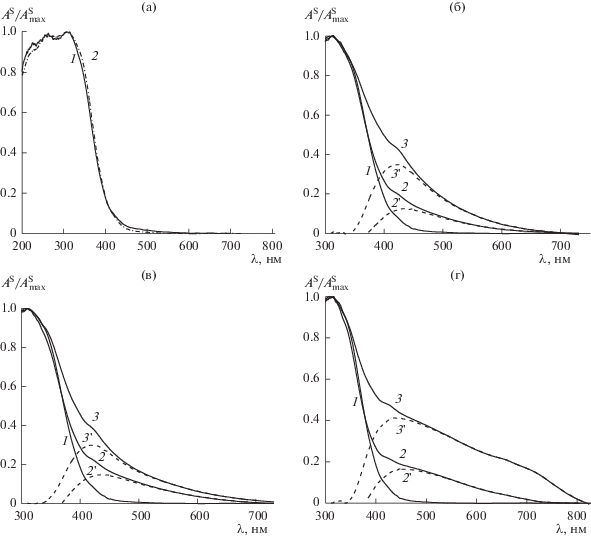
Как следует из приведенных рис. 4а−4г, спектральные изменения зависят от структуры сорбируемых ФПК (в частности, количества и расположения фенольных ОН-групп) и их концентрации и указывают на изменения в составе, структуре и физико-химических свойствах поверхности НДЦ, вызванные присутствием молекул кислот-антиоксидантов. Учитывая редокс-свойства НДЦ, можно предположить, что, адсорбируясь на поверхности сорбента, гидрокси-ФПК частично восстановливают Ce(IV) до Ce(III), образуя при этом продукты окисления и интермедиаты, имеющие высокую реакционную способность. Известно, что окисление пространственно незатрудненных полифенолов – процесс сложный и многостадийный. Так, согласно литературным данным [22], при окислении ФПК в растворах в результате образования новых связей С–С и С–О при рекомбинации соответствующих арилоксильных радикалов образуются различные конденсированные димерные соединения, которые поглощают в области 430−450 нм.
Кофейная кислота, в состав которой входит орто-гидроксильная группа, при окислении образует соединения хиноидного типа, для которых характерно хелатирование металлов [23]. По-видимому, именно комплексообразование и обусловливает хемосорбцию кофейной кислоты на диоксиде церия, которой соответствует изотерма Н-типа. При этом центрами хемосорбции являются не кислые или основные ОН-группы поверхности адсорбента, а координационно-ненасыщенные ионы церия. При взаимодействии кофейной кислоты с диоксидом церия, очевидно, происходит перенос заряда в комплексе церий–антиоксидант, что проявляется в спектрах отражения кофейной кислоты в виде появлении новой полосы в области 600−800 нм по сравнению со спектрами моно-гидрокси-ФПК. Аналогичная полоса с высоким коэффициентом экстинкции в области 500−700 нм была интерпретирована авторами работы [24] как внутримолекулярный перенос заряда при образовании комплексов переходных металлов с катехолатами в анаэробных условиях. Поскольку изменение цвета системы НДЦ/ФПК свидетельствует о степени восстановительной способности адсорбируемых антиоксидантов (кумаровой, феруловой и кофейной кислот) и типе связывания с поверхностью НДЦ, эти спектральные изменения могут быть использованы для оценки антиоксидантной активности ФПК и разработки соответствующих тест-систем.
Таким образом, установлены закономерности адсорбции на поверхности нанодисперсного диоксида церия природных антиоксидантов – 3-фенилпропеновых кислот в зависимости от их химической структуры и кислотности водных растворов в диапазоне физиологических значений рН. Найдено, что различие в сорбционных свойствах определяется наличием в молекулах кумаровой, феруловой, кофейной кислот гидроксильных групп, которые обеспечивают их эффективную сорбцию в более широком интервале рН раствора и способствуют их окислению на поверхности НДЦ. Совпадение величин максимальной адсорбции всех кислот свидетельствует о том, что в области плато изотерм ФПК сорбируются преимущественно по одному механизму, а именно через карбоксильные группы, константы диссоциации которых практически одинаковы.
Работа выполнена при финансовой поддержке УНТЦ (грант P 707) и Шведского исследовательского совета (VR), контракт 348-2014-4250.
Список литературы
Щербаков А.Б., Иванова О.С., Спивак Н.Я., Козик В.В., Иванов В.К. Синтез и биомедицинские применения нанодисперсного диоксида церия. Томск: Издательский дом ТГУ, 2016.
Ould-Moussa N., Safi M., Guedeau-Boudeville M. et al. // Nanotoxicology. 2014. V. 8. P. 799.
Власова Н.Н., Головкова Л.П., Стукалина Н.Г. // Коллоид. журн. 2015. Т. 77. С. 433.
Власова Н.Н. // Коллоид. журн. 2016. Т. 78. С. 700.
Меньщикова Е.Б., Ланкин В.З., Кандалинцева Н.В. Фенольные антиоксиданты в биологии и медицине. Строение, свойства, механизмы действия. Saarbrücken: LAP LAMBERT Academic Publ., 2012.
Яшин Я.И., Рыжнев В.Ю., Яшин А.Я., Черноусова Н.И. Природные антиоксиданты. Содержание в пищевых продуктах и влияние их на здоровье и старение человека. М.: ТрансЛит, 2009.
Pokorny J. // EJEAF Chem. 2008. V. 7. P. 3320.
El-Seedi H.R., El-Said A.M., Khalifa S.A. et al. // J. Agric. Food Chem. 2012. V. 60. P. 10877.
Физическая химия лигнина / Под ред. Боголицына К.Г., Лунина В.В. Архангельск: Архан. гос. техн. ун-т, 2009.
Чуев Г.Н., Базилевский М.В. // Успехи химии. 2003. Т. 72. С. 827.
Kulik T.V., Lipkovska N.A., Barvinchenko V.N. et al. // J. Colloid Interface Sci. 2009. V. 339. P. 60.
Kulik T.V., Barvinchenko V.N., Lipkovska N.A. et al. // J. Anal. Appl. Pyrolysis. 2011. V. 90. P. 219.
Kulik T.V., Lipkovska N.A., Barvinchenko V.N. et al. // J. Colloid Interface Sci. 2016. V. 470. P. 132.
Бернштейн И.Я., Каминский Ю.Л. Спектрофотометрический анализ в органической химии. Л.: Химия, 1986.
Общая органическая химия / Под ред. Бартона Д., Оллиса У.Д. М.: Химия, 1983.
Naseem S., Laurent A.D., Carroll E.C. et al. // J. Photochem. Photobiol. A. 2013. V. 270. P. 43.
Friedman M., Jurgens H.S. // J. Agric. Food Chem. 2000. V. 48. P. 2101.
Linder P. W. // Polyhedron. 1987. V. 6. P. 53.
Muzafarov E.N., Zolotareva E.K. // Biochem. Physiol. Pflanz. 1989. P. 363.
Giles C.H., MacEwan T.H., Nakhwa S.N., Smith D. // J. Chem. Soc. 1960. V. 10. P. 3973.
Chemical information resources from the National Library of Medicine http://sis.nlm.nih.gov/chemical.html.
Roche M., Dufour C., Mora N., Dangles O. // Org. Biomol. Chem. 2005. V. 3. P. 423.
Dei A., Gatteschi D., Sangregorio C., Sorace L. // Acc. Chem. Res. 2004. V. 37. P. 827.
Sever M.J., Wilker J.J. // Dalton. Trans. 2004. V. 7. P. 1061.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал