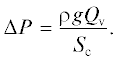Коллоидный журнал, 2019, T. 81, № 1, стр. 125-136
Осмос в отрицательно заряженных нанокапиллярах и его усиление анионным поверхностно-активным веществом
Yu. Yamauchi 1, И. В. Блонская 1, П. Ю. Апель 1, 2, *
1 Объединенный институт ядерных исследований
141980 Московская обл., Дубна, ул. Жолио-Кюри, 6, Россия
2 Государственный университет “Дубна”
141982 Московская обл., Дубна, ул. Университетская, 19, Россия
* E-mail: apel@jinr.ru
Поступила в редакцию 16.07.2018
Аннотация
Измерены осмотические потоки через трековые мембраны с радиусом пор 10–50 нм в системе вода/мембрана/раствор соли при концентрациях последней порядка нескольких ммоль/л. Установлено, что интенсивный транспорт воды сквозь поры происходит лишь в случае растворенного вещества, диссоциирующего на ионы (KCl, K2SO4, додецилсульфат натрия). Молекулы низкомолекулярных неэлектролитов практически не вызывают осмотического течения при данных значениях радиуса капилляров, что указывает на определяющую роль двойного электрического слоя в механизме осмотического транспорта. Показано, что транспорт через поры под действием осмотического давления имеет конвективный характер: выполняется закон Пуазейля для вязкого течения через цилиндрический капилляр. Определены величины осмотического давления при разной концентрации соли, и рассчитаны коэффициенты отражения. Они коррелируют с величинами кажущихся коэффициентов диффузии соли в нанопорах, которые принимают существенно более низкие значения по сравнению с объемными. Сорбция анионного поверхностно-активного вещества увеличивает заряд поверхности мембраны и усиливает осмотический эффект.
1. ВВЕДЕНИЕ
Осмос представляет собой течение растворителя, например воды, сквозь полупроницаемую мембрану из области с низкой концентрацией растворенного вещества в область с его более высокой концентрацией. Это явление имеет огромное значение в природе для обеспечения транспортных процессов в растениях и живых организмах, а также используется в современных технологиях, например, для разделения смесей или выработки “зеленой” электроэнергии [1, 2]. Несмотря на то, что осмос давно известен и исследуется с 19-го столетия [3–10], его природа до сих пор остается сложной для понимания. Существует несколько моделей, объясняющих механизм осмоса, включая и ошибочные, которые, тем не менее, переходят из одного источника информации в другой. Исторический обзор этого феномена с анализом современных представлений дан, например, в работах [11–13]. Традиционно считается, что явление осмоса характерно для полупроницаемых мембран, то есть таких, которые практически полностью задерживают молекулы растворенного вещества. Поэтому в случае пористых (“капиллярных”) мембран, осмотические эксперименты проводили лишь с растворами высокомолекулярных веществ [7, 14, 15]. Такая ситуация сложилась в силу укоренившегося мнения, что “the osmotic pressures of lipid-insoluble solutes are effective across cell membranes, whereas only osmotic pressures of macromolecular solutes are effective across capillary membranes” [7].
Однако выполненные недавно эксперименты с асимметричными трековыми мембранами (ТМ) показали, что ярко выраженные осмотические эффекты можно наблюдать в порах радиусом в единицы-десятки нанометров, работая с растворами низкомолекулярных солей [16, 17]. Было обнаружено, что конические поры, получаемые по методике асимметричного травления [18], в условиях большого градиента концентрации электролита генерируют легко регистрируемые осмотические потоки. Такие поры имеют сильно различающиеся радиусы на своих противоположных концах (5–10 и 150–300 нм соответственно) и поэтому оказывают значительно меньшее сопротивление вязкому потоку по сравнению с цилиндрическими каналами [19]. Это обстоятельство способствовало обнаружению эффекта, однако затрудняет тщательное исследование процесса, поскольку геометрические характеристики таких пор, особенно их узких участков, известны с большой погрешностью.
Целью настоящей работы было исследовать основные закономерности осмоса в каналах субмикрометрового диапазона. Для этого мы использовали “обычные” ТМ с цилиндрическими порами, которые были тщательно охарактеризованы несколькими методами. Измеряли осмотические потоки воды, вызываемые как растворами электролитов, так и растворами не диссоциирующих в воде веществ. Параллельно измеряли скорость встречной диффузии растворенного вещества. Полученные результаты позволили понять основные особенности осмотического процесса, обусловленного двойным электрическим слоем (ДЭС) в порах ТМ.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Мембраны
Использовали ТМ из полиэтилентерефталата (ПЭТФ) c различными радиусами пор. Мембраны были получены облучением ПЭТФ-пленок тяжелыми ионами на ускорителях Лаборатории ядерных реакций им. Г.Н. Флерова ОИЯИ и последующей физико-химической обработкой, обеспечивающей образование пор цилиндрической формы [20]. Физико-химическая обработка включала воздействие ультрафиолетового излучения (длина волны >285 нм) и последующее химическое травление в растворе гидроксида натрия. В зависимости от требуемого диаметра пор концентрацию гидроксида натрия варьировали в пределах от 0.5 до 3 моль/л, а температуру от 80 до 90°С. Мембрана представляла собой ленту шириной 320 мм, из которой для экспериментов вырезали кружки диаметром 30 мм, соответствующим размеру гнезда в измерительной ячейке.
Характеристики мембран приведены в табл. 1. Плотность пор в расчете на единицу поверхности определяли по микрофотографиям, полученным в растровом электронном микроскопе (РЭМ). Независимо от статистики, набранной при подсчете пор (но не менее 700), средняя плотность пор в образцах характеризуется доверительным интервалом около ±10%, поскольку условия облучения ионами не обеспечивают более однородного распределения. Типичные микрофотографии поверхности ТМ, использованных в экспериментах, приведены на рис. 1а–1г. Следует подчеркнуть, что размер входного отверстия не отражает диаметра канала с достаточной точностью, поскольку поры малых размеров имеют воронкообразные входы, обусловленные воздействием ультрафиолетового излучения на поверхностный слой ПЭТФ. Эту особенность можно увидеть, сравнивая РЭМ-изображения поверхности и сечения мембран с невысокой пористостью, чтобы внутренняя структура мембраны отчетливо просматривалась [17]11. Для примера на рис. 1д показан фрагмент мембраны, где одновременно видны каналы пор в ее глубине и отверстия на поверхности. В связи с этим более объективной характеристикой является эффективный диаметр пор, рассчитанный из газопроницаемости или водопроницаемости мембраны при небольшом перепаде давления. При аккуратных измерениях эти методы дают очень хорошее согласие в случае ТМ с порами нанометрового диапазона [21, 22].
Таблица 1.
Основные характеристики исследованных трековых мембран
| Мембрана | Средняя толщина, мкм | Плотность пор, см–2 | Qair, мл см–2 мин–1 |
Эффективный диаметр пор dair, нм | Qw, мл см–2 мин–1 |
Эффективный диаметр пор dw, нм |
|---|---|---|---|---|---|---|
| ТМ-25 | 10.8 | 8 × 109 | 8.7 при 10 кПа |
26 ± 2 | 3.7 × 10–3 при 10 кПа |
24 ± 1 |
| ТМ-40 | 11.9 | 2.9 × 109 | 5.8 при 5 кПа |
41 ± 2 | 1.0 × 10–2 при 10 кПа |
41 ± 1 |
| ТМ-100 | 9.6 | 1.1 × 109 | 120 при 10 кПа |
111 ± 5 | 8.4 × 10–2 при 5 кПа |
100 ± 3 |
| ТМ-2000 | 17.8 | 2.0 × 106 | 3.4 × 103 при 10 кПа |
(2.1 ± 0.1) × 103 | – | – |
Примечания. 1. Qair и Qw – объемные расходы воздуха и деионизованной воды, соответственно, при указанных в таблице значениях перепада давления. 2. Погрешности нахождения эффективных диаметров складываются из случайных погрешностей определения плотности пор, толщины и площади мембраны и измеренных расходов.
Рис. 1.
Электронные микрофотографии поверхности трековых мембран: (а) ТМ-25, (б) ТМ-40, (в) ТМ-100, (г) ТМ-2000; (д) электронная микрофотография фрагмента скола ТМ с эффективным диаметром пор 33 нм и плотностью пор 108 см–2.

Характерной особенностью ультра- и микрофильтрационных ТМ, включая практически все представленные на современном рынке, является непараллельность каналов пор [22]. В наших образцах оси каналов пор были равномерно распределены в интервале углов φ от 0° до 30° относительно нормали. Следовательно, как для диффузионного транспорта, так и для вязкого течения эффективная длина пор не равна толщине мембраны. Легко рассчитать, что для указанного диапазона углов среднее значение косинуса угла наклона поры составляет 〈cos φ〉 = 0.956, и, следовательно, эффективная длина l каналов пор в мембранах составляет l0/0.956, где l0 – толщина мембраны. Это обстоятельство учитывалось при расчете эффективных диаметров пор и диффузионной проницаемости ТМ.
2.2. Измерение осмотических и диффузионных потоков
Эксперименты проводили в прозрачной ячейке из полированного плексигласа, разделенной пополам перегородкой (см. рис. 2). Левую половину ячейки заполняли раствором известной концентрации, правую половину – особо чистой водой, полученной на установке Ариум (Владисарт, Россия). Между половинами ячейки, в отверстие в перегородке помещали образец ТМ, его рабочая площадь составляла 3.14 см2. Для каждого эксперимента брали новый образец. Левая половина ячейки вмещала 300 мл раствора, правая – 250 мл воды. Левая половина ячейки была снабжена полисульфоновым капилляром внутренним диаметром 1.00 ± 0.02 мм. Диаметр определили по разнице масс сухого и заполненного водой капилляра длиной 1500 мм. Раствор интенсивно перемешивали при помощи покрытого фторопластом магнитного мешальника. В правой половине ячейки перемешивание осуществляли посредством погружной мешалки.
Рис. 2.
Ячейка для измерения осмотических и диффузионных потоков: 1 – мембрана, 2 – измерительный капилляр, 3 – магнитный мешальник, 4 – погружная мешалка, 5 – датчик кондуктометра.
Начальный уровень жидкости в капилляре, как правило, был ненулевым после сборки ячейки, ее заполнения и включения интенсивного перемешивания, что не было помехой для наблюдений осмотических потоков. Измеряли высоту поднятия раствора в капилляре как функцию времени, h(t). Высота максимального поднятия hmax давала величину осмотического давления для данного раствора. Скорость течения раствора через мембрану под действием гидростатического давления измеряли, заменив воду в правой половине ячейки на эквивалентный по концентрации рабочий раствор, уравнивая тем самым осмотичность по обе стороны мембраны. Уровень раствора в капилляре начинал падать, давая возможность измерить убывающую функцию $h{\text{'(}}t).$ Эксперименты проводили при комнатной температуре 22 ± 1°C.
При помощи кондуктометра ProfLine Cond 3110 контролировали удельную электропроводность в правой половине ячейки и рассчитывали концентрацию диффундирующей через мембрану соли. В условиях эксперимента (низкие концентрации, ≤ 4 ммоль/л) наблюдалась практически линейная зависимость электропроводности от концентрации соли. Коэффициенты для расчета концентрации из значений удельной электропроводности составляли 1.46 × 10–5, 3.37 × 10–6 и 6.83 × 10–6 (моль/л)/(мкСм/cм) для додецилсульфата натрия (ДСН), K2SO4 и KCl соответственно. Погрешность нахождения концентрации определялась в основном колебаниями температуры, составлявшими ±1°С. Диффузию неионогенного поверхностно-активного вещества (ПАВ) – полиоксиэтилен-4-нонилфенилового эфира c десятью оксиэтиленовыми звеньями (ПОЭНФЭ10) измеряли, периодически регистрируя оптическое поглощение раствора в правой половине ячейки [24]. Растворы находились в равновесии с окружающим воздухом и имели pH в диапазоне от 5.6 до 6.5. Диффузионную проницаемость мембран рассчитывали в предположении отсутствия неперемешиваемых слоев. Для проверки провели несколько диффузионных экспериментов с крупнопористой мембраной (ТМ-2000), радиус пор которой несоизмеримо больше толщины ДЭС. Получили значения, близкие к справочным величинам объемных коэффициентов диффузии (они приведены в нижней части табл. 4). Подчеркнем, что методика не гарантирует погрешности в определении диффузионной проницаемости, меньшей ±10%, поскольку вариации пористости мембраны вносят определяющий вклад в суммарную ошибку.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
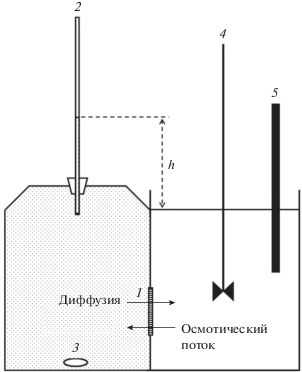
На рис. 3а представлены диаграммы роста уровня раствора, вызванного осмотическим течением через мембрану ТМ-25. Примерно через 7 ч уровень достигает предельного значения hmax, которое соответствует величине осмотического давления ΔΠизм, характерного для данного раствора и данной мембраны. Рисунок 3б показывает временную зависимость концентрации электролита в правой половине ячейки, которая растет линейно на всем исследованном интервале. Изменение объема раствора в левой половине ячейки не превышает 1 мл, а рост концентрации электролита в правой половине ячейки к моменту достижения hmax составляет около 1% от концентрации в левой половине ячейки. Таким образом, оба процесса – осмотическое течение воды и встречная диффузия электролита – происходят при практически постоянном значении движущей силы. Такие диаграммы были записаны для различных электролитов в нескольких разных концентрациях и трех ТМ с разными диаметрами пор. Измеренные значения осмотических давлений сведены в табл. 2–4. Коэффициент отражения (“reflection coefficient”, [1–7]) рассчитывали как отношение измеренного осмотического давления ΔΠизм к идеальному, ΔΠ = icRT:
где i – коэффициент, учитывающий диссоциацию соли, c – молярная концентрация, R – газовая постоянная, T – абсолютная температура.Рис. 3.
(а) Временны'е зависимости уровня раствора в левой половине измерительной ячейки для растворов K2SO4 концентрацией 1 (кривая 1) и 2 ммоль/л (кривая 2); (б) измеренные параллельно зависимости концентрации K2SO4 в правой половине ячейки. Мембрана ТМ-25.
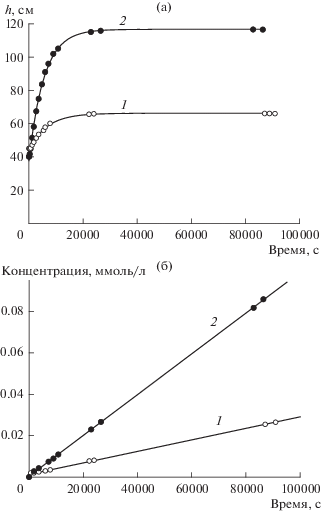
Таблица 2.
Осмотическое давление, коэффициент отражения и диффузионная проницаемость мембраны ТМ-25
| Растворенное вещество |
Концентрация, ммоль/л | Высота столба hmax, м |
Осмотическое давление ΔΠизм, кПа |
Идеальное осмотическое давление, кПа | Коэффициент отражения, σ | Диффузионная проницаемость, см2 c–1 |
|---|---|---|---|---|---|---|
| ДДДН | 1.00 | 0.636 | 6.21 | 7.38 | 0.84 | – |
| 2.00 | 1.13 | 11.1 | 14.8 | 0.75 | – | |
| 4.00 | 1.94 | 18.9 | 29.5 | 0.64 | – | |
| K2SO4 | 1.00 | 0.661 | 6.45 | 7.38 | 0.87 | 7.0E-07 |
| 2.00 | 1.14 | 11.2 | 14.8 | 0.76 | 1.3E-06 | |
| 3.95 | 1.70 | 16.6 | 29.2 | 0.57 | 2.6E-06 | |
| ДСН | 1.00 | 0.384 | 3.75 | 4.92 | 0.76 | 1.0E-06 |
| 2.00 | 0.726 | 7.09 | 9.84 | 0.72 | 1.2E-06 | |
| 4.00 | 1.24 | 12.1 | 19.7 | 0.62 | 1.7E-06 | |
| KCl | 1.00 | 0.378 | 3.69 | 4.92 | 0.75 | 2.1E-06 |
| 2.00 | 0.606 | 5.92 | 9.84 | 0.60 | 4.0E-06 | |
| 4.00 | 0.872 | 8.52 | 19.7 | 0.43 | 5.0E-06 | |
| ПОЭНФЭ10 | 3.00 | ≤0.03 | ≤0.3 | 7.38 | – | 2.40E-07 |
Таблица 3.
Осмотическое давление, коэффициент отражения и диффузионная проницаемость мембраны ТМ-40
| Растворенное вещество |
Концентрация, ммоль/л | Высота столба hmax, м |
Осмотическое давление ΔΠизм, кПа |
Идеальное осмотическое давление, кПа | Коэффициент отражения σ | Диффузионная проницаемость, см2 с–1 |
|---|---|---|---|---|---|---|
| K2SO4 | 0.50 | 0.322 | 3.15 | 3.69 | 0.85 | 1.2E-06 |
| 1.00 | 0.539 | 5.26 | 7.38 | 0.71 | 2.2E-06 | |
| 2.00 | 0.803 | 7.84 | 14.8 | 0.53 | 3.7E-06 | |
| 4.00 | 0.939 | 9.17 | 29.5 | 0.31 | 6.0E-06 | |
| ДСН | 1.00 | 0.341 | 3.33 | 4.92 | 0.68 | 1.8E-06 |
| 4.00 | 0.889 | 8.68 | 19.7 | 0.44 | 3.0E-06 | |
| 8.20 | 1.27 | 12.4 | 40.3 | 0.31 | 3.7E-06 | |
| KCl | 2.00 | 0.405 | 3.96 | 9.84 | 0.40 | 6.4E-06 |
| 4.00 | 0.611 | 5.97 | 19.7 | 0.30 | 8.0E-06 | |
| Сахароза | 2.00 | ≤0.1 | ≤1 | 4.92 | – | – |
| ПОЭНФЭ10 | 2.77 | ≤0.04 | ≤0.4 | 6.81 | – | – |
Таблица 4.
Осмотическое давление, коэффициент отражения и диффузионная проницаемость ТМ с диаметром пор 100 и 2000 нм
| Мембрана | Растворенное вещество |
Концентрация, ммоль/л |
Высота столба hmax, м |
Осмотическое давление ΔΠизм, кПа | Идеальное осмотическое давление, кПа | Коэффициент отражения σ | Диффузионная проницаемость, см2 c–1 |
|---|---|---|---|---|---|---|---|
| ТМ-100 | K2SO4 | 0.25 | 0.050 | 0.48 | 1.84 | 0.26 | 2.3E-06 |
| 0.50 | 0.108 | 1.06 | 3.69 | 0.29 | 2.9E-06 | ||
| 1.00 | 0.124 | 1.21 | 7.38 | 0.16 | 3.6E-06 | ||
| 2.00 | 0.111 | 1.09 | 14.8 | 0.07 | 4.4E-06 | ||
| 4.00 | 0.115 | 1.12 | 29.5 | 0.04 | 4.5E-06 | ||
| ДСН | 0.26 | 0.036 | 0.35 | 1.26 | 0.28 | 3.1E-06 | |
| 0.51 | 0.081 | 0.79 | 2.52 | 0.31 | 2.9E-06 | ||
| 1.03 | 0.088 | 0.86 | 5.04 | 0.17 | 2.5E-06 | ||
| 2.05 | 0.111 | 1.08 | 10.1 | 0.11 | 3.0E-06 | ||
| 3.08 | 0.165 | 1.61 | 15.1 | 0.11 | 2.9E-06 | ||
| 4.10 | 0.190 | 1.86 | 20.2 | 0.09 | 2.8E-06 | ||
| 8.20 | 0.193 | 1.88 | 40.3 | 0.05 | 3.0E-06 | ||
| 14.50 | 0.192 | 1.88 | 71.3 | 0.03 | 2.5E-06 | ||
| KCl | 2.00 | 0.087 | 0.85 | 9.84 | 0.09 | 5.4E-06 | |
| Сахароза | 2.00 | <0.01 | <0.1 | 4.92 | – | – | |
| ПОЭНФЭ10 | 4.00 | <0.01 | <0.1 | 9.84 | – | 1.3E-07 | |
| ТМ-2000 | KCl | 2.00 | – | – | – | – | 1.3E-05 |
| 4.00 | – | – | – | – | 1.7E-05 | ||
| 8.00 | – | – | – | – | 2.1E-05 | ||
| ПОЭНФЭ10 | 4.00 | – | – | – | – | 7.1E-06 |
Одновременно с осмотическим потоком воды из правой половины ячейки в левую имеет место встречный диффузионный транспорт электролита. Разница в наклонах прямых 1 и 2 на рис. 3б существенно превышает фактор 2, что обусловлено разными значениями диффузионной проницаемости. Тенденция уменьшения кажущегося коэффициента диффузии с понижением концентрации обнаруживается на всех трех ТМ с порами ≤100 нм и для всех исследованных электролитов (см. последние колонки в табл. 2–4). Эта закономерность обусловлена хорошо известным эффектом исключения коионов из пор в результате действия электрического поля [25]. При химическом травлении треков в ПЭТФ-пленке разрывы сложноэфирных связей приводят к образованию концевых карбоксильных групп [26]. При pH > 4 карбоксильные группы находятся в диссоциированной форме, благодаря чему фронтальная поверхность ТМ и стенки пор покрыты “сеткой” отрицательных элементарных зарядов. Поверхностная плотность заряда в полиэтилентерефталатных ТМ по оценкам, проведенным различными методами, находится в интервале примерно от 0.1 до 1 элементарного заряда на 1 нм2 [27–33].
Очевидно, что ДЭС обуславливает и наблюдаемый осмотический эффект. Как следует из экспериментальных данных, при низких концентрациях электролита ТМ с наименьшими порами развивает осмотическое давление, близкое к идеальному (см. табл. 2). Так, для раствора K2SO4 концентрацией 1 ммоль/л в мембране ТМ-25 коэффициент отражения составляет 0.87. В этом случае радиус пор и дебаевская длина близки по величине. С ростом концентрации электролита коэффициент отражения падает, что связано со сжатием ДЭС в порах мембраны. О решающей роли электростатического механизма в осмотическом эффекте свидетельствует и тот факт, что при одинаковой молярной концентрации 1-1-валентного электролита (KCl) и 1-2-валентного электролита (K2SO4) коэффициент отражения принимает большее значение во втором случае. Растворы неэлектролитов – сахарозы и ПОЭНФЭ10 – при аналогичных концентрациях вызывают лишь незначительные изменения уровня жидкости в измерительном капилляре.
Представляет интерес также сравнение осмотических эффектов, вызываемых сорбирующимся и несорбирующимся (слабо сорбирующимся) электролитами. На рис. 4а представлены концентрационные зависимости измеренного осмотического давления растворов KCl и ДСН. При низких концентрациях (≤1 ммоль/л) осмотическое давление близко к идеальному и одинаково у обоих электролитов. При увеличении концентрации до 4 ммоль/л проявляется существенная разница, заключающаяся в том, что осмотическое давление выше у раствора ДСН. По всей вероятности, сорбция аниона додецилсульфата на поверхности ТМ приводит к увеличению плотности электрического заряда. Известно, что при концентрациях порядка 1 ммоль/л и выше додецилсульфат-ионы, хотя и являются коионами по отношению к отрицательно заряженной поверхности полимера, способны сорбироваться за счет гидрофобного взаимодействия [34, 35]. Сорбция существенно растет при приближении к критической концентрации мицеллообразования, равной 8 ммоль/л [35]. Рост плотности поверхностного заряда ведет к росту селективности мембраны, как и предсказывает теория [10]. Аналогичный эффект можно наблюдать в случае 1-2-валентных электролитов и более крупных пор (рис. 4б). Растворы другого ПАВ, додецилдифенилоксид дисульфоната натрия (ДДДН), развивают вдвое большее осмотическое давление, чем растворы сульфата калия, причем максимальное значение достигается уже при концентрации 1–2 ммоль/л. Заметим, что при с = 1 ммоль/л дебаевская длина для 1-2-валентного электролита равна 5.6 нм, что составляет лишь примерно 11% от радиуса пор мембраны ТМ-100. Тем не менее, эффект исключения анионов из пор приводит к генерации заметного осмотического потока. Такой результат можно было ожидать из закономерностей сорбции ДДДН в порах ТМ [36]. В этой работе было установлено, что при концентрациях ПАВ ∼ 0.1 ммоль/л и отсутствии фонового электролита сорбция данного ПАВ в порах с эффективным радиусом ≈ 130 нм исчезающе низка.
Рис. 4.
(а) Зависимости измеренного осмотического давления от концентрации 1-1-валентных электролитов – ДСН (2) и KCl (3), прямая 1 соответствует идеальному осмотическому давлению для 1-1-валентного электролита; мембрана ТМ-25. (б) То же для 1-2-валентных электролитов – ДДДН (2) и K2SO4 (3); мембрана ТМ-100.
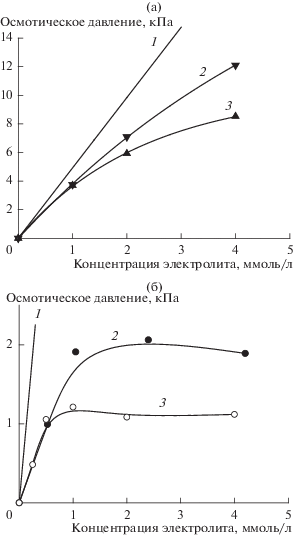
Рассмотрим динамику поднятия столба раствора в измерительном капилляре в процессе осмоса. Согласно теории [1–4], объемный поток жидкости через мембрану Jv находится как
(2)
${{J}_{{{\text{v}}\quad}}} = {{L}_{{\text{p}}}}\left[ {\sigma \Delta {\text{П }} - \Delta P} \right],$При высоте h столба жидкости плотностью ρ перепад гидростатического давления на мембране составит
где $g$ – ускорение свободного падения. Вводя величину объема жидкости в измерительном капилляре Qv и площадь сечения капилляра Sc, выражаем гидростатическое давление через эти величины:Учитывая, что $\sigma \Delta {\text{П }}$ = $\Delta {{{\text{П }}}_{{{\text{и з м }}}}} = \quad$ hmax$g\rho $, а Jv = = dQv/dt, легко прийти к формуле, описывающей изменение во времени высоты столба раствора в капилляре под действием осмотического давления, которое компенсируется изменяющимся во времени гидростатическим давлением:
(5)
$h\left( t \right) = {{h}_{{{\text{max}}}}}\left[ {1 - {{e}^{{{{ - t} \mathord{\left/ {\vphantom {{ - t} {\tau }}} \right. \kern-0em} {\tau }}}}}} \right].$Здесь hmax – предельное значение высоты столба жидкости, t – время, τ – параметр, зависящий от гидравлической проницаемости мембраны:
Обработка кривых h(t), полученных в экспериментах, показала, что рост высоты столба раствора во времени с хорошей точностью соответствует выражению (5). Аппроксимация экспериментальных данных экспонентой позволяет найти численное значение коэффициента гидравлической проницаемости Lp, который характеризует мембрану при осмотическом движении воды сквозь поры. С целью исследовать поведение величины Lp в разных режимах процедуру дальнейших экспериментов изменили следующим образом. Первая фаза эксперимента включала регистрацию изменяющейся высоты столба раствора h(t) в измерительном капилляре, когда левая половина ячейка заполнена исследуемым раствором, а правая – водой. После достижения раствором уровня hmax воду в правой половине ячейки заменяли на раствор, эквивалентный находящемуся в левой половине, уравнивая осмотичность по обе стороны ТМ. Вторая фаза эксперимента состояла в измерении уровня $h{\text{'(}}t)$, спадающего под действием гидростатического давления. Типичные результаты таких двухстадийных экспериментов представлены на рис. 5 и в табл. 5. Снижение уровня раствора на ниспадающей части кривой следует уравнению
где величина τ1 характеризует гидравлическую проницаемость мембраны в условиях вязкого течения под действием гидростатического давления. В последнем столбце табл. 5 представлены значения эффективного радиуса пор r, рассчитанные из величин Lp по формуле ПуазейляРис. 5.
Результаты измерений проницаемости ТМ при осмотическом течении (возрастающая ветвь функции h(t), кривая 1) и действии гидростатического давления (ниспадающая ветвь функции h'(t), кривая 2). Точки – экспериментальные данные, сплошные линии – аппроксимация формулами (5) и (7). (а) Раствор 4 ммоль/л K2SO4, мембрана ТМ-25; (б) раствор 4 ммоль/л KCl, мембрана ТМ-40.
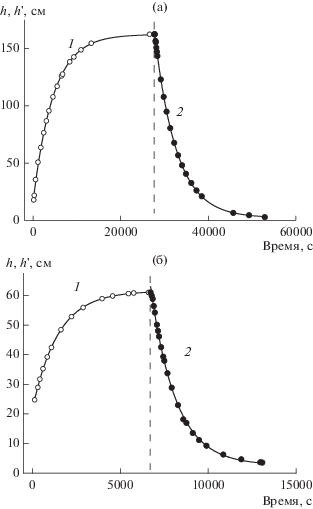
Таблица 5.
Гидравлическая проницаемость ТМ и эффективные радиусы пор при течении, вызываемом осмотическим и гидростатическим давлением
| Мембрана | Состав фаз по разные стороны мембраны | τ, с | τ1, с | Lp, 10–14 м4 с кг–1 | r, нм |
|---|---|---|---|---|---|
| ТМ-25 | 4 мМ KCl/H2O | 4298 ± 54 | 1.87 | 12.0 | |
| 4 мМ KCl/4 мМ KCl | 4387 ± 32 | 1.83 | 11.9 | ||
| 4 мМ ДСН/H2O | 8116 ± 48 | 0.99 | 10.1 | ||
| 4 мМ ДСН/4 мМ ДСН | 9141 ± 96 | 0.88 | 9.8 | ||
| 4 мМ K2SO4/H2O | 4605 ± 84 | 1.74 | 11.8 | ||
| 4 мМ K2SO4/4 мМ K2SO4 | 4989 ± 27 | 1.61 | 11.6 | ||
| ТМ-40 | 4 мМ K2SO4/H2O | 1245 ± 24 | 6.45 | 21.5 | |
| 4 мМ K2SO4/4 мМ K2SO4 | 1265 ± 12 | 6.35 | 21.4 | ||
| 4 мМ ДСН/H2O | 2012 ± 86 | 3.99 | 19.2 | ||
| 4 мМ ДСН/4 мМ ДСН | 1853 ± 46 | 4.33 | 19.6 | ||
| 4 мМ KCl/H2O | 1451 ± 8 | 5.53 | 21.0 | ||
| 4 мМ KCl/4 мМ KCl | 1438 ± 27 | 5.58 | 21.0 | ||
| ТМ-100 | 4 мМ ДСН/H2O | 100.0 ± 2.0 | 80.2 | 49.4 | |
| 4 мМ ДСН/4 мМ ДСН | 91.9 ± 5.6 | 87.3 | 50.5 |
Здесь N – число пор в образце, µ – коэффициент динамической вязкости. Вязкость растворов принимали равной вязкости воды при температуре опыта. Вследствие низкой концентрации растворов, в том числе растворов ПАВ, различие в вязкости было пренебрежимо малым [37].
Как видно в табл. 5, гидравлическая проницаемость мембран практически одинакова для обеих фаз эксперимента и соответствует режиму вязкого течения. Таким образом, осмотический поток через каналы пор ТМ является конвективным, а не диффузионным. В противоположность этому, авторы работы [15], используя набор ТМ Nuclepore и раствор не проникающего в поры высокомолекулярного соединения, нашли, что гидравлическая проницаемость при осмотическом течении прямо пропорциональна эффективной площади пор, то есть фактору Nπr 2. На основании этого факта был сделан вывод, что транспорт воды сквозь поры соответствует диффузионному механизму. Наши результаты со всей очевидностью указывают на противоположное: осмотическое давление, возникающее на границе мембрана/раствор соли, вызывает вязкое течение, гидравлическая проницаемость для которого пропорциональна Nπr 4. Заметим, что в наших экспериментах не было выявлено электровязкостного эффекта: пуазейлевский радиус пор, найденный в условиях течения воды, а также раствора соли в симметричных и асимметричных условиях, в пределах погрешностей измерений был одинаков. Если кажущееся изменение вязкости составляло лишь несколько процентов, то оно не могло быть достоверно зафиксировано в данных экспериментах.
В случае мембран ТМ-25 и ТМ-40 рассчитанные из гидравлической проницаемости эффективные радиусы пор принимают в среднем на ≈1.8 нм меньшие значения, когда электролитом выступает ДСН (см. последнюю колонку в табл. 5). Это может свидетельствовать о том, что адсорбционный слой ДСН на стенках сужает проходное сечение поры.
Представляет интерес сравнить абсолютные значения встречных потоков воды и соли в условиях осмотического течения. Например, для мембраны ТМ-25 и раствора K2SO4 концентрацией 2 ммоль/л осмотический поток воды в первые минуты эксперимента имеет величину 5 × 10–6 моль/с, а встречный диффузионный поток соли составляет лишь 2.5 × 10–10 моль/с. Таким образом, соотношение между потоками растворителя и растворенного вещества превышает 104 и по порядку величины примерно соответствует соотношению их мольных долей в растворе. Принимая радиус пор равным ∼10 нм, легко рассчитать усредненную по сечению поры скорость $v$ движения воды в канале. В данном эксперименте она составляет около 1 × 10–3 см/с. Грубую оценку продольного профиля концентрации соли c(x) в цилиндрической поре при наличии одновременных диффузионного и конвективного потоков можно получить, решая уравнение [17]
где D – коэффициент диффузии растворенного компонента в поре. Уравнение написано при упрощающих предположениях, что коэффициент диффузии не зависит от концентрации, а концентрация усредняется по поперечному сечению поры, то есть зависит только от х. Как показано в [17], если параметр ${v \mathord{\left/ {\vphantom {v D}} \right. \kern-0em} D}$ принимает значение, меньшее 1000 см–1, градиент концентрации в поре практически линеен, и конвективное движение не влияет на скорость диффузии. Если брать объемные значения коэффициентов диффузии использованных нами солей, условие ${v \mathord{\left/ {\vphantom {v D}} \right. \kern-0em} D}$ < 1000 всегда выполняется при скорости конвекции $v$ = = 1 × 10–3 см/с. Действительно, в большинстве наших экспериментов рост концентрации соли в правой половине ячейки происходил практически с постоянной скоростью независимо от скорости встречного осмотического потока (см. рис. 3б). Однако в некоторых случаях (4 ммоль/л ДСН, ТМ-25; 8 ммоль/л ДСН, ТМ-40) мы наблюдали достоверное увеличение диффузионного потока на 10–20%, коррелированное с уменьшением осмотического потока. По-видимому, в этих условиях начальная скорость конвективного потока была достаточно велика, чтобы повлиять на диффузию. При этом коэффициенты диффузии в нанопорах существенно ниже объемных значений, на что указывают данные в последних колонках табл. 2–4, а также литературные данные [23].Отметим, что ионная селективность ТМ с малыми порами и их обратноосмотические свойства были обнаружены и исследованы достаточно давно. Для этого использовали мембраны со значениями эффективного диаметра пор 8 и 3 нм, изготовленные особыми методами – термоусадкой обычной ТМ либо экстракцией низкомолекулярной фракции из облученной тяжелыми ионами ПЭТФ-пленки [10, 38]. В более поздней работе [39] селективность по отношению к растворам KCl (2.5 и 10 ммоль/л) была исследована для ТМ, чрезвычайно близкой по параметрам к нашему образцу ТМ-25. Однако процесс прямого осмоса на ТМ оставался без внимания до сих пор. В литературе мы нашли лишь одно беглое упоминание о возможной необходимости учета этого эффекта [35] при измерениях мембранного потенциала.
В связи с интерпретацией полученных нами результатов представляется необходимым упомянуть явление капиллярного осмоса. Теория капиллярного осмоса была развита для более широких капилляров, в которых транспорт жидкости носит характер капиллярно-осмотического скольжения [40]. Эксперименты по капиллярному осмосу в растворах электролитов были проведены с порами, радиус которых был примерно на два порядка больше, нежели в наших образцах ТМ [41]. Скорость капиллярно-осмотического транспорта при Δс = 10–3–0.5 ммоль/л имела порядок 10–5 см/с и слабо зависела от концентрации. Характер осмотического течения через нанопоры в наших образцах ТМ (пуазейлевский поток, скорость ∼10–3 см/с и выше) показывает, что для условий, когда протяженность диффузных ионных слоев сравнима с радиусом капилляра или превышает его, требуется иная модель.
В литературе имеется ряд теоретических моделей, описывающих осмос в нанопорах или наноканалах с заряженными стенками, например [42–45]. В настоящей работе мы не ставим своей целью детально проанализировать результаты в плане их соответствия той или иной модели. На данном этапе исследования представляется важным зафиксировать факт, что ТМ с радиусами пор 10–50 нм показали себя удобным объектом для изучения осмотических эффектов, вызываемых градиентом концентрации электролита. Правильная цилиндрическая геометрия пор дала возможность идентифицировать пуазейлевский режим течения, который является индикатором параболического распределения скорости жидкости в поре, в то время как теория предсказывает, вообще говоря, иную форму профиля скоростей [5, 42, 45]. Применение ионогенного ПАВ позволило наблюдать эффекты, связанные с изменением плотности поверхностного заряда. Использование этих возможностей в дальнейших экспериментах с ТМ, вкупе с расширением диапазона исследуемых концентраций, а также применением других электролитов, в частности 2-1-валентных, даст дополнительные критерии, по которым можно будет судить об адекватности той или иной модели.
Более глубокое понимание физико-химических процессов в нанокапиллярах при градиенте концентрации растворенного вещества важно и в связи с конкретными практическими задачами. Например, направленное использование осмотических эффектов позволяет регулировать форму асимметричных нанопор [17], применяемых в качестве рабочего элемента молекулярных сенсоров.
Полученное в настоящей работе подтверждение определяющей роли ДЭС может помочь в понимании осмотических явлений, сопровождающих асимметричное травление треков тяжелых ионов. Формирующиеся в этом процессе конические поры обладают низким сопротивлением вязкому течению. Вследствие этого скорость конвективного потока в устье поры может быть достаточно высока, чтобы обеспечить разбавление электролита и увеличение толщины ДЭС до размера, сравнимого с радиусом устья, несмотря на то, что для травления используют концентрированные растворы.
4. ЗАКЛЮЧЕНИЕ
Подавляющее большинство исследований осмотических явлений проводят с полупроницаемыми мембранами. В настоящей работе мы исследовали осмотические потоки через трековые, то есть капиллярно-пористые, мембраны и продемонстрировали, что при тех концентрациях электролита, когда толщина ДЭС сравнима с радиусом пор, осмотический транспорт воды может быть весьма существенным. Необходимая для этого селективность мембраны полностью обусловлена электрическим зарядом ее поверхности. Плотность заряда может быть дополнительно повышена применением раствора ионогенного ПАВ. Правильная геометрия пор в ТМ позволила провести эксперименты, адресно направленные на выяснение механизма течения, вызванного осмотической движущей силой. Они показали, что осмотическое течение через нанокапилляры радиусом 10–50 нм является чисто конвективным.
Авторы благодарят О.Л. Ореловича и Н.Е. Лизунова за помощь в исследовании ТМ методом РЭМ.
Список литературы
Wijmans J.G., Baker R.W. // J. Membr. Sci. 1995. V. 107. P. 1.
Cath T.Y., Childress A.E., Elimelech M. // J. Membr. Sci. 2006. V. 281. P. 70.
Mauro A. // Science. 1957. V. 126. P. 252.
Anderson J.L., Malone D.M. // Biophys. J. 1974. V. 14. P. 957.
Marshall E.A. // J. Theor. Biol. 1977. V. 66. P. 107.
Thomas S.R., Mikulecky D.C. // Microvasc. Res. 1978. V. 15. P. 207.
Schultz J.S., Valentine R., Choi C.Y. // J. Gen. Physiol. 1979. V. 75. P. 49.
Hill A. // Proc. R. Soc. Lond. B. 1989. V. 237. P. 369.
Hill A. // J. Membr. Biol. 1994. V. 137. P. 197.
Yaroshchuk A.E. // Adv. Colloid Interface Sci. 1995. V. 60. P. 1.
Guell D.C., Brenner H. // Ind. Eng. Chem. Res. 1996. V. 35. P. 3004.
Kramer E.M., Myers D.R. // Am. J. Phys. 2012. V. 80. P. 694.
Kramer E.M., Myers D.R. // Trends Plant Sci. 2013. V. 18. P. 195.
Zeman L., Wales M. // Sep. Sci. Technol. 1981. V. 16. P. 275.
Comper W.D., Williams R.P.W. // Biophys. Chem. 1990. V. 36. P. 215.
Apel P.Y., Bashevoy V.V., Blonskaya I.V., Lizunov N.E., Olejniczak K., Orelovitch O.L., Trautmann C. // Phys. Chem. Chem. Phys. 2016. V. 18. P. 25421.
Apel P.Y., Blonskaya I.V., Lizunov N.E., Olejniczak K., Orelovitch O.L., Tomil-Molares M.E., Trautmann C. // Small. 2018. V. 14. P. 1703327.
Apel P.Yu., Korchev Yu.E., Siwy Z., Spohr R., Yoshida M. // Nucl. Instrum. Meth. Phys. Res. B. 2001. V. 184. P. 337.
Гусинский Г.М., Кремер Е.Б., Кремер М.И., Мчедлишвили Б.В. // Инж.-физ. журн. 1979. Т. 37. С. 1119.
Apel P. // Radiat. Meas. 2001. V. 34. P. 559.
Beck R.E., Schultz J.S. // Biochim. Biophys. Acta. 1972. V. 255. P. 273.
Apel P.Y. // Encyclopedia of Membrane Science and Technology. Ed. by Hoek E.M.V. and Tarabara V.V. New Jersey: John Wiley and Sons, 2013. P. 332.
Schoenenberger C., van der Zande B.M.I., Fokkink L.G.J., Henny M., Schmid C., Krueger M., Bachtold A., Huber R., Birk H., Staufer U. // J. Phys. Chem. B. 1997. V. 101. P. 5497.
Yamauchi Yu., Блонская И.В., Апель П.Ю. // Коллоид. журн. 2017. Т. 79. С. 668.
Plecis A., Schoch R.B., Renaud P. // Nano Lett. 2005. V. 5. P. 1147.
Lück H.B. // Nucl. Instrum. Meth. Phys. Res. 1983. V. 213. P. 507.
Apel P.Yu., Pretzsch G. // Nucl. Tracks Radiat. Meas. 1986. V. 11. P. 45.
Березкин В.В., Киселева О.А., Нечаев А.Н., Соболев В.Д., Чураев Н.В. // Коллоид. журн. 1994. Т. 56. С. 319.
Geissman C., Ulbricht M. // Macromol. Chem. Phys. 2005. V. 206. P. 268.
Dejardin P., Vasina E.N., Berezkin V.V., Sobolev V.D., Volkov V.I. // Langmuir. 2005. V. 21. P. 4680.
Yaroshchuk A.E., Zhukova O., Ulbricht M., Ribitsch V. // Langmuir. 2005. V. 21. P. 6872.
Cervera J., Alcaraz A., Schiedt B., Neumann R., Ramirez P. // J. Phys. Chem. C. 2007. V. 111. P. 12265.
Xue J., Xie Y., Yan Y., Ke J., Wang Y. // Biomicrofluidics. 2009. V. 3. 022408.
Keesom W.H., Zelenka R.L., Radtke C.J. // J. Colloid Interface Sci. 1988. V. 123. P. 575.
Сидорова М.П., Ермакова Л.Э., Савина И.А., Мчедлишвили Б.В. // Коллоид. журн. 1990. Т. 52. С. 895.
Yamauchi Yu., Apel P.Yu. // Colloid J. 2017. V. 79. P. 286.
Ito T., Mizutani Y. // Jpn. Oil Chem. Soc. 1968. V. 17. P. 246 (in Japanese).
Березкин В.В., Нечаев А.Н., Фомичев С.В., Мчедлишвили Б.В., Житарюк Н.И. // Коллоид. журн. 1991. Т. 53. С. 339.
Yaroshchuk A., Boiko Y., Makovetsky A. // Langmuir. 2009. V. 25. P. 9605.
Дерягин Б.В., Чураев Н.В., Муллер В.М. Поверхностные силы. М.: Наука, 1985.
Дерягин Б.В., Коптелова М.М., Муллер В.М., Тихомолова К.П. // Коллоид. журн. 1977. Т. 39. С. 1060.
Sasidhar V., Ruckenstein E. // J. Colloid Interface Sci. 1981. V. 82. P. 439.
Sasidhar V., Ruckenstein E. // J. Colloid Interface Sci. 1982. V. 85. P. 332.
Qian S., Das B., Luo X. // J. Colloid Interface Sci. 2007. V. 315. P. 721.
Liu K.-L., Hsu J.-P., Tseng S. // Langmuir. 2013. V. 29. P. 9598.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал