Коллоидный журнал, 2019, T. 81, № 1, стр. 115-124
Особенности взаимодействия мицелл бромида додецилтриметиламмония с 4-стиролсульфонатом натрия
Ю. В. Шулевич 1, *, Ю. А. Захарова 2, М. В. Мотякин 3, И. С. Ионова 3, Е. Г. Духанина 1, А. В. Навроцкий 1, И. А. Новаков 1
1 Волгоградский государственный технический университет
400005 Волгоград, просп. Ленина, 28, Россия
2 Московский государственный университет имени М.В. Ломоносова, химический факультет
119992 Москва, Ленинские горы, Россия
3 Институт химической физики им. Н.Н. Семенова РАН
119991 Москва, ул. Косыгина, 4, Россия
* E-mail: shulevich@vstu.ru
Поступила в редакцию 31.05.2018
Аннотация
Методами ЭПР-спектроскопии спиновых зондов и УФ-спектроскопии изучено взаимодействие гидрофобного анионного мономера, стиролсульфоната натрия, с мицеллами катионного ПАВ, бромида додецилтриметиламмония. Показано, что в результате взаимодействия с мономером критическая концентрация мицеллообразования ПАВ в водных растворах снижается. Установлено, что мономер встраивается в мицеллу, поэтому присутствие ПАВ может препятствовать полимеризации мономера.
ВВЕДЕНИЕ
Свободнорадикальная полимеризация является наиболее распространенным способом получения полимеров, в том числе и полиэлектролитов. Различные методы ее осуществления и большое разнообразие мономеров, инициаторов, ингибиторов и агентов передачи цепи позволяет синтезировать полимеры различных молекулярной массы, состава и строения. Однако в свободнорадикальной полимеризации достаточно трудно контролировать молекулярно-массовые характеристики получаемых полимеров, к тому же продукты синтеза отличаются высокой полидисперсностью. Поэтому в современной химии высокомолекулярных соединений все более актуальной становится разработка новых способов контролируемой полимеризации, позволяющих получать полимеры заданной молекулярной массы с относительно узким молекулярно-массовым распределением.
Перспективным способом синтеза полимеров с высокой молекулярной массой и низким коэффициентом полидисперсности является матричная полимеризация. Ее основные принципы [1, 2] развиты на примере виниловых мономеров, способных образовывать с матрицей водородные связи или ионные пары. В качестве матрицы используют структурно и химически комплементарные макромолекулы поливинилового спирта, поли(мет)акриловой кислоты, полистиролсульфоната натрия и других полимеров. В этом случае продукт полимеризации представляет собой стехиометричный полиэлектролитный комплекс, который, как правило, нерастворим в большинстве известных органических растворителей, что существенно затрудняет процесс выделения дочернего полимера. Возможным вариантом решения этой проблемы является использование в качестве матрицы мицелл поверхностно-активных вещества (ПАВ).
Ранее в работах [3, 4] было изучено взаимодействие катионного мономера с мицеллами додецилсульфата натрия и показано, что мономер связывается с мицеллами противоположно заряженного ПАВ и формирует на их поверхности слой противоионов. На основании полученных данных был сделан вывод о принципиальной возможности осуществления радикальной полимеризации в присутствии мицелл ПАВ и определены оптимальные условия, при которых процесс будет протекать преимущественно по матричному механизму. Действительно, как было показано затем в работе [5], полиэлектролиты, синтезированные в таких условиях, характеризуются меньшими значениями молекулярной массы и коэффициента полидисперсности по сравнению с полиэлектролитами, получаемыми свободнорадикальной полимеризацией в водных растворах. В то же время общие закономерности радикальной полимеризации с использованием в качестве матриц мицелл противоположно заряженных ПАВ в настоящее время изучены явно недостаточно. Вопросы, связанные с влиянием химической структуры ПАВ и мономера, соотношения их концентраций и других факторов на полимеризацию в присутствии ПАВ, являются открытыми, что стимулирует дальнейшие исследования в данной области.
Целью данной работы является изучение влияния анионного мономера на формирование, структуру и локальную динамику мицелл катионного ПАВ в широком диапазоне концентраций и составов смеси.
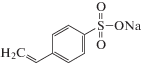
Отметим, что сведения о возможности матричной полимеризации анионных мономеров в мицеллярных растворах катионных ПАВ, насколько нам известно, в литературе отсутствуют. Среди анионных мономеров особый интерес представляет стиролсульфонат натрия (CCNa), прежде всего, в связи с широким практическим применением полимеров на его основе. Кроме того, молекула CCNa содержит гидрофобное ароматическое кольцо, способное встраиваться в мицеллы противоположно заряженного ПАВ [6] и, таким образом, существенно влиять как на связывание, так и на структуру образующихся продуктов. В качестве катионных ПАВ целесообразно применение четвертичных аммониевых солей – алкилтриметиламмония галогенидов, устойчивых в широком интервале рН, например додецилтриметиламмония бромида (ДДТАБ).
В качестве основного метода исследования в работе был выбрана ЭПР-спектроскопия спиновых зондов, которая широко используется при изучении мицеллярных систем [7], т.к. параметры ЭПР-спектров зондов (время корреляции вращения и константа сверхтонкого взаимодействия (СТВ)) чувствительны к образованию мицелл и их строению.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Мономер – 4-стиролсульфонат натрия (Sigma-Aldrich, Германия) предварительно перекристаллизовывали из смеси (1 : 3) воды и этилового спирта. Выделенную соль высушивали под вакуумом (1.5−2.0 мм рт. ст.) при температуре 20 ± ± 0.5°C до постоянной массы. Структурная формула CCNa представлена ниже.
ДДТАБ (ABCR, Германия) использовали без дополнительной очистки.
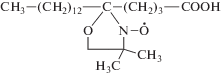
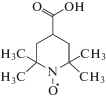
В качестве зондов были выбраны стабильные нитроксильные радикалы: 5-доксилстеариновая кислота (5-ДСК) и 4-карбокси-ТЕМПО (4-СТ) (Sigma-Aldrich, Германия), структурные формулы которых приведены ниже.
Согласно [8] гидрофобный зонд 5-ДСК встраивается в мицеллу ПАВ таким образом, что его карбоксильная группа находится вблизи заряженных групп мицеллы, а нитроксильная группа локализована глубже примерно на 5−7 Å.
Зонд 4-СТ является слабой кислотой (pKa = = 4.03) и в зависимости от рН раствора может существовать как в протонированной, так и в депротонированной форме [9]. Однако, как показывают данные потенциометрии, значения pH водных растворов ПАВ, мономера и их смесей независимо от концентрации компонентов или их мольного соотношения оказываются всегда выше pH 5, т.е. больше pKa зонда. Поэтому в исследуемых системах зонд 4-СТ находится в ионизированной (депротонированной) форме. Более того, поскольку зонд и катион ДДТАБ заряжены противоположно, можно полагать, что зонд будет связываться с мицеллой ПАВ за счет электростатических взаимодействий.
ЭПР спектры Х-диапазона регистрировали на автоматизированном спектрометре Радиопан (Польша) при 20°С. Каждый спектр содержал 1024 оцифрованные точки. Время оцифровки одной точки составляло 64 мс при постоянной времени записи 0.1 с. Значение микроволновой мощности в резонаторе, чтобы избежать эффектов насыщения, не превышало 3 мВт. При записи спектров амплитуда модуляции всегда была существенно меньше ширины резонансной линии и не превышала 0.5 Гс.
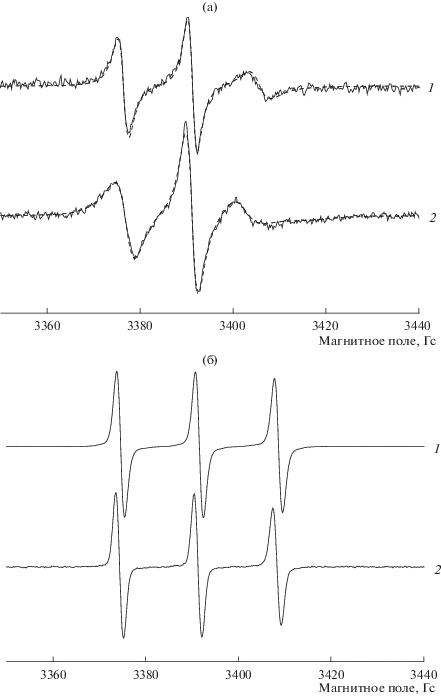
Анализ спектров зонда 5-ДСК проводили путем сопоставления экспериментальных спектров с теоретическими, рассчитанными в рамках определенной модели с помощью программы, разработанной Фридом с сотр. [10]. С учетом геометрии радикала была выбрана модель анизотропного броуновского вращения. Главные значения g-тензора и тензора СТВ зонда 5-ДСК были следующими: gxx = 2.0088, gyy = 2.0061, gzz = 2.0027, Ахх = 6 Гс, Ayy = 5.5 Гс, Azz = 33.5 Гс [11]. Константы СТВ варьировали в процессе моделирования в диапазоне ±0.5 Гс таким образом, чтобы среднее значение (Axx + Ayy + Azz)/3 совпадало с экспериментальным значением константы изотропного СТВ, aN. Рассчитанные спектры 5-ДСК хорошо совпадали с экспериментальными (рис. 1).
Рис. 1.
(а) Экспериментальные (сплошные линии) и рассчитанные (пунктирные линии) ЭПР-спектры зонда 5-ДСК: 1 – в 25 мМ водном растворе ДДТАБ, 2 – в смешанном водном растворе ДДТАБ (25 мМ) и ССNa (250 мМ); (б) экспериментальные спектры зонда 4-СТ в воде (1) и в 25 мМ мицеллярном растворе ДДТАБ (2).
Времена корреляции вращения, τ, зонда 4-СТ определяли по известной формуле [12]
Ошибка рассчитанных значений времени корреляции вращения в обоих случаях составляла примерно 7% от измеряемой величины, константу изотропного СТВ, aN, определяли с точностью 0.05 Гс. Примеры теоретических и экспериментальных спектров использованных зондов приведены на рис. 1.
Оптическую плотность растворов измеряли с помощью спектрофотометра Cary 60 UV-Vis (Agilent Technologies, США). Концентрацию растворов и толщину кюветы подбирали таким образом, чтобы регистрируемая оптическая плотность A не превышала 1.
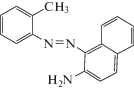
В работе использовали маслорастворимый краситель Oil Yellow OB, структурная формула которого приведена ниже.
Для изучения солюбилизации навеску красителя (3−5 мг) помещали в исследуемый раствор, который выдерживали до достижения равновесного значения оптической плотности (7−10 дней). Перед измерением оптической плотности исследуемые растворы центрифугировали (10 000 об./мин, 30 мин) для удаления избытка красителя.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 представлены времена корреляции вращения зондов 5-ДСК и 4-СТ и их константы СТВ в растворителях с различной диэлектрической проницаемостью, в водных растворах мономера, а также в мицеллярных растворах ДДТАБ в присутствии и в отсутствие CCNa.
Таблица 1.
Времена корреляции вращения (τ) и константы СТВ (аN) зондов 5-ДСК и 4-СТ в различных средах
| Система | ККМ, мМ |
С, мМ | 5-ДСК | 4-СТ | |||
|---|---|---|---|---|---|---|---|
| τ × 1010, с | aN, Гс | τ × 1010, с | aN, Гс | ||||
| Вода | − | 0.8 | 15.9 | 0.40 | 17.1 | ||
| Этанол | 1.0 | 15.1 | 0.6 | 16.2 | |||
| Бутанол | 1.1 | 14.8 | – | – | |||
| Гексан | 1.0 | 14.0 | – | – | |||
| Растворы мономера | − | 10 | 0.85 | 15.8 | 0.4 | 17.1 | |
| 100 | 1.0 | 15.7 | 0.4 | 17.1 | |||
| 500 | 1.3 | 15.6 | 0.5 | 17.1 | |||
| 1000 | 2.1 | 15.5 | 0.5 | 17.0 | |||
| Растворы ДДТАБ | 15.6 | Ниже ККМ | 5 | 0.8 | 15.9 | 0.40 | 17.1 |
| Выше ККМ | 25 | 8.4 | 15.0 | 1.3 | 16.9 | ||
| 50 | 8.4 | 15.0 | 1.9 | 16.9 | |||
| 100 | 8.4 | 15.0 | 1.9 | 16.7 | |||
| 250 | 9.4 | 15.0 | 1.9 | 16.7 | |||
| Растворы смеси Na2SO4/ДДТАБ = 1/1 |
12 | 12 | 10.0 | 15.1 | – | – | |
| Растворы смеси ССNa/ДДТАБ = 1/1 |
3.0 | 3.0 | 17.0 | 14.9 | 0.4 | 17.1 | |
| 25 | 21 | 14.8 | 0.4 | 17.1 | |||
| 50 | 20 | 14.8 | 0.5 | 17.1 | |||
| 100 | 19 | 14.8 | 0.6 | 17.1 | |||
| 250 | 17 | 14.7 | 0.6 | 17.1 | |||
Как следует из данных, приведенных в табл. 1, формирование мицелл ДДТАБ в водном растворе приводит к значительным изменениям параметров ЭПР-спектров зондов, обусловленным их связыванием с мицеллами. Как уже было отмечено выше, зонд 5-ДСК локализуется внутри мицеллы, а его парамагнитный фрагмент располагается в приповерхностном внутреннем слое мицеллы. Связывание с мицеллами вызывает увеличение времени корреляции вращения зонда 5-ДСК на порядок, что свидетельствует об ограничении локальной подвижности катионов ПАВ при формировании мицелл, а уменьшение aN вызвано снижением локальной диэлектрической проницаемости вблизи парамагнитных фрагментов молекул зонда, расположенных внутри мицелл.
Время корреляции вращения зонда 4-СТ при взаимодействии с мицеллой изменяется значительно меньше, в 4 раза по сравнению с водным раствором, что позволяет предположить, что этот зонд не солюбилизируется мицеллой ДДТАБ, но находится вблизи ее поверхности, возможно, в конденсированном слое противоионов. Отметим, что полярность локального микроокружения зонда 4-СТ при связывании с мицеллами также незначительно уменьшается.
Полученные результаты показывают, что зонды 4-СТ и 5-ДСК чувствительны к образованию мицелл ДДТАБ, и подтверждают правильность их выбора для данного исследования.
Растворы мономера
Совершенно неожиданно было обнаружено, что рост концентрации водного раствора мономера также приводит к изменениям параметров вращения зондов. Незначительные изменения параметров вращения гидрофильного зонда 4-СТ вызваны, по всей видимости, просто изменениями макроскопических свойств системы (вязкости и диэлектрической проницаемости) с ростом концентрации мономера до 0.5−1 М. Однако увеличение значений времени корреляции вращения зонда 5-ДСК в 2.5 раза, свидетельствующее о заметном уменьшении его подвижности с ростом концентрации CCNa, обусловлено, на наш взгляд, не только возрастанием макроскопической вязкости раствора. Мы полагаем, что с ростом концентрации ССNa проявляется его склонность к агрегации, и за счет π–π-стейкинга ароматических фрагментов формируются ассоциаты мономера, что подтверждается данными о солюбилизации маслорастворимого красителя Oil Yellow OB (рис. 2). Краситель Oil Yellow OB не растворяется в воде (A = 0), но способен растворяться в любых слабополярных средах, в том числе он солюбилизируется мицеллами ПАВ и используется для исследования мицеллообразования в самых разных системах [13–16].
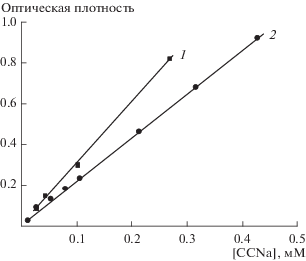
Рис. 2.
Концентрационная зависимость оптической плотности растворов ССNa, содержащих маслорастворимый краситель Oil Yellow OB, на длине волны λ = 346 нм, соответствующей максимуму поглощения красителя. Толщина кюветы 1 см.
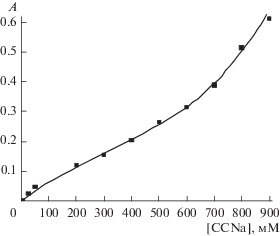
В отсутствие мономера оптическая плотность растворов равна нулю (см. рис. 2), так как краситель в этих условиях не растворяется. Введение ССNa приводит к постепенному росту концентрации красителя в растворе (рост оптической плотности в видимой области, при длине волны, соответствующей максимуму поглощения красителя), особенно сильному при концентрации мономера выше 600 мМ. Мы полагаем, что растворение красителя обусловлено его солюбилизацией в формирующихся ассоциатах мономера.
Можно предположить, что зонд 5-ДСК, содержащий длинный алифатический фрагмент, связывается с ассоциатами мономера за счет гидрофобных взаимодействий (несмотря на то, что зонд и мономер заряжены одноименно), что приводит к росту τ и уменьшению aN. Заметим, что формирование смешанных агрегатов одноименно заряженных дифильных соединений, содержащих ароматические и алифатические гидрофобные фрагменты, описано в литературе на примере ПАВ и водорастворимых красителей (см., например, [17]).
Влияние мономера на критическую концентрацию мицеллообразования ДДТАБ
Как было показано ранее [3, 4], взаимодействие катионного мономера, метилсульфата триметилметакрилоилоксиэтиламмония, с противоположно заряженными ПАВ сопровождается уменьшением критической концентрации мицеллообразования (ККМ) ПАВ и формированием адсорбционного слоя катионов мономера на поверхности мицелл. Поскольку в основе взаимодействия компонентов лежит электростатическое связывание, можно ожидать, что анионные мономеры будут взаимодействовать с катионными ПАВ аналогичным образом.
Действительно, введение эквимольного количества ССNa снижает ККМ ДДТАБ примерно в 5 раз (с 16 до 3 мМ) в отличие от простой соли Na2SO4, которая снижает ККМ незначительно, с 16 до 12 мМ (табл. 1). Полученные результаты, во-первых, полностью соответствует литературным данным, показывающим, что введение простых солей, таких как хлориды, фосфаты, сульфаты и цитраты, снижает ККМ ДДТАБ до 10 мМ при десятикратном избытке соли [18]. Во-вторых, они совпадают с аналогичными данными для изученной ранее системы анионное ПАВ−катионный мономер [3] и указывают на то, что заметное понижение ККМ в присутствии мономера обусловлено не только подавлением электростатического отталкивания заряженных фрагментов молекул ПАВ, но и специфическим и эффективным взаимодействием мономера с противоположно заряженными катионами ДДТАБ.
Как следует из данных, приведенных в табл. 1, образование мицелл ДДТАБ в присутствии эквимольного количества мономера сопровождается значительными изменениями параметров вращения зонда 5-ДСК. Имеет место примерно двукратный рост τ и некоторое уменьшение aN по сравнению со значениями этих параметров для зонда в мицеллах ПАВ в отсутствие ССNa. Напротив, параметры вращения зонда 4-СТ в растворах эквимольных смесей ДДТАБ и мономера практически совпадают с параметрами его вращения в воде. Для выяснения причин наблюдаемых изменений рассмотрим более подробно, что происходит при введении мономера в мицеллярные растворы ПАВ.
Взаимодействие мономера с мицеллами ПАВ
Зонд 4-СТ. На рис. 3 приведены зависимости времени корреляции вращения и константы СТВ зонда 4-СТ от состава (мольного соотношения) смесей ССNa/ДДТАБ для различных концентраций ПАВ. Видно, что введение мономера в мицеллярные растворы ДДТАБ вплоть до эквимольного соотношения компонентов (или чуть большего) приводит к резкому уменьшению времени корреляции вращения и росту константы СТВ зонда до значений (τ = (5 − 6) × 10–11 с, aN = 17.10 − 17.15 Гс), близких к параметрам его вращения в воде (см. таблицу). Очевидно, что отрицательно заряженный мономер, введенный в мицеллярные растворы ДДТАБ, конкурирует с одноименно заряженным зондом 4-СТ за связывание с поверхностью мицелл и постепенно, по мере возрастания его концентрации, вытесняет зонд в раствор, что и вызывает наблюдаемое увеличение константы СТВ и уменьшение времени корреляции.
Рис. 3.
Зависимости времени корреляции (а) и константы СТВ (б) зонда 4-СТ от мольного соотношения ССNa/ДДТАБ. Концентрация ДДТАБ, мМ: 1 – 25, 2 – 50, 3 – 100, 4 – 250.
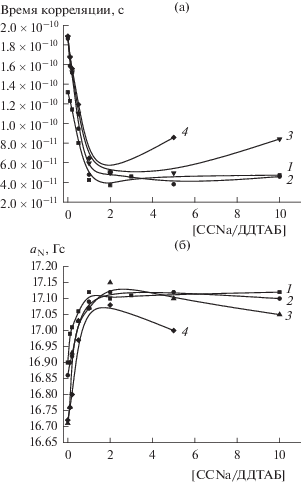
Заметим, что даже начальные участки этих зависимостей существенно отличаются от таковых, полученных ранее для системы катионный мономер−додецилсульфат натрия и гидрофильного зонда КАТ-1 [4]. Катионный зонд КАТ-1 связывался с мицеллами этого ПАВ за счет электростатических взаимодействий, и введение мономера приводило к резкому росту времени корреляции вращения при соотношениях мономер/ ПАВ < 1, и лишь при избытке мономера наблюдалось сильное уменьшение τ, вызванное вытеснением молекул зонда из приповерхностного слоя мицелл в воду. При этом для системы катионный мономер−додецилсульфат натрия все данные указывали на то, что мономер образует слой противоионов на поверхности мицеллы. Понятно, что при такой локализации мономера и малых значениях мольного соотношения ССNa/ДДТАБ (т.е. при недостатке мономера) молекулы КАТ-1 оказывались “зажатыми” между связавшимися с мицеллой молекулами мономера, что приводило к резкому росту τ, вызванному уменьшением подвижности зонда.
В нашем случае резкое уменьшение времени корреляции вращения 4-СТ даже при минимальных количествах введенного мономера и практически независимо от абсолютной концентрации компонентов в системе позволяет предположить, что молекулы ССNa локализуются не в слое противоионов на поверхности мицелл ДДТАБ, но с самого начала встраиваются в мицеллы. При этом молекулы зонда 4-СТ, взаимодействующие с мицеллой только электростатически, не “запираются” между связавшимися с мицеллой ионами мономера, а уменьшение поверхностного заряда мицеллы по мере встраивания в нее мономера приводит к постепенному ослаблению связывания зонда, что и является причиной постепенного увеличения его подвижности.
Тот факт, что органические молекулы различной химической природы способны встраиваться в мицеллы ПАВ, подтвержден огромным количеством публикаций. Например, солюбилизация ионных красителей мицеллами как противоположно, так и одноименно заряженных или неионных ПАВ хорошо известна и описана в [17, 19]. Формирование смешанных агрегатов переменного состава показано, например, для систем бромид цетилтриметиламмония–бутилбензосульфонаты [20]. Непосредственное участие ароматических фрагментов полистиролсульфоната натрия в формировании мицеллярной фазы противоположно заряженных ПАВ подтверждено методом ЯМР-спектроскопии [6].
Таким образом, встраивание стиролсульфонат-ионов в мицеллы ДДТАБ никак не противоречит имеющимся литературным данным. Более того, именно такая локализация мономера подтверждается данными УФ-спектроскопии. На рис. 4 приведены УФ-спектры мономера в воде и в 25 мM водном растворе ДДТАБ, а на рис. 5 − зависимости оптической плотности этих растворов на длине волны, соответствующей максимуму поглощения мономера (255 нм – для растворов ССNa в воде и 257 нм – в присутствии ПАВ), от его концентрации. Различие в значениях тангенса угла наклона этих зависимостей свидетельствует об уменьшении молярного коэффициента экстинкции мономера примерно на 30% в присутствии мицелл ДДТАБ (от 30 521 до 21 769 л моль–1 см–1). При этом при значениях концентрации ПАВ выше ККМ (равной 3 мМ в присутствии эквимольного количества ССNa), коэффициент экстинкции мономера остается постоянным (данные не показаны). Следует особо отметить, что изменения спектральных характеристик, очень похожие на наблюдающиеся на рис. 4 (гипохромный эффект (равный примерно 20%) и батохромный сдвиг максимума поглощения на 2 нм), наблюдали при образовании комплексов полистиролсульфоната натрия с бромидом тетрадецилтриметиламмония [21]. Хорошо известно, что гипохромный эффект (уменьшение оптической плотности при неизменной концентрации хромофора) может быть обусловлен стейкинг-взаимодействием молекул хромофора [22, 23] или ограничением степеней их свободы, например, при включении в мицеллярную фазу [21]. Батохромный сдвиг (сдвиг максимума поглощения в длинноволновую область) наблюдается для множества органических соединений, например красителей, при изменении полярности окружения их молекул, в частности, при солюбилизации в мицеллах ПАВ (см., например, [17]).
Рис. 4.
Спектры CCNa в воде (1) и в 25 мМ водном растворе ДДТАБ (2). Толщина кюветы 0.1 см. [ССNa] = 2.5 × 10–4 М.
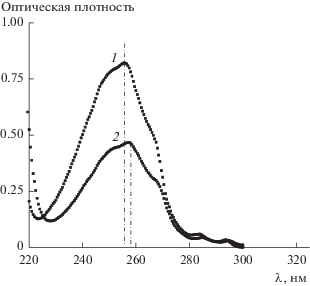
Рис. 5.
Концентрационные зависимости оптической плотности растворов мономера CCNa (1) и смесей ССNa/ДДТАБ (2). [ДДТАБ] = 25 мМ. Толщина кюветы 0.1 см.
Таким образом, данные УФ-спектроскопии и ЭПР-спектроскопии зонда 4-СТ указывают на то, что ССNa, вводимый в мицеллярные растворы ДДТАБ, встраивается в мицеллы ПАВ, в отличие от катионного мономера, формирующего слой противоионов на поверхности мицелл додецилсульфата натрия.
Возвращаясь к данным, приведенным на рис. 3, следует отметить, что для двух меньших концентраций ДДТАБ (25 и 50 мМ) зависимости τ и aN от состава смесей ССNa/ДДТАБ выходят на плато после достижения эквимольного (или чуть большего) соотношения компонентов. При этом значения времени корреляции вращения и константы СТВ указывают на свободное вращение зонда 4-СТ в водном окружении. Напротив, при концентрации ПАВ 100 и 250 мМ и избытке мономера имеет место заметный (в два раза) рост τ и уменьшение aN (ничего похожего не наблюдалось при изучении систем катионный мономер−анионное ПАВ).
В то же время исследование растворов ДДТАБ различной концентрации в присутствии и в отсутствие мономера методом ротационной вискозиметрии [24] показало, что зависимости вязкости (при нулевой скорости сдвига), η0, от соотношения компонентов при всех изученных концентрациях ПАВ носят ярко выраженный экстремальный характер с максимумом при значении этого соотношения, близком к эквимольному. Дальнейшее увеличение содержания мономера в смесях, независимо от концентрации ПАВ, приводит к резкому уменьшению вязкости, несмотря на все возрастающую концентрацию мономера. Поэтому увеличение времени корреляции вращения зонда 4-СТ при избытке мономера не может быть вызвано ростом макровязкости системы.
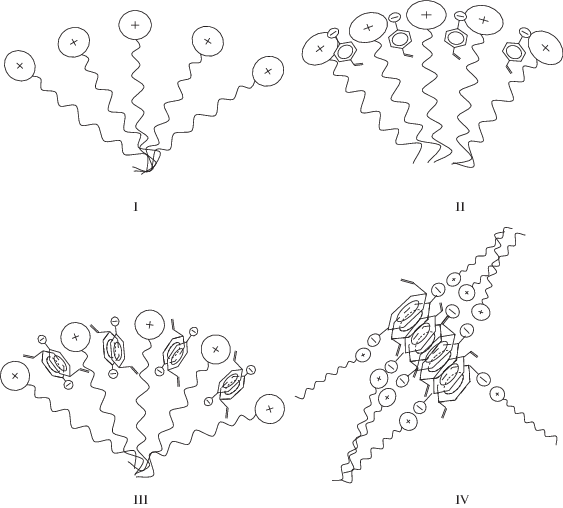
Можно предположить, что при избытке мономера и больших концентрациях ПАВ (и, соответственно, мономера) формируются смешанные агрегаты ПАВ−мономер принципиально иного типа. Они содержат в качестве основной (организующей) структуры не мицеллы ДДТАБ, в которые встраивается мономер, а ассоциаты мономера, образовавшиеся в результате π–π-стейкинга ароматических колец, с которыми за счет электростатических и гидрофобных взаимодействий связаны ионы ПАВ и зонда 4-СТ. Схематически взаимодействие CCNa с ДДТАБ представлено на рис. 6.
Рис. 6.
Предполагаемая схема взаимодействия CCNa и ДДТАБ. I – мицелла ДДТАБ в воде, II – мицелла ДДТАБ в присутствии мономера (0 < [CCNa]/[ДДТАБ] < 1), III − мицелла ДДТАБ со встроенными первичными ассоциатами (димерами) CCNa, IV – ассоциаты CCNa с адсорбированным ДДТАБ.
Зонд 5-ДСК. Данные, полученные методом ЭПР-спектроскопии зонда 5-ДСК, не противоречат высказанным выше предположениям. На рис. 7 приведены зависимости времени корреляции вращения и константы СТВ зонда 5-ДСК от состава смеси ПАВ/мономер при различной концентрации ДДТАБ. Видно, что введение мономера в мицеллярные растворы ДДТАБ, независимо от их концентрации, сначала приводит к резкому увеличению (в 2−3 раза) значений τ зонда 5-ДСК (рис. 7а) и уменьшению значений aN (рис. 7б). Полученные результаты понятны и очевидны, так как связывание противоионов с мицеллами ДДТАБ ослабляет отталкивание между заряженными частями его молекул, тем самым повышая плотность упаковки катионов ПАВ в мицелле (рис. 6, структуры I и II) и вызывая уменьшение локальной подвижности парамагнитного фрагмента зонда 5-ДСК, локализованного внутри мицеллы. При этом повышение плотности упаковки катионов ПАВ и встраивание мономера в мицеллу сопровождается вытеснением молекул воды из приповерхностного слоя мицеллы (на схеме не показано), что приводит к снижению локальной диэлектрической проницаемости и, как следствие, к уменьшению aN.
Рис. 7.
Зависимости времени корреляции (а) и константы СТВ (б) зонда 5-ДСК от мольного соотношения [CCNa]/[ДДТАБ]. Концентрация ДДТАБ, мМ: 1 – 25, 2 – 50, 3 – 100, 4 – 250.
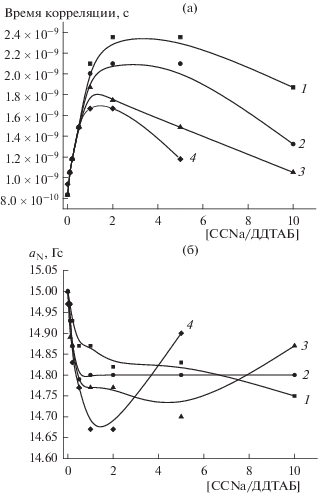
Заметим, что при эквимольном соотношении ССNa/ДДТАБ наблюдаются аномальные зависимости времени корреляции и константы СТВ для зонда 5-ДСК от суммарной концентрации этих компонентов: чем она выше, тем меньше τ (т.е. больше подвижность зонда) и больше aN (т.е. выше полярность локального окружения парамагнитного фрагмента). Однако такая аномальная зависимость представляется вполне естественной, если верны наши предположения о встраивании в мицеллы ПАВ сначала мономера, а затем и его ассоциатов (рис. 6, структура III). Очевидно, что тенденция к формированию таких ассоциатов будет проявляться тем сильнее, чем выше абсолютная концентрация мономера в растворе. Следовательно, с ростом суммарной концентрации компонентов формирование смешанных агрегатов, содержащих уже не молекулы мономера, но его ассоциаты, будет проявляться раньше, при меньших соотношениях компонентов смеси. Химическая некомплементарность этих компонентов, “усиленная” формированием ассоциатов мономера, неизбежно должна приводить к “разрыхлению” мицеллы вплоть до ее разрушения и формированию новых смешанных агрегатов на основе ассоциатов ССNa (рис. 6, структура IV). Поэтому представляется закономерным, что при дальнейшем росте содержания мономера (при значениях соотношения [ССNa]/[ДДТАБ] > 2) время корреляции вращения зонда 5-ДСК уменьшается независимо от концентрации ДДТАБ, а константа СТВ увеличивается (рис. 7). Подчеркнем, что такое поведение смеси ССNa−ДДТАБ принципиально отличается от поведения изученной ранее системы катионный мономер−анионное ПАВ [3, 4], а детальное изучение состава, строения и фазового поведения смешанных агрегатов ССNa и противоположно заряженного ПАВ – предмет дальнейших специальных исследований.
Таким образом, проведенные исследования указывают на то, что гидрофобный мономер, CCNa, встраивается внутрь мицелл противоположно заряженного ПАВ. Как следует из схемы, приведенной на рис. 6, в присутствии ДДТАБ, независимо от концентрации и соотношения компонентов в растворе, двойные связи мономера, по которым должна идти полимеризация, оказываются экранированными от воздействия инициатора или “разнесенными” на большие расстояния друг от друга (рис. 6, структуры II−IV). Это означает, что противоположно заряженное мицеллообразующее ПАВ будет препятствовать полимеризации гидрофобного мономера, способного встраиваться в мицеллы и формировать смешанные агрегаты.
ЗАКЛЮЧЕНИЕ
Изучение взаимодействия анионного гидрофобного мономера, стиролсульфоната натрия, с мицеллами противоположно заряженного ПАВ, бромида додецилтриметиламмония, показало, что мономер встраивается в мицеллы. Увеличение концентрации мономера в растворе приводит к образованию его ассоциатов за счет стейкинг-взаимодействий ароматических колец. Предполагается, что при больших концентрациях мономера и больших его избытках относительно ПАВ образуются смешанные агрегаты, в которых катионы ПАВ адсорбированы на стейкинг-ассоциатах мономера за счет электростатических и гидрофобных взаимодействий, экранируя двойные связи мономера от взаимодействий с инициатором. Таким образом, полученные экспериментальные данные позволяют предположить, что присутствие в растворе противоположно заряженного мицеллообразующего ПАВ будет препятствовать полимеризации стиролсульфоната натрия.
Работа выполнена при финансовой поддержке гранта Президента РФ МК-2017.2017.3 и государственного задания ФАНО России (0082-2018-0006, № АААА-А18-118020890097-1).
Список литературы
Паписов И.М. // Высокомолек. соед. Б. 1997. Т. 39. С. 562.
Polowinski S. // Prog. Polym. Sci. 2002. V. 27. P. 537.
Мотякин М.В., Шулевич Ю.В., Захарова Ю.А., Вассерман А.М., Навроцкий А.В., Новаков И.А. // Коллоид. журн. 2009. Т. 71. С. 657.
Шулевич Ю.В., Мотякин М.В., Захарова Ю.А., Духанина Е.Г., Вассерман А.М., Навроцкий А.В., Новаков И.А. // Коллоид. журн. 2015. Т. 77. С. 108.
Новаков И.А., Шулевич Ю.В., Захарова Ю.А., Ле Тхи Доан Чанг, Духанина Е.Г., Навроцкий А.В. // Изв. АН. Серия хим. 2015. С. 597.
Gao Z., Kwak J.C.T., Wasylishen R.E. // J. Colloid Interface Sci. 1988. V. 126. P. 371.
Вассерман А.М. // Успехи химии. 1994. Т. 63. С. 391.
Лившиц В.А., Дзиковский Б.Г. // Журн. физ. химии. 1994. Т. 68. С. 1650.
Saracino G.A.A., Tedeschi A., D’Errico G., Improta R., Franco L., Ruzzi M., Corvaia C., Barone V. // J. Phys. Chem. A. 2002. V. 106. P. 10700.
Budil D.E., Lee S., Saxena S., Freed J.H. // J. Magn. Reson. A. 1996. V. 120. P. 155.
Метод спиновых меток. Теория и применение. / Под ред. Берлинера Л. М.: Мир, 1979.
Бучаченко А.Л., Вассерман А.М. Стабильные радикалы. М.: Химия, 1973.
Hayakawa K., Fukutome T., Satake I. // Langmuir. 1990. V. 6. P. 1495.
Hayakawa K., Shinohara S., Sasawaki S., Satake I., Kwak J. // Bull. Chem. Soc. Jap. 1995. V. 68. P. 2183.
Шулевич Ю.В., Ковалева О.Ю., Навроцкий А.В., Захарова Ю.А., Зезин А.Б., Новаков И.А. // Высокомолек. соед. А. 2007. Т. 49. С. 2085.
Zakharova J.A., Novoskoltseva O.A., Pyshkina O.A., Karpushkin E.A., Sergeyev V.G. // Colloid Polym Sci. 2018. V. 296. P. 835.
Williamson C.E., Corwin A.H. // J. Colloid Interface Sci. 1972. V. 38. P. 567.
Hooshyar H., Sadeghi R. // J. Chem. Eng. Data. 2015. V. 60. P. 983.
Bilski P., Dabestani R., Chignell C.F. // J. Phys. Chem. 1991. V. 95. P. 5784.
Bhat M., Gaikar V.G. // Langmuir. 1999. V. 15. P. 4740.
Popov A., Zakharova J., Wasserman A., Motyakin M., Kasaikin V. // J. Phys. Chem. B. 2012. V. 116. P. 12332.
Itaya T., Ochiai H., Ueda K., Imamura A. // Macromolecules. 1993. V. 26. P. 6021.
Kubota M., Ono A. // Tetrahedron Lett. 2004. V. 45. P. 1187.
Шулевич Ю.В., Ильин С.О., Духанина Е.Г., Озерин А.С., Тутаев Д.С., Навроцкий А.В., Куличихин В.Г., Новаков И.А. // Изв. АН. Сер. хим. 2016. С. 1161.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал