Коллоидный журнал, 2019, T. 81, № 2, стр. 139-145
Эффект самоочищения пленок изотактического полипропилена от неизвестных импрегнированных примесей
Е. П. Агеев 1, *, Н. Л. Струсовская 1, Н. Н. Матушкина 1
1 Московский государственный университет имени М.В. Ломоносова,
химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: ageev@phys.chem.msu.ru
Поступила в редакцию 29.10.2018
После доработки 06.11.2018
Принята к публикации 02.11.2018
Аннотация
Объектом изучения были промышленные пленки стереорегулярного изотактического полипропилена (ПП). Цель работы, – рассматривая ПП как совокупность гидрофобных и гидрофильных локализованных и делокализованных сорбентов, обосновать механизм обнаруженного нами ранее уменьшения массы пленок ПП в результате последовательной сорбции ими гидрофобного и гидрофильного веществ. В качестве метода исследования использовали варьируемую последовательность процессов сорбции молекул-зондов разной полярности, а инструментом исследования служили только аналитические весы. Показано, что эффект потери массы пленками ПП при сорбции гидрофильного вещества (воды) после их предварительного набухания в гидрофобном сорбате (гексане), содержащем небольшое количество нативной воды, обусловлен образованием молекулами воды комплексов с гидрофильными примесями. В результате возникает обратный поток этих комплексов из полимера по транспортным каналам, возникающим при его набухании в гидрофобном сорбате (гексане).
ВВЕДЕНИЕ
Полипропилен (ПП) относится к монозамещенным виниловым полимерам. Существуют ПП: атактический (нерегулярный), изо- и синдиотактические (стереорегулярные) и стереоблочный. По объему производства ПП занимает среди полимеров второе место (по данным Plastinfo.ru и приближается к ста тысячам тонн в год), уступая только полиэтилену. Наибольшее промышленное значение имеет изотактический ПП, в котором все метильные группы распложены по одну сторону полимерной цепи.
В промышленности ПП получают на катализаторах Циглера–Натта. После окончания синтеза катализатор и другие вещества, присутствовавшие или образовавшиеся при создании конечного продукта, переходят в разряд ненужных примесей. Какие они и сколько их, точно неизвестно и вряд ли будет известно, потому что катализаторы крупнотоннажных производств и добавки к ним представляют коммерческую тайну.
Катализаторы Циглера–Натта представляют собой композицию переходного металла и металлов I–III групп. Для увеличения поверхности катализатора его наносят на порошки, эффективность стереоконтроля удается повысить, добавляя к катализаторам органические основания Льюиса. Кроме того, полимер может содержать наполнители, стабилизаторы, непрореагировавший мономер.
Неизбежно возникает вопрос: что такое импрегнированные примеси и можно ли удалить их из пленок изотактического ПП? Термин импрегнирование, вообще говоря, означает пропитку растворами или эмульсиями тканей, древесины и прочего. В нашем случае речь пойдет о хаотически распределенных в полимере твердых примесях, не образующих с ним химических связей.
Представим такую картину: имеем набор исходных химических соединений (компонентов). Среди них есть пропилен, содержащий асимметричный атом третичного углерода. Началась реакция полимеризации. Образуются стереорегулярные изотактические цепи, они, вследствие стерического отталкивания метильных групп, сворачиваются в спирали, в которых на один виток приходятся три мономерных звена. При кристаллизации ПП из-за наличия макромолекул с повышенным числом звеньев на виток образуются области с различной локальной плотностью: пониженной, вследствие деформации участков спирали, и повышенной, в которых стереорегулярность отсутствует [1]. Таким образом, в результате синтеза получается целевой материал – стереорегулярный изотактический ПП, а импрегнированные примеси (во что они превратились после реакции полимеризации?), выполнив свою функцию, стали, если можно так выразиться, “строительным мусором”.
Управлять удалением неизвестных примесей из полимера можно только в рамках самопроизвольных процессов их извлечения. Такими процессами являются диффузия, сорбция, химическая реакция при соответствующих начальных условиях. При химических реакциях массы их участников изменяются пропорционально друг другу:
Глава бельгийских термодинамиков Теофил де Донде в свое время ввел понятие сродства:
Таким образом, самопроизвольный массоперенос происходит в системе, которая сама совершает работу при соответствующем в начале процесса градиенте химического потенциала. Поэтому используемый в статье термин “самоочищение” вполне корректен с позиции термодинамики.
Далее нужно подобрать сорбаты-зонды, с их помощью изучить сорбционную предыисторию кинетики набухания. Термин “сорбционная предыистория” в нашем контексте отражает зависимость транспортных свойств от маршрута процесса.
Первые эксперименты по изучению набухания пленок изотактического ПП в жидких сорбатах-зондах [2, 3] должны были ответить на два вопроса: есть ли в гидрофобном ПП гидрофильные примеси и обладают ли они свойствами сорбента? При изучении кинетики набухания ПП в воде обнаружен новый эффект – масса сорбента (ПП + примеси), поглощающего сорбат, не увеличилась, а уменьшилась! Для реализации наблюдаемого эффекта необходимы гидрофильные сорбционные центры, которые могут находиться в импрегнированных примесях ПП. В данном случае на самом деле была обнаружена ситуация, когда кроме потока вещества из раствора в полимер существовал обратный поток сорбционного комплекса сорбат–примесь из полимера в раствор, причем второй поток был существенно больше первого.
Цель данной работы, рассматривая ПП как совокупность гидрофобных и гидрофильных локализованных и делокализованных сорбентов, обосновать механизм появления противоположно направленного потока вещества в процессе набухания пленок изотактического ПП в жидких сорбатах-зондах и объяснить, каким образом гидрофильные примеси могут диффундировать по гидрофобной матрице полимера.
Для выяснения механизма обнаруженного эффекта необходимо иметь представления о термодинамических и кинетических характеристиках диффузионного массопереноса и о зависимости транспортных свойств сорбатов-зондов от маршрута (последовательности стадий) сорбции.
Для идеальных систем обобщенная диффузионная силаYi, приложенная к 1 молю компонента раствора, равна [4]:
где R = 8.31 Дж/(К моль) = 0.848 (кг м)/(К моль) – универсальная газовая постоянная, ci – концентрация, r – расстояние. Для оценки примем $\Delta r$ = = 1 см, ${{\Delta {{c}_{i}}} \mathord{\left/ {\vphantom {{\Delta {{c}_{i}}} {{{c}_{i}}}}} \right. \kern-0em} {{{c}_{i}}}} = 1,$ T = 300 К. Расчет дает Yi = 25.4 × × 103 кг/моль.Оценим время, в течение которого устанавливается стационарная скорость диффузии, приняв D ~ 10–5 см2/с, М ~ 100 г/моль, Т = 300 К.
Запишем второй закон Ньютона с учетом действующей диффузионной силы Yi и силы трения fi:
Сила трения связана со скоростью частицы wi соотношением wi = −Bi fi, где Bi – подвижность. Объединяя уравнения и интегрируя с учетом начальных условий t = 0, wi = 0, находим:
При t → 0, разлагая экспоненту в ряд и ограничиваясь двумя первыми членами, получим при малых временах равноускоренное движение ${{w}_{i}} = ({{{{Y}_{i}}} \mathord{\left/ {\vphantom {{{{Y}_{i}}} {{{m}_{i}})t,}}} \right. \kern-0em} {{{m}_{i}})t,}}$ но при t → ∞ движение станет равномерным, т.е.
Оценим время, за которое скорость будет равна 99% от своего стационарного значения, т.е. ${{w}_{i}} = 0.99{{Y}_{i}}{{B}_{i}}.$ Подставляя принятое значение скорости, получим t = miBi ln 102. Подвижность, как известно, связана с коэффициентом диффузии соотношением Di = Bi kT, где k – постоянная Больцмана. Тогда
В заключение отметим, что обобщенная диффузионная сила Yi, равная отрицательному градиенту химического потенциала, представляет относительно большую величину, а время достижения 99% стационарного состояния процесса диффузии чрезвычайно мало.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Объектами исследования были промышленные пленки изотактического ПП марки 01030 [5]. Пленки имели толщину 20 мкм, плотность 0.96 г/см3, температуру плавления 160−168°C. Методом малоуглового рентгеновского рассеяния было установлено, что объемная доля аморфной фазы в них составляет 47.5% [6]. В качестве гидрофильных, дифильных и гидрофобных сорбатов-зондов выбрали воду, ацетон, диоксан, н-гексан, н-нонан.
Были разработаны 4 маршрута проведения эксперимента.
Маршрут № 1. Сорбция пленками ПП жидких сорбатов-зондов. Взвешивали воздушно-сухую пленку в закрытом бюксе. Затем ее вынимали и помещали в бюкс с исследуемым сорбатом. Через определенные промежутки времени пленку вынимали из жидкости, промокали фильтровальной бумагой и помещали для взвешивания в сухой бюкс. Операцию повторяли до достижения пленкой постоянного веса.
Маршрут № 2. Эксперимент проводили по маршруту № 1. После достижения сорбционного равновесия пленку сушили на воздухе до достижения постоянного веса и проводили на ней повторную сорбцию изучаемого вещества. Таким образом, маршрут состоял из стадий сорбция–десорбция–сорбция–десорбция.
Маршрут № 3. Сорбция–десорбция гидрофильного сорбата проводится после аналогичной процедуры для гидрофобного сорбата. Пленки ПП хорошо набухают в гидрофобном сорбате, увеличивается избыточный свободный объем полимера, что облегчает последующую диффузию гидрофильного сорбата.
Маршрут № 4. Сначала эксперимент проводили по маршруту № 1. Получив нестационарное равновесное значение степени набухания ПП в гидрофильном сорбате, помещали пленку ПП в бюкс с гидрофобным сорбатом. И вновь через определенные промежутки времени пленку ПП извлекали из жидкого сорбата, промокали фильтровальной бумагой и помещали для взвешивания в сухой бюкс. Операцию повторяли до достижения пленкой постоянного веса. Степень набухания пленки ПП в гидрофобном сорбате определяли относительно пленки, набухшей в гидрофильном сорбате. Ниже будет показано, что такой маршрут может обеспечить массоперенос гидрофильных примесей через гидрофобную матрицу ПП.
Количество параллельных опытов было не меньше пяти. Результаты, описывающие экспериментальные данные, обрабатывали по теории ошибок. Доверительный интервал рассчитывали для уровня значимости 0.0511.
Напомним, что каждая кинетическая кривая сорбции, приведенная в данной работе, соответствует одному сорбату, но разным неизвестным импрегнированным примесям-сорбентам в составе пленки полимера. Надо учесть также, что распределение примесей по полимеру случайно, используемые сорбаты летучи (температура кипения ацетона 56°C, гексана – 68.7°C), поэтому причин разброса экспериментальных данных много, и мы сознательно используем различные способы их представления в зависимости от того, какой способ в конкретном случае более выразителен. На рис. 1, 2 представлена совокупность необработанных экспериментальных данных, на рис. 3, 5 – их средние значения с доверительным интервалом, а на рис. 4, 6 – без него.
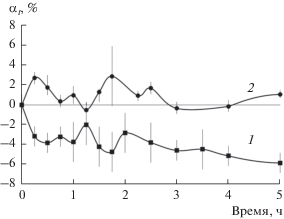
Рис. 1.
Кинетика сорбции воды пленками ПП по маршруту № 1 (а), и кинетика ее десорбции на конечной стадии маршрута № 2 (б). Видно, что произошло самоочищение пленок от гидрофильных импрегнированных примесей.
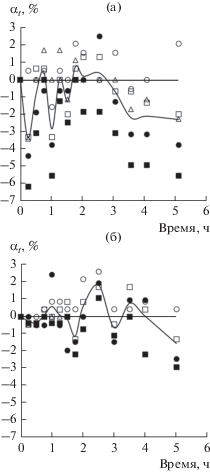
Рис. 2.
Кинетика набухания пленок ПП в диоксане по маршруту № 1 (а) и по маршруту № 2 (б). Сравнение экспериментальных данных рис. 2а и 2б подтверждает наличие потоков сорбата из раствора в пленку, масса которой в результате увеличивается, и реверсивного потока делокализованного комплекса сорбат–примесь, приводящего к уменьшению массы пленки.
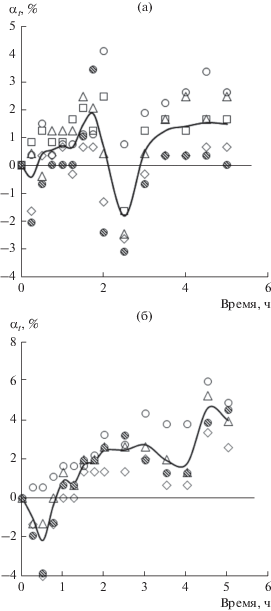
Рис. 4.
Кинетика набухания пленок ПП в воде: 1 – по маршруту № 1, извлечены гидрофильные примеси с поверхности ПП, 2 – по маршруту № 4, извлечены гидрофильные примеси из избыточного набухшего объема ПП.
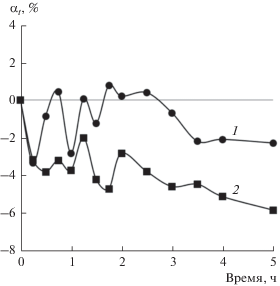
Рис. 5.
Кинетика последовательного набухания пленок ПП в гексане и затем в ацетоне: 1 – по маршруту № 4, 2 – по маршруту № 3.
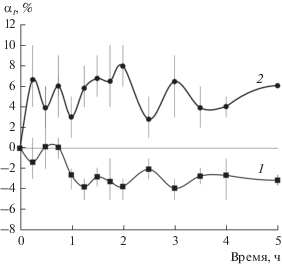
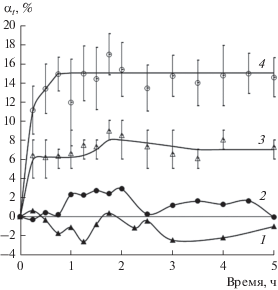
Рис. 6.
Кинетика набухания пленок ПП по маршруту № 1: 3 – в гексане, 4 – в н-нонане. Кривые 1 и 2 показывают кинетику набухания пленок ПП в воде при проведении сорбции по маршруту № 4 для случаев, когда в качестве вспомогательного сорбата были использованы гексан и нонан соответственно.
На рис. 1а приведена кинетика сорбции пленкой гидрофобного изотактического ПП воды при проведении эксперимента по маршруту № 1. Гидрофильная вода не смачивает ПП и практически им не сорбируется. Наблюдаемое уменьшение массы пленки полимера в процессе сорбции обусловлено наличием импрегнированных гидрофильных примесей.
Представим, что в процессе набухания ПП жидкий сорбат-зонд адсорбировался на полимере и за счет отрицательного градиента химического потенциала продолжает двигаться вглубь полимера, пока не достигнет локализованной импрегнированной гидрофильной примеси (сорбента) и не образует с ней сорбционный комплекс. Возникновение внутри полимера сорбционного комплекса вызывает появление отрицательного градиента химического потенциала – обобщенной диффузионной силы, которая преодолевает силы притяжения между сорбционным комплексом и полимером, и за счет теплового движения локализованный сорбционный комплекс становится делокализованным. Направление его движения определяет градиент химического потенциала: из полимера в раствор. В результате имеем следующую последовательность процессов: перенос жидкого сорбата в полимер, образование локализованного сорбционного комплекса сорбат–частица, преодоление сил притяжения между сорбционным комплексом и полимером, т.е. делокализация комплекса сорбат–частица, перенос сорбционного комплекса в раствор. В потоке из раствора в полимер содержится только один сорбат, а в обратном потоке из полимера в раствор появился сорбат вместе с примесью. В отличие от десорбции такой поток мы назвали реверсивной сорбцией. Замечательное свойство реверсивной сорбции состоит в том, что она позволяет очистить полимерные материалы от импрегнированных примесей, имеющих сродство к подобранным сорбатам.
На рис. 1б приведена кинетика десорбции воды из пленок ПП, дающая, на самом деле, информацию только о состоянии поверхности полимера, так как вода не может проникнуть в его объем. На поверхности полимера отсутствуют импрегнированные примеси, потому что нет статически значимых отрицательных значений степени набухания αt. Точность текущих значений степени набухания с учетом доверительного интервала при уровне значимости 0.05 близка к нулю. Следовательно, уже первый цикл сорбции–десорбции воды в маршруте № 2 оказывается достаточным, чтобы иметь очищенную от примеси поверхность полимерной пленки.
На рис. 2 показана кинетика набухания пленок ПП в диоксане – сорбате, молекулы которого имеют гидрофильные и гидрофобные сорбционные центры. На рис. 2а набухание идет по маршруту № 1, а на рис. 2б – по маршруту № 2. Ранее мы пришли к выводу, что кинетика набухания определяется двумя потоками вещества: из раствора в полимер поступает поток сорбата, увеличивающий массу полимера, а с формально отрицательным реверсивным потоком сорбционного комплекса из полимера уходят импрегнированные примеси. Тогда, например, если уменьшается отрицательный поток, то положительный должен расти. Экспериментальные данные рис. 2 подтверждают этот вывод: на рис. 2а величина αt приближается к значению 2 мас. %, а на рис. 2б уменьшение формально отрицательного реверсивного потока привело к росту положительного значения αt до 3–4 мас. %.
Чтобы гидрофильная вода могла проникнуть внутрь пленок гидрофобного ПП, необходимо увеличить избыточный свободный объем полимера за счет его набухания в углеводороде, содержащем растворенную (“нативную”) воду. В справочниках можно найти данные о содержании воды в граммах на 100 г жидких углеводородов гомологического ряда н-алканов. В первых трех жидких н-алканах – пентане, гексане и гептане – содержание воды в указанных единицах равно 3.6 × 10–2, 1.4 × 10–2 и 0.5 × 10–2 соответственно. Из этих трех алканов пригоден только гексан, потому что пентан, имея температуру кипения 36°C, сильно летуч, а в гептане содержание воды уже в три раза меньше, чем в гексане.
Единственный источник информации о различных вариантах истории и предыстории изучаемого процесса – изменение массы пленок. Рычагом управления процессом набухания пленок полимера служит выбор сорбатов-зондов. При переходе от одного маршрута эксперимента к другому можно использовать сушку пленок, десорбцию, двойную сорбцию, реверсивную сорбцию, изменение уровня отсчета степени набухания. Например, отсчет степени набухания от массы пленки включает рассмотрение всех идущих процессов, отсчет от массы сорбированного гидрофобного вещества – только процессов с участием гидрофильных сорбентов. Различные уровни отсчета степени набухания полимера путем использования маршрутов № 3 и № 4, в которых участвуют вспомогательный и основной сорбаты, позволяют экспериментально различить локализованные и делокализованные примеси и дать полную картину их поведения при набухании.
Введем обозначения: гидрофильный сорбат (Н2О), вспомогательный гидрофобный сорбат (С6Н14 · Н2О), содержащий небольшое количество “нативной” воды, PS+, PS– – сорбционные центры самого ПП, ImS+ и ImS– – импрегнированные гидрофобные и гидрофильные сорбенты (примеси), Sb – сорбция, DSb – десорбция, RSb – реверсивная сорбция, LK – локализованный комплекс, DLK – делокализованный комплекс.
Рассмотрим для простоты схему сорбции одного сорбата (С6Н14 · Н2О) двумя сорбентами: ПП и Im+ (на самом деле число Im+ неизвестно):
Схема означает, что в самом ПП и в примесях имеются локализованные гидрофобные центры, сорбирующие гексан, в котором растворено малое количество воды. Набухание ПП в гексане “отключает” гидрофобные взаимодействия с участием локализованных сорбционных центров полимера, т.е. сорбенты [PS+(C6H14 · H2O)]SbLK↓ в дальнейших процессах участвовать не могут. После сорбции гексана масса пленок увеличилась, а в полимере остались гидрофильные примеси.
Кинетическую кривую реверсивной сорбции можно получить, используя маршрут № 4. Для этого переносят набухшую в гексане пленку в бюкс с водой, сорбцию которой на гидрофильных примесях можно описать схемой
Через определенные промежутки времени пленку промокают фильтровальной бумагой и взвешивают в сухом бюксе до достижения постоянного веса. Особенность маршрута № 4 состоит в двух последовательных процессах набухания ПП в гидрофобном и гидрофильном сорбатах, что позволяет извлекать из объема ПП делокализованные сорбционные комплексы, состоящие из гидрофильной импрегнированной примеси и гидрофильного сорбата – воды. Степень набухания полимера определяли, учитывая текущие потери массы пленками ПП за счет реверсивной сорбции комплексов вода–примесь, за уровень отсчета принимали степень набухания пленок в гексане.
На рис. 3 приведена кинетика набухания пленок ПП в воде. Кривая 1 описывает реверсивную сорбцию делокализованных сорбентов, представляющих собой комплексы сорбат–примесь, по маршруту № 4. Маршрут № 4 состоит из двух последовательных стадий набухания пленок ПП – в гексане, а затем в воде. Таким путем можно извлечь из пленок ПП комплексы вода–гидрофильная примесь.
Кривая 2 на рис. 3 описывает маршрут № 2, который содержит две стадии десорбции делокализованных примесей. Видно, что десорбция “убирает” мобильные гидрофильные примеси, и в пленке остается небольшая часть локализованных гидрофобных примесей.
На рис. 4 также представлена кинетика набухания пленок ПП в воде, но при изменении маршрутов сорбции. Кривая 1, полученная при проведении эксперимента по маршруту № 1, свидетельствует о том, что с помощью реверсивной сорбции извлечены комплексы вода–примесь с поверхности пленок ПП, а кривая 2, полученная в маршруте № 4, – о том, что комплексы вода–примесь извлечены и из объема набухших в гексане пленок ПП.
На рис. 5 приведены данные о кинетике последовательного набухания пленок ПП в гексане (вспомогательном сорбате) и, затем, в ацетоне (основном сорбате). Кривая 1 соответствует кинетике набухания пленок ПП в ацетоне после сорбции ими гексана, т.е. реализации маршрута № 4. Кривая 2 отвечает кинетике набухания в ацетоне пленок ПП после десорбции из них гексана, т.е. проведению эксперимента по маршруту № 3. Специфика выбранной неводной системы состоит в том, что ацетон является дифильным сорбатом, т.е. имеет гидрофильную карбонильную группу и две метильных группы. Это приводит к тому, что экспериментальная кривая 2 сильно смещена в область локализованной сорбции.
Гексан как вспомогательный гидрофобный сорбат играет ключевую роль в механизме самоочищения пленок ПП от импрегнированных примесей. Сорбция гексана приводит к значительному набуханию ПП, во всяком случае, его аморфных областей. В образовавшийся “раствор” проникают молекулы присутствующей в гексане воды, которые и образуют комплексы с гидрофильными примесями. По всей видимости, именно по такому механизму “запускается” реверсивный поток вещества из пленки ПП, приводящий к переносу гидрофильных примесей через гидрофобную матрицу полимера в окружающий пленку жидкий гидрофобный сорбат (гексан). Подчеркнем, что связывание воды в комплекс с примесями приводит к ее “дефициту” в объеме пленки и, как следствие, к дополнительной сорбции из внешнего раствора в гексане. Ясно поэтому, что в качестве основного гидрофобного сорбата необходимо использовать алкан, в котором вода растворяется в приемлемом количестве.
На рис. 6 изображены кривые набухания пленок ПП в гексане (кривая 3) и в нонане (кривая 4) по маршруту № 1. В течение первых пяти часов эксперимента нестационарная степень набухания ПП в нонане превышала в два раза степень его набухания в гексане. Кривые 1 и 2 показывают степень набухания ПП в воде при проведении сорбции по маршруту № 4. Они различаются тем, что в первом случае вспомогательным гидрофобным сорбатом был гексан, а во втором – нонан. Как уже было сказано, в гексане присутствует в заметных количествах нативная вода, а в нонане ее практически нет. В результате, несмотря на то, что ПП в нонане набухает существенно лучше, чем в гексане, кривая 1 свидетельствует о десорбции делокализованных комплексов сорбат–гидрофильная примесь, а кривая 2 – о том, что такая десорбция не происходит.
Таким образом, экспериментально доказано, что импрегнированные гидрофильные примеси можно удалить из промышленных пленок полипропилена только при использовании гидрофобного сорбата, содержащего приемлемое количество растворенной воды.
Авторы выражают искреннюю благодарность В.М. Рудому за полезное обсуждение материала статьи и ценные рекомендации при ее написании.
Список литературы
Семчиков Ю.Д. Высокомолекулярные соединения. М.: Издательский центр “Академия”, 2005.
Агеев Е.П., Струсовская Н.Л., Матушкина Н.Н. // Журн. физ. химии. 2017. Т. 91. С. 1116.
Агеев Е.П., Струсовская Н.Л., Матушкина Н.Н. // Журн. физ. химии. 2018. Т. 92. С. 313.
Агеев Е.П. Неравновесная термодинамика в вопросах и ответах. Изд. 2-е. М.: МЦНМО, 2005.
Полипропилен и сополимеры полипропилена / ГОСТ 26 996-86.
Любимов А.Г., Прокопчук Н.Р., Мануленко А.Ф. // Химия и технология органических веществ и биотехнология. Труды БГТУ. 2011. № 4. С. 59.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал