Коллоидный журнал, 2019, T. 81, № 3, стр. 281-288
Спонтанное зародышеобразование в перегретых растворах гелия в метане
В. Г. Байдаков *
Институт теплофизики, Уральское отделение РАН
620016 Екатеринбург, Россия
* E-mail: baidakov@itp.uran.ru
Поступила в редакцию 16.11.2018
После доработки 07.12.2018
Принята к публикации 12.12.2018
Аннотация
В опытах по измерению времени жизни перегретой жидкости исследована кинетика спонтанного вскипания перегретого жидкого метана, насыщенного гелием. При давлении $p$ = 1.6 и 2.0 МПа и концентрации гелия в жидком метане $x$ = 0.06 и 0.10 мол. % определена температурная зависимость частоты зародышеобразования J в интервале от 104 до 108 с–1 м–3. Результаты экспериментов сопоставлены с классической теорией зародышеобразования. Как и в случае чистого метана, при J > 4 × 106 с–1 м–3 достигнутые в опыте температуры перегрева растворов систематически (на 0.6–1.0 К) ниже их теоретических значений. Показано, что рассогласование теории и опыта связано с размерной зависимостью поверхностного натяжения на границе критический пузырек–раствор.
1. ВВЕДЕНИЕ
Во многих природных явлениях и технологических процессах фазовые превращения протекают в средах, содержащих растворенный газ. Иногда они сопровождаются метастабильностью одной из фаз. Фазовая метастабильность в газонасыщенных системах наблюдается при вскрытии газоконденсатных месторождений [1], в гейзерах [2], в магме при вулканических извержениях [3–5], в химических реакциях [6, 7].
Обычно центрами газовыделения выступают плохо смачиваемые жидкостью стенки сосуда, газ в трещинах и порах стенок, твердых взвешенных частиц. Образующиеся таким путем зародыши газовой фазы называются гетерогенными.
Физически более простым и определенным случаем является спонтанное возникновение зародышей в “чистых” условиях (гомогенное зародышеобразование). Внутренняя причина гомогенного зародышеобразования – флуктуации при тепловом движении частиц жидкости.
Гомогенное зародышеобразование в перегретых чистых жидкостях исследовалось в работах [8–10]. Влияние газонасыщения на достижимый перегрев (предельное растяжение) жидкостей рассматривалось в [11–30].
Первые экспериментальные исследования нуклеации в нелетучей газонасыщенной жидкости были выполнены Хеммингсеном [11, 12]. Исследуемая жидкость (вода) насыщалась газом при давлениях в несколько сотен атмосфер. В опыте при сбросе давления определялось давление интенсивного газовыделения. Аналогичные эксперименты проводились Финкельштейном и Тамиром [13], а также Боверсом и др. [14].
Мори с сотр. [15] при исследовании достижимых значений перегрева жидких пропана и изобутана, насыщенных двуокисью углерода, использовали метод всплывающих капель. Для двуокиси углерода характерна большая растворимость в жидких углеводородах (до 33 мол. % в исследованном диапазоне параметров состояния). Растворение двуокиси углерода приводило к сдвигу границы спонтанного вскипания жидкости в сторону более низких температур. При исследовании перегрева раствора азот–этиловый эфир Форест и Уорд [16] использовали метод изотермического понижения давления. Данные работ [15, 16] по температуре перегрева в пределах погрешности эксперимента (1–2 К) совпали с предсказаниями классической теории зародышеобразования (КТЗ).
Другой подход к исследованию спонтанного зародышеобразования в газонасыщенной жидкости развит в работах Боверса и др. [17, 18]. Для создания пересыщения вместо сброса давления авторы [17, 18] использовали химические реакции. Исследуя предельное пересыщение растворов кислорода и азота в воде Боверс и др. [17, 18] установили, что достигнутые в опыте предельные значения концентрации растворенных газов в 15 раз меньше рассчитанных в рамках КТЗ.
Методом определения времени жизни метастабильной системы кинетика зародышеобразования в газонасыщенных криогенных жидкостях (кислород, азот, аргон) исследовалась Байдаковым и др. [19–21]. Содержание газового компонента в растворе не превышало 0.5 мол. %. В работах [19–21] констатировались малые, но систематические отклонения достигнутых в опыте значений перегрева от предсказываемых КТЗ.
Теоретически кинетика зарождения пузырьков в пересыщенном газом растворе впервые была рассмотрена Несисом и Френкелем [22]. Авторы [22] предполагали, что в пространстве состава смеси поток зародышей идет через седловую точку активационного барьера по линии наискорейшего спуска. В дальнейшем было показано [23–25], что термодинамически оптимальный путь движения зародышей через седловую точку может смениться более выгодной с кинетической точки зрения траекторией, которая сдвинута от седловой точки в сторону одного из склонов активационного барьера.
Теории зародышеобразования в газонасыщенной нелетучей вязкой жидкости предложены Дерягиным и Прохоровым [26], a также Куни и др. [27, 28]. В работе [26] предполагался свободномолекулярный режим поступления газа в пузырек, авторы [27, 28] постулировали диффузионный режим роста пузырька. Кинетика спонтанного вскипания газонасыщенной жидкости с учетом вязких и инерционных сил, а также свободномолекулярного и диффузионного подвода молекул растворенного вещества и растворителя рассмотрена Байдаковым [29]. Теория зародышеобразования в многокомпонентной газированной системе представлена в работе [30].
Термодинамика зарождения парогазового пузырька в слабых растворах газа в жидкости обсуждалась Уорд и др. [31]. Для согласования данных по предельным пересыщениям газонасыщенных жидкостей, достигнутым в результате химических реакций [17, 18], с КТЗ Квак и Пантон [32], а затем Боверс и др. [17] ввели представление о формировании в растворе на стадии, предшествующей образованию критического пузырька, “уплотнений” из молекул растворенного газа (“кластеров” [32] или “блобов” [17]). Это позволило авторам [17, 32] понизить высоту активационного барьера ${{W}_{*}}$ до значения ~102kBT (kB – постоянная Больцмана), характерного для зародышеобразования в однокомпонентных жидкостях, и согласовать результаты КТЗ и эксперимента [17, 18].
В данной работе исследуется кинетика спонтанного зародышеобразования в растворах метан–гелий при давлениях выше атмосферного и температурах, близких к границе спонтанного вскипания чистого растворителя (метана). Для системы метан–гелий характерны слабая растворимость газового компонента в жидкой фазе и его преобладание при низких температурах в паровой фазе.
Первый раздел статьи – введение. Во втором разделе рассмотрены термодинамика и кинетика зародышеобразования в газонасыщенной жидкости. В третьем разделе дано описание методики измерений и представлены полученные экспериментальные данные. Четвертый раздел посвящен результатам сопоставления опытных данных и КТЗ. Пятый раздел – заключение.
2. ТЕРМОДИНАМИКА И КИНЕТИКА ЗАРОЖДЕНИЯ ПУЗЫРЬКОВ В СЛАБЫХ РАСТВОРАХ ГАЗА В ЖИДКОСТИ
Распад метастабильного раствора является термодинамически необратимым процессом. В чистых условиях на его начальной стадии спонтанно возникают зародыши новой фазы. Каждый такой акт связан с преодолением активационного барьера, который представляет собой седловую поверхность в пространстве характеристических переменных зародыша. При постулировании сферической формы зародышей их объем и поверхность вполне определены одним параметром – радиусом R. Другими переменными будут парциальные давления пара и газа в зародыше или число молекул растворителя и растворенного вещества в нем.
Минимальная работа образования зародыша ${{W}_{*}}$ определяется седловой точкой активационного барьера и, если появление зародыша не изменяет состояния окружающей его среды, то [33]
(1)
${{W}_{*}} = \frac{{16\pi }}{3}\frac{{\gamma _{*}^{3}}}{{{{{(p_{*}^{'} - p)}}^{2}}}} = \frac{{4\pi }}{3}R_{*}^{2}{{\gamma }_{*}},$Давление в критическом пузырьке $p_{*}^{'}$ есть сумма парциальных давлений паров растворителя $p_{{1*}}^{'}$ и растворенного газа $p_{{2*}}^{'}.$ Полагаем, что жидкий раствор – слабый и несжимаемый, а пузырек заполнен идеальной парогазовой смесью. Для парциального давления паров растворителя в критическом пузырьке в этом случае имеем [31]
(2)
$p_{{1*}}^{'} = {{p}_{{{\text{s}}0}}}(1 - x)\left( {1 - \frac{{{{\upsilon }_{{10}}}}}{{\upsilon _{{10}}^{'}}}\frac{{{{p}_{{{\text{s}}0}}} - p}}{{{{p}_{{{\text{s}}0}}}}}} \right),$Парциальное давление растворенного газа в критическом пузырьке равно:
(3)
$p_{{2*}}^{'} = {{k}_{{\text{H}}}}x\left( {1 - \frac{{{{\upsilon }_{2}}}}{{\upsilon _{2}^{'}}}\frac{{{{p}_{{\text{s}}}} - p}}{{{{p}_{{\text{s}}}}}}} \right),$Формула (3) отличается от полученной в работе [31], согласно которой $p_{{2*}}^{'} = {{px} \mathord{\left/ {\vphantom {{px} {{{x}_{{\text{s}}}}}}} \right. \kern-0em} {{{x}_{{\text{s}}}}}},$ где ${{x}_{{{\kern 1pt} {\text{s}}}}}$ – равновесная концентрация растворенного газа в насыщенной жидкости при давлении p.
В КТЗ постулируется существование функции распределения пузырьков по их характеристическим переменным, а эволюция ансамбля зародышей рассматривается как диффузионный процесс в пространстве этих переменных в поле термодинамических сил [34, 10 ]. Для стационарного случая конечный результат теории – выражение для числа закритических зародышей, образующихся в единицу времени в единице объема метастабильной фазы (частоты зародышеобразования), может быть представлен в виде [8]
(4)
$J = \rho zB\exp ({{ - {{W}_{*}}} \mathord{\left/ {\vphantom {{ - {{W}_{*}}} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}}),$Кинетический множитель $B$ связан с инкрементом нарастания объема критического зародыша ${{\lambda }_{0}}$ выражением [29]
(5)
$B = \rho _{*}^{'}R_{*}^{2}{{\left( {\frac{{{{k}_{{\text{B}}}}T}}{{{{\gamma }_{*}}}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{\lambda }_{0}}.$Факторами, сдерживающими рост парогазового пузырька на его начальной стадии – стадии зарождения, могут быть вязкость и инерционность раствора, скорость подвода тепла, а также скорость обмена молекулами между пузырьком и материнской фазой. Последняя связана как с чисто молекулярным обменом, так и с диффузионным подводом растворенного газа к пузырьку.
Какой из указанных факторов является основным, определяется величиной безразмерных параметров
(6)
$\begin{gathered} \chi = \frac{{{{\rho }_{{\text{l}}}}{{\gamma }_{*}}{{R}_{*}}}}{{8{{\eta }^{2}}}},\,\,\,\,{{b}_{i}} = \frac{{2{{\gamma }_{*}}}}{{{{R}_{*}}p_{{^{*}i}}^{'}}}, \\ {{\omega }_{i}} = \frac{3}{2}\frac{{{{\alpha }_{i}}{{\upsilon }_{{{{t}_{i}}}}}\eta }}{{{{\gamma }_{*}}}},\,\,\,\,{{\beta }_{i}} = \frac{{{{\alpha }_{i}}{{\upsilon }_{{{{t}_{i}}}}}{{R}_{*}}}}{{4{{k}_{{\text{B}}}}TD\rho {{H}_{i}}}}. \\ \end{gathered} $Здесь $\eta $ – вязкость раствора, $p_{{*i}}^{'},$ ${{\alpha }_{i}},$ ${{\upsilon }_{{{{t}_{i}}}}}$ – парциальное давление в критическом пузырьке, коэффициент конденсации и средняя тепловая скорость движения молекул i-го компонента раствора, $D$ – коэффициент диффузии, ${{H}_{i}} = {{d{{x}_{i}}} \mathord{\left/ {\vphantom {{d{{x}_{i}}} {dp_{{*i}}^{'}}}} \right. \kern-0em} {dp_{{*i}}^{'}}}.$
Мы рассматриваем кинетику нуклеации парогазовых пузырьков в газонасыщенной жидкости. Ввиду очень малой растворимости гелия в метане (менее 1% в условиях наших экспериментов) жидкий раствор считается слабым, а газовая фаза в пузырьке идеальной. Из-за высокой теплопроводности и большой теплоемкости раствора будем полагать, что пузырек и материнская фаза находятся при одинаковой температуре. Температуру, давление и концентрацию раствора считаем заданными. Инерционными эффектами в динамике пузырька пренебрегаем. Условием такого пренебрежения является $\chi < 1.$
Опыты проводятся при положительных давлениях, близких к критической точке, когда ωi$ \gg $ 1, но не столь велико, чтобы начала сказываться инерционность жидкости. Для невязкой и неинерционной газонасыщенной жидкости определяющими механизмами роста пузырька будут свободномолекулярный обмен для растворителя и диффузионный подвод растворенного газа к пузырьку. В этом случае параметр $\lambda {{{\kern 1pt} }_{0}}$ определяется выражением [29, 10 ]
(7)
$\tilde {\lambda }{{{\kern 1pt} }_{0}}\, = \frac{1}{2}\frac{{b\chi }}{{(3 - b)}}\left\{ { - A + {{{\left[ {{{A}^{2}} + 4\frac{{{{\omega }_{1}}{{\omega }_{2}}}}{{{{\beta }_{2}}}}\left( {\frac{{3 - b}}{b}} \right)} \right]}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}} \right\},$Из-за очень малого содержания гелия в жидкой фазе раствора по сравнению с паровой фазой считается, что для образования равновесного критического пузырька необходим диффузионный подвод газового компонента к поверхности пузырька [27, 28]. Условием этого является ${{\beta }_{2}} \gg 1.$ В этом предположении и записано уравнение (7). Простой расчет показывает, что диффузионный механизм может оказаться необязательным. Рассмотрим образование парогазового пузырька вблизи границы спонтанного вскипания: $p$ = 2.0 МПа, $T$ = 175.0 K. Оценим число молекул метана и гелия, присутствующих в растворе с концентрацией $x$ = 0.10 мол. % в объеме, равном объему критического пузырька (${{R}_{*}}$ = 4.7 нм). Полагая газ равномерно распределенным, получим, что в области критического размера до зародышеобразования содержится приблизительно 5 атомов гелия и 4720 молекул метана, а после образования зародыша – приблизительно 22 атома гелия и 755 молекул метана. Таким образом, в процессе зародышеобразования объем критического размера покидают преимущественно молекулы метана. Критический пузырек состоит как из газа, так и из пара, но главным образом из молекул пара. В этом случае диффузия не нужна, а приток недостающих 17 атомов гелия может произойти за счет теплового движения.
Кроме того, как показывают результаты молекулярно-динамического моделирования зародышеобразования в газонасыщенной жидкости, спонтанному образованию пузырьков всегда предшествуют значительные флуктуации состава [35]. В результате таких флуктуаций в метастабильном растворе образуются “сгустки” из частиц растворенного газа. Так как силы притяжения между частицами растворяемого газа и растворителя существенно слабее, чем силы притяжения между частицами растворителя, то пузырек возникает, как правило, на таких “сгустках”. При формировании критического пузырька это обеспечивает тот недостаток частиц легколетучего компонента, который имеет место в однородном растворе. Таким образом, при описании зародышеобразования в газонасыщенной жидкости можно исключить диффузионный механизм подвода легколетучего компонента к пузырьку.
Согласно Кагану [36] поправочный множитель к нормировке равновесной функции распределения пузырьков по размерам z = 1. По Дерягину и Прохорову [26] $z = {\rho \mathord{\left/ {\vphantom {\rho {\rho {\text{'}}}}} \right. \kern-0em} {\rho {\text{'}}}};$ его характерная величина – 5–10.
3. ЭКСПЕРИМЕНТ И ЕГО РЕЗУЛЬТАТЫ
Кинетика спонтанного вскипания растворов метан–гелий исследована в опытах по определению их среднего времени жизни в перегретом состоянии при фиксированных значениях $p,$ T и x. Используемые для приготовления растворов вещества имели чистоту 99.99 (метан) и 99.995 об. % (гелий). Основными примесями в метане были кислород и азот. Экспериментальная установка и методика проведения опытов подробно описаны в работах [10, 19, 37]. Здесь мы остановимся только на идейной стороне экспериментов, обработке получаемых данных и погрешности измеряемых величин.
Раствор перегревался в стеклянной ячейке объемом $V$ = 88 мм3. Перегрев создавался сбросом давления на термостатируемую (±0.005 K) жидкость. Давление раствора в исходном состоянии превышало давление фазового равновесия ${{p}_{{\text{s}}}}$ на 0.5–1.0 МПа. Для уменьшения эффекта охлаждения жидкости в процессе понижения давления переход к состоянию $p$ осуществлялся в два этапа. Первоначально давление снижалось на 0.2–0.5 МПа ниже давления ${{p}_{{\text{s}}}},$ а после релаксации температурных возмущений – до значения p. Точность поддержания давления $p$ не хуже ±0.002 МПа. Погрешность определения давления в опыте равна ±0.005 МПа, температуры – ±0.02 K.
Исследуемый раствор готовился в специальных мерных емкостях и конденсировался в измерительную ячейку. Концентрация раствора определялась в процессе его приготовления и контролировалась в ходе опыта по давлению насыщенных паров. Для этого экспериментальная установка была оснащена специальным устройством, позволяющим измерять давление фазового равновесия в измерительной ячейке.
Момент вскипания раствора фиксировался по резкому повышению давления. В опыте определялось время τ от момента перевода раствора в метастабильное состояние до момента вскипания. С целью уменьшения статистической погрешности в определении среднего времени жизни перегретой жидкости $\bar {\tau } = \sum\nolimits_i {{{{{\tau }_{i}}} \mathord{\left/ {\vphantom {{{{\tau }_{i}}} N}} \right. \kern-0em} N}} $ проводили от N = 20 до 50 измерений $\tau .$ При постоянстве значений $p,$ T, $x$ и большом числе наблюдений распределение времен жизни раствора описывается распределением Пуассона [8]. Для распределения пуассоновского типа характерна независимость вероятности наступления отдельного события от начала отсчета времени. Это позволяло вычитанием из всех измеренных времен некоторой величины ${{\tau }_{0}},$ заведомо большей длительности переходного процесса, исключить его влияние на результат опыта. В наших измерениях ${{\tau }_{0}}$ = 0.3–0.5 с.
Время жизни перегретой жидкости $\tau $ отождествлялось со временем ожидания появления первого закритического пузырька, поскольку время распада системы гораздо меньше наблюдаемых времен жизни. Между средним временем ожидания появления зародыша $\bar {\tau }$ в объеме V метастабильной жидкости и частотой зародышеобразования J существует очевидная связь: $J = {{(\bar {\tau }V)}^{{ - 1}}}.$
В опытах при постоянстве давления (p = 1.6, 2.0 МПа) и концентрации растворенного газа ($x$ = 0.06, 0.10 мол. %) определялась температурная зависимость среднего времени жизни перегретого раствора. Измерения проводились в диапазоне средних времен ожидания вскипания от 0.07 с до 10 мин, что соответствует интервалу частот зародышеобразования $J = 2 \times {{10}^{4}}{\kern 1pt} - {\kern 1pt} 1.6 \times {{10}^{8}}$ с–1 м–3 (рис. 1).
Рис. 1.
Температурная зависимость среднего времени жизни (а) и частоты зародышеобразования (б) в перегретом жидком метане (1 – x = 0 мол. %) и растворах метан–гелий (2 – x = 0.06, 3 – x = 0.10 мол. %) при давлении p = 1.6 (а) и 2.0 МПа (б). Вертикальный размер точек соответствует погрешности определения регистрируемой величины. Штриховые линии – расчет по КТЗ. Значения $\bar {\tau }$ и J чистого метана приводятся по данным работы [38].
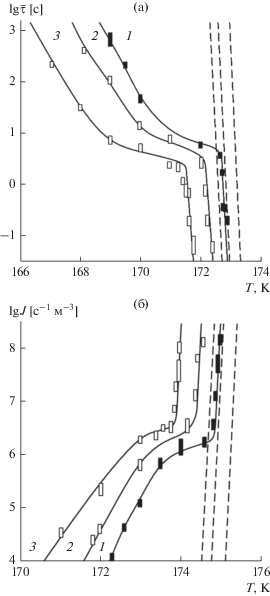
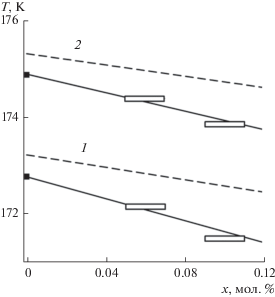
На экспериментальных кривых можно выделить два участка, различающихся характером температурной зависимости среднего времени жизни и частоты зародышеобразования. При $\bar {\tau } \leqslant $ 3 с и $J > 4 \times {{10}^{6}}$ с–1 м–3 имеет место резкая зависимость $\bar {\tau }$ и J от температуры. Здесь при изменении температуры на 1 K значения $\bar {\tau }$ и J изменяются на 7–12 порядков. Мы связываем этот участок кривых с гомогенным зародышеоб-разованием. Для чистого метана при p = 1.6 МПа и $J$ = 107 с–1 м–3 температура предельного перегрева ${{T}_{{\text{n}}}}$ = 172.76 K, а величина перегрева $\Delta {{T}_{{\text{n}}}} = {{T}_{{\text{n}}}} - {{T}_{{\text{s}}}}$ ≈ 12.64 К [38]. Растворение в метане 0.1 мол. % гелия понизило температуру предельного перегрева до 171.49 К (см. рис. 2). Величина перегрева $\Delta {{T}_{{\text{n}}}}$ при этом возросла до 15.72 K за счет снижения ${{T}_{{\text{s}}}}.$
Рис. 2.
Температура достижимого перегрева растворов метан–гелий ($J = $ 107 с–1 м–3) как функция концентрации гелия при давлении p = 1.6 (1) и 2.0 МПа (2). Горизонтальный размер точек соответствует погрешности определения концентрации смеси. Штриховые линии – расчет по КТЗ. Значения ${{T}_{{\text{n}}}}$ чистого метана (черные точки) приводятся по данным работы [38].
При относительно больших средних временах жизни (малых частотах зародышеобразования) на экспериментальных кривых появляются загибы (рис. 1). Аналогичные загибы имеют место на изобарах чистой жидкости [8–10]. Они связаны с инициирующим вскипание воздействием внешнего фактора. Как показано в работе [8], одним из таких факторов является естественный радиационный фон.
4. СОПОСТАВЛЕНИЕ КТЗ И ЭКСПЕРИМЕНТА
Конечный результат КТЗ (уравнение (4)) замечателен тем, что он содержит мало изменяющийся с перегревом предэкспоненциальный множитель $\rho zB$ и очень сильно зависящий от пересыщения экспоненциальный сомножитель. Формула (1) свидетельствует об очень сильной зависимости ${{W}_{*}}$ от поверхностного натяжения на границе между зарождающейся и материнской фазами. Зародышеобразование поэтому относится не только к флуктуационным, но и к поверхностным явлениям. Если принять погрешность данных о поверхностном натяжении на границе пузырька равной 2%, то это приведет к неопределенности в теоретической оценке J в два порядка. Такой же сдвиг частоты зародышеобразования дает погрешность в определении давления в критическом пузырьке, равная 0.8–1.2%. Требования к точности других величин, входящих в формулы (1)–(6), существенно ниже, чем к ${{\gamma }_{*}}$ и $p_{*}^{'}.$
При расчетах по формулам КТЗ использовались экспериментальные данные по теплофизическим свойствам системы метан–гелий. Поверхностное натяжение на плоской межфазной границе $\gamma $ было измерено ранее в нашей лаборатории дифференциальным капиллярным методом [39]. Данные о $\gamma $ чистого метана получены в работе [40]. Давление насыщенных паров системы метан–гелий представлено в работах [41–43]. Кроме того, оно рассчитывалось по уравнению состояния GERG-2008 [44]. С помощью этого уравнения состояния также определялись плотности сосуществующих фаз раствора. Ввиду слабого влияния малых добавок гелия на вязкость, величина $\eta $ принималась равной вязкости чистого жидкого метана [45]. В расчетах J полагалось, что коэффициент конденсации αi как первого, так и второго компонента на поверхности пузырька равен 1.
Согласно уравнению (4) частота зародышеобразования менее чувствительна к точности определения кинетического множителя $B$, чем работы образования критического зародыша ${{W}_{*}}$. Неопределенность для B в два порядка целиком переносится на рассчитываемое значение J. При p = 1.6 МПа сдвиг J на два порядка соответствует изменению температуры перегрева чистого метана на 0.16 K. Это составляет всего 1.3% от величины перегрева $\Delta {{T}_{{\text{n}}}},$ обеспечивающей заданную частоту зародышеобразования в жидкости. Конечно, чем точнее определен множитель B, тем более тонкие эффекты могут быть выявлены при изучении кинетики зародышеобразования.
Малое влияние значительных изменений частоты зародышеобразования на достижимый перегрев жидкости связано с очень крутой ее зависимостью от пересыщения. Согласно (4) с хорошим приближением можно принять, что $\ln J = {\text{const}} - {{{{W}_{*}}} \mathord{\left/ {\vphantom {{{{W}_{*}}} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}}$ и
(8)
${{d\ln J} \mathord{\left/ {\vphantom {{d\ln J} {dT}}} \right. \kern-0em} {dT}} \approx {{ - d\left( {{{{{W}_{*}}} \mathord{\left/ {\vphantom {{{{W}_{*}}} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}}} \right)} \mathord{\left/ {\vphantom {{ - d\left( {{{{{W}_{*}}} \mathord{\left/ {\vphantom {{{{W}_{*}}} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}}} \right)} {dT}}} \right. \kern-0em} {dT}}.$Используя выражения (1)–(4), по известным теплофизическим свойствам можно найти ${{W}_{*}}$ и производную ${{d\left( {{{{{W}_{*}}} \mathord{\left/ {\vphantom {{{{W}_{*}}} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}}} \right)} \mathord{\left/ {\vphantom {{d\left( {{{{{W}_{*}}} \mathord{\left/ {\vphantom {{{{W}_{*}}} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}}} \right)} {dT}}} \right. \kern-0em} {dT}}$ и тем самым оценить крутизну зависимости $\ln J(T).$ В табл. 1 приведены полученные таким способом значения ${{d\lg J} \mathord{\left/ {\vphantom {{d\lg J} {dT}}} \right. \kern-0em} {dT}}$ для чистого метана и раствора метан–гелий при величинах перегрева, соответствующих частоте зародышеобразования $J$ = 107 с–1 м–3.
Таблица 1.
Температура достижимого перегрева ${{T}_{{\text{n}}}}$ и производная ${{d{\text{lg}}J} \mathord{\left/ {\vphantom {{d{\text{lg}}J} {dT}}} \right. \kern-0em} {dT}}$ растворов метан–гелий ($J$ = 107 с–1 м–3)
| p, МПа | x, мол. % | ${{T}_{{\text{s}}}},$ К | ${{T}_{{\text{n}}}},$ К | ${{d{\text{lg}}J} \mathord{\left/ {\vphantom {{d{\text{lg}}J} {dT,}}} \right. \kern-0em} {dT,}}$ К–1 | ||
|---|---|---|---|---|---|---|
| эксперимент | теория | эксперимент | теория | |||
| 1.6 | 0 | 160.12 | 172.76 | 173.19 | 10 | 12 |
| 0.06 | 157.72 | 172.14 | 172.82 | 7 | 11 | |
| 0.10 | 155.77 | 171.49 | 172.56 | 8 | 11 | |
| 2.0 | 0 | 165.87 | 174.86 | 175.29 | 11 | 14 |
| 0.06 | 164.24 | 174.37 | 174.95 | 12 | 14 | |
| 0.10 | 162.97 | 173.84 | 174.71 | 11 | 13 | |
Результаты расчета частоты зародышеобразования в растворе по КТЗ показаны на рис. 1. Как и в случае чистой жидкости, имеет место систематическое занижение достигнутых в опыте значений перегрева относительно предсказаний КТЗ. Расхождения составляют 0.6–1.1 K. Это может означать, что в (4) использовано заниженное значение B или уравнение (1) завышает работу ${{W}_{*}}$. Чтобы устранить рассогласование КТЗ и эксперимента по $\Delta {{T}_{{\text{n}}}},$ нужно принять, что кинетический множитель в (4) на 8–12 порядков больше рассчитанного по формулам (5), (6) или, что поверхностное натяжение на границе парогазового пузырька критического размера ${{\gamma }_{*}}$ меньше, чем на плоской границе фаз $\gamma $. Если все рассогласование теории с опытом отнести за счет влияния кривизны разделяющей поверхности зародыша, то, используя формулы (1)–(6), можно определить “микроскопическое” натяжение ${{\gamma }_{*}},$ которое оказывается на 8–12% меньше его “плоского” предела $\gamma .$ Критические пузырьки при этом имеют радиус от 4 до 5 нм и содержат от 650 до 940 молекул. Данный результат ранее фиксировался в чистых криогенных жидкостях [46, 10 ]. Как следует из проведенных экспериментов, это имеет место и для слабых растворов газа в жидкости.
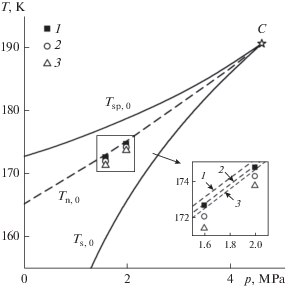
На рис. 3 температуры предельного перегрева растворов метан–гелий и чистого метана представлены в зависимости от давления. Там же для чистого метана показаны бинодаль $T{{{\kern 1pt} }_{{{\text{s}},0}}}$ и спинодаль $T{{{\kern 1pt} }_{{{\text{sp}},0}}},$ рассчитанная по теории Фюрта [8].
Рис. 3.
Температура достижимого перегрева чистого метана (1) [38] и растворов метан–гелий с содержанием гелия $x$ = 0.06 (2) и 0.10 мол. % (3). C – критическая точка, ${{T}_{{{\text{s}},0}}}$ – температура насыщения, ${{T}_{{{\text{sp}},0}}}$ – спинодаль чистого метана. Штриховая линия – расчет по КТЗ (J = 107 с–1 м–3) для чистого метана, ${{T}_{{{\text{n}},0}}}.$
5. ЗАКЛЮЧЕНИЕ
Мы исследовали процесс образования зародышей парогазовой фазы в слабых растворах гелия в метане. Показано, что растворенный газ понижает температуру достижимого перегрева растворителя и его предельное растяжение (рис. 3). Это связано с уменьшением радиуса критического пузырька вследствие понижения поверхностного натяжения и возрастанием давления в пузырьке. Как и для чистого метана, для раствора метан–гелий мы наблюдаем систематическое занижение достигнутых в опыте перегревов (растяжений) по сравнению с рассчитанными по КТЗ. Величина отклонений температур $T_{{\text{n}}}^{{{\text{exp}}}}$ от $T_{{\text{n}}}^{{{\kern 1pt} {\text{calc}}}}$ в метане и растворах метан–гелий составляет в исследуемом диапазоне параметров состояния 0.4–1.1 К, что значительно больше погрешности определения температуры перегрева в опыте. Эти отличия не связаны с предэкспоненциальным множителем уравнения (4). Учет различных факторов, определяющих динамику пузырька, приводит к неопределенности в кинетическом множителе, не превышающей трех порядков [8–10]. При фиксированной величине J такая неопределенность может дать изменение в температуре перегрева, не превышающее 0.3 К. Таким образом, расхождение теории и эксперимента, по-видимому, связано с экспоненциальным сомножителем (уравнение (4)).
Основной вклад в показатель экспоненты – работу образования критического зародыша вносят поверхностное натяжение и давление в критическом пузырьке. Для критических пузырьков в чистой жидкости величина ${{\gamma }_{*}}$ меньше, чем на плоской межфазной границе жидкость–пар на 5–7% [10, 46]. Учет этого факта в уравнении (4) позволяет согласовать теорию и эксперимент по величине $\Delta {{T}_{{\text{n}}}}$ в пределах их совокупной погрешности.
Одно из главных отличий раствора от однокомпонентной жидкости – наличие адсорбции растворенного вещества на межфазной границе. Именно адсорбция легколетучего компонента приводит к снижению поверхностного натяжения ${{\gamma }_{*}}$ по мере растворения газового компонента в жидкости. Здесь следует отметить два обстоятельства. Во-первых, сопоставляя КТЗ и эксперимент, мы предполагаем, что время прохождения зародышем критической области активационного барьера превышает время установления адсорбционного равновесия на границе пузырек–раствор. Данные молекулярно-динамического моделирования свидетельствуют, что это условие может нарушаться [47]. Во-вторых, даже при наличии квазиравновесия между зародышами критического размера и исходной фазой характер размерной зависимости ${{\gamma }_{*}}$ в случае раствора может отличаться от аналогичной зависимости для чистой жидкости. При увеличении содержания растворенного вещества в растворителе первая поправка на кривизну межфазной границы (параметр Толмена) меняет свой знак и становится положительной величиной [48]. Для больших пузырьков это означает рост поверхностного натяжения пузырька по мере увеличения кривизны межфазной границы. Данный эффект становится заметным при значениях концентрации, составляющих единицы процентов [49]. Мы надеемся зафиксировать его в опытах с системами этан–метан или этан–азот.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-08-00403).
Автор благодарен А.М. Каверину и А.С. Панкову за помощь в проведении данной работы.
Список литературы
Sulla J., Demicheva M., Casal J. // J. Loss Prev. Process Ind. 2006. V. 19. P. 690.
Pruess K., Narasimhan T.N. // J. Geophys. Res. 1982. V. 87. P. 9329.
Sahagian D. // Nature (London). 1999. V. 402. P. 589.
Lensky N.G., Navon O., Lyakhovsky V. // J. Volcanol. Geotherm. Res. 2004. V. 129. P. 7.
L’Heureux J. // J. Geophys. Res. B. 2007. V. 112. P. B12208.
Rubin M.B., Noyes R.M. // J. Phys. Chem. 1987. V. 91. P. 4193.
Rubin M.B., Noyes R.M. // J. Phys. Chem. 1992. V. 96. P. 993.
Скрипов В.П. Метастабильная жидкость. М.: Наука, 1972.
Скрипов В.П., Синицын Е.Н., Павлов П.А., Ермаков Г.В., Муратов Г.Н., Буланов Н.В., Байдаков В.Г. Теплофизические свойства жидкостей в метастабильном состоянии. М.: Атомиздат, 1980.
Baidakov V.G. Explosive Boiling of Superheated Cryogenic Liquids. Weinheim: Wiley, 2007.
Hemmingsen E.A. // Science. 1970. V. 167. P. 1493.
Gerth W.A., Hemmingsen E.A. // Z. Naturforsch. A. 1976. V. 31. P. 1711.
Finkelstein Y., Tamir A. // AIChE J. 1985. V. 31. P. 1409.
Bowers P.G., Hofstetter C., Ngo H.L., Toomey R.T. // J. Colloid Interface Sci. 1999. V. 215. P. 441.
Mori Y., Hijikata K., Nagatani T. // Int. J. Heat Mass Transfer. 1976. V. 19. P. 1153.
Forest T.W., Ward C.A. // J. Chem. Phys. 1977. V. 66. P. 2322.
Bowers P.G., Hofstelter C., Letter G.R., Toomey R.T. // J. Phys. Chem. 1995. V. 99. P. 9632.
Bowers P.G., Bar-Eli K., Noyes R.M. // J. Chem. Soc. Faraday Trans. 1996. V. 92. P. 2843.
Baidakov V.G., Kaverin A.M., Boltachev G. // J. Phys. Chem. B. 2002. V. 106. P. 167.
Baidakov V.G. // Chem. Phys. Lett. 2008. V. 462. P. 201.
Baidakov V.G., Kaverin A.M., Andbaeva V.N. // J. Phys. Chem. B. 2008. V. 112. P. 12973.
Несис Е.И., Френкель Я.И. // Журн. техн. физики. 1952. Т. 22. С. 1500.
Staufer D. // J. Aerosol Sci. 1976. V. 7. P. 319.
Trinkaus H. // Phys. Rev. B. 1983. V. 27. P. 7372.
Зицерман В.Ю., Бережковский Л.М. // Журн. физ. химии. 1990. Т. 64. С. 1795.
Дерягин Б.В., Прохоров А.В. // Коллоид. журн. 1982. Т. 44. С. 847.
Куни Ф.М., Огенко В.М., Ганюк Л.М., Гречко Л.Г. // Коллоид. журн. 1993. Т. 55. С. 22.
Мелихов А.А., Трофимов Ю.В., Куни Ф.М. // Коллоид. журн. 1994. Т. 56. С. 201.
Baidakov V.G. // J. Chem. Phys. 1999. V. 110. P. 3955.
Kuchma A.E., Shchekin A.K., Martyukova D.S. // J. Chem. Phys. 2018. V. 148. P. 234103.
Ward C.A., Balakrishnan A., Hooper F.C. // Trans. ASME. 1970. V. 92. P. 695.
Kwak H., Panton R.N. // J. Chem. Phys. 1983. V. 78. P. 5795.
Гиббс Дж.В. Термодинамические работы. М.–Л.: Гостехиздат, 1950.
Зельдович Я.Б. // Журн. эксп. теор. физики. 1942. Т. 12. С. 525.
Protsenko S.P., Baidakov V.G., Teterin A.S., Zhdanov E.R. // J. Chem. Phys. 2007. V. 126. P. 094502.
Каган Ю.М. // Журн. физ. химии. 1960. Т. 34. С. 92.
Baidakov V.G., Kaverin A.M., Boltachev G.Sh. // J. Chem. Phys. 1997. V. 106. P. 5648.
Байдаков В.Г., Каверин А.М., Скрипов В.П. // Коллоид. журн. 1980. Т. 42. С. 314.
Baidakov V.G., Grishina K.A. // Fluid Phase Equilib. 2013. V. 354. P. 245.
Байдаков В.Г., Хвостов К.В., Муратов Г.Н. // Журн. физ. химии. 1982. Т. 56. С. 814.
Sinor J.E., Schindler D.L., Kurata F. // AIChE J. 1966. V. 12. P. 353.
Heck C.K., Hiza M.J. // AIChE J. 1967. V. 13. P. 593.
DeVaney W.E., Rhodes H.L., Tully P.C. // J. Chem. Eng. Data. 1971. V. 16. P. 158.
Kunz O., Wagner W. // J. Chem. Eng. Data. 2012. V. 57. P. 3032.
Hellemans J., Zink H., Van Paemel O. // Physica. 1970. V. 46. P. 395.
Байдаков В.Г., Скрипов В.П. // Журн. физ. химии. 1982. Т. 56. С. 818.
Baidakov V.G., Protsenko S.P., Brukhanov V.M. // Fluid Phase Equilib. 2019. V. 481. P. 1.
Baidakov V.G., Khotienkova M.N. // Fluid Phase Equilib. 2016. V. 425. P. 402.
Baidakov V.G., Pankov A.S. // Int. J. Heat Mass Transfer. 2015. V. 86. P. 930.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


