Коллоидный журнал, 2019, T. 81, № 4, стр. 472-477
Взаимодействие кверцетина с высокодисперсным оксидом алюминия в водно-этанольной среде
Н. А. Липковская 1, *, В. Н. Барвинченко 1
1 Институт химии поверхности им. А.А.Чуйко Национальной академии наук Украины
03164 Киев-164, ул. Генерала Наумова, 17, Украина
* E-mail: lipkovska@ukr.net
Поступила в редакцию 09.01.2019
После доработки 13.02.2019
Принята к публикации 19.02.2019
Аннотация
Проведены комплексные адсорбционные и спектральные исследования взаимодействия природного флавонола кверцетина с высокодисперсным оксидом алюминия в водно-этанольной среде. Показано, что сорбция кверцетина на оксиде алюминия начинается при pH > 2.5 и достигает максимальных значений в нейтральной среде, коррелируя с содержанием недиссоциированных поверхностных групп ≡AlOH. Изотерма сорбции кверцетина относится к H-типу, характерному для хемосорбции. Совпадение спектральных характеристик флавонола на поверхности высокодисперсного оксида алюминия и в растворах, содержащих ионы Al(III), свидетельствует об образовании однотипных хелатных комплексов в этих системах.
ВВЕДЕНИЕ
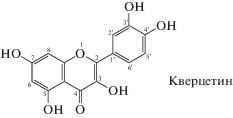
В настоящее время все больше внимания уделяется выделению из растительного сырья и определению биоактивного флавонола кверцетина (Кв, Qu(OH)5), который благодаря своей высокой фармакологической активности [1–3] входит в состав биологически активных добавок, лекарственных препаратов и пищевых продуктов [4, 5]. Молекула Кв состоит из двух ароматических колец (A и B), которые связаны кислородсодержащим гетероциклом (кольцо C).
Согласно литературным данным [6–8], для концентрирования и определения индивидуальных флавонолов или их смесей в водных и водно-этанольных экстрактах применяют преимущественно сорбционно-хроматографические методы с использованием модифицированных силикагелей, полимерных сорбентов (полистирол, пенополиуретан), высокоосновных анионообменников, высокоупорядоченных наноструктурированных мезопористых материалов, в частности, полимеров с молекулярными отпечатками Кв. Однако, наиболее перспективными промышленными сорбентами могут быть неорганические оксиды, в частности, диоксид кремния и оксид алюминия.
Ранее нами было установлено, что сорбция Кв из водных растворов на поверхности высокодисперсного кремнезема незначительна (5%), поскольку происходит только за счет образования водородных связей, но возрастает до 95% в составе положительно заряженных супрамолекулярных комплексов с катионными поверхностно-активными веществами (декаметоксином, мирамистином, этонием) [9, 10]. Более эффективным сорбентом может оказаться оксид алюминия, так как известно, что Кв способен образовывать в растворах хелатные комплексы с ионами алюминия [11]. Оксид алюминия является механически прочным, гидролитически устойчивым и доступным сорбентом. В растворах его поверхность подвергается гидратации с формированием на ней кислотных и основных, как льюисовских, так и бренстедовских, центров [12], что обусловливает возможность взаимодействия Al2O3 с различными полифункциональными органическими соединениями по разным механизмам. Так, была показана возможность адсорбционного закрепления на поверхности оксида алюминия динатриевой соли 4,5-дигидроксибензол-1,3-дисульфокислоты [13, 14], салициловой и сульфосалициловой кислот [14] при получении модифицированных сорбентов для селективного извлечения ионов металлов из растворов. По мнению этих авторов, сорбция реагентов происходит преимущественно за счет электростатического взаимодействия с положительно заряженной поверхностью Al2O3. Сведений о сорбции Кв, содержащего карбонильную и пять гидроксильных групп, что предполагает возможность нескольких механизмов связывания с поверхностью оксида алюминия, в научной литературе нами обнаружено не было.
Цель настоящей работы – изучение закономерностей сорбции на поверхности оксида алюминия полифункционального органического соединения кверцетина в зависимости от концентрации и кислотности его водно-этанольных растворов в диапазоне физиологических значений рН, установление взаимосвязи между процессами комплексообразования с ионами алюминия в растворе и на поверхности сорбента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали высокодисперсный пирогенный оксид алюминия Aeroxide Alu C с размером частиц 13 нм и удельной поверхностью 100 м2/г (Evonik Degussa AG) в форме 0.05%-ной водной дисперсии (ионная сила 0.01 н), которую готовили перемешиванием навесок сорбента (0.25 г) и NaCl (0.29 г) с водой (500 мл) магнитной мешалкой в течение 2 ч. Исходные растворы кверцетина (Sigma) готовили растворением точных навесок в этаноле. Растворы хлористоводородной кислоты и щелочи готовили из концентрированных HCl и NaOH марки “ч. д. а.” Все исследования проводили в 40%-ном растворе этанола, который обеспечивал стабильность растворов малорастворимого в воде Кв.
Электронные спектры поглощения растворов Кв до и после смешивания с дисперсией оксида алюминия измеряли на спектрофотометре Specord M-40 (Karl Zeiss Jena, Германия) в ячейке для мутных растворов в кварцевых кюветах. С целью устранения влияния фона на аналитический сигнал, использовали метод гетерохроматической экстраполяции при двух длинах волн [15]. Кислотность растворов до и после сорбции контролировали с помощью стеклянного электрода универсального иономера Hanna instruments HI 221.
Сорбцию Кв на поверхности оксида алюминия изучали в статических условиях, для чего 10 мл раствора Кв соответствующей концентрации смешивали с 10 мл 0.05%-ной водной дисперсии сорбента, задавали необходимое значение рН раствора, перемешивали до установления равновесия (2 ч при 20°C) и измеряли поглощение дисперсии (Aдисп). Равновесный раствор отделяли центрифугированием (8000 об./мин, 15 мин) и измеряли его поглощение (A[C]). Поглощение сорбированного на оксиде алюминия кверцетина (As) определяли как арифметическую разницу:
В качестве образца сравнения использовали дисперсию чистого оксида алюминия, проведенную через все те же стадии, что и исследуемые образцы.
Принимая во внимание, что спектральные характеристики Кв являются постоянными при pH < 3 [16], его равновесную концентрацию определяли по собственному поглощению в кислой среде, для чего в центрифугат добавляли 1 н раствор HCl до установления pH 2.5 ± 0.2, измеряли поглощение этого раствора (A) и рассчитывали равновесную концентрацию исходя из молярного коэффициента поглощения Кв (ε376 нм = 22 194), который был определен экспериментально для этих условий.
Величину сорбции (a, моль/г) рассчитывали по формуле a = (C − [C])V/m, где C и [C], – соответственно, исходная и равновесная концентрации Кв (М), V – объем раствора (л), m – масса сорбента (г).
Изотерму сорбции анализировали с использованием уравнения Ленгмюра
(2)
$a = {{{{a}_{\infty }}k[C]} \mathord{\left/ {\vphantom {{{{a}_{\infty }}k[C]} {(1{\text{ }} + k[C]),}}} \right. \kern-0em} {(1{\text{ }} + k[C]),}}$В линейной форме уравнение (2) имеет вид
(3)
${{[C]} \mathord{\left/ {\vphantom {{[C]} a}} \right. \kern-0em} a} = {1 \mathord{\left/ {\vphantom {1 {{{a}_{\infty }}k}}} \right. \kern-0em} {{{a}_{\infty }}k}} + {{[C]} \mathord{\left/ {\vphantom {{[C]} {{{a}_{\infty }}.}}} \right. \kern-0em} {{{a}_{\infty }}.}}$Построеный в координатах [C]/a от [C] график представляет собой прямую линию, исходя из параметров которой рассчитывали величины предельной сорбции а∞ и константу равновесия сорбционного процесса k.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектральные свойства сорбированного кверцетина изучали путем непосредственного измерения оптической плотности дисперсии оксида алюминия, поскольку в области исследуемых концентраций (0.025%) она обладает высокой седиментационной устойчивостью и достаточной прозрачностью. Это дает возможность исследовать в одинаковых условиях спектральные характеристики Кв в растворах и на поверхности сорбента.
На рис. 1а приведены спектры поглощения дисперсии оксида алюминия в растворах Кв различной концентрации, которые представляют собой суммарные спектры поглощения сорбента и равновесного раствора. Видно, что при малых концентрациях Кв в спектрах наблюдается преимущественно полоса с λmax ≈ 440 нм, к которой при увеличении концентрации Кв в растворе добавляется его собственная полоса поглощения при данном значении pH (λmax = 380 нм). Центрифугирование дисперсии и последующее измерение поглощения равновесного раствора позволяет рассчитать по уравнению (1) спектры самого оксида алюминия с сорбированным Кв (Кв/Al2O3) − рис. 1б.
Рис. 1.
Спектры поглощения: (а) дисперсии оксида алюминия в растворах Кв различной концентрации, (б) комплекса Кв на поверхности сорбента (Кв/Al2O3). Исходная концентрация Кв (10–5 М): 0.25 (1), 0.5 (2), 1.0 (3), 1.5 (4), 2.0 (5), 2.5 (6), 3.0 (7), 3.5 (8), 4.0 (9), 5.0 (10). Образец сравнения – дисперсия Al2O3; l = 1 см.
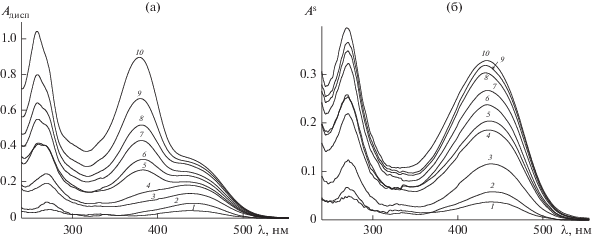
Можно видеть, что спектры Кв/Al2O3 (рис. 1б) сдвинуты относительно спектра Кв в растворе (рис. 1а) в длинноволновую область на 60 нм. Такой значительный батохромный сдвиг может быть обусловлен образованием поверхностных комплексов Кв с оксидом алюминия, аналогичных его комплексам с ионами Al(III) в растворах [11].
При исследовании сорбционных взаимодействий в гетерогенной системе “оксид алюминия–раствор Кв” необходимо учитывать все возможные реакции, происходящие в растворе сорбата и на поверхности сорбента. Исходя из этого была изучена зависимость сорбции Кв от рН растворов, поскольку кислотность среды является важным параметром сорбционного процесса для соединений, содержащих гидроксильные группы. Учитывая, что при рН > 8 флавонолы постепенно окисляются кислородом воздуха, сорбцию Кв изучали в диапазоне рН 2–7. Из данных, представленных на рис. 2 (кривая 1), видно, что сорбция Кв начинается при рН > 3 и достигает максимальных значений в области рН 6−7, что свидетельствует о том, что с повышением рН раствора равновесие смещается в сторону образования поверхностных комплексов Кв.
Рис. 2.
Сорбция Кв (1), распределение на поверхности оксида алюминия протонированных $ \equiv {\kern 1pt} {\text{AlО Н }}_{{\text{2}}}^{ + }$ (2), недиссоциированных ≡AlOH (3) и депротонированных ≡AlO– (4) групп [17, 18]; распределение молекулярной (5) и депротонированной (6) форм Кв в растворе в зависимости от рН; зависимость сорбции Кв от относительной доли групп ≡AlOH (7).
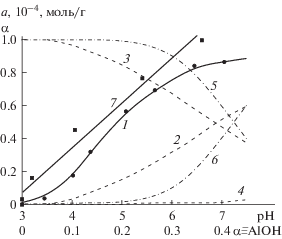
Для установления факторов, которые определяют зависимость сорбции от рН, было проанализировано состояние поверхностных групп оксида алюминия в условиях эксперимента. Известно, что поверхность Al2O3 амфотерна, и, в соответствии с положениями теории комплексообразования [19], ее заряд изменяется при взаимодействии с протонами водного раствора. Такие равновесия протонирования и депротонирования поверхностных ≡AlOH-групп описываются уравнениями
Как видно из данных, приведенных на рис. 2, величина сорбции Кв начинает расти при рН > 3 пропорционально увеличению относительной доли недиссоциированных ≡AlOH-групп, причем эта зависимость (кривая 7) линеарилизуется с высоким коэффициентом корреляции R = 0.987 и свидетельствует о том, что на поверхности оксида алюминия Кв взаимодействует именно с группами ≡AlOH. Исходя из этого образование поверхностных комплексов можно описать следующим уравнением:
Исследование зависимости сорбции Кв от его концентрации в водно-этанольных растворах проводили при рН 6.5 ± 0.2, т.е. в области максимальной сорбции. Приведенную на рис. 3 (кривая 1) изотерму сорбции Кв, можно отнести к H-типу, поскольку в области низких концентраций она имеет практически вертикальный участок, где a > 0 при [C] ≈ 0.
Рис. 3.
Изотерма сорбции Кв на оксиде алюминия (1) и та же изотерма в координатах линейной формы уравнения Ленгмюра (2); рН 6.5 ± 0.2.
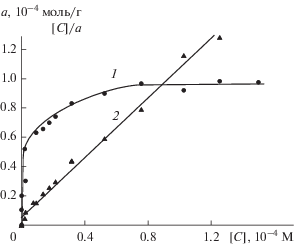
Изотерма сорбции была проанализирована с использованием модели Ленгмюра (уравнения (2), (3)). Построенный в координатах [C]/a от [C] график (кривая 2) представляет собой прямую линию, исходя из параметров которой были рассчитаны величина максимальной сорбции Кв (a∞= 9.79 ммоль/г), которая полностью совпала с экспериментальными даными (кривая 1), а также константа равновесия адсорбционного процесса (k = 0.2 × 106 л/ммоль) и коэффициент корреляции (R = 0.995).
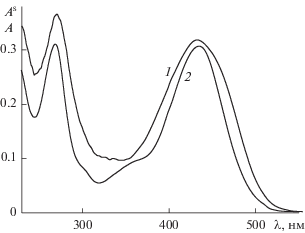
Для выяснения механизма взаимодействия Кв с поверхностью оксида алюминия были проведены спектральные исследования его комплексообразования с раствором хлорида алюминия в тех же экспериментальных условиях, что и при изучении сорбции. На рис. 4 приведены спектры поглощения комплексов Кв на поверхности Al2O3 при а = 0.90 × 10–4 моль/г (кривая 1), которая соответствует области максимальной сорбции, и в растворе AlCl3 при соотношении концентраций Кв : Al(III) = 1 : 1 (кривая 2). Видно, что спектры Кв как на поверхности оксида алюминия, так и в растворе хлорида алюминия характеризуються одной и той же величиной λмакс = 434 нм, что может являться доказательством образования комплексов одного типа.
Рис. 4.
Спектры поглощения комплексов Кв на поверхности оксида алюминия (1) и в растворе соли Al(III) (2). а = 0.90 × 10–4 моль/г (1); CКв = CAl(III) = = 5 × 10–5 М (2), рН 6.5; l = 1.0 (1), 0.5 см (2).
Молекула Кв имеет несколько центров, потенциально способных образовывать хелатные комплексы с ионами алюминия; их положение определяется наличием пар расположенных рядом гидроксильной и карбонильной групп. Так, пара групп 3'-ОН и 4'-ОН кольца В (пирокатехиновая группа) рассматривается некоторыми исследователями как наиболее вероятный центр связывания ионов металлов [20, 21]. Однако это касается только щелочной среды, в которой происходит депротонирование 3'- и 4'-гидроксилов. В хелатообразовании также могут принимать участие пары групп 3-ОН и 4-С=О или 5-ОН и 4-С=О. Поскольку начальной стадией комплексообразования является электрофильная атака иона металла на молекулу флавонола, большое значение имеет распределение электронной плотности в лиганде, в частности, величина зарядов на атомах кислорода, где электронная плотность максимальна.
Анализ взаимосвязи “структура–реакционная способность” дает основание утверждать, что наибольший отрицательный заряд в молекуле Кв расположен на атоме кислорода 4-карбонильной группы Действительно, результаты теоретических расчетов методом PMЗ (программа Мораса 6.0) энтальпий образования монолигандних комплексов с Кв показали [22], что энергия связывания ионов алюминия с функциональными группами его молекулы уменьшается в ряду группировок: 3-ОН и 4-С=О > 4-С=О и 5-ОН > 3'-ОН и 4'-ОН. Следует отметить, что в наших экспериментальных условиях (рН ≤ 7) группы 3'- и 4'-ОН в комплексообразовании не задействованы, что имеет принципиальное значение для сохранения антиоксидантной активности Кв на поверхности Al2O3. Это предположение подтвердили положительные пробы на антиоксидантную активность образцов оксида алюминия с сорбированным Кв, полученные с применением реактива Фолина.
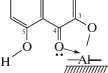
Следует отметить, что хелатные комплексы органических реагентов с ионами металлов образуются в той области рН, где последние гидролизуются с образованием гидроксокомплексов. Учитывая, что катионы Al3+ в кислой водной среде образуют аквакомплексы [Al(OH2)6]3+, а уменьшение концентрации катионов Н+ в реакционной среде обусловливает ступенчатое образования гидроксокомплексов [Al(OH)n(OH2)6 –n](3 –n)+ [23], можно утверждать, что Кв в наших экспериментальных условиях в растворах взаимодействует с гидроксокомплексами хлорида алюминия, а на поверхности – с нейтральними группами ≡AlOH оксида алюминия. Кв образует хелат за счет взаимодействия 3-ОН-группы с группой ≡AlOH поверхности с появлением новой связи алюминий–кислород, что сопровождается появлением полос поглощения в ИК-спектре в области частот 400−650 см–1 [24], и координационной связи алюминия с кислородом карбонильной группы 4-С=О, в результате чего замыкается пятичленный цикл. Схема образования хелатного комплекса Кв на поверхности оксида алюминия приведена ниже.
Таким образом, установлены закономерности сорбции на поверхности высокодисперсного оксида алюминия природного флавонола кверцетина в зависимости от его химической структуры и кислотности водно-этанольных дисперсий в диапазоне физиологических значений рН. Показано, что благодаря наличию в молекуле расположенных рядом гидроксильной и карбонильной групп Кв взаимодействует с недиссоциированными группами ≡AlOH оксида алюминия с образованием на поверхности сорбента хелатов, аналогичных комплексам Кв с Al(III) в растворах. Сорбция Кв на поверхности Al2O3 за счет комплексообразования подтверждается H-типом его изотермы, характерным для хемосорбции. Найденные закономерности и параметры сорбции позволяют выработать практические рекомендации по использованию оксида алюминия в качестве сорбента для извлечения и концентрирования кверцетина.
Список литературы
Wang W.Y., Sun C.X., Mao L.K. et al. // Trends Food Sci. Technol. 2016. V. 56. P. 21.
Тараховский Ю.С., Ким Ю.А., Абдрасилов Б.С., Музафаров Е.Н. Флавоноиды: биохимия, биофизика, медицина. Пущино: Synchrobook, 2013.
Chen C., Zhou J., Ji C. // Life Sci. 2010. V. 87. P. 333.
Wach A., Pyrzyska K., Biesaga M. // Food Chem. 2007. V. 100. P. 699.
Яшин Я.И., Рыжнев В.Ю., Яшин А.Я., Черноусова Н.И. Природные антиоксиданты. Содержание в пищевых продуктах и влияние их на здоровье и старение человека. М.: ТрансЛит, 2009.
Naczk M., Shahidi F. // J. Chromatogr. A. 2004. V. 1054. P. 95.
Rijke E., Out P., Niessen W.M.A. et al. // Trends Food Sci. Technol. 2016. V. 56. P. 21.
Дмитриенко С.Г., Кудринская В.А., Апяри В.В. // Журн. аналит. химии. 2012. Т. 67. С. 340.
Барвинченко В.Н., Липковская Н.А., Федя- нина Т.В. и др. // Коллоид. журн. 2014. Т. 76. С. 157.
Барвинченко В.Н., Липковская Н.А. // Коллоид. журн. 2018. Т. 80. С. 47.
Pękal A., Pyrzynska K. // Food Anal. Methods. 2014. V. 7. P. 1776.
Чукин Г.Д. Строение оксида алюминия и катализаторов гидрообессеривания. Механизмы реакций. М.: ООО “Принта”, 2010.
Тихомирова Т.И., Кубышев С.С, Иванов А.В. // Журн. физ. химии. 2013. Т. 87. С. 1366.
Jiang L., Gao L., Liu Y. // Colloids Surf. A. 2002. V. 211. P. 165.
Бернштейн И.Я., Каминский Ю.Л. Спектрофотометрический анализ в органической химии. Л.: Химия, 1986.
Липковская Н.А., Барвинченко В.Н., Федянина Т.В. и др. // Журн. прикл. спектроскопии. 2014. Т. 81. С. 589.
Tombácz E., Szekeres M. // Langmuir. 2001. V. 17. P. 1411.
Tombácz E., Szekeres M., Klumpp E. // Langmuir. 2001. V. 17. P. 1420.
Westall J.C., Hohl H. // Adv. Colloid Interface Sci. 1980. V. 12. P. 265.
Malešev D., Kuntić V. // J. Serb. Chem. Soc. 2007. V. 72. P. 921.
Cornard J.P., Merlin J.C. // J. Inorg. Biochem. 2002. V. 92. P. 19.
Рошаль А.Д., Сахно Т.В. // Вестн. ХНУ. Серия Химия. 2001. № 532. Вып. 7. С. 237.
Gregory J., Duan J. // Pure Appl. Chem. 2001. V. 73. P. 2017.
De Souza R.F.V., De Giovani W.F. // Spectrochim. Acta. Part A. 2005. V. 61. P. 1985.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал