Коллоидный журнал, 2020, T. 82, № 1, стр. 26-36
Процессы растворения фосфорил-замещенного фталоцианината цинка в воде в присутствии бромида тетрадецилтриметиламмония в интервале pH 4–9
Т. Г. Мовчан 1, *, А. Ю. Чернядьев 1, Е. В. Плотникова 1, А. Ю. Цивадзе 1, В. Е. Баулин 1, 2
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
2 Институт физиологически активных веществ РАН
142432 Московская область, Черноголовка,
Северный проезд, 1, Россия
* E-mail: movchan_tamara@mail.ru
Поступила в редакцию 26.07.2019
После доработки 05.08.2019
Принята к публикации 08.08.2019
Аннотация
Методами электронной спектроскопии поглощения и флуоресцентной спектроскопии проанализированы процессы агрегации фосфорил-замещенного фталоцианината цинка на примере 2,(3),9,(10),16,(17),23,(24)-тетра(2-фосфорил)феноксифталоцианината цинка ([ZnPc(PO(OH)2)4]) в диметилсульфоксиде и в воде при различных значениях pH. Установлено, что в водных системах при pH 4–9 это соединение существует в агрегированном состоянии, а в диметилсульфоксиде образует молекулярный раствор. Кроме того, ZnPc(PO(OH)2)4 фактически не растворяется в воде при pH < 5.7. Добавление бромида тетрадецилтриметиламмония в качестве катионного ПАВ в водный раствор ZnPc(PO(OH)2)4 позволяет достичь эффекта полного распада агрегатов красителя на отдельные молекулы в широком диапазоне pH (от 4 до 9.18), а также существенно увеличить растворимость ZnPc(PO(OH)2)4 в сильнокислых средах. Проведенный анализ флуоресцентных свойств мицеллярных растворов ПАВ, содержащих ZnPc(PO(OH)2)4, указывает на способность таких систем к генерации синглетного молекулярного кислорода. В то же время высокая интенсивность флуоресценции ZnPc(PO(OH)2)4 в мицеллярных растворах обеспечивает возможность визуального наблюдения распределения мицелл, несущих неагрегированные молекулы красителя, в живых тканях.
ВВЕДЕНИЕ
Фталоцианины и их комплексы с металлами широко используются в качестве красителей, полупроводников в фотовольтаических и термоэлектрических преобразователях, носителей информации в перезаписываемых CD- и DVD-дисках, материалов, обладающих жидкокристаллическими свойствами, супрамолекулярных сенсоров на катионы, анионы и нейтральные молекулы различной природы и т.д. [1–6].
Одной из важных областей применения фталоцианинов в последние десятилетия стала фотодинамическая терапия (ФДТ), где они играют роль генераторов синглетного кислорода под действием света видимого и ближнего ИК-диапазона [6–12 ]. Для применения в ФДТ фталоцианины должны обладать растворимостью в воде, которая может быть достигнута включением в состав их молекул анионных, катионных, неионных или водорастворимых полимерных заместителей. Однако данные спектроскопии поглощения и других методов анализа строения вещества указывают на существование фталоцианинов с сульфо-, карбокси- и фосфорильными заместителями в водных растворах в виде агрегатов, образованных за счет как π–π-стэкинга сопряженных систем электронов соседних тетрапиррольных молекул, так и множественных межмолекулярных водородных связей [6–14 ].
Среди фталоцианинов, модифицированных кислотными фрагментами, наиболее доступны в синтетическом плане и изучены их сульфо- и карбоксипроизводные [3, 4, 6–12 ], а фосфорил-замещенные фталоцианины изучены сравнительно мало [5, 14]. Синтезированные моно- и дизамещенные фталоцианина цинка с фосфорильными группами могут рассматриваться как соединения, перспективные в качестве генераторов синглетного кислорода для ФДТ [5], поскольку наряду с необходимыми для такой генерации физико-химическими свойствами обладают еще и более низкой светостойкостью по сравнению с другими применяемыми в ФДТ фталоцианинами (с сульфо- и карбокси-заместителями при фталоцианиновом цикле). Низкая светостойкость фосфорил-замещенных фталоцианинатов, генерирующих синглетный кислород, позволяет избежать нежелательного разрушения здоровых клеток уже после сеанса химиотерапии накопившимися в тканях молекулами красителя, как это происходит при использовании стойких к свету препаратов для ФДТ.
Для решения проблемы агрегации фталоцианинов в водных средах может быть применен метод их растворения в присутствии мицелл ПАВ. Известно, что этот метод хорошо работает в случае сульфо- и карбоксизамещенных фталоцианинов при pH 7.5 [3, 4, 7–11 ]. Ранее мы его применили для краун-замещенного фталоцианината магния [15, 16] и тетракарбоксилированного фталоцианината цинка [17]. Он оказался эффективным и применительно к фталоцианинату цинка с окси(пентилокси)фосфорильными группами на периферии макроцикла в фосфатном буфере при pH 7.4 в присутствии додецилсульфата натрия, бромидов цетилтриметиламмония и цетилтрифенилфосфония [14].
Данная работа продолжает начатые исследования по дезагрегации производных металлофталоцианинов в водных средах [15–17]. Ее цель – оценить возможность применения бромида тетрадецилтриметиламмония (С14ТАБ) для растворения фосфорил-замещенного фталоцианината цинка – соединения, которое может быть перспективно в ФДТ в силу отмеченной выше его низкой светостойкости. Однако, как и другие фталоцианины с анионными заместителями, он существует в водных растворах преимущественно в виде агрегатов, что препятствует эффективной генерации синглетного молекулярного кислорода.
Нами исследовано влияние С14ТАБ на дезагрегацию 2,(3),9,(10),16,(17),23,(24)-тетра(2-фосфорил)феноксифталоцианината цинка (ZnPc(PO(OH)2)4) в водных растворах при изменении pH в интервале 4–9, поскольку известно, что межклеточная жидкость опухолей может быть как слабощелочной, так и слабокислой в зависимости от химической природы соединений, выделяемых клетками опухоли.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
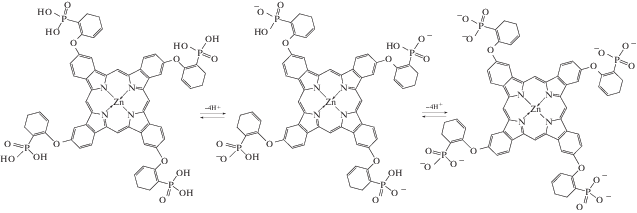
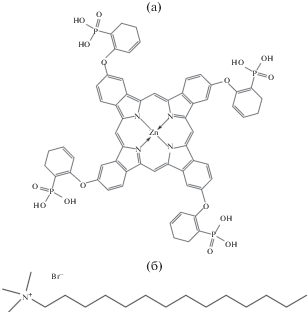
Исследуемый ZnPc(PO(OH)2)4 (рис. 1) синтезирован согласно разработанной ранее методике [18]. С14ТАБ (рис. 1) производства Acros Organics с содержанием основного вещества 99.8% дополнительной очистке не подвергали. Значение его ККМ, определенное методом кондуктометрии, равно 0.0038 М [19]. Концентрацию С14ТАБ (c) варьировали от 4 × 10–4 до 0.08 М в условиях изменения pH среды от 4 до 9.18.
Рис. 1.
Структурные формулы 2,(3),9,(10), 16,(17),23,(24)-тетра(2-фосфорил)феноксифталоцианината цинка (а) и катионного ПАВ – С14ТАБ (б).
Для приготовления буферных растворов с pH 1.68, 4.0, 6.86, 7.0, 9.18 использовали стандарт-титры. Растворы с промежуточными значениями pH готовили, смешивая свежеприготовленный водный раствор NaOH и разбавленную соляную кислоту. Концентрация исходных растворов NaOH и HCl не превышала 10–4 М.
Значения pH среды определяли на приборе Seven Multi (Mettler Toledo), используя комбинированный электрод InLab Expert Pro pH. Калибровку электрода осуществляли по стандартным буферным растворам в диапазоне pH 1.68–9.18.
В отсутствие ПАВ растворы ZnPc(PO(OH)2)4 готовили из его кристаллов в среде с соответствующим значением pH. Концентрацию фосфорилсодержащего фталоцианината цинка (cф) варьировали от 2 × 10–5 до 10–4 M.
Растворы с ПАВ в кислых средах (pH 1.68, 4.0 и 5.7) готовили путем введения сухого порошка С14ТАБ в насыщенные растворы ZnPc(PO(OH)2)4, в которых осадок находился в равновесии с растворенным веществом. При pH 4.0 и 5.7 С14ТАБ вводили до полного растворения кристаллов ZnPc(PO(OH)2)4, что фиксировали визуально. В случае pH 5.7 разбавлением концентрированного (10–4 М) раствора ZnPc(PO(OH)2)4, полученного его растворением при c С14ТАБ, равной 0.027 М, готовили образцы для исследования в домицеллярной области ПАВ. При необходимости в разбавленные растворы дополнительно вводили ПАВ.
Слабокислые (pH 6.5 и 6.86) и щелочные (pH 7–9) растворы ZnPc(PO(OH)2)4, содержащие ПАВ, готовили на основе разбавленных (до cф = = 10–5 M и менее) растворов ZnPc(PO(OH)2)4 путем введения в них С14ТАБ в виде сухого порошка.
Свежеприготовленные растворы фталоцианината цинка без ПАВ и в его присутствии выдерживали в закрытых емкостях в защищенном от света месте в течение нескольких суток (в зависимости от pH), наблюдая за изменением их окраски и определяя степень растворения ZnPc(PO(OH)2)4 путем спектрофотометрического анализа периодически отбираемых проб.
Электронные спектры поглощения (ЭСП) растворов ZnPc(PO(OH)2)4 регистрировали с помощью однолучевого сканирующего спектрофотометра UV-2800 (UNICO, США) по методике, изложенной в [20]. Исследуемые растворы помещали в кварцевые кюветы с длиной светового пути (l) 0.1 или 1 см в зависимости от концентрации ZnPc(PO(OH)2)4 в растворе.
Спектры флуоресценции измеряли на модульном спектрофлуориметре Fluorolog 3 (Horiba Jobin Yvon S.A.S.) с ксеноновой лампой в качестве источника света в прозрачной по четырем граням кварцевой кювете (1 см × 1 см) при длине волны возбуждения 611 нм. При этом ширина щелей каналов возбуждения и регистрации составляла 5 нм. Для регистрации спектров флуоресценции ZnPc(PO(OH)2)4 с низкой интенсивностью (в водных растворах без ПАВ) ширину щелей увеличивали до 9 нм. На представленных ниже рисунках показаны исправленные на спектральную чувствительность ФЭУ (истинные) спектры флуоресценции.
Квантовый выход флуоресценции (φF) в диапазоне 640–850 нм определяли абсолютным методом с использованием интегрирующей сферы Quanta-φ при возбуждении образца светом с длиной волны λвозб = 611 нм, ширина щели в процессе накопления спектра флуоресценции – 2.5 нм. Образец не подвергали процедурам дегазации или продувки инертными газами. Значение оптической плотности в максимуме наиболее интенсивной полосы поглощения исследуемого раствора (Q-полоса ZnPc(PO(OH)2)4) не выходило за рамки рекомендуемого интервала 0.05–0.1, что требуется для нивелирования эффекта самопоглощения. Значение квантового выхода вычисляли с помощью программы FluoroEssenceTM.
Измерения затухания флуоресценции выполнены методом счета единичных фотонов с помощью модуля FluoroHub, управляемого программой DataStation 2.6. Использовался импульсный диод (NanoLED) с λмакс = 370 нм в качестве источника возбуждения и ФЭУ R928 в качестве детектора, ширина щели канала эмиссии составляла 2 нм для всех измерений кривых затухания образцов и определения аппаратной функции. Времена жизни определяли путем моделирования экспериментальных кривых одноэкспоненциальной функцией в программе DAS 6.6. Все измерения проводили при комнатной температуре (25°С).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
1. Процессы растворения и агрегации ZnPc(Po(OH)2)4 в диметилсульфоксиде и воде при изменении pH раствора
Исследуемый фталоцианинат цинка ZnPc(PO-(OH)2)4 растворяется в диметилсульфоксиде (ДМСО) – полярном органическом растворителе. По данным электронных спектров поглощения (1) и флуоресценции (2) (вставка на рис. 2) растворение ZnPc(PO(OH)2)4 в ДМСО происходит с образованием истинного раствора, что, по-видимому, связано с координацией его молекул атомом цинка молекулы ZnPc(PO(OH)2)4, препятствующей формированию кофациальных агрегатов фталоцианината цинка. В ЭСП ZnPc(PO(OH)2)4 в ДМСО (1 на вставке рис. 2) отсутствуют характерные полосы поглощения агрегатов в области полосы Сорэ и в области Q-полос [5, 14] и присутствуют полосы поглощения его индивидуальных молекул.
Рис. 2.
Нормированные спектры поглощения (1) и флуоресценции (2) (на вставке) и кривая затухания флуоресценции ZnPc(PO(OH)2)4 (3) при концентрации cф = 2 × 10–6 М в ДМСО и λвозб = 611 нм.
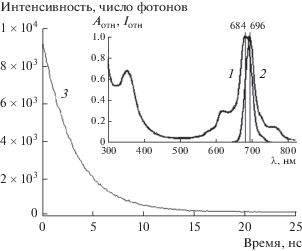
Достаточно интенсивная флуоресценция растворов ZnPc(PO(OH)2)4 в ДМСО также указывает на присутствие в растворе неагрегированных молекул фталоцианината цинка, поскольку агрегаты ZnPc(PO(OH)2)4 не флуоресцируют, как и агрегаты других фталоцианинатов цинка [4, 6, 9–12 ]. Квантовый выход флуоресценции ZnPc(PO(OH)2)4 в ДМСО составляет 7% по данным измерений, проведенным абсолютным методом с использованием интегрирующей сферы. Кривая затухания флуоресценции, полученная методом счета единичных фотонов, характеризуется экспоненциальным спадом, что свидетельствует об однородном микроокружении всех флуоресцирующих центров в растворе (кривая 3 на рис. 2). Время жизни флуоресценции ZnPc(PO(OH)2)4 в растворе ДМСО составляет 3.01 нс по данным моделирования экспериментальных кривых одной экспонентой в программе DataStation 6.6.
В диапазоне концентраций ZnPc(PO(OH)2)4 в ДМСО cф = (0.05–2) × 10–5 М зависимость оптической плотности раствора в максимуме Q-полосы при 684 нм отвечает уравнению Бугера–Ламберта–Бера. При этом коэффициент ε = 1.37 × × 105 М–1 см–1, т.е. почти в два раза больше, чем для ZnPc(COOH)4 (ε = 0.72 × 105 М–1 см–1) [17, 21].
В подкисленной воде (pH 4.0 и 5.7) ZnPc-(PO(OH)2)4 практически не растворяется. После выдерживания таких систем в течение 7 сут были зарегистрированы слабоинтенсивные полосы поглощения агрегатов (с максимумом в области 640 нм) фталоцианината цинка (спектры 6 и 7 на вставке рис. 3). При pH 6.5–7 количество агрегатов по данным ЭСП заметно возрастает (спектры 1–3 на рис. 3). При этом постепенно увеличивается и скорость растворения, о чем свидетельствует наблюдаемое окрашивание водного раствора в зелено-изумрудный цвет уже в первые минуты контакта твердого вещества с раствором при pH ≥ 6.86. Заметим, что в случае фталоцианина цинка с карбоксильными группами (ZnPc(COOH)4) растворение осуществлялось только в щелочной среде (при pH ≥ 7.4), а при pH 6.86 он был практически не растворим [3, 9–11, 17 ].
Рис. 3.
Электронные спектры поглощения ZnPc(PO(OH)2)4 при cф = 10–5 М и pH 6.5 (1), 6.86 (2), 7.0 (3), 7.5 (4), 9.18 (5), а на вставке при pH 4.0 (6) и 5.7 (7). Длина оптического пути l = 1 см.
В диапазоне pH 7–9.18 ZnPc(PO(OH)2)4 существует также преимущественно в виде агрегатов (кривые 3 и 4 на рис. 3), о чем свидетельствует наличие в ЭСП только полосы поглощения с максимумом в области 640 нм при фактически полном отсутствии полосы поглощения неагрегированных молекул ZnPc(PO(OH)2)4. При этом заметного роста концентрации агрегатов ZnPc(PO(OH)2)4 с увеличением pH не наблюдается, о чем свидетельствует фактически неизменная интенсивность полосы поглощения агрегатов ZnPc(PO(OH)2)4 при pH 7 и 7.5 даже после длительного выдерживания твердого фталоцианината цинка в этих растворах. При pH 9.18 наблюдается небольшое снижение интенсивности поглощения (спектр 5 на рис. 3) по сравнению с интенсивностью при pH 7 и 7.5.
Спектры флуоресценции (рис. 4) ZnPc(PO(OH)2)4 в растворах с pH 6.86–9.18 (регистрация при ширине щелей каналов возбуждения и эмиссии 9 нм, что обусловлено низкой интенсивностью флуоресценции) свидетельствуют об очень малом содержании неагрегированных молекул фталоцианината цинка.
Рис. 4.
Спектры флуоресценции ZnPc(PO(OH)2)4 при cф = 10–5 М в воде с pH 6.86 (1), 7.0 (2), 7.5 (3) и 9.18 (4). λв = 611 нм. На вставке – спектр возбуждения флуоресценции при pH 6.86 и λвозб = 725 нм.
Формирование агрегатов может реализовываться как за счет π−π стэкинга ароматических систем электронов соседних молекул фталоцианината цинка, так и за счет образования водородных связей между фосфорильными группами соседних молекул ZnPc(PO(OH)2)4 по аналогии с карбоновыми кислотами [22]. По-видимому, и в твердом состоянии молекулы ZnPc(PO(OH)2) связаны друг с другом множественными водородными связями, что может объяснять медленное растворение данного соединения в кислых водных растворах по сравнению со щелочными.
Ускорение растворения ZnPc(PO(OH)2)4 в слабокислой среде (при pH 6–7), по-видимому, связано с повышением степени диссоциации достаточно сильной тетрафосфоновой кислоты, особенно по сравнению с карбоксильной. В щелочной среде при растворении происходит реакция нейтрализации тетрафосфоновой кислоты ZnPc(PO(OH)2)4 с образованием фосфонатов щелочного металла ${\text{ZnPc}}{{\left( {{\text{РO}}_{{\text{3}}}^{{{\text{2}}--}}} \right)}_{{\text{4}}}}{\text{M}}_{{\text{4}}}^{ + }$ (схема 1 ), чем и объясняется быстрое растворение данного соединения при pH ≥ 7.
Схема 1 . Процессы диссоциации молекул ZnPc(PO(OH)2)4 в растворе.
Однако такие растворы не могут применяться в ФДТ, поскольку агрегаты ZnPc(PO(OH)2)4 в кислой среде и ZnPc(PO(O–)2)4 в щелочной среде не обладают способностью генерировать под действием света синглетный кислород, необходимый для деструкции клеток новообразований.
2. Растворение ZnPc(COOH)4 в присутствии ПАВ
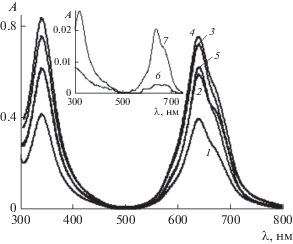
2.1. Растворение ZnPc(COOH)4 в присутствии ПАВ в слабокислой и щелочной средах. В домицеллярных растворах ПАВ при pH 6.5–7 ЭСП ZnPc(PO(OH)2)4 с концентрацией cф = 10–5 М иллюстрируют отсутствие характерных полос поглощения агрегатов с λмах = 640 нм и присутствие полос поглощения его неагрегированных молекул в области 682–684 нм (2 на рис. 5; 2, 3 и 2 ', 3 ' на рис. 6). В случае растворов карбоксифталоцианината цинка ZnPc(COOH)4 с концентрацией 8.2 × 10–6 М (близкой к концентрации растворов ZnPc(PO(OH)2)4) мономерные полосы поглощения красителя в домицеллярной области С14ТАБ регистрировались только при pH ≥ 7.5 [17].
Рис. 5.
Электронные спектры поглощения ZnPc(PO(OH)2)4 при cф = 10–5 М и pH 7 в воде (1) и в растворах С14ТАБ при с = 0.0007 (2), 0.0039 (3) и 0.006 М (4). На вставке зависимость оптической плотности (А) в максимуме Q-полосы ZnPc(PO(OH)2)4 от c С14ТАБ (5). l = 1 см.
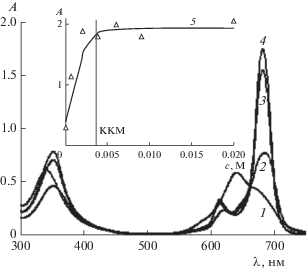
Рис. 6.
Электронные спектры поглощения ZnPc(PO(OH)2)4 при cф = 10–5 М, pH 6.5 (1) и 9.18 (1 ') без ПАВ, а также в растворах С14ТАБ при pH 6.5 и с = 0.0005 (2), 0.0023 (3), 0.0038 М (4) и при pH 9.18 и с = 0.001 (2 '), 0.0015 (3 ') и 0.0034–0.02 М (4 '). l = 1 см. На вставке – зависимости A(с) при pH 6.5 (5) и 9.18 (6).
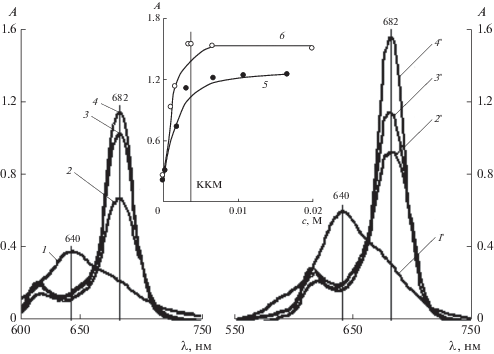
В мицеллярных растворах С14ТАБ на ЭСП наблюдается увеличение оптической плотности A в максимуме Q-полосы ZnPc(PO(OH)2)4 до с ≈ ≈ 0.008–0.012 М, соответствующей двум−трем ККМ, после чего ее рост прекращается (вставки на рис. 5, 6). Скорость повышения A в домицеллярной области с ПАВ при pH 6.86–9.18 примерно одинакова, но выше, чем при pH 6.5. При pH 9.18 (спектр 4 ' на рис. 6) наблюдается снижение оптической плотности, по сравнению со значениями при pH 7 (спектры 3, 4 на рис. 5), что может быть связано с координацией гидрокосид-аниона атомом цинка (схема 1 ).
В соответствии с уравнением cф = A/l ε, в котором l – длина оптического пути (см), ε – коэффициент экстинкции, провели оценку количества неагрегированных молекул ZnPc(PO(OH)2)4 в различных средах. В расчетах при pH 4.0, 5.7 и 6.5 использовали значение ε = 1.37 × 105 М–1 см–1, (вычислено для Q-полосы в ЭСП раствора ZnPc(PO(OH)2)4 в ДМСО), а при pH 6.86, 7.0, 7.5 и 9.18 – значения ε (105 М–1 см–1), равные 1.6, 2, 2 и 1.6 соответственно, вычисленные для той же Q-полосы в ЭСП водных мицеллярных растворов ZnPc(PO(OH)2)4. Расчет коэффициентов поглощения проводили для нескольких растворов в интервале cф = (0.05–2) × 10–5 М при концентрации С14ТАБ 0.01 М, усредненную величину принимали за истинное значение коэффициента поглощения.
Расчет по приведенной выше формуле показывает, что при исходной концентрации ZnPc(PO(OH)2)4 10–5 М доля его неагрегированных молекул в домицеллярных растворах С14ТАБ (c = 0.002 и 0.0006 М (в случае pH 7.5)) при pH 6.5, 6.86, 7.0, 7.5 и 9.18 составляет 48, 60, 85, 76 и 71% соответственно. При концентрации ПАВ с = 0.01 М расчет показывает 100%-ную дезагрегацию ZnPc(PO(OH)2)4 в диапазоне pH 6.5–9.18.
Наблюдаемые изменения в спектрах поглощения ZnPc(PO(OH)2)4 в средах с pH 6.5–9.18 после введения ПАВ, в том числе высокую степень мономеризации красителя в домицеллярных растворах С14ТАБ, можно объяснить следующим образом. В слабокислой (pH 6.5, 6.86), нейтральной (pH 7) и щелочной (pH 7.5 и 9.18) средах, как было показано выше, кристаллы ZnPc(PO(OH)2)4 хорошо растворяются, но в этих средах он существует преимущественно в виде агрегатов за счет π–π-стэкинга ароматических систем электронов соседних молекул фталоцианината цинка и образования различного рода водородных связей. Поверхностно-активные молекулы С14ТАБ с длинной углеводородной цепью, адсорбируясь на поверхности агрегата, разрушают эти связи, понижают поверхностную энергию агрегата и предотвращают агрегацию образующихся мономеров. По сути это – проявление эффекта Ребиндера в процессе дезагрегации ZnPc(PO(OH)2)4 в растворах ПАВ.
С увеличением содержания ПАВ в растворе его адсорбция повышается, пока не наступит равновесие вследствие возникающих и растущих сил отталкивания между адсорбированными катионами. Поэтому при повышении содержания ПАВ в домицеллярном растворе сначала наблюдается интенсивный рост оптической плотности в максимуме Q-полосы, а затем – его замедление при приближении к ККМ.
По достижении ККМ в растворе возникают мицеллы, которые более активны, чем индивидуальные молекулы ПАВ. В их присутствии разрушение агрегатов связано с растворяющей и сорбционной способностью мицелл, т.е. их способностью к солюбилизации тех или иных веществ. Известно [23], что поглощенное мицеллой вещество (в зависимости от строения и свойств молекул обоих компонентов и среды) может локализоваться в разных местах мицеллы, начиная от ее внутренней части (ядра) и до внешнего палисадного слоя. В случае длинноцепочечных катионных ПАВ предпочтительна локализация поглощенного вещества в пограничном слое мицеллы, ближе к ее поверхности. Однако где бы вещество не локализовалось, с точки зрения термодинамики оно становится равноправным компонентом мицеллы [23]. С ростом количества мицелл С14ТАБ увеличивается число поглощенных (солюбилизированных) молекул ZnPc(PO(OH)2)4, вплоть до полного разрушения находящихся в растворе агрегатов, что подтверждается приведенными расчетами для систем, содержащих 10–5 М фталоцианина.
С ростом pH увеличивается степень диссоциации кислотных групп фосфорильных фрагментов ZnPc(Po(OH)2)4, а значит, и число центров для адсорбции как индивидуальных молекул С14ТАБ, так и мицелл. Поэтому количество неагрегированных молекул ZnPc(PO(OH)2)4 (и пропорциональная ему оптическая плотность), повышается, наиболее резко в области pH 6.5–6.86.
Согласно работе [14], тетра(пентил-2-оксифенил)фосфонат фталоцианината цинка диссоциирует при pH > 7.16 с образованием дианионов. По сравнению с ним в молекуле ZnPc(PO(OH)2)4 больше кислотных групп, что, по-видимому, способствует снижению значения pH, при котором возникают многозарядные анионы. Очевидно, что малые изменения оптической плотности в диапазоне pH 6.86–7.5 свидетельствует о том, что после образования всех анионов дальнейшее увеличение pH не влияет на процесс растворения макроциклов.
2.2. Растворение ZnPc(COOH)4 в присутствии ПАВ в кислой среде. В сильнокислой среде (pH 1.68) фталоцианинат цинка ZnPc(PO(OH)2)4 в отсутствие ПАВ практически не растворяется. Его кристаллы лежат на дне сосуда, раствор не имеет окраски, а в ЭСП пробы раствора (см. методику эксперимента) не обнаруживаются характерные полосы поглощения ни индивидуальных молекул фталоцианината цинка, ни его агрегатов.
Добавление С14ТАБ в количестве, выбранном так, чтобы его с = 0.01 М в 6.8 × 10–5 М растворе ZnPc(PO(OH)2)4 (уже содержащем нерастворенную навеску красителя, которая обеспечила бы его концентрацию 6.8 × 10–5 М при условии растворения), приводит к появлению зеленовато-изумрудной окраски. При этом в ЭСП пробы раствора наблюдается слабоинтенсивная полоса поглощения неагрегированных молекул ZnPc(PO(OH)2)4 с максимумом на λмакс = 682 нм (A = 0.07 при l = 1 см). С увеличением содержания ПАВ все большее количество нерастворенного ZnPc(PO(OH)2)4 переходит в водную среду, что подтверждается ростом интенсивности поглощения ZnPc(PO(OH)2)4 в пробе насыщенного раствора. Через 15 суток в растворе с pH 1.68 и c = 0.1 М сохраняются кристаллы фталоцианината цинка, а оптическая плотность раствора достигает значения A = 1.46 при λмакс = 682 нм (l = 1 см). Оценка доли неагрегированных молекул фталоцианината цинка в таком растворе дает величину cф = 1.07 × 10–5 М (при условии, что коэффициенты поглощения ZnPc(PO(OH)2)4 в мицеллярном растворе и в растворе в ДМСО одинаковы), что соответствует 16% от общего содержания ZnPc(PO(OH)2)4 в системе. Заметим, что в слабокислой и слабощелочной средах концентрации ZnPc(PO(OH)2)4 на уровне 10–5 М можно достичь при с С14ТАБ, равной 0.01 М, т.е. в 10 раз меньшей, чем при pH 1.68.
В водных средах без ПАВ при pH 4 и 5.7, как уже было отмечено выше, ZnPc(PO(OH)2)4 растворяется медленно и очень плохо. На его ЭСП – полосы поглощения агрегатов низкой интенсивности (спектры 6 и 7 на вставке рис. 3). При pH 4.0 в насыщенном растворе фталоцианината цинка (cф = 2.6 × 10–5 М) после введения С14ТАБ (с = = 0.01 М) появились неагрегированные молекулы ZnPc(PO(OH)2)4. Об этом свидетельствует полоса поглощения мономера низкой интенсивности (спектр 1 на рис. 7 и его вставке). С увеличением содержания С14ТАБ до с ≈ 0.016 М оптическая плотность полосы ZnPc(PO(OH)2)4 медленно возрастает (кривая 7 на вставке рис. 7). При концентрации ПАВ с ≥ 0.023 М наблюдается более интенсивный рост оптической плотности этой полосы, что может быть связано с появлением [24] в растворах С14ТАБ асимметричных мицелл. Известно [23], что солюбилизационная способность асимметричных мицелл ПАВ выше, чем сферических.
Рис. 7.
Электронные спектры поглощения насыщенных растворов ZnPc(PO(OH)2)4 при pH 4.0 и содержании С14ТАБ с, М: 0.01 (1), 0.016 (2), 0.023 (3), 0.03 (4), 0.04 (5) и 0.077 (6). На вставках – зависимости A(c) и спектр 1. l = 0.1 см.
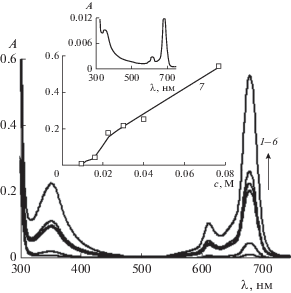
Оценка количества неагрегированных молекул фталоцианината цинка в 0.01 и 0.016 М растворах С14ТАБ при pH 4 (спектры 1 и 2 на рис. 7) показывает, что их содержание не превышает 3 и 12%, соответственно, от исходного значения (2.6 × 10–5 М). При значениях c 0.03, 0.04 и 0.077 М (спектры 4–6 на рис. 7) аналогичная оценка приводит к доле неагрегированных молекул ZnPc(PO(OH)2)4, равной 59, 74 и 100% соответственно. Проведенные расчеты подтверждают визуальное наблюдение полной растворимости ZnPc(PO(OH)2)4 через 7 сут при его концентрации 2.6 × 10–5 М в среде с pH 4 при c ПАВ, равной 0.077 М.
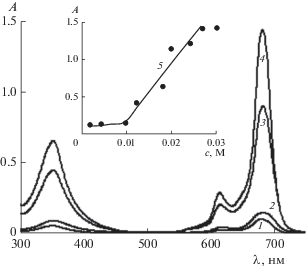
При pH 5.7 в присутствии ПАВ заметный рост A насыщенных растворов ZnPc(PO(OH)2)4 (cф = = 10–4 М) наблюдается при 0.027 М > с ≥ 0.01 М (кривая 5 на вставке рис. 8). При с = 0.027 М кристаллы фталоцианината цинка в растворе визуально не обнаруживаются, и при увеличении содержания ПАВ значение A не изменяется (рис. 8). Заметим, что в случае карбоксизамещенного фталоцианината цинка, ZnPc(COOH)4, его полная дезагрегация (при cф = 3.3 × 10–5 М) в кислой среде (pH 6.0) наблюдалась в растворе С14ТАБ при с = 0.04 М [17]. Расчет показывает, что при с = = 0.013 и 0.018 М концентрация растворенного ZnPc(Po(OH)2)4 равна 3 × 10–5 и 4.7 × 10–5 М соответственно, т.е. составляет 30 и 47% от исходного значения (10–4 М), а при с = 0.027 М достигается уже 100%-ное растворение красителя.
Рис. 8.
Электронные спектры поглощения насыщенных водных растворов ZnPc(PO(OH)2)4 при pH 5.7 и содержании С14ТАБ с, М: 0.002 (1), 0.01 (2), 0.014 (3) и 0.027 (4). На вставке – зависимость A(c). l = 0.1 см.
В присутствии С14ТАБ можно достичь достаточно высокого содержания неагрегированных молекул ZnPc(PO(OH)2)4 в водных кислых растворах: при pH 1.68 их концентрация достигает 10–5 М, при pH 4.0–2.6 × 10–5 М, а при pH 5.7–10–4 М при концентрации С14ТАБ, равной 0.1, 0.077 и 0.027 М соответственно.
Растворение ZnPc(PO(OH)2–)4 в кислых средах с pH 1.68 и 4.0 происходит благодаря присутствию в системе мицелл несферической формы при высоких (0.077–0.1 М) концентрациях С14ТАБ. Адсорбируясь на поверхности агрегатов, они способствуют ослаблению взаимодействий между молекулами фталоцианината цинка, но при этом усиливаются взаимодействия между молекулами ZnPc(PO(OH)2–)4 и мицеллами ПАВ. При низкой степени диссоциации фосфорильных групп ZnPc(PO(OH)2–)4 преобладающими являются гидрофобные взаимодействия между макроциклом и углеводородными цепями мицеллы, которые предполагают локализацию молекул фталоцианината цинка в кислотной форме дальше от водной среды, в глубине мицеллы.
Увеличение растворимости ZnPc(PO(OH)2)4 в присутствии ПАВ с ростом pH раствора обусловлено смещением вправо равновесия процессов диссоциации молекул фталоцианината цинка (схема 1 ) и соответствующим ростом концентрации депротонированного ZnPc(Po(OH)2)4, который растворяется легче, чем его исходная “кислая” форма в кристаллах. Для кислой формы ZnPc(Po(OH)2)4 характерно образование множественных межмолекулярных водородных связей, разрыв которых при растворении сопряжен с большими затратами энергии. Растущие с увеличением pH электростатические взаимодействия между анионами фосфорилсодержащего фталоцианината цинка и катионами ПАВ в мицеллах способствуют локализации молекул ZnPc(PO(OH)2)4 ближе к водной среде.
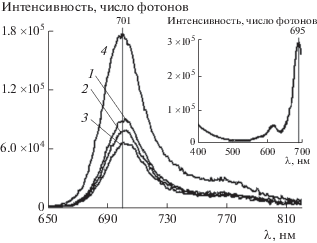
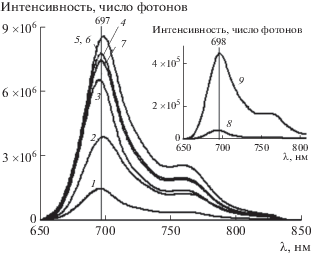
2.3. Характеристики флуоресценции ZnPc(COOH)4 в водных растворах ПАВ при изменении pH среды. Для водных растворов ZnPc(PO(OH)2)4 в присутствии мицелл С14ТАБ при pH 4.0–9.18 регистрируются спектры флуоресценции высокой интенсивности с максимумом в области 697 нм (1–7 на рис. 9), хорошо соответствующие правилу зеркальной симметрии по отношению к ЭСП. Это подтверждает присутствие большого числа неагрегированных молекул ZnPc(PO(OH)2)4 в растворе, так как его агрегаты не флуоресцируют.
Рис. 9.
Спектры флуоресценции ZnPc(PO(OH)2)4 при cф = 5 × 10–6 М и pH 4.0 (1), 5.7 (2), 6.5 (3), 6.86 (4), 7.0 (5), 7.5 (6) и 9.18 (7) в 0.01 М растворе С14ТАБ. На вставке – спектры флуоресценции ZnPc(PO(OH)2)4 в домицеллярных растворах С14ТАБ при рН 5.7 и с = = 0.0004 (8) и 0.002 M (9). λвозб = 611 нм, ширина щели канала регистрации 5 нм (1–7, 9) и 9 нм (8).
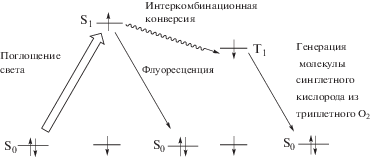
Квантовый выход флуоресценции ZnPc(PO(OH)2)4 в 8 × 10–7 M растворе при концентрации С14ТАБ 0.03 М и значениях pH 4.0, 6.86, 7.5 и 9.18 составляет 25.5, 25.2, 24.0 и 23.4%, т.е. слабо зависит от pH, но оказывается существенно более высоким по сравнению с раствором в ДМСО (7%). Низкий квантовый выход флуоресценции ZnPc(PO(OH)2)4 в ДМСО может объясняться двумя эффектами. Во-первых, – усилением безызлучательной деградации электронно-возбужденных состояний молекул красителя за счет колебаний координированных катионом цинка молекул ДМСО. Во-вторых, – возмущающим влиянием электрического дипольного момента связи S=O координированных и некоординированных молекул ДМСО на электронно-возбужденные состояния молекул ZnPc(PO(OH)2)4 с увеличением вероятности переходов интеркомбинационной конверсии (схема 2 ). Это приводит, в свою очередь, к снижению заселенности уровня S1 и вероятности переходов флуоресценции с увеличением заселенности триплетных уровней молекул фталоцианината цинка [25].
Схема 2 . Электронные переходы поглощения, интеркомбинационной конверсии, флуоресценции и триплет-синглетный переход в основное состояние S0 молекулы ZnPc(PO(OH)2)4 при генерации молекулы синглетного O2 из триплетного O2 в процессе межмолекулярного переноса энергии.
Слабое влияние pH раствора на квантовый выход флуоресценции фталоцианината цинка ZnPc(PO(OH)2)4 хорошо согласуется с аналогичными данными для окта-карбоксифталоцианината цинка, для которого значения φF составляют 0.20 при pH 2.18, 0.19 при pH 5, 0.18 при pH 10 [26]. Квантовый выход флуоресценции ZnPc(PO(OH)2)4 в мицеллярных растворах на уровне φF = 23–25% с одной стороны позволяет визуализировать распределение фталоцианината цинка в живых тканях по характерному красному свечению. С другой стороны обеспечивается высокая вероятность перехода молекул красителя в возбужденные триплетные состояния, поскольку согласно уравнению φF + φT = 1 по теории [27] (φT – квантовый выход интеркомбинационной конверсии) до 75–77% поглощенной молекулой ZnPc(PO(OH)2)4 световой энергии может расходоваться на заселение ее триплетных уровней через процесс интеркомбинационной конверсии. А это, в свою очередь, может способствовать эффективной генерации молекул триплетного кислорода (схема 2 ) – основного агрессивного агента по отношению к “плохим” клеткам, генерируемого в процессе ФДТ [7]. Кроме того, бромид-ионы, входящие в состав С14ТАБ, могут создавать внешний эффект тяжелого атома [28, 29]. Он способствует увеличению вероятности запрещенных по спину синглет-триплетных и триплет-синглетных переходов в молекуле ZnPc(PO(OH)2)4, а также вероятности межмолекулярного переноса энергии с триплетного уровня молекулы ZnPc(PO(OH)2)4 на синглетный уровень молекулы O2. При высоких концентрациях С14ТАБ в растворе бромид-ионы могут координироваться атомами цинка молекул ZnPc(PO(OH)2)4, за счет чего может “включаться” и эффект внутреннего тяжелого атома [29, 30], также способствующий увеличению вероятности запрещенных по спину электронных переходов.
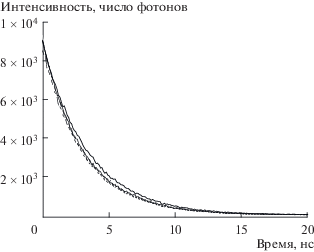
Малое время жизни флуоресценции (3.01 нс) фталоцианината цинка в ДМСО также указывает на высокую полярность микроокружения его молекул в данном растворителе. Одноэкспоненциальный спад интенсивности флуоресценции ZnPc(PO(OH)2)4 в ДМСО свидетельствует о наличии одинакового микроокружения у всего множества центров флуоресценции в таком растворе. Мицеллярные (с = 0.03 М) растворы ZnPc(PO(OH)2)4 при cф = 8 × 10–7 M и варьировании pH среды от 4.0 до 9.18 также характеризуются одноэкспоненциальным характером кривой затухания флуоресценции (рис. 10). Однако время жизни флуоресценции красителя в этих растворах несколько возрастает и составляет 3.38 нс при pH 4, 3.09 при pH 6.86, 3.11 при pH 7.5 и 3.13 при pH 9.18. Большее время жизни флуоресценции ZnPc(PO(OH)2)4 в водных мицеллярных растворах по сравнению с раствором в ДМСО, вероятно, обусловлено уменьшением полярности микроокружения молекул фталоцианината цинка в мицеллах по сравнению с раствором в ДМСО [25]. Большее значение времени жизни флуоресценции раствора при pH 4.0 по сравнению с растворами с pH 6.86, 7.5 и 9.18 может указывать на более глубокое проникновение молекулы ZnPc(PO(OH)2)4 в ядро мицеллы в кислой среде.
ЗАКЛЮЧЕНИЕ
На основании полученных результатов можно сделать вывод о том, что в водных мицеллярных растворах катионного ПАВ – бромида тетрадецилтриметиламмония – можно достичь эффекта полного распада агрегатов ZnPc(PO(OH)2)4 на отдельные молекулы в широком диапазоне значений pH – от 4 до 9.18. Это, в свою очередь, открывает возможность применения получаемых мицеллярных растворов в ФДТ, поскольку именно неагрегированные молекулы фталоцианинатов цинка эффективно генерируют синглетный молекулярный кислород, убивающий клетки опухоли [3–14 ].
Список литературы
Цивадзе А.Ю. // Успехи химии. 2004. Т. 73. С. 6.
Erk P., Hengelsberg H. Phthalocyanine Dyes and Pigments // In: The Porphyrin Handbook / Ed. by Kadish K.M., Smith K.M., Guilard R. N.Y.: Academic Press, 2003. V. 19. P. 105.
Kaliya O.L., Lukyanets E.A., Vorozhtsov G.N. // J. Porphyr. Phthalocyanines. 1999. P. 592.
Nackiewicz J., Kliber M. // ARKIVOC. 2015. P. 269.
Komissarov A.N., Makarov D.A., Yuzhakova, O.A., Savvina L.P., Kuznetsova N.A., Kaliya O.L., Lukyanets E.A., Negrimovsky V.M. // Macroheterocycles. 2012. V. 5. P. 169.
Bıyıklıoglu Z., Çakır V., Çakır D., Kantekin H. // J. Organomet. Chem. 2014. V. 749. P. 18.
Лукьянец. Е.А. // Фотодинамическая терапия и фотодиагностика. 2013. Т. 2. № 3. С. 3.
Якубовская Р.И., Плютинская А.Д., Лукьянец Е.А. // Рос. биотерапевтич. журн. 2014. Т. 13. С. 65.
Jadhao M., Mukherjee S., Joshi R., Kumar H., Ghosh S.K. // RSC Adv. 2016. V. 6. P. 77161.
Zhou L., Chen E., Jin W., Wang Yu., Zhou J., Wei Sh. // RSC Adv. 2016. V. 45. P. 15170.
Xi-you Li, Xu He, Anthony C.H.Ng, Chi Wu, Dennis K.P.Ng. // Macromolecules. 2000. V. 33. P. 2119.
Дементьева О.В., Виноградова М.М., Лукьянец Е.А., Соловьева Л.И., Огарев В.А., Рудой В.М. // Коллоид. журн. 2014. Т. 76. С. 587.
Калашникова И.П., Баулин В.Е. // Biomedical Chemistry: Research and Methods. 2018. Т. 1. № 3. e00024. https://doi.org/10.18097/bmcrm00024
Goldshleger N.F., Gak V.Yu., Lapshina M.A., Baulin V.E., Shiryaev A.A., Tsivadze A.Yu. // Russ. Chem. Bull., Int. Ed. 2018. V. 67. P. 2205.
Мовчан Т.Г., Аверин А.А., Баулин Д.В., Плотникова Е.В., Баулин В.Е., Цивадзе А.Ю. // Коллоид. журн. 2018. Т. 80. С. 528.
Мовчан Т.Г., Чернядьев А.Ю., Аверин А.А., Плотникова Е.В., Баулин В.Е., Цивадзе А.Ю. // Коллоид. журн. 2018. Т. 80. С. 694.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2019. Т. 81. С. 750.
Kalashnikova I. P., Baulin V. E., Baulin D.V., Tsivadze A.Yu. // Russ. J. Gen. Chem. 2018. V. 88. P. 1853.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2016. Т. 78. С. 750.
Мовчан Т.Г., Плотникова Е.В., Усьяров О.Г. // Коллоид. журн. 2013. Т. 75. С. 351.
Лебедева Н.Ш., Попова Т.Е., Малькова Е.А., Губарев Е.А. // Журн. физ. химии. 2013. Т. 17. С. 2070.
Березин Б.Д., Березин Д.Б. Курс современной органической химии. М.: Высшая школа, 1999.
Русанов А.И. Мицеллообразование в растворах поверхностно-активных веществ. СПб.: Химия, 1992.
González-Pérez A., Czapkiewicz J., Prieto G., Rodriguez J.R. // Colloid Polym. Sci. 2003. V. 281. P. 1191.
Лакович Дж. Основы флуоресцентной спектроскопии. М.: Мир, 1986.
Калия О.Л., Кузнецова Н.А., Булгаков Р.А, Соловьева Л.И., Шевченко Е.Н., Сливка Л.К., Лукьянец Е.А. // Макрогетероциклы. 2016. V. 9. P. 186.
Ermolaev V.L., Sveshnikova E.B. // Acta Phys. Pol. 1968. V. 34. P. 71.
Мак-Глинн С., Адзуми Т., Киносита М. Молекулярная спектроскопия триплетного состояния. М.: Мир, 1972.
Соловьев К.Н., Борисевич Е.А. // Успехи физ. наук. 2005. Т. 175. С. 247.
Ермолаев В.Л., Бодунов Е.Н., Свешникова Е.Б., Шахвердов Т.А. Безызлучательный перенос энергии электронного возбуждения. Л.: Наука, 1977.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал