Коллоидный журнал, 2020, T. 82, № 1, стр. 37-46
Метод одностадийного синтеза субмикронных золотых частиц
Е. В. Панфилова 1, *, А. М. Буров 1, Б. Н. Хлебцов 1
1 Институт биохимии и физиологии растений и микроорганизмов РАН
410049 Саратов,
просп. Энтузиастов, 13, Россия
* E-mail: Panfilova_e@ibppm.ru
Поступила в редакцию 17.07.2019
После доработки 30.08.2019
Принята к публикации 03.09.2019
Аннотация
Золотые нано- и субмикронные частицы представляют большой интерес для применения в оптике, биофотонике и аналитической химии. Несмотря на огромный прогресс в разработке методов химического жидкофазного синтеза таких коллоидов, надежных протоколов для получения монодисперсных частиц с размерами более 300 нм предложено не было. В данной работе разработан одностадийный жидкофазный метод синтеза субмикронных золотых частиц, который заключается в восстановлении ионов золота дофамином в присутствии стабилизатора поливинилпирролидона. Обнаружено, что изменение концентрации поливинилпирролидона в реакционной смеси позволяет варьировать размер целевых частиц в диапазоне 120–500 нм. Показано, что коллоиды с наиболее узким распределением сферических частиц по размеру получаются при концентрации поливинилпирролидона в диапазоне от 0.01 до 1 мг/мл. Синтезированные субмикронные частицы могут быть использованы в качестве меток для спектроскопии гигантского комбинационного рассеяния, а также конфокальной лазерной микроскопии.
1. ВВЕДЕНИЕ
В настоящее время золотые наночастицы широко используются в различных отраслях медицины и биологии: в геномике, биосенсорике, иммуноанализе, детектировании и фототермолизе микроорганизмов и раковых клеток, направленной доставке лекарств, молекул белков, ДНК и антигенов, и т.д. [1, 2].
Для получения коллоидов золота используют различные методы, которые условно можно разделить на две группы. К первой группе относятся методы, основанные на диспергировании массивного образца металла с помощью электродугового разряда или высокомощного импульсного лазерного излучения (лазерная абляция [3]). При всех своих достоинствах, данные подходы весьма ограничены с точки зрения управления размерами и формой получаемых частиц. Гораздо большее распространение получили методы восстановления ионов золота с конденсацией в жидкой фазе. Пара Au3+/Au имеет один из самых высоких окислительно-восстановительных потенциалов, около +1.5 В, т.е. золотосодержащие ионы являются очень мощным окислителем. Это приводит к тому, что для восстановления ионов золота может быть использован широчайший круг соединений – от часто применяемых гидроксиламина [4, 5], борогидрида натрия [6], аскорбиновой кислоты [7], цитрата натрия [8, 9], гидрохинона [10, 11], пероксида водорода [12] до сложных субстанций, например вытяжки чайного листа [13]. Детальный обзор методик синтеза коллоидного золота с использованием различных восстановителей сделан в недавней работе [14]. Следует отметить, что использование комплексных многостадийных методов синтеза с добавлением поверхностно-активных веществ, стабилизаторов и полимеров позволяет получать не только квазисферические частицы, но и наностержни, нанооболочки, нанозвезды, наноклетки, нанокубы, треугольные призмы и частицы многих других форм [15, 16].
Поливинилпирролидон (ПВП) является одним из наиболее часто используемых стабилизаторов при синтезе металлических наночастиц в водной фазе [17]. Взаимодействие ПВП–Au является донорно-акцепторным. Повторяющееся звено полимера предоставляет электронную пару атома азота или кислорода карбонильной группы, а атомы золота – свободную орбиталь [18]. В зависимости от условий реакции ПВП может служить поверхностным стабилизатором, модификатором роста и диспергирующим агентом для наночастиц [19].
Гидрохлорид дофамина впервые был предложен в качестве восстановителя золотохлористовородной кислоты (ЗХВК) до металлического золота в 2004 г. [20]. Простым добавлением при комнатной температуре в присутствии Тритона Х к раствору ЗХВК раствора гидрохлорида дофамина были получены золотые наночастицы размером 0.5–3 нм. В работе [21] помимо ЗХВК и дофамина в реакционную смесь вводили хлорид цетилтриметиламмония, а в качестве реакционной среды использовали не воду, а 10 мМ фосфатный буфер. В результате были синтезированы как мелкие (порядка 5 нм), так и более крупные (около 25 нм) наночастицы. В дальнейшем [22] восстановлением ЗХВК дофамином были получены достаточно крупные (200 нм) наночастицы разветвленной морфологии. Было показано, что они покрыты тонким слоем полимеризованного дофамина. Таким образом, дофамин может служить восстановителем при синтезе золотых наночастиц при комнатной температуре.
Несмотря на многообразие существующих видов коллоидов золота, практически все исследования были сфокусированы на получении частиц с размерами в диапазоне от 3 до 150 нм. Это объясняется тем, что именно для этого диапазона размеров наблюдается эффект резонансного колебания свободных электронов в металле под действием света видимого и инфракрасного спектра, называемый плазмонным резонансом [23]. С другой стороны, для некоторых приложений может быть существенным наибольшее поглощение и рассеяние света на единичной частице. Следует отметить, что только частицы размером более 300 нм могут визуализироваться с использованием простой оптической микроскопии светлого поля. С этой точки зрения смещение диапазона размеров получаемых золотых частиц в субмикронную область представляет несомненный интерес.
В данной работе мы предлагаем новый одностадийный метод синтеза гидрозолей золота с узким распределением субмикронных частиц по размеру путем восстановления ЗХВК дофамином в присутствии ПВП. Обсуждаются механизмы формирования субмикронных частиц и способы управления их размером.
2. МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали следующие реагенты: тригидрат золотохлористоводородной кислоты 99.99% (Alfa Aesar), дофамина гидрохлорид (Sigma-Aldrich), ПВП с молекулярной массой 55 000 Да (Sigma-Aldrich,), нитротиофенол (Sigma-Aldrich). Для приготовления буфера использовали трис(гидроксиметил)аминометан (Merck), соляную кислоту (“х. ч.”, “Радиан”).
Растворителем служила вода, дистиллированная и деионизированная на установке Milli-Q (удельное сопротивление 18 МОм/см). Для отмывки предметных и покровных стекол использовался состав “пиранья”: смесь концентрированного пероксида водорода (37%, Химмед) и концентрированной серной кислоты (“ос. ч.” “11-5”, Сигма Тек) в соотношении 3 : 1.
Взвешивание реактивов проводили с помощью аналитических весов (Acculab, точность 0.1 мг). Растворы дозировали с помощью автоматических пипеток Eppendorf максимального объема 0.2, 1 и 5 мл с одноразовыми пластиковыми наконечниками производства Biohit. При синтезе гидрозолей золота использовали магнитную мешалку MR-Hei-Standart (Heidolph, 1400 об./мин, нагрев до 300°С) с покрытыми тефлоном якорями длиной 0.5 и 1 см и автоматическим термоконтроллером EK-Hei-Con (Heidolph, точность 0.5°C). Для осаждения частиц из коллоидных растворов использовали центрифугу Eppendorf Centrifuge 5810 R, одноразовые центрифужные пробирки (50 мл, Юнимед-С) и пробирки Eppendorf объемом 1.5 и 2 мл. Ресуспендировали частицы с помощью ультразвуковой ванны УЗУМИ (Россия).
Спектры оптической плотности образцов измеряли в 2-мм кварцевых кюветах с помощью спектрофотометра Specord 250 (Analytik Jena) в диапазоне длин волн 400–900 нм. Размер и форму частиц анализировали в просвечивающем электронном микроскопе (ПЭМ) Libra 120 (Carl Zeiss). Для получения микрофотографий с увеличением 10 000–40 000 раз, образец коллоида наносили на медные сеточки для электронной микроскопии (300 ячеек/мм, Carl Zeiss), покрытые пленкой формвара.
Спектры гигантского комбинационного рассеяния (ГКР) Измеряли с помощью спектрометра Peak Seeker Pro 785 (Ocean Optics) в 1-см кварцевой кювете с использованием излучения длиной волны 785 нм и мощностью 30 мВт; время интеграции составляло 30 с, все спектры усреднялись по результатам 10 независимых измерений.
Эксперимент по конфокальной лазерной микроскопии проводили на микроскопе Leica SP5 (Leica, Германия). Частицы синтезированного гидрозоля золота осадили и ресуспендировали в горячем 1%-ном растворе агарозы. После этого 10 мкл коллоида нанесли на предметное стекло, предварительно отмытое смесью “пиранья”.
Синтез сферических частиц
Для синтеза субмикронных золотых частиц мы использовали следующую методику. Приготовили буфер Трис-HCl с концентрацией 10 мМ и pH 8.5. Выбор в качестве реакционной среды именно буфера Трис-HCl объясняется тем, что в этом буфере ЗХВК легко восстанавливается дофамином с образованием наночастиц золота [24], кроме того, основным его компонентом является трис(гидроксиметил)аминометан. Нельзя исключить, что он (как и другие амины) способен координировать ионы металла, что может способствовать гомогенной нуклеации частиц. Далее приготовили серию растворов ПВП в с концентрацией полимера 1 (проба 1), 0.1 (проба 2), 0.05 (проба 3), 0.01 (проба 4) и 0.001 мг/мл (проба 5). Флаконы с растворами поставили на магнитную мешалку (скорость перемешивания 500 об./мин). К 7.2 мл раствора ПВП каждой концентрации добавили 3.6 мл раствора гидрохлорида дофамина в воде с концентрацией 4 мг/мл. Через 3 мин после добавления раствора гидрохлорида дофамина в каждый флакон добавили по 7.2 мл раствора ЗХВК с концентрацией 0.1 мас. % и оставили перемешиваться в течение 3 ч при комнатной температуре. По окончании синтеза частицы осадили центрифугированием в течение 10 мин со скоростью 1000 об./мин для пробы 1, 2000 об./мин для пробы 2 и 3000 об./мин для проб 3, 4 и 5. Процедуру осаждения/ресуспендирования провели дважды. Окончательно частицы ресуспендировали в воде и измеряли их спектры поглощения. Распределения по размерам вычисляли по результатам анализа ПЭМ-изображения 200 частиц.
Синтез несферических частиц
Золотые несферические частицы были получены при двукратном и четырехкратном уменьшении (относительно протокола синтеза сферических частиц) количества добавляемого дофамина при фиксированном количестве ЗХВК, а также при двукратном и четырехкратном уменьшении количества добавляемой ЗХВК при фиксированном количестве дофамина. Таким образом, в реакционную смесь вводили 3.6 мл раствора дофамина (4 мг/мл) и 3.6 мл 0.1%-ной ЗХВК, 3.6 мл раствора дофамина и 1.8 мл 0.1%-ной ЗХВК (б), 1.8 мл раствора дофамина и 7.2 мл 0.1%-ной ЗХВК (в), 0.9 мл раствора дофамина и 7.2 мл 0.1%-ной ЗХВК (г) соответственно. Концентрация ПВП во всех экспериментах была фиксирована и составляла 0.1 мг/мл.
Покрытие частиц золота оболочкой из полидофамина
Суспензию (2 мл) золотых частиц размером 120 нм отцентрифугировали и частицы ресуспендировали в 4 мл 10 мМ Трис-буфера (pH 8.5). Добавили к реакционной смеси 100 мкл водного раствора дофамина с концентрацией 5 мг/мл. Оболочка полидофамина образуется уже через час, однако во избежание слипания частиц в ходе центрифугирования, суспензию перемешивали еще 48 ч.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1. Синтез субмикронных золотых частиц
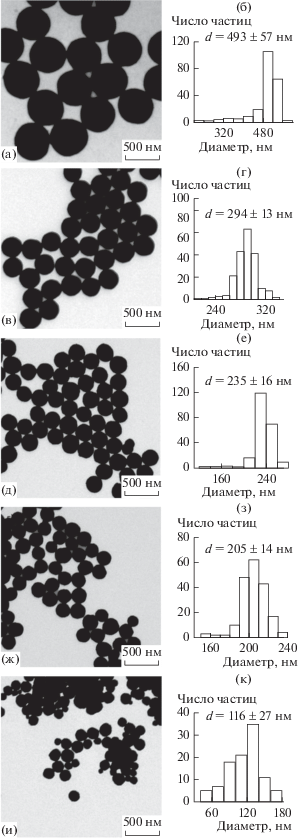
Для получения частиц различной морфологии и размеров, мы варьировали количество добавляемых в реакционную смесь ЗХВК и дофамина, а также концентрацию ПВП. Формирование сферических субмикронных частиц происходит при добавлении к раствору ПВП заданной концентрации 3.6 мл дофамина с концентрацией 4 мг/мл и 7.2 мл 0.1%-нoго раствора ЗХВК. Уменьшение количества добавляемой ЗХВК при неизменных прочих условиях приводит к образованию разветвленных шероховатых (рис. 1а) и просто шероховатых частиц (рис. 1б). При снижении количества добавляемого дофамина образуются шероховатые частицы (рис. 1в), а при дальнейшем снижении – квазисферические частиц с несколькими гранями (рис. 1г), размер которых не превышает 200 нм. Следует отметить, что такая “огранка”, характерная для частиц большого размера, частично наблюдается и на ПЭМ-изображениях образцов сферических частиц (рис. 2д, 2ж), однако в гораздо меньшей степени.
Рис. 1.
ПЭМ-изображения золотых частиц, полученных при добавлении в реакционную смесь, содержащую 0.1 мг/мл ПВП, разных количеств других реагентов. (а) 3.6 мл раствора дофамина (4 мг/мл) и 3.6 мл 0.1%-ной ЗХВК, (б) 3.6 мл раствора дофамина и 1.8 мл 0.1%-ной ЗХВК, (в) 1.8 мл раствора дофамина и 7.2 мл 0.1%-ной ЗХВК, (г) 0.9 мл раствора дофамина и 7.2 мл 0.1%-ной ЗХВК. На вставке (г) представлено ПЭМ-изображение частиц с ярко выраженными гранями, полученное при большем увеличении.

Рис. 2.
ПЭМ-изображения золотых субмикронных сфер, полученных при концентрации ПВП 1 (а), 0.1 (в), 0.05 (д), 0.01 (ж) и 0.001 мг/мл (и), и соответствующие им гистограммы распределения частиц по размерам (б, г, е, з, к).
Формирование полидисперсного коллоида несферических шероховатых частиц может быть связано с тем, что в слабощелочных условиях в реакционной смеси, содержащей дофамин и ЗХВК, одновременно идут процессы полимеризации дофамина и восстановления ЗХВК до металлического золота. Авторы [25] предполагают, что формирование разветвленных структур при смешении ЗХВК и дофамина в слабощелочной среде может быть связано с окислительным травлением полидофамина. Катехольные группы полимера окисляются до хинонных, водородные связи разрушаются, и происходит частичное разрушение полимера с одновременным восстановлением ЗХВК дофамином на поверхности полимерного зародыша. Эти процессы обуславливают анизотропный рост золотых наночастиц и формирование, в конечном итоге, разветвленных наноструктур.
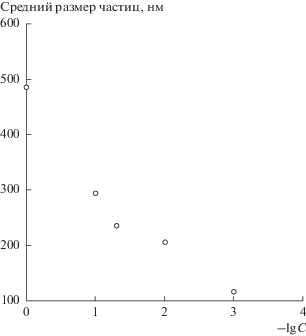
Далее мы провели серию опытов, зафиксировав количества добавляемых дофамина (3.6 мл, 4 мг/мл) и ЗХВК (7.2 мл 0.1%-ного раствора), обеспечивающие формирование сферических частиц, для выяснения влияния концентрации ПВП на размер и морфологию частиц. Концентрацию ПВП варьировали от 1.0 до 0.001 мг/мл. В результате, в интервале концентраций ПВП от 1.0 до 0.01 мг/мл были получены золотые частицы сферической формы диаметром 493 ± 57, 294 ± 13, 235 ± 16 и 205 ± 14 нм (их ПЭМ-изображения представлены на рис. 2а, 2в, 2д, 2ж соответственно) с узким распределением по размеру. Нами были обсчитаны выборки по 200 частиц каждого размера и по полученным данным построены соответствующие гистограммы распределения по размерам (рис. 2б, 2г, 2е, 2з). Видно, что образцы частиц имеют достаточно узкие распределения по размерам, что является признаком высокого качества образцов. Понижение концентрации ПВП до 0.001 мг/мл приводит к формированию полидисперсного коллоида со средним размером частиц около 120 нм (рис. 2и). Из рис. 2 следует, что при уменьшении концентрации ПВП размер частиц золота уменьшается. Кроме того, видны ограничения метода по концентрации ПВП: при минимальной из выбранных концентраций (0.001 мг/мл) образуются сильно полидисперсные частицы (рис. 2и).
В табл. 1 приведены данные о влиянии концентрации ПВП на размер частиц. На основании полученных данных была построена зависимость размера субмикронных частиц от концентрации ПВП в реакционной смеси (рис. 3). Видно, что зависимость среднего размера частиц от отрицательного логарифма концентрации полимера представляет собой экспоненциальную функцию.
Таблица 1.
Размер частиц, полученных при различной концентрации ПВП в реакционной смеси
| Размер частиц, нм | 493 ± 57 | 294 ± 13 | 235 ± 16 | 205 ± 14 | 116 ± 27 |
| Концентрация ПВП, мг/мл | 1 | 0.1 | 0.05 | 0.01 | 0.001 |
Рис. 3.
Зависимость среднего размера сферических частиц от отрицательного логарифма концентрации ПВП.
Обсудим роль ПВП в реакции. По данным [17, 26–28] ПВП сам способен восстанавливать ионы благородных металлов, в том числе золота [17], с образованием наночастиц. В указанных исследованиях, как правило, приводятся данные, касающиеся ПВП с молекулярной массой 10 000 Да и меньше, также процесс, в основном, ведут при нагревании [28, 17 ]. Для выяснения, является в нашем случае восстановителем ПВП или дофамин, мы провели опыт по описанному выше протоколу, но без добавления дофамина. Сразу после добавления ЗХВК реакционная смесь приобрела желтый цвет, который не изменялся в течение суток. Ни седиментации, ни осаждения частиц при центрифугировании не наблюдалось. Мы считаем, что это свидетельствует о том, что при заданных условиях (концентрации, комнатной температуре) ПВП с молекулярной массой 55 000 Да не проявляет восстановительных свойств относительно ЗХВК.
Что касается способности полидофамина образовывать оболочку на поверхности, покрытой ПВП, в литературе имеются противоречивые данные. Так исследователи [29] успешно вырастили оболочку полидофамина на нанокристаллах целлюлозы, покрытых ПВП, а в работе [30] сообщается, что ПВП препятствует формированию полидофамина.
Мы предполагаем, что формирование сферических золотых частиц происходит следующим образом. Первоначально образуются Au-зародыши нуклеации, к которым присоединяются молекулы ПВП за счет координационной связи между карбонильной группой полимера и атомом металла, образуя своеобразную “щетину” из молекул ПВП вокруг зародыша и обеспечивая дальнейший равномерный рост зародышей по мере восстановления ионов ${\text{AuCl}}_{{\text{4}}}^{--}$ на их поверхности. Кроме того, вполне вероятно взаимодействие между ПВП и молекулами дофамина посредством водородных связей с образованием промежуточного комплекса, состав которого будет в той или иной степени изменяться при изменении соотношения ПВП/дофамин. Это может повлиять на все протекающие в системе процессы, а значит, и на размер конечных частиц.
Таким образом, мы предполагаем, что на поверхности частиц золота находится оболочка ПВП, однако не исключаем, что эта оболочка, в свою очередь, покрыта оболочкой из полидофамина. С целью выяснить, препятствует ли наличие оболочки ПВП на частицах формированию поверх нее оболочки полидофамина, мы воспользовались протоколом [25] и покрыли синтезированные частицы слоем полидофамина толщиной около 30 нм (рис. 4). Следует отметить, что частицы, покрытые полидофамином, склонны к агрегации по причине высоких адгезионных свойств полидофамина.
3.2 Оптические свойства субмикронных золотых частиц
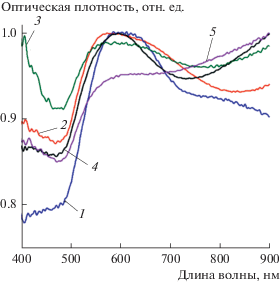
Для всех полученных коллоидов не наблюдается четко выраженного плазмонного резонанса (что обусловлено большим размером частиц). Измеренные спектры экстинкции (рис. 5) представляют собой кривую с достаточно широким максимумом в области 550–650 нм в зависимости от размера частиц. Крупные частицы (размером более 200 нм) имеют достаточно сложные спектры и практически одинаково ослабляют свет во всем видимом диапазоне. Это приводит к тому, что цвет всех коллоидов субмикронных золотых частиц – серый или серо-голубой (в отличие от ярко-красного цвета, характерного для коллоидов золотых наночастиц). Очевидно, для исследуемого диапазона размеров экстинкция в основном определяется рассеянием, а не поглощением света. Принимая во внимание слабую спектральную зависимость экстинкции, можно предположить, что субмикронные частицы могут служить эффективными метками для оптических технологий, использующих рассеяние света.
Для оценки возможности использования синтезированных частиц в качестве меток в спектроскопии гигантского комбинационного рассеяния мы сравнили интенсивность сигнала ГКР при использовании полученных золотых субмикронных частиц (на примере сфер диметром 300 нм), золотых наносфер диаметром 30 нм и золотых наностержней. Для этого мы инкубировали 2 мл каждого коллоида с 50 мкл 2 мМ спиртового раствора нитротиофенола в течение 1 ч. После этого частицы были осаждены центрифугированием и ресуспедированы в 2 мл воды. Максимальная оптическая плотность каждого из коллоидов была равна 1 при измерении в кювете с оптическим путем 1 см. Спектры комбинационного рассеяния нитротиофенола, усиленного поверхностью различных частиц, показаны на рис. 6б. Видно, что наибольший сигнал ГКР регистрируется при использовании золотых наностержней (рис. 6б). Для характерной колебательной линии нитрогруппы 1343 см–1, интенсивность составила 4450 отсчетов. При тех же условиях измерения интенсивность этой линии в случае субмикронных частиц составила около 1000 отсчетов, в то время как для малых золотых наносфер сигнал практически отсутствовал. Это объясняется тем, что для золотых наностержней длина волны плазмонного резонанса совпадает с длиной волны возбуждающего лазерного излучения, а для сферических наночастиц плазмонный резонанс и лазерное возбуждение декоррелированы.
Рис. 6.
(а) Увеличенное ПЭМ-изображение золотой субмикронной частицы, видна оболочка полидофамина. (б) Спектры комбинационного рассеяния нитротиофенола, адсорбированного на золотых наностержнях (1), золотых субмикронных частицах диаметром 300 нм (2), золотых наносферах диаметром 30 нм (3).
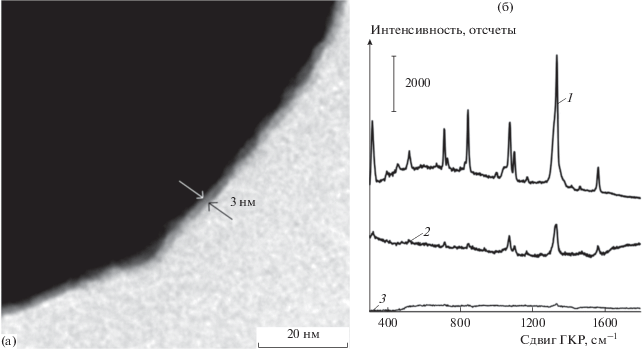
Следует отметить, что золотые нано- и субмикронные частицы достаточно легко хемосорбируют на своей поверхности нитротиофенол за счет реакции золота с тиогруппой. Возможно, наличие оболочки полидофамина толщиной порядка 3 нм на сферических частицах (рис. 6а), также способствует адсорбции на их поверхности молекул нитротиофенола благодаря наличию в структуре полимера катехольных групп [31, 32].
Мы предположили, что благодаря своему крупному размеру и, следовательно, большому сечению рассеяния, полученные частицы обладают потенциалом для использования в качестве меток в конфокальной микроскопии. Конфокальная микроскопия позволяет неинвазивно получать изображения, близкие по разрешению к гистологическим срезам, но не в вертикальной плоскости, а в горизонтальной, послойно, благодаря фокусировке изображения на разной глубине образца. Нами были взяты для сравнения образец золотых сфер диаметром примерно 500 нм и образец сферических частиц диоксида кремния того же диаметра (рис. 7). Важно отметить, что при одинаковых размерах сечение рассеяния золотых частиц было на несколько порядков больше. Частицы были инкорпорированы в слой агарозного геля и визуализировались с помощью конфокального микроскопа при облучении лазером (длина волны излучения λ = 543 и 633 нм).
Рис. 7.
Полученные в конфокальном микроскопе изображения образцов золотых субмикронных частиц (диаметр около 500 нм) (а) и частиц диоксида кремния такого же диаметра (б). Длина волны возбуждения – 543 нм, эмиссия в диапазоне 590–600 нм.

На изображении, полученном в конфокальном микроскопе (рис. 7а), хорошо видны яркие точки, соответствующие субмикронным частицам золота, также видны агрегаты частиц, яркость которых визуально не превышает яркости отдельных частиц. Люминесценция в области длин волн 590–600 нм наблюдается при облучении лазером с λ = 543 нм, а также в области 689–750 нм при облучении лазером с λ = 633 нм. Частицы диоксида кремния (рис. 7б), несмотря сопоставимый размер, не обладают такой яркостью свечения при облучении лазером с длиной волны как 543 нм, так и 633 нм. Вопрос о природе наблюдаемого для золотых субмикронных частиц свечения является дискуссионным. С одной стороны, флуоресценция золота известна достаточно давно [33]. Однако квантовый выход флуоресценции объемного образца не превышает 10–10. Даже наблюдавшееся ранее увеличение квантового выхода в миллион раз для золотых наностержней [34] не позволяло визуализировать их с помощью обычного конфокального микроскопа. Возможно, в нашем случае сочетание относительно больших геометрических размеров субмикронных частиц и специфических мультипольных плазмонных мод позволяют обеспечить сечение люминесценции, достаточное для визуализации отдельной частицы. Изучение квантового выхода и спектральной зависимости фотолюминесценции золотых субмикронных частиц выходит за рамки данной работы и будет исследоваться отдельно.
4. ЗАКЛЮЧЕНИЕ
Разработан одностадийный метод получения золотых субмикронных частиц, основанный на восстановлении ионов золота дофамином в присутствии ПВП. Основным параметром, определяющим размер наносфер, является концентрация ПВП. Показано, что варьирование концентрации ПВП в реакционной смеси в пределах от 0.001 до 1 мг/мл позволяет получить золотые наносферы диаметром от 120 до 500 нм, однако монодисперсные субмикронные частицы образуются при концентрации ПВП выше 0.001 мг/мл. Продемонстрирована возможность конструирования метки ГКР на основе полученных частиц. Также показано, что благодаря высокой яркости свечения субмикронные золотые частицы могут служить эффективной меткой для конфокальной лазерной микроскопии.
Список литературы
Gold Nanoparticles in Bioanalytical Techniques. Ed. by Shtykov S. Berlin: De Gruyter, 2018.
Dykman L., Khlebtsov N. // Chem. Soc. Rev. 2012. V. 41. P. 2256.
Correard F., Maximova K., Estève M.A., Villard C., Roy M., Al-Kattan A., Sentis V., Gingras M., Kabashin A.V., Braguer D. // Int. J. Nanomed. 2014. V. 9. P. 5415.
Brown K.R., Natan M.J. // Langmuir. 1998. V. 14. P. 726.
Brown K.R., Walter D.G., Natan M.J. // Chem. Mater. 2000. V. 12. P. 306.
Jana N.R., Gearheart L., Murphy C.J. // Langmuir. 2001. V. 17. P. 6782.
Ziegler C., Eychmüller A. // J. Phys. Chem. C. 2011. V. 115. P. 4502.
Frens G. // Nature Phys. Sci. 1973. V. 241. P. 20.
Bastús N.G., Comenge J., Puntes V. // Langmuir. 2011. V. 27. P. 11098.
Perrault S.D., Chan W.C.W. // J. Am. Chem. Soc. 2009. V. 131. P. 17042.
Kumar D., Mutreja I., Sykes P. // Nanotechnology. 2016. V. 27. 355601.
Liu X., Xu H., Xia H., Wang D. // Langmuir. 2012. V. 28. P. 13720.
Onitsuka S., Hamada T., Okamura H. // Colloids Surf. B. 2019. V. 173. P. 242.
Дыкман Л.А., Хлебцов Н.Г. // Успехи химии. 2019. Т. 88. С. 229.
Dreaden E.C., Alkilany A.M., Huang X., Murphy C.J., El-Sayed M.A. // Chem. Soc. Rev. 2012. V. 41. P. 2740.
Jimenez-Ruiz A., Perez-Tejeda P., Grueso E., Castillo P.M., Prado-Gotor R. // Chem. Eur. J. 2015. V. 21. P. 9596.
Hoppe C.E., Lazzari M., Pardinas-Blanco I., Lopez-Quitela M.A. // Langmuir. 2006. V. 22. P. 7027.
Pastoriza-Santos I., Liz-Marzan L.M. // Adv. Funct. Mater. 2009. V. 19. P. 679.
Koczkur K.M., Mourdikoudis S., Polavarappu L., Skrabalak S.E. // Dalton Trans. 2015. V. 44. P. 17883.
Pal A. // J. Nanoparticle Res. 2004. V. 6. P. 28.
Baron R., Zayats M., Wilner I. // Anal. Chem. 2005. V. 77. P. 1566.
Lu C.-C., Zhang M., Li A.-J., He X.-W., Yin X.-B. // Electroanalysis. 2011. V. 23. 2421.
Amendola V., Pilot R., Frasconi M., Maragò O.M., Iatì M.A. // J. Phys.: Condens. Matter. 2017. V. 29. 203002.
Zhou J., Jiang Y., Hou S., Upputuri P.-K., Wu D., Li J., Wang P., Zhen X., Pramanik M., Pu K., Duan H. // ACS Nano. 2018. V. 12. P. 2643.
Kumar A., Kumar S., Rhim W.-K., Kim G.-H., Nam J.-M. // J. Am Chem. Soc. 2014. V. 136. P. 16317.
Shui L., Zhang G., Hu B., Chen X., Jin M., Zhou G., Li N., Muhler M., Peng B. // J. Energy Chem. 2019. V. 36. P. 37.
Washio I., Xiong Y., Yin Y., Xia Y. // Adv. Mater. 2006. V. 18. P. 1745.
Xiong Y., Washio I., Chen J., Cai H., Li Z.-Y., Xia Y. // Langmuir. 2006. V. 22. P. 8563.
Chen L., Si P., Zhao B. // J. Mater. Sci.–Mater. El. 2019. V. 30. P. 12077.
Zhang Y., Thingholm B., Goldie K.-N., Ogaki R. Stadler B. // Langmuir. 2012. V. 28. P. 17585.
Ruy J.-H., Messersmith P.-B., Lee H. // ACS Appl. Mater. Interfaces. 2018. V. 10. P. 7523.
Zhang Y., Zhou W., Xue Y., Yang Y., Liu D. // Anal. Chem. 2016. V. 88. P. 12502.
Mooradian A. // Phys. Rev. Lett. 1969. V. 22. P. 185.
Yorulmaz M., Khatua S., Zijlstra P., Gaiduk A., Orrit M. // Nano Lett. 2012. V. 128. P. 4385.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал