Коллоидный журнал, 2020, T. 82, № 4, стр. 408-415
Коллоидно-химические свойства гидрозолей Ce0.5Zr0.5O2 и природа их агрегативной устойчивости
Н. Н. Гаврилова 1, *, И. В. Иванов 1, В. В. Назаров 1
1 Российский химико-технологический университет имени Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: ngavrilova@muctr.ru
Поступила в редакцию 16.01.2020
После доработки 29.01.2020
Принята к публикации 07.02.2020
Аннотация
Определены основные коллоидно-химические свойства гидрозоля, частицы которого состоят из твердого раствора диоксидов церия и циркония состава Ce0.5Zr0.5O2. Показано, что этот гидрозоль по агрегативной устойчивости близок к гидрозолям ZrO2, хотя его частицы содержат 50 мол. % менее гидрофильного диоксида церия. При различных значениях pH дисперсионной среды определены размеры, плотность, фазовый состав и электрокинетический потенциал частиц. Исследовано самопроизвольное диспергирование ксерогелей, получаемых сушкой гидрозоля. Оценена толщина поверхностного слоя частиц, обеспечивающего агрегативную устойчивость гидрозоля. На основании комплекса полученных данных сделан вывод о наличии на поверхности частиц золя ионизированного гидратированного гель-слоя.
ВВЕДЕНИЕ
Гидрозоли различных соединений металлов (сульфидов, оксидов, гидроксидов и др.) традиционно относят к числу типичных лиофобных дисперсных систем. При этом среди широкого ряда гидрозолей, которые можно синтезировать в форме относительно устойчивых дисперсий, особое место занимают гидрозоли SiO2, ZrO2, TiO2, AlOOH, а также оксидов молибдена переменной валентности (“молибденовые сини”). Перечисленные объекты обладают аномально высокой агрегативной устойчивостью. В определенных условиях по своим свойствам (отсутствие коагуляции, постоянство дисперсности во времени, устойчивость к добавлению электролитов) эти золи приближаются к лиофильным дисперсным системам [1–5].
Многими исследователями было показано, что устойчивость перечисленных гидрозолей обусловлена наличием на частицах развитых поверхностных слоев [1–4]. Имеющиеся данные указывают на то, что, вероятно, при определенных условиях (например, при определенных значениях pH дисперсионной среды) на поверхности частиц образуются разрыхленные заряженные и сильно гидратированные слои, получившие название гель-слоев.
В плане понимания роли поверхностных слоев в обеспечении агрегативной устойчивости гидрозолей оксидов металлов определенный интерес представляют коллоидно-химические свойства гидрозолей, частицы которых представлены бинарными оксидами. В качестве такого примера можно рассмотреть гидрозоли бинарных оксидов церия и циркония. Интерес к исследованию коллоидно-химических свойств гидрозолей CeZrO2 обусловлен тем, что один из компонентов бинарных оксидов является оксидом с сильно лиофилизированной поверхностью (ZrO2), а другой компонент не обладает такими ярко выраженными свойствами (CeO2).
Гидрозоли состава Ce0.5Zr0.5O2 представляют и значительный практический интерес, так как они используются при получении керамических материалов [6], газовых сенсоров [7] и различных каталитических систем [8, 9].
Цель данной работы заключалась в определении основных коллоидно-химических свойств гидрозолей Ce0.5Zr0.5O2 и установлении факторов, обеспечивающих их агрегативную устойчивость.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования использовались гидрозоли CeZrO2 с мольным соотношением Ce/Zr = 1/1 (далее – Ce0.5Zr0.5O2). Гидрозоли были синтезированы в соответствии со способом, описанным в работе [10], который заключается в проведении совместного гидролиза смеси неорганических солей (нитрата церия и оксинитрата циркония) с последующей пептизацией полученного осадка. В качестве пептизирующего агента использовалась азотная кислота.
В ходе исследования свойств использовались гидрозоли с различной концентрацией дисперсной фазы и разным значением pH дисперсионной среды. Концентрацию дисперсной фазы (в пересчете на оксиды Ce0.5Zr0.5O2) определяли гравиметрически, прокаливая сухой остаток после сушки золя при температуре 600°C на воздухе.
Значения pH определяли с помощью pH-метра HI98128 (HANNA Instruments, Германия) с использованием стеклянного электрода. Точность определения величины pH составляла ±0.01 единицы. Регулирование величины pH гидрозолей осуществляли добавками азотной кислоты или водного раствора аммиака.
Размер частиц гидрозолей определяли двумя способами. Первый заключался в анализе микрофотографий, полученных с использованием просвечивающего электронного микроскопа (ПЭМ) LEO 912AB Omega (Carl Zeiss, Германия). Образцы готовили нанесением 1–2 мкл золя на покрытую формваром медную сеточку, которую затем сушили на воздухе. Изображения получали при ускоряющем напряжении 100 кВ. Анализ микрофотографий и расчет размеров частиц проводили с помощью программы Image Tool v.3.
Второй способ определения размеров частиц основан на использовании фотон-корреляционной спектроскопии. Гидродинамический диаметр частиц золя определяли с помощью анализатора размера и дзета-потенциала частиц Photocor Compact-Z (ООО Фотокор, Россия). Измерения проводились с использованием лазера с длиной волны 632.8 нм и мощностью излучения 20 мВт. С помощью этого же прибора определяли электрофоретическую подвижность частиц гидрозолей. Величина напряженности приложенного электрического поля при измерениях составляла от 3 до 15 В/см. Погрешность измерения электрофоретической подвижности составляла ±1 × 10–9 м2/(с В).
Электрофоретическую подвижность рассчитывали по соотношению
где V – скорость движения частиц в электрическом поле, E – напряженность электрического поля.Поскольку размеры частиц гидрозолей сопоставимы с толщиной диффузной части двойного электрического слоя (ДЭС), для расчета величины электрокинетического потенциала использовалась формула Генри [11]:
(2)
${\zeta } = {\text{\;}}\frac{{3{\eta }{{U}_{{{\text{эф}}}}}}}{{2{\varepsilon }{{{\varepsilon }}_{0}}}}{\text{\;\;}}\frac{1}{{{{f}_{1}}\left( {\kappa r} \right)}},$Для расчета функции f1(κr) использовалось соотношение, предложенное в работе [12]:
(3)
${\text{\;}}{{f}_{1}}\left( {\kappa r} \right) = 1 + \frac{1}{2}{{\left[ {1 + \left( {\frac{{2.5}}{{\kappa r\left[ {1{\text{\;}} + {\text{\;}}2{\text{exp}}\left( { - \kappa r} \right)} \right]}}} \right)} \right]}^{{ - 3}}}.$Значения оптической плотности гидрозолей измерены на сканирующем спектрофотометре Leki SS2110 UV (MEDIORA OY, Финляндия) при длине волны, равной 440 нм. Измерения проводили с использованием кварцевых кювет толщиной 10 мм.
Плотность частиц в гидрозолях Ce0.5Zr0.5O2 определяли с использованием концентрационных зависимостей плотности гидрозолей в предположении, что объем золя является аддитивной величиной по отношению к объемам дисперсной фазы и дисперсионной среды. В этом случае взаимосвязь между плотностью золя ρ, плотностью частиц ρ1 и плотностью дисперсионной среды ρ0 выражается следующим соотношением:
(4)
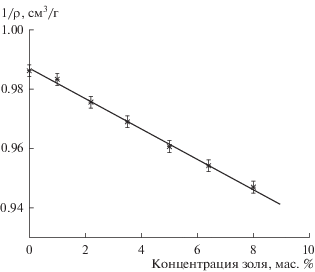
$\frac{1}{{\rho }} = \frac{1}{{{{{\rho }}_{0}}}} - \frac{{c\left( {{{{\rho }}_{1}} - {\text{\;}}{{{\rho }}_{0}}} \right)}}{{{{{\rho }}_{1}}{{{\rho }}_{0}}}},~$Данные о плотности золей обрабатывались в координатах этого линейного уравнения. Пример такой обработки представлен на рис. 1, из которого следует, что экспериментальные точки хорошо ложатся на прямую линию. Это позволяет провести расчет плотности частиц и плотности дисперсионной среды, используя угловые коэффициенты и отрезки, отсекаемые на оси ординат полученными прямыми.
В качестве примера на рис. 1 приведена одна из таких прямых, построенная для гидрозоля Ce0.5Zr0.5O2 с величиной pH, равной 1.7.
Плотность гидрозолей была измерена с помощью плотномера Density Meter DDM 2911 Plus (Rudolph Research Analytical, США).
Термический анализ ксерогеля Ce0.5Zr0.5O2 проводили на термоанализаторе Q600 (SDT, США). Образец ксерогеля прокаливали на воздухе в интервале температуры от 25 до 1000°C при скорости нагрева 10 град/мин.
Фазовый состав частиц гидрозолей определяли на основании данных рентгенографического и электронографического анализа. Рентгенографические эксперименты проводили на дифрактометре с вращающимся анодом Rigaku D/MAX 2500 (Rigaku, Япония) в режиме отражения (геометрия Брегга–Брентано) с использованием CuKα-излучения и графитового монохроматора. Электронограммы были получены с использованием ПЭМ LEO 912AB Omega (Carl Zeiss, Германия), съемка осуществлялась в режиме микродифракции.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Гидрозоли Ce0.5Zr0.5O2, синтезированные пептизацией совместно осажденных гидратированных оксидов, представляют собой опалесцирующие дисперсии светло-желтого цвета. На рис. 2а приведена микрофотография частиц исследуемого гидрозоля, из которой видно, что дисперсная фаза золя представлена частицами по форме близкой к сферической (фактор формы, определенный как отношение максимального размера частицы к минимальному, составляет 1.1).
Рис. 2.
Микрофотография частиц гидрозоля Ce0.5Zr0.5O2 в светлом (а) и темном поле (б); гистограмма распределения частиц гидрозоля по размеру (в); зависимость гидродинамического диаметра частиц от величины pH дисперсионной среды (г).
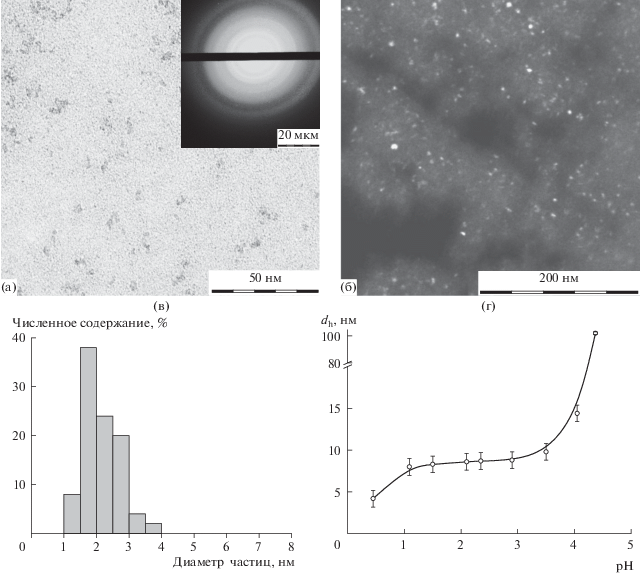
На электронограмме, представленной на рис. 2а, наблюдаются сильно размытые дифракционные кольца. Такой вид электронограмм может наблюдаться в двух случаях: при анализе рентгеноаморфных частиц или очень мелких кристаллических образований. Для проверки одного из этих предположений были получены микрофотографии частиц (рис. 2б) в режиме микродифракции, на которых отчетливо видно светлые точки, соответствующие кристаллическим областям.
Таким образом, дисперсная фаза гидрозолей представлена частично закристаллизованными частицами. Обработка наиболее интенсивных колец показала, что частицы исследуемого образца Ce0.5Zr0.5O2 состоят из твердого раствора диоксидов церия и циркония с кубической кристаллической решеткой.
На основании данных обработки нескольких микрофотографий (не менее 250 частиц) была построена гистограмма распределения частиц по размерам (рис. 2в). Как следует из приведенных данных, диаметр частиц гидрозолей не превышает 4 нм, при этом их среднемассовый диаметр составляет 2.1 нм.
По данным фотон-корреляционной спектроскопии (рис. 2г) в зоне агрегативной устойчивости гидрозоля в интервале значений pH от 1.0 до 3.0 средний гидродинамический диаметр (dh) частиц составляет от 8 до 9 нм. При более низком значении pH наблюдается уменьшение гидродинамического диаметра частиц, что вероятно обусловлено их частичным растворением, а также сжатием диффузной части ДЭС и, следовательно, уменьшением гидродинамического диаметра. Увеличение dh при значениях pH > 3.5 связано с агрегацией частиц. Таким образом, гидрозоли Ce0.5Zr0.5O2 агрегативно устойчивы в области pH < 3.5.
Разница в размерах частиц, определенных методами электронной микроскопии и фотон-корреляционной спектроскопии, свидетельствует о наличии развитых поверхностных слоев на частицах гидрозолей.
Для оценки электроповерхностных свойств частиц, была измерена зависимость ζ-потенциала частиц Ce0.5Zr0.5O2 от величины pH дисперсионной среды, представленная на рис. 3.
Рис. 3.
Зависимость ζ-потенциала частиц (1) и оптической плотности (2) гидрозоля Ce0.5Zr0.5O2 от величины pH дисперсионной среды.
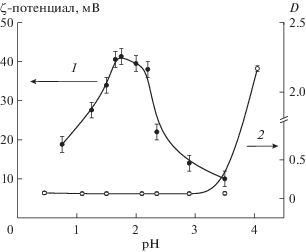
Как видно из представленной зависимости, в исследованной области рН частицы золей заряжены положительно, а максимальное значение ζ-потенциала соответствует pH ≈ 1.7. Падение величины ζ-потенциала при меньших значениях рН обусловлено значительным увеличением ионной силы из-за роста концентрации кислоты и растворения частиц и, как следствие, сжатием диффузной части ДЭС. Уменьшение значений ζ-потенциала с ростом величины рН выше 2.0 очевидно связано с приближением к изоэлектрической точке (ИЭТ). Значения рНИЭТ для оксидов CeO2 и ZrO2 находятся в интервале 6.5–7.6 [13–16].
Интересно отметить, что в области значений рН, в которой наблюдается уменьшение ζ-потенциала (при значениях рН менее 1.7), потери агрегативной устойчивости гидрозолей не происходит. Об этом свидетельствует постоянство значений оптической плотности гидрозолей (рис. 3, кривая 2) и гидродинамического диаметра их частиц (рис. 2в). Эти параметры не претерпевали значительных изменений и с течением времени (измерения проводились в течение 6 месяцев). Данный факт свидетельствует о том, что электростатический фактор устойчивости, обусловленный наличием ДЭС на поверхности частиц, не является основным.
В предыдущих исследованиях [17] было отмечена высокая агрегативная устойчивость гидрозолей CeZrO2 по отношению к индифферентным электролитам. В частности, было установлено, что при добавлении NaNO3 в золи до концентрации 0.5 моль/л наблюдается снижение электрокинетического потенциала до 2.8 мВ, но при этом в золях не наблюдалось коагуляции, они сохраняли устойчивость в течение длительного времени. Подобную устойчивость гидрозолей в присутствии индифферентных электролитов часто объясняют наличием структурного фактора устойчивости, обусловленного образованием гидратных оболочек на поверхности частиц [3].
Однако, в отличие от золей SiO2, для которых структурная составляющая проявляется вблизи ИЭТ, для гидрозолей Ce0,5Zr0,5O2 действие структурной составляющей проявляется при pH < pHИЭТ, что, вероятно, обусловлено появлением гидратированных катионных форм церия и циркония на поверхности частиц.
Для оценки влияния pH на толщину поверхностных слоев частиц гидрозолей Ce0.5Zr0.5O2 был проведен следующий расчет. Толщину слоя (δ) оценивали по разности значений гидродинамического диаметра и диаметра, определенного по ПЭМ-изображениям (использовалось значение среднемассового диаметра частиц). Полученные результаты приведены в табл. 1. Для сравнения было также рассчитано значение толщины диффузной части ДЭС (λ) при различных значениях pH.
Таблица 1.
Результаты оценки толщины поверхностных слоев частиц Ce0.5Zr0.5O2 при различных значениях pH гидрозоля
| pH | 0.5 | 1.1 | 1.5 | 1.7 | 2.1 | 2.4 |
|---|---|---|---|---|---|---|
| Толщина слоя δ, нм | 1.0 | 3.0 | 3.1 | 3.2 | 3.3 | 3.5 |
| λ, нм | 0.5 | 1.0 | 1.7 | 2.1 | 3.4 | 4.6 |
Как видно из полученных данных, в области агрегативной устойчивости гидрозолей наблюдается незначительное изменение гидродинамического диаметра (см. рис. 2в), а, следовательно, и толщины поверхностных слоев частиц Ce0.5Zr0.5O2. В отличие от величины δ, толщина λ диффузной части ДЭС при варьировании pH изменяется более существенно (см. табл. 1). Такие результаты можно объяснить исходя из представлений о существовании на поверхности частиц гидратированного гель-слоя, проницаемого для ионов.
О наличии развитых гидратных слоев на частицах исследуемого гидрозоля свидетельствует и расчетное значение плотности частиц, найденное с использованием уравнения (4). Из полученных данных следует, что плотность частиц гидрозолей составляет 1.65 г/см3 в области значений pH, в которой золи агрегативно устойчивы, что значительно меньше плотности кристаллических оксидов CeO2 и ZrO2 (7.2 и 5.8 г/см3 соответственно [18]).
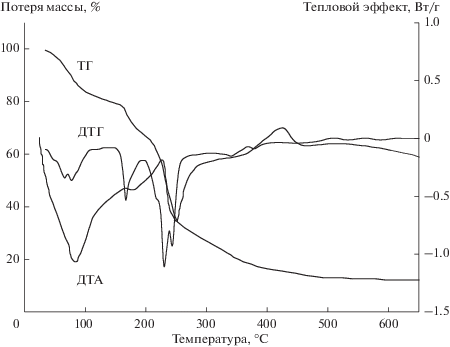
Предположение о высокой степени гидратации частиц подтверждают и данные термогравиметрического анализа ксерогеля Ce0.5Zr0.5O2, приготовленного сушкой золя при комнатной температуре (см. рис. 4).
Как видно из представленных данных, потеря массы образцом происходит ступенчато и наблюдается в основном в области невысоких температур (до 400°C). Потеря массы при температуре несколько ниже 100°C соответствует удалению капиллярной и слабосвязанной воды (порядка 15% от общей потери массы). При значениях температуры несколько ниже и выше 200°C очевидно происходит потеря структурной воды (35% от общей потери массы), что сопровождается эндотермической трансформацией гидроксильных групп в оксо-связи. Экзоэффект при температуре около 440°C обусловлен кристаллизацией рентгеноаморфной части частиц [19].
Интересно отметить, что ксерогели Ce0.5Zr0.5O2, получаемые сушкой гидрозоля, обладают способностью к самопроизвольному диспергированию в воде с образованием золей. При этом температура сушки ксерогелей может быть достаточно высокой. Так, например, ксерогели, полученные сушкой при температуре до 210°C, самопроизвольно диспергируются полностью. Ксерогели, высушенные при температуре выше 210°C, диспергируются частично, при этом в образовавшихся гидрозолях наблюдается некоторое количество крупных агрегатов. Дальнейшее увеличение температуры сушки приводит к уменьшению степени диспергируемости ксерогелей, и образцы, прокаленные при 300°C, уже практически не диспергируются. Таким образом, при значениях температуры выше 210°C происходят необратимые изменения в поверхностных слоях частиц Ce0.5Zr0.5O2, которые обеспечивают агрегативную устойчивость рассматриваемых гидрозолей, что коррелирует с данными термогравиметрии (см. рис. 4).
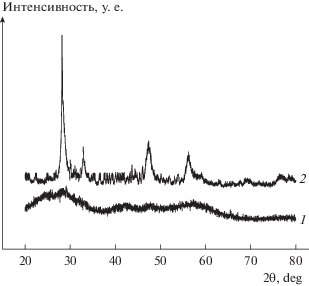
Повышение температуры сушки ксерогелей приводит как к уменьшению гидратации частиц, так и к более высокой степени их кристалличности. По сравнению с дифрактограммами исходного ксерогеля, на дифрактограммах ксерогеля, прокаленного при 260°C, наблюдаются более четкие рефлексы от кубической кристаллической решетки (рис. 5).
Рис. 5.
Дифрактограммы ксерогелей Cе0.5Zr0.5O2, полученных сушкой при температуре 25 (1) и 260°C (2).
На рис. 6а приведена микрофотография частиц золя, полученного диспергированием ксерогеля, прокаленного при 260°C. Во-первых, частицы дисперсной фазы этого гидрозоля имеют более контрастное изображение. Во-вторых, на электронограмме наблюдаются отчетливые рефлексы (рис. 6б), свидетельствующие о значительно большей степени кристалличности частиц ксерогеля, по сравнению с частицами исходного гидрозоля (см. рис. 1). Согласно данным пикнометрического анализа плотность частиц гидрозоля, приготовленного самопроизвольным диспергированием ксерогеля, составляет 3.3 г/см3.
Рис. 6.
Микрофотография (а) и электронограмма (б) частиц гидрозоля Ce0.5Zr0.5O2, полученного диспергированием ксерогеля, прокаленного при 260°C.

Таким образом, термообработка ксерогелей (получаемых сушкой золя при комнатной температуре) при повышенной температуре ведет к уплотнению, частичной кристаллизации и дегидратации частиц (как минимум, частичной), что, в свою очередь, приводит к изменению агрегативной устойчивости гидрозолей Ce0.5Zr0.5O2.
Для оценки агрегативной устойчивости гидрозолей, полученных диспергированием ксерогелей, прокаленных при 260°C, были определены пороги быстрой коагуляции в присутствии нитрата натрия (см. рис. 7) по методике, описанной в работе [17].
Рис. 7.
Зависимость порога быстрой коагуляции Cкр, вызванной NaNO3, от величины pH дисперсионной среды. Концентрация золя – 0.6 мас. %.
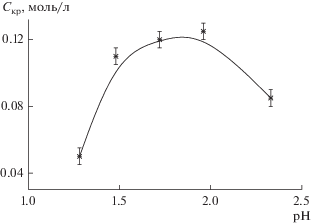
Зависимость порогов коагуляции от величины pH дисперсионной среды носит экстремальный характер, при этом максимальные значения порогов коагуляции наблюдаются при таких значениях pH, при которых частицы золя обладают максимальным значением дзета-потенциала (см. рис. 3). Как показали исследования, пороги коагуляции в присутствии нитрата натрия не зависят от концентрации золя, то есть коагуляция проходит по концентрационному механизму.
Из приведенных данных следует, что гидрозоль, приготовленный из подвергшегося термообработке ксерогеля в результате самопроизвольного диспергирования, становится чувствительным к введению индифферентного электролита, в присутствии которого исходные гидрозоли Cе0,5Zr0,5O2 не коагулируют.
ВЫВОДЫ
Проведенными исследованиями установлено, что гидрозоли бинарных оксидов Ce0.5Zr0.5O2 обладают высокой агрегативной устойчивостью вследствие большого вклада структурного фактора устойчивости, обусловленного наличием на частицах развитого поверхностного слоя (гель-слоя).
Высокая степень гидратации частиц обеспечивает возможность повторного самопроизвольного диспергирования ксерогелей (приготовленных сушкой золя) в воде с образованием устойчивых гидрозолей.
На основании данных просвечивающей электронной микроскопии и фотон-корреляционной спектроскопии проведена оценка толщины поверхностных слоев частиц, согласно которой она зависит от величины pH дисперсионной среды и составляет до 3.5 нм. Анализ зависимостей гидродинамического диаметра и ζ-потенциала частиц Ce0.5Zr0.5O2 от величины pH дисперсионной среды указывает на то, что гель-слой является ионизированным и проницаемым для ионов.
Список литературы
Шабанова Н.А., Саркисов П.Д. Основы золь-гель технологии нанодисперсного кремнезема. М.: ИКЦ Академкнига, 2004.
Грищенко Л.И., Медведкова Н.Г., Назаров В.В., Фролов Ю.Г. // Коллоид. журн. 1994. Т. 56. С. 269.
Горохова Е.В., Назаров В.В., Медведкова Н.Г., Каграманов Г.Г., Фролов Ю.Г. // Коллоид. журн. 1993. Т. 55. С. 30.
Назаров В.В., Валесян Е.К., Медведкова Н.Г. // Коллоид. журн. 1999. Т. 60. С. 395.
Баженова М.Д., Гаврилова Н.Н., Назаров В.В. // Коллоид. журн. 2015. Т. 77. С. 3.
Мосунов А.В., Подзорова Л.И. // Неорг. материалы. 2008. Т. 44. С. 890.
Kumar A., Jaiswal A., Sanbui M., Omar S. // Scr. Mater. 2016. V. 121. P. 10.
Trovarelli A., Boardo M., Rocchini E., de Leitenburg C., Dolcetti G. // J. Alloys Compd. 2001. V. 323–324. P. 584.
Брыкин А.В., Артемов А.В., Колегов К.А. // Катализ в промышленности. 2013. № 4. С. 7.
Гаврилова Н.Н., Назаров В.В. // Коллоид. журн. 2010. Т. 72. С. 465.
Henry D.C., Lapworth A. // Proc. Royal Soc. A. 1931. V. 133. P. 106.
Ohshima H. // J. Colloid Interface Sci. 1994. V. 168. P. 269.
Parks G.A., de Bruyn P. L. // J. Phys. Chem. 1962. V. 66. P. 967.
Дуда Л.В., Голикова Е.В., Григорьев В.С., Чернобережский Ю.М. // Коллоид. журн. 1999. Т. 61. С. 487.
Necula B.S., Apachitei I., Fratila-Apachitei L.E., Teodosiu C., Duszczyk J. // J. Colloid Interface Sci. 2007. V. 314. P. 514.
Голикова Е.В., Рогоза О.М., Щелкунов Д.М., Чернобережский Ю.М. // Коллоид. журн. 1995. Т. 57. С. 25.
Гаврилова Н.Н., Назаров В.В. // Коллоид. журн. 2011. Т. 73. С. 30.
Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. М.: Химия, 1997.
Rossignol S., Madier Y., Duprez D. // Cat. Today. 1999. V. 50. P. 261.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал