Коллоидный журнал, 2020, T. 82, № 4, стр. 476-487
Поверхностные свойства водных растворов смесей додецилсульфата натрия и линалоола в равновесных и динамических условиях
О. А. Соболева 1, *, Л. А. Царькова 1
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, д. 1, стр. 3, Россия
* E-mail: Oxana_Soboleva@mail.ru
Поступила в редакцию 16.12.2019
После доработки 30.01.2020
Принята к публикации 18.02.2020
Аннотация
Изучено влияние концентрации и состава смеси традиционного ПАВ додецилсульфата натрия (SDS) и линалоола (LL) – летучего душистого вещества, обладающего поверхностно-активными свойствами, на поверхностное натяжение их водных растворов. Измерения поверхностного натяжения проводили как в равновесных, так и в динамических условиях формирования поверхности (в диапазоне времени от 20 мс до 20 с), а также при испарении растворов. Установлено, что в равновесных условиях индивидуальные ПАВ и их смеси проявляют схожую поверхностную активность. Напротив, в динамических условиях LL быстрее понижает поверхностное натяжение по сравнению с SDS, а величина поверхностного натяжения смешанных растворов определяется адсорбцией LL. Обнаружен синергетический эффект при снижении поверхностного натяжения при высоких концентрациях ПАВ, проявляющийся как в динамических, так и в равновесных условиях. При испарении капель смешанных растворов на временном интервале порядка минут происходит изменение состава адсорбционного слоя за счет десорбции LL в газовую фазу, так что поверхностное натяжение определяется адсорбцией второго компонента – SDS.
ВВЕДЕНИЕ
Интерес к изучению смесей ПАВ определяется широким использованием композиций на основе ПАВ при создании моющих средств, флотореагентов, эмульсий в фармацевтической и косметической промышленности, при стабилизации дисперсий разного состава и т.д. Были изучены смеси мицеллообразующих ПАВ разного типа [1], мономерных и димерных ПАВ [2, 3], мицеллообразующего компонента с немицеллообразующим [4]. Практическое использование смесей ПАВ диктует проведение исследований не только в условиях достижения равновесия между фазами и адсорбционным слоем, но и в отсутствие равновесия. Например, в таких процессах как нанесение покрытий, пропитка пористых тел, эмульгирование и пенообразование новая поверхность возникает быстро (на временных интервалах порядка миллисекунд), и зачастую эффективность процесса зависит от способности ПАВ снижать поверхностное натяжение в динамических условиях. Напротив, на больших временах может происходить изменение состава адсорбционного слоя за счет десорбции/испарения, что также оказывает влияние на величину поверхностного натяжения. Практически каждая система в зависимости от состава и потенциального применения требует своей специфики проведения эксперимента и обоснования применимости различных теоретических моделей для описания и трактовки экспериментальных данных.
Предметом исследования настоящей работы являются смеси традиционного анионного ПАВ додецилсульфата натрия (SDS) и органического дифильного соединения линалоола (3,7-диметил-1,6-октадиен-3-ол, LL) (рис. 1).
Поверхностные свойства одного из компонентов исследуемой смеси – SDS – очень хорошо изучены. Целым рядом авторов получены весьма воспроизводимые коллоидно-химические характеристики водных растворов SDS (табл. 1) [1, 5–9]. LL представляет собой третичный спирт класса монотерпенов и широко используется в различных композициях, прежде всего, парфюмерных, средствах личной гигиены, моющих средствах как душистое вещество. LL является компонентом ароматических масел ряда растений, присутствует в лаванде, ландыше, апельсине, лимоне, кориандре и других растениях. Основные работы, касающиеся LL, посвящены исследованию его функциональных свойств в качестве душистого вещества. Например, изучали эффективность высвобождения LL из различных дисперсных систем – эмульсий [10], гелей [11], а также систем, содержащих липосомы [12]. Вместе с тем, тот факт, что LL обладает заметной поверхностной активностью, был обнаружен сравнительно недавно [13, 14]. Установлено, что с ростом концентрации LL в растворе поверхностное натяжение снижается, достигая минимального значения для насыщенного водного раствора [13]. При этом в литературе приводятся различные данные для предельной растворимости LL в воде в зависимости от температуры (от 854 мг/л при 23.5°C до 1589 мг/л при 25°C) [15]. Неточности в определении молекулярной растворимости органических соединений могут быть также обусловлены выбранным методом измерения ввиду их перехода вблизи насыщения к коллоидной растворимости в виде капель нанометрового размера [16].
Особенностью LL, как и других душистых соединений, является способность эффективно понижать поверхностное натяжение раствора при малых временах формирования поверхности, т.е. в динамических условиях. Другая особенность LL заключается в том, что при проведении длительных статических измерений в условиях испарения капель поверхностное натяжение растворов LL возрастает [14]. Летучесть LL следует учитывать при приготовлении, хранении и изучении его растворов.
Необходимость изучения композиций LL в смесях с другими ПАВ связана, как уже сказано выше, с использованием LL в качестве душистой добавки в моющих средствах, косметических препаратах, средствах личной гигиены, т.е. в системах, содержащих традиционные ПАВ. Так, в последние годы проведена серия работ по исследованию смешанных адсорбционных слоев LL и ПАВ на границе фаз водный раствор/воздух методом малоуглового рассеяния Х-лучей [17–20]. Были выявлены некоторые особенности влияния традиционных ПАВ на адсорбцию LL [17, 18]: в смеси LL с SDS происходит их совместная адсорбция, в смеси с более гидрофобным додецил-6-бензолсульфонатом LL вытесняется из адсорбционного слоя. Добавки электролита также приводят к уменьшению адсорбции LL из смешанных растворов с ионогенными ПАВ. На величину адсорбции влияет и испарение LL из адсорбционного слоя: наиболее интенсивное уменьшение поверхностной концентрации LL вследствие испарения происходит при малом содержании LL в смеси с SDS. При повышении доли LL в смеси поверхностная концентрация LL со временем практически не изменяется, так как испарение компенсируется адсорбцией из раствора [19]. Установлено, что кинетику испарения ПАВ из адсорбционного слоя на границе фаз водный раствор/воздух можно регулировать, используя смеси полимер/ПАВ [20]. Так, при сильном взаимодействии полимера с ПАВ (смесь SDS с катионным полимером поли(диметилдиаллиламмоний хлоридом)) формируются плотные адсорбционные слои, замедляющие адсорбцию и соответственно испарение LL. Напротив, при слабом взаимодействии полимера с ПАВ (смесь SDS с поли(этиленимином)) скорость испарения LL возрастает. Следует отметить, что все эти исследования проводились в условиях длительного формирования смешанных адсорбционных слоев на границе фаз раствор/воздух.
Для более глубокого понимания процесса формирования смешанных адсорбционных слоев требуется рассмотрение поверхностных свойств водных растворов смесей LL и SDS при разных условиях формирования поверхности. Значения поверхностного натяжения, измеренные в равновесных условиях, определяются изменением свободной энергии при адсорбции отдельных компонентов, а также энергией взаимодействия между компонентами в слое. Экспериментально полученные изотермы поверхностного натяжения для индивидуальных веществ и смесей позволяют провести термодинамические расчеты адсорбции индивидуальных компонентов на границе фаз водный раствор/воздух, а также рассчитать состав смешанного адсорбционного слоя и параметры взаимодействия между компонентами в слое. Неравновесные условия могут быть созданы разными способами: или путем быстрого формирования новой поверхности, или за счет испарения капель растворов. Можно ожидать, что при малых временах формирования новой поверхности, до нескольких секунд, на поверхностное натяжение смешанных растворов будет влиять, в основном, различие в кинетике диффузии компонентов к поверхности. Поверхностное натяжение будет определяться компонентом с бóльшим коэффициентом диффузии. При формировании поверхности в условиях испарения (висящая или сидящая капля на воздухе) величина поверхностного натяжения будет определяться изменением состава поверхностного слоя вследствие испарения LL и воды. Соответственно, для более полного исследования поверхностных свойств смешанных растворов необходимо использовать разные экспериментальные методы определения поверхностного натяжения, обеспечивающие его измерение в широком временнóм диапазоне существования поверхности.
Цель настоящей работы состояла в исследовании поверхностных свойств растворов смесей SDS и LL в разных условиях: при малых временах формирования поверхности, в равновесных условиях и при испарении капель растворов LL–SDS.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В экспериментах использовали SDS и LL (Sigma-Aldrich), растворы готовили на дистиллированной воде. Исходные растворы получали весовым методом, рабочие растворы – последовательным разбавлением исходных.
Динамическое поверхностное натяжение измеряли методом максимального давления в пузырьке воздуха с помощью тензиометра SITA pro line t100 (SITA GmbH, Германия) с использованием капилляров из полиэфиркетона.
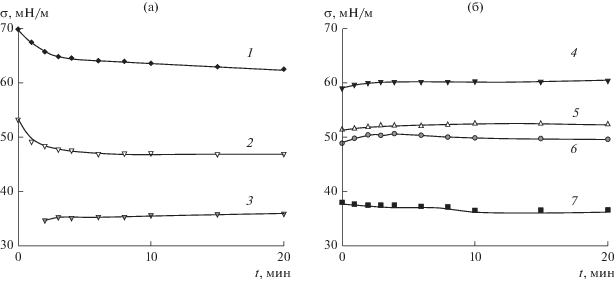
Равновесные значения поверхностного натяжения определяли методом висящей капли. Каплю формировали на торце капилляра, помещенного в закрытую кювету, на дно которой был налит соответствующий раствор ПАВ. Каплю фотографировали с помощью горизонтального микроскопа, оборудованного цифровой видеокамерой DCM-130. Поверхностное натяжение рассчитывали по профилю капли путем численного интегрирования уравнения Юнга–Лапласа и приближением рассчитанного профиля капли к полученному экспериментально. Для всех растворов измеряли зависимость поверхностного натяжения от времени; в качестве примера на рис. 2 представлены соответствующие зависимости для растворов индивидуальных ПАВ. Время установления постоянного значения поверхностного натяжения составляет примерно 3–5 мин для LL и от 2 до 15 мин для SDS (в зависимости от концентрации ПАВ). Аналогичные измерения были выполнены со всеми смешанными растворами. Равновесные значения поверхностного натяжения определяли при времени формирования висящей капли 20 мин.
Рис. 2.
Зависимости поверхностного натяжения растворов SDS (а) и LL (б) от времени формирования их капель в закрытой кювете. Концентрация растворов: 5 × 10–4 (1), 2.5 × 10–3 (2), 10–2 (3), 10–3 (4), 2.5 × 10–3 (5), 5 × 10–3 (6), 7.5 × 10–3 моль/л (7).
Для изучения влияния испарения на поверхностное натяжение, каплю соответствующего раствора формировали на открытом воздухе.
Все эксперименты были выполнены при температуре 25°C.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Равновесные условия
Равновесные изотермы поверхностного натяжения σ, полученные для индивидуальных ПАВ, приведены на рис. 3.
Рис. 3.
Изотермы поверхностного натяжения водных растворов SDS (а) и LL (б). Пунктиром показана аппроксимация по уравнению Шишковского.
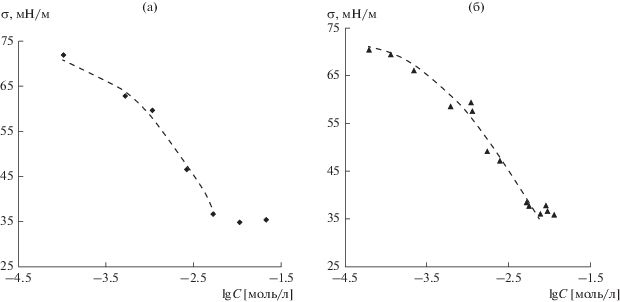
Начальные участки изотерм поверхностного натяжения были аппроксимированы с помощью уравнения Шишковского σ = σ0 – b ln(AC + 1), где σ0 – поверхностное натяжение воды, b и A – константы, подобранные методом наименьших квадратов. Были рассчитаны следующие адсорбционные параметры: максимальная адсорбция Гmax = b/nRT (R – универсальная газовая постоянная, T – абсолютная температура, n = 1 для LL и n = 2 для SDS), площадь на молекулу в насыщенном адсорбционном слое S1 = 1/ГmaxNA (NA – число Авогадро), рС20 = –lg C20 (C20 – концентрация, при которой σ понижается на 20 мН/м) (табл. 1). Рассчитанные по полученным экспериментальным данным характеристики адсорбции SDS на границе фаз раствор/воздух удовлетворительно согласуются с приводимыми в литературе, тогда как в случае LL имеются определенные расхождения. Причину отличий мы связываем с разными методами измерения поверхностного натяжения растворов LL. В работе [13], из которой мы взяли данные для табл. 1, поверхностное натяжение измеряли методом уравновешивания пластинки. При такой постановке эксперимента неизбежны изменения поверхностного натяжения вследствие испарения LL, поэтому авторы получили несколько завышенные значения σ и заниженные значения Гmax по сравнению с найденными нами.
Отметим, что, согласно данным на рис. 3б, постоянное минимальное значение поверхностного натяжения для растворов LL достигается при концентрации 7.5 × 10–3 моль/л (1.14 г/л), что несколько ниже приводимых в литературе данных по молекулярной растворимости LL. Возможно, тензиометрический метод может быть использован для обновления базы данных о растворимости в воде малорастворимых дифильных соединений.
Эксперименты со смешанными растворами SDS–LL выполняли так, как это обычно делается при изучении поведения смесей ПАВ [3, 13, 21, 22]. Готовили исходные растворы смесей общей концентрацией от 10–4 до 10–2 моль/л при мольной доле LL α = 0.25 и 0.5. Концентрация 10–2 моль/л для раствора индивидуального LL близка к соответствующей его растворимости в воде.
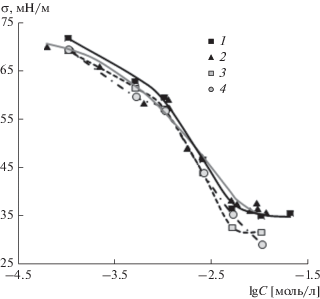
SDS и LL имеют близкую поверхностную активность в условиях равновесия, и смешанные растворы в домицеллярной области концентраций ведут себя практически так же, как и растворы индивидуальных веществ (рис. 4).
Рис. 4.
Изотермы поверхностного натяжения растворов SDS (1), LL (2) и их смешанных растворов с мольной долей LL α = 0.25 (3) и 0.5 (4).
Для расчета состава смешанных адсорбционных слоев и параметра взаимодействия между молекулами была применена модель Розена [1, 21]. Согласно этой модели рассматривается термодинамическое равновесие между объемом и поверхностным слоем, причем поверхностный адсорбционный слой считают регулярным раствором одного компонента смеси в другом. Тогда состав адсорбционного слоя (мольную долю LL Х1 в слое) можно рассчитать, численно решая следующее уравнение:
Рис. 5.
Зависимость мольной доли LL в адсорбционном слое на границе фаз раствор/воздух (X1) от мольной доли LL в растворе (α).
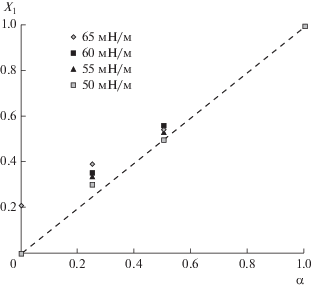
Таблица 2.
Параметр взаимодействия β между SDS и LL в смешанных адсорбционных слоях
| σ, мН/м | α = 0.25 | α = 0.5 |
|---|---|---|
| 65 | –1.8 | –1.4 |
| 60 | –0.6 | –0.5 |
| 55 | –0.6 | –0.4 |
| 50 | –0.8 | –0.7 |
Получено, что при всех указанных значениях поверхностного натяжения, т.е. в широкой области общей концентрации ПАВ, состав поверхностного слоя практически совпадает с составом раствора (пунктирная линия на рис. 5). Малые отрицательные значения параметра взаимодействия, по-видимому, указывают на выгодность образования смешанного адсорбционного слоя вследствие экранирования электростатического отталкивания одноименно заряженных сульфатных групп молекулами LL. В результате формируется более плотный смешанный адсорбционный слой, который способствует более сильному снижению поверхностного натяжения при высоких концентрациях ПАВ (рис. 4).
Динамическое поверхностное натяжение при малых временах формирования поверхности
Образование новых поверхностей в технологических процессах, как правило, происходит в условиях, далеких от равновесных. В этом случае поверхностные свойства систем определяются величиной динамического поверхностного натяжения, которое во многом обусловлено кинетикой адсорбции ПАВ. Известны различные механизмы кинетики адсорбции. Первый из них – диффузионный, когда скорость процесса лимитируется диффузией ПАВ из объема раствора в приповерхностный слой. Второй – энергетический, при котором лимитирующей стадией является преодоление молекулами ПАВ энергетического барьера при переходе из этого слоя на поверхность. И, наконец, возможен смешанный механизм, когда скорости обоих процессов соизмеримы. При малых временах формирования поверхности, как правило, реализуется диффузионный механизм процесса адсорбции. Следует, однако, подчеркнуть, что имеющиеся диффузионные теории не учитывают переход растворенных веществ через поверхность в газообразную фазу, что предопределяет их ограниченную применимость для растворов легколетучих ПАВ [14].
На рис. 6 представлены зависимости поверхностного натяжения водных растворов LL и SDS разной концентрации от времени, измеренные методом максимального давления в пузырьке воздуха при времени формирования поверхности от 20 мс до 20 с.
Рис. 6.
Динамическое поверхностное натяжение воды (1) и водных растворов LL (а) и SDS (б) в зависимости от времени формирования пузырька воздуха. Концентрация растворов LL: 5.6 × 10–5 (2), 1.9 × 10–4 (3), 5.6 × 10–4 (4), 2.5 × × 10–3 (5), 5.0 × 10–3 (6), 7.1 × 10–3 моль/л (7); концентрация растворов SDS: 10–4 (2), 5 × 10–4 (3), 10–3 (4), 2.2 × 10–3 (5), 3.8 × 10–3 (6), 5 × 10–3 (7), 8 × 10–3 (8), 10–2 (9), 2 × 10–2 моль/л (10).
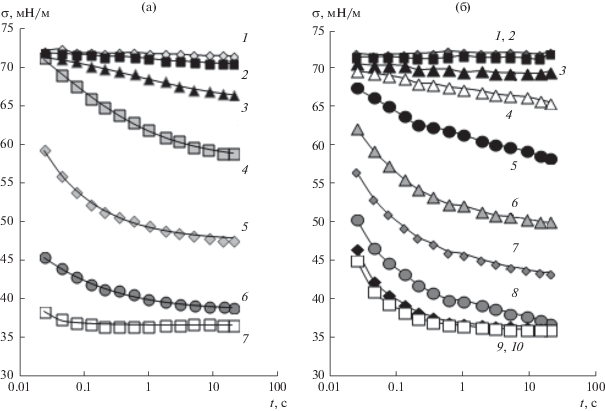
Поверхностное натяжение растворов LL, измеренное в динамических условиях, заметно снижается при увеличении времени формирования поверхности от 20 мс до 10 с и в дальнейшем практически не изменяется. Значения поверхностного натяжения, измеренного при времени формирования поверхности 20 с, практически совпадают с равновесными значениями, полученными методом висящей капли. Обращает на себя внимание тот факт, что при концентрации LL выше 2.5 × 10–3 моль/л происходит заметное уменьшение поверхностного натяжения уже при времени формирования поверхности 20 мс (начальная точка на зависимостях, представленных на рис. 6). Сопоставление величин σ, измеренных для индивидуальных растворов LL и SDS при малых временах формирования поверхности (40 мс) показывает, что в этих условиях LL снижает поверхностное натяжение сильнее по сравнению с SDS (рис. 7).
Рис. 7.
Концентрационные зависимости поверхностного натяжения растворов LL (1) и SDS (2), полученные при времени формирования поверхности 40 мс.
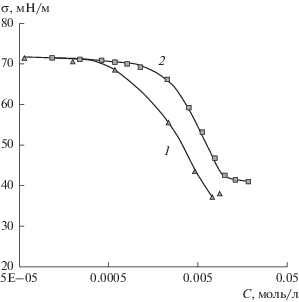
Сопоставление динамического поверхностного натяжения индивидуальных и смешанных растворов ПАВ показывает, что в домицеллярной области, при общей концентрации ПАВ 1 × 10–3 и 2.5 × 10–3 моль/л, зависимости поверхностного натяжения от времени для смешанных растворов близки к соответствующим зависимостям для растворов LL (рис. 8а, 8б). Можно предположить, что при малых временах адсорбционный слой содержит, в основном, молекулы LL. Адсорбция LL преобладает благодаря большему значению его коэффициента диффузии, а также большему градиенту концентрации этого ПАВ вследствие его испарения. Оба фактора способствуют увеличению диффузионного потока LL из объема к поверхности по сравнению с SDS. Рассчитанные по уравнению Эйнштейна–Смолуховского коэффициенты диффузии LL и SDS составляют 5.29 × 10–10 и 4.52 × 10–10 м2/с соответственно.
Рис. 8.
Зависимости поверхностного натяжения от времени формирования поверхности растворов SDS (1), LL (2) и их смесей при α = 0.25 (3) и 0.5 (4) и общей концентрации ПАВ 1 × 10–3 (а), 2.5 × 10–3 (б), 7.5 × 10–3 моль/л (в).
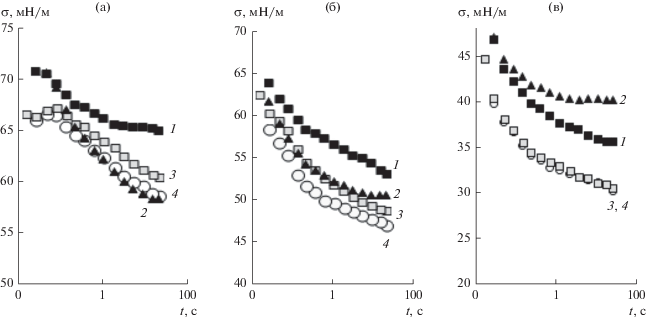
При общей концентрации ПАВ, близкой к критической концентрации мицеллообразования (ККМ) SDS (7.5 × 10–3 моль/л), наблюдается синергетический эффект: поверхностное натяжение смешанного раствора достигает более низкого значения по сравнению с поверхностным натяжением растворов индивидуальных ПАВ такой же концентрации (рис. 8в). Последний результат согласуется с данными измерений равновесного поверхностного натяжения в области больших концентраций ПАВ (рис. 4).
Таким образом, несмотря на близость поверхностных свойств растворов SDS, LL и их смесей в равновесных условиях, измерения поверхностного натяжения при малых временах формирования поверхности (в динамических условиях) демонстрируют более высокую поверхностную активность LL по сравнению с SDS. При этом добавки LL к водному раствору SDS приводят к более быстрому снижению поверхностного натяжения в динамических условиях. Полученный результат важен с практической точки зрения при составлении композиций на основе ПАВ для оптимизации процессов, в которых межфазная поверхность формируется быстро, за время порядка нескольких секунд и меньше (растекание капель, нанесение покрытий, пенообразование, струйная печать).
Испарение капель растворов смесей додецилсульфата натрия с линалоолом
С точки зрения практического использования смесей SDS–LL важно знать, как изменяется поверхностное натяжение при контакте растворов с открытой атмосферой, когда происходит их испарение. Можно считать, что SDS является практически нелетучим соединением, поэтому изменение состава смешанного раствора происходит за счет испарения воды и десорбции LL в газовую фазу. Измерения поверхностного натяжения при испарении капель проводили методом висящей капли в лабораторных условиях в открытой атмосфере. Были выбраны растворы SDS трех концентраций: 5 × 10–4 моль/л (поверхностное натяжение воды снижено на 8 мН/м, что соответствует образованию разреженного адсорбционного слоя), 2.5 × 10–3 моль/л (область формирования насыщенного монослоя на границе фаз вода/воздух) и 10–2 моль/л (концентрация выше ККМ). Измерения проводили для растворов SDS в чистой воде и в двух растворах LL (2.5 × 10–3 и 5 × 10–3 моль/л) в течение 15 мин, поскольку при бóльших временах капли сильно уменьшаются в объеме вследствие испарения, что затрудняет обработку данных.
Начальные величины поверхностного натяжения, измеренные при испарении капель водных растворов SDS в отсутствие LL (рис. 9а), практически совпадают с соответствующими величинами, полученными в закрытой камере. Последующее уменьшение поверхностного натяжения связано с уменьшением объема капли и повышением вследствие этого концентрации SDS. Исключение составляют растворы концентрацией выше ККМ, поверхностное натяжение которых не изменяется при испарении капли. Это – очевидный результат, поскольку с ростом концентрации ПАВ выше ККМ поверхностное натяжение практически не изменяется.
Рис. 9.
Изменение поверхностного натяжения при испарении капель растворов SDS (а) и LL (б). Концентрация рас-творов SDS: 5 × 10–4 (1), 2.5 × 10–3 (2), 10–2 моль/л (3). Концентрация растворов LL: 2.5 × 10–3 (1), 5 × 10–3 (2), 10–2 моль/л (3).
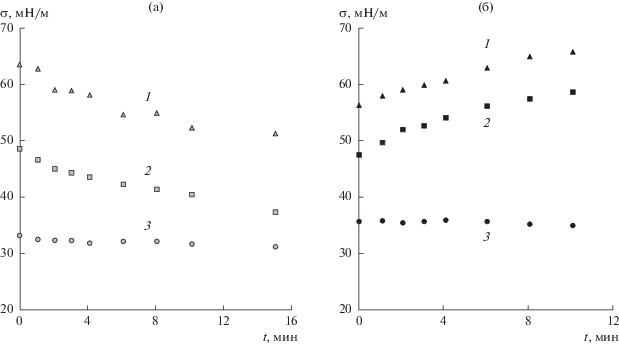
В отличие от капель растворов нелетучего SDS испарение капель растворов LL приводит к росту поверхностного натяжения (рис. 9б). Несмотря на то, что давление насыщенных паров у воды выше, чем у LL (23.77 и 0.17 мм рт. ст. при 25°С для воды и LL соответственно [23]), концентрация LL в поверхностном слое повышена вследствие адсорбции, и совместное испарение воды и летучего ПАВ вызывает изменение состава поверхностного слоя. Концентрация LL в поверхностном слое уменьшается, что приводит к заметному росту поверхностного натяжения.
На рис. 10 приведены данные, относящиеся к испарению капель растворов смесей SDS–LL разной концентрации. Для сопоставления на каждом рисунке представлены соответствующие зависимости, полученные при испарении растворов SDS в воде таких же концентраций. На рис. 10а и 10б видно, что через определенное время t* (табл. 3) значения поверхностного натяжения смешанных растворов начинают совпадать со значениями поверхностного натяжения растворов SDS в отсутствие LL. При этом наблюдается тенденция к увеличению t* с ростом концентрации LL и его доли в смеси ПАВ.
Рис. 10.
Изменение поверхностного натяжения растворов SDS (1) и смесей LL–SDS (2, 3). Концентрация SDS: 5 × 10–4 (а), 2.5 × 10–4 (б) и 1 × 10–2 моль/л (в); концентрация LL в смешанных растворах: 2.5 × 10–3 (2) и 5 × 10–3 моль/л (3).
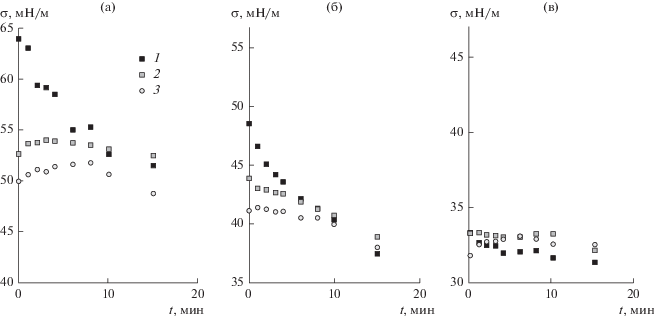
Таблица 3.
Время t*, при котором поверхностное натяжение растворов смесей ПАВ начинает совпадать с поверхностным натяжением растворов SDS
| CSDS, M | CLL, M | Мольное отношение LL : SDS |
Мольная доля LL |
Время t*, мин |
|---|---|---|---|---|
| 5 × 10–4 | 2.5 × 10–3 | 5 | 0.83 | 10 |
| 2.5 × 10–3 | 2.5 × 10–3 | 1 | 0.50 | 4 |
| 5 × 10–4 | 5 × 10–3 | 10 | 0.91 | >15 |
| 2.5 × 10–3 | 5 × 10–3 | 2 | 0.67 | 8 |
Можно сделать вывод, что сначала образуется смешанный адсорбционный слой SDS и LL (в пределах первой минуты формирования капли). Затем происходит испарение LL, и через определенное время поверхностное натяжение смешанного раствора начинает определяться исключительно адсорбцией SDS. В отличие от растворов индивидуальных ПАВ, поверхностное натяжение смешанных растворов со временем практически не изменяется. Можно предположить, что имеют место два процесса, противоположным образом влияющие на величину поверхностного натяжения: 1) изменение объема капли за счет испарения воды и вследствие этого повышение концентрации ПАВ (снижение поверхностного натяжения) и 2) испарение LL, вызывающее повышение поверхностного натяжения. Согласно полученным данным, эти два процесса практически уравновешивают друг друга с точки зрения их влияния на поверхностное натяжение.
Описанные выше эффекты относятся к домицеллярной области концентраций ПАВ. При концентрации SDS выше ККМ добавки LL практически не влияют на равновесное поверхностное натяжение растворов даже в условиях испарении капель (рис. 10в).
Схема совместной адсорбции додецилсульфата натрия и линалоола на границе водный раствор/воздух
На основании проведенных измерений поверхностного натяжения растворов при разных способах формирования межфазной поверхности можно предложить схему совместной адсорбции SDS и LL на границе фаз водный раствор/воздух, представленную на рис. 11.
Рис. 11.
Схема совместной адсорбции SDS и LL на границе фаз водный раствор/воздух при малых временах формирования поверхности (1), при установлении равновесия поверхностного слоя с объемами контактирующих фаз (2) и в условиях испарения (3).
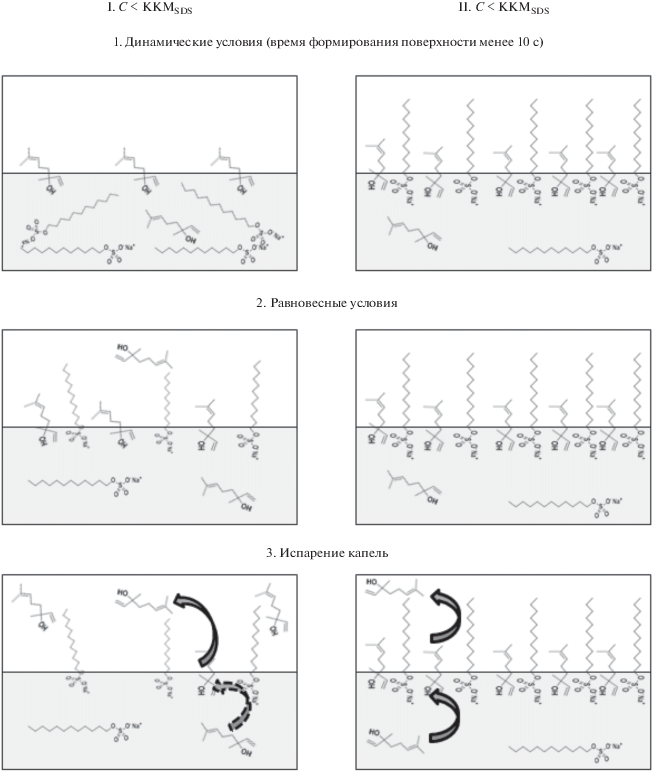
I. В домицеллярной области концентраций SDS совместная адсорбция SDS и LL протекает следующим образом.
1. При малых временах формирования межфазной поверхности водный раствор/воздух адсорбционный слой состоит преимущественно из LL.
2. По мере достижения равновесия поверхностно-активные анионы SDS встраиваются в адсорбционный слой, вытесняя часть молекул LL в газовую фазу. Состав смешанного адсорбционного слоя соответствует составу раствора.
3. Испарение капель смешанных растворов приводит к снижению содержания LL в адсорбционном слое, поверхностные свойства капель смешанных растворов через определенное время начинают определяться адсорбцией SDS. Поток LL из объема раствора не компенсирует уменьшение концентрации LL в поверхностном слое вследствие испарения.
II. В области концентраций SDS выше ККМ при его совместной адсорбции с LL характерно следующее поведение системы.
1. На начальной стадии формирования межфазной поверхности наблюдается синергетический эффект снижения поверхностного натяжения за счет формирования более плотного адсорбционного слоя по сравнению со слоями индивидуальных компонентов. Это обусловлено экранированием молекулами LL электростатического отталкивания одноименно заряженных анионных групп SDS.
2. Со временем синергетический эффект ослабевает, но сохраняется и в равновесных условиях.
3. Испарение капель смешанных растворов происходит при неизменном поверхностном натяжении, которое практически совпадает с поверхностным натяжением растворов индивидуальных веществ. Испарение LL из поверхностного слоя компенсируется его адсорбцией из раствора.
ЗАКЛЮЧЕНИЕ
Изучены водные растворы смесей традиционного ПАВ SDS и летучего ПАВ LL. В равновесных условиях эти два ПАВ проявляют схожую поверхностную активность, и их смешанные растворы ведут себя так же, как растворы индивидуальных веществ. Однако при малых временах формирования поверхности LL сильнее снижает поверхностное натяжение, чем SDS, и величины динамического поверхностного натяжения смешанных растворов контролируются LL. Напротив, в условиях испарения концентрация легколетучего LL в поверхностном слое уменьшается, и поверхностные свойства раствора определяются адсорбцией SDS.
Выявленные особенности поведения смесей ПАВ открывают перспективы использования таких смесей в процессах, при которых важно снизить поверхностное натяжение на быстрой стадии формирования новой поверхности и не требуется присутствия ПАВ на последующих стадиях. Например, при струйной печати формирование капли происходит за время порядка микросекунд, и для обеспечения оптимального выброса капель необходимо, как следует из практики, чтобы при временах формирования поверхности 50 мс поверхностное натяжение чернил составляло около 55 мН/м. В случае традиционных ПАВ такие показатели могут быть достигнуты только за счет применения значительных количеств ПАВ, которые остаются в печатном продукте, ухудшая его свойства. В случае летучих ПАВ обе указанные выше проблемы могут быть успешно решены. Поэтому полученные данные имеют перспективу применения при создании нового поколения чернил для струйной печати. Изучение влияния смесей традиционного и летучего ПАВ на смачивание и кинетику испарения капель является отдельной интересной научной задачей.
Список литературы
Rosen M.J., Kunjappu J.T. Surfactants and Interfacial Phenomena. 4th Ed. Hoboken, New Jersey: John Wiley & Sons, 2012.
Rodriguez A., del Mar Graciani M., Moreno-Vargas J., Moya M.L. // J. Phys. Chem. 2008. V. 112. P. 11942.
Соболева О.А., Бадун Г.А., Сумм Б.Д. // Коллоид. журн. 2006. Т. 68. С. 255.
Задымова Н.М., Цикурина Н.Н., Руделев Д.С., Потешнова М.В. // Коллоид. журн. 2004. Т. 66. С. 175.
Абрамзон А.А., Гаевой Г.М. Поверхностно-активные вещества. Л.: Химия, 1979.
Jakubowska A. // J. Colloid Interface Sci. 2010. V. 346. P. 398.
Paul B.C., Islam S.S., Ismail K. // J. Phys. Chem. B. 1998. V. 102. P. 7807.
Соболева О.А., Пронченко К.С., Чернышева М.Г., Бадун Г.А. // Журн. физ. химии. 2012. Т. 86. С. 460.
Chernysheva M.G., Ivanov R.A., Soboleva O.A., Badun G.A. // Colloids Surf. A. 2013. V. 436. P. 1121.
Friberg S.E., Aikens P.A. // J. Colloid Interface Sci. 2009. V. 333. P. 599.
Chen X.-W., Chen Y.-J., Wang J.-M., Guo J., Yin S.-W., Yang X.-Q. // Food Chem. 2017. V. 221. P. 1491.
Pereira I., Zielinska A., Ferreira N.R., Silva A.M., Souto E.B. // Int. J. Pharm. 2018. V. 549. P. 261.
Lewandowski A., Szymczyk K. // Adsorption. 2019. V. 25. P. 301.
Soboleva O.A., Protsenko P.V., Korolev V.V., Viktorova J., Yakushenko A., Kudla R., Gutmann J.S., Tsarkova L.A. // ACS Appl. Mater. Interfaces. 2019. V. 11. P. 40988.
CLH Report for Linalool. https://www.google.com/ url?sa=t&rct=j&q=&esrc=s&source=web&cd=3&cad= rja&uact=8&ved=2ahUKEwiLq7KP06jnAhVgDGMBHeOuBjAQFjACegQIBBAB&url=https%3A%2F%- 2Fecha.europa.eu%2Fdocuments%2F10162%2F51b-5de87-ca6d-45f1-9c46-4717698bd049&usg=AOvVaw-2TRCnnzcbXXcu-Zh8K4Gdn
Rak D., Sedlák M. // J. Phys. Chem. B. 2019. V. 123. P. 1365.
Bradbury R., Penfold J., Thomas R.K., Tucker I.M., Petkov J.T., Jones C. // J. Colloid Interface Sci. 2013. V. 403. P. 84.
Bradbury R., Penfold J., Thomas R.K., Tucker I.M., Petkov J.T., Jones C. // Langmuir. 2013. V. 29. P. 3361.
Penfold J., Thomas R.K., Bradbury R., Tucker I.M., Petkov J.T., Jones C.W. // Colloids Surf. A. 2017. V. 520. P. 178.
Bradbury R., Penfold J., Thomas R.K., Tucker I.M., Petkov J.T., Jones C. // J. Colloid Interface Sci. 2016. V. 466. P. 220.
Rosen M.J. // Phenomena in Mixed Surfactant Systems. ACS Symp. Ser. Washington, DC: Am. Chem. Soc. 1986. V. 311. P. 349.
Писаев И.В., Соболева О.А., Иванова Н.И. // Коллоид. журн. 2009. Т. 71. С. 256.
https://pubchem.ncbi.nlm.nih.gov.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал