Коллоидный журнал, 2021, T. 83, № 1, стр. 66-74
Межфазное разделение компонентов органической фазы в системах с водными коллоидными растворами ди(2-этилгексил)фосфата натрия
В. И. Кузьмин 1, М. Н. Лескив 1, И. В. Петерсон 1, Д. В. Кузьмин 1, Н. В. Гудкова 1, *, А. И. Булавченко 2
1 Институт химии и химической технологии СО РАН
660036 Красноярск, ул. Академгородок, 50, стр. 24, Россия
2 Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, просп. Академика Лаврентьева, 3, Россия
* E-mail: navlla@mail.ru
Поступила в редакцию 03.02.2020
После доработки 13.07.2020
Принята к публикации 21.08.2020
Аннотация
Изучено межфазное разделение компонентов экстрагентов на основе ди(2-этилгексил)фосфорной кислоты (ди-2ЭГФК) в толуоле и смеси ди-2ЭГФК и триоктиламина в толуоле при обработке водными растворами гидроксида натрия с образованием органической фазы и водного коллоидного раствора натриевой соли ди-2ЭГФК. Найдены условия выделения фаз практически чистой ди-2ЭГФК и толуола, ди-2ЭГФК и раствора триоктиламина в толуоле. Коллоидные водные растворы изучены кондуктометрическим методом, а также методами динамического рассеяния света и 1Н ЯМР-спектроскопии. Данные системы перспективны для использования в гидрометаллургии для улучшения показателей извлечения металлов и их концентрирования в реэкстрактах.
ВВЕДЕНИЕ
Соли щелочных металлов ряда органических кислот являются сильными поверхностно-активными веществами и могут образовывать в органических растворителях и воде обратные и прямые мицеллы соответственно. В двухфазных системах при одновременном присутствии органического растворителя и воды такие соли преимущественно переходят в одну из фаз. Процесс образования такого коллоидного раствора нередко сопровождается значительным поглощением второго растворителя (солюбилизацией органического растворителя или “обратной” солюбилизацией воды). Такие системы хорошо исследованы и широко используются на практике для различных целей. Перспективным направлением их практического применения, на наш взгляд, может быть разделение органической фазы на компоненты при жидкостной экстракции с использованием органических кислот.
Рассмотрим эту проблему более детально. Управление современными процессами экстракции в гидрометаллургии осуществляется за счет регулирования состава водных растворов на стадиях экстракции, реэкстракции или промывки экстрактов. В этих системах состав органической фазы изменяется лишь в результате обратимого межфазного переноса в органическую фазу компонентов водной фазы и в непрерывном цикле экстракция–реэкстракция не претерпевает изменений. В какой-то мере исключением можно считать трехфазную экстракцию [1–3], продемонстрированную в лабораторных экспериментах, когда при извлечении металлов происходит расслаивание органического экстракта на две фазы.
Ранее нами была рассмотрена возможность управления процессами жидкостной экстракции путем изменения состава органической фазы на стадиях экстракции и реэкстракции металлов для систем с органическими кислотами на примере бис(2,4,4-триметилпентил)дитиофосфиновой кислоты (Cyanex 301) [4, 5]. Разделение органической фазы на составные компоненты достигалось ее обработкой щелочными водными растворами с переводом органической кислоты в натриевую форму с образованием водного коллоидного раствора. Далее, после разрушения тонких эмульсий центрифугированием, органическую кислоту выделяли из этой фазы подкислением раствора. В наиболее простом случае таким путем можно разделить органическую кислоту и углеводородный растворитель. Это обеспечивает возможность в непрерывном процессе экстракции применять на стадии извлечения металлов концентрированный экстрагент, а на стадии реэкстракции – разбавленный, что позволяет повысить эффективность процесса. Существенно больший эффект изменения активности экстрагента может быть достигнут при разделении смесей органических кислот и аминов по межфазной реакции (1). В этом случае активности выделяемой органической кислоты (HA) и ее соли с амином (R3N ∙ НА) различаются на несколько порядков.
(1)
$\begin{gathered} {{{\text{R}}}_{{\text{3}}}}{\text{N}} \cdot {\text{Н}}{{{\text{А}}}_{{({\text{о}})}}} + {\text{NaO}}{{{\text{H}}}_{{({\text{в}})}}} \to \\ \to {{{\text{R}}}_{{\text{3}}}}{{{\text{N}}}_{{({\text{о}})}}} + {\text{Na}}{{{\text{A}}}_{{({\text{к - в}})}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $Здесь нижние индексы (о), (в) и (к-в) обозначают принадлежность компонента реакции к органической, водной или коллоидной водной фазе соответственно.
Предварительные эксперименты по разделению экстрагента на отдельные компоненты выявили ряд проблем. Одна из важных из них – отрицательная роль солюбилизации, за счет которой уменьшаются коэффициенты разделения компонентов органической фазы. В настоящей работе рассмотрены особенности мицеллообразования и межфазного разделения компонентов органической фазы для системы с известным и широко применяемым на практике экстрагентом – ди(2-этилгексил)фосфорной кислотой (ди-2ЭГФК), а также солью, образуемой ею с триоктиламином в органическом растворителе.
Коллоидообразование при экстракции металлов с помощью ди-2ЭГФК и ряда других катионообменных экстрагентов достаточно хорошо известно и изучено. В зависимости от условий проведения процесса могут образовываться как обратные, так и прямые мицеллы, а также микроэмульсии.
Образование обратных мицелл непосредственно связано с ассоциацией продуктов экстракции в органической фазе и существенно влияет на кинетику извлечения металлов и экстракционное равновесие, что следует учитывать при описании систем. В частности, этот вопрос рассмотрен при анализе процессов извлечения щелочноземельных и редкоземельных металлов, а также циркония с помощью ди-2ЭГФК в смесях толуола и октанола [6, 7]. Установлено, что коллоидообразование в органической фазе приводит к снижению селективности процесса и заметному росту емкости экстрагента. При этом также наблюдается извлечение в органическую фазу солей, в особенности хлоридов, при катионообменном характере извлечения металлов. По мнению авторов, выявленные аномалии обусловлены солюбилизацией, а также, вероятно, образованием смешанных комплексных соединений.
Прямая обработка фосфорорганических кислот водными растворами щелочей используется в технологии экстракционного разделения редкоземельных металлов и предназначена для последующего глубокого насыщения экстрагента разделяемыми металлами. В этом случае в определенных условиях могут образовываться прямые мицеллы и микроэмульсии, что приводит к потерям как экстрагента, так и разбавителя из-за солюбилизации [8–11]. Для предотвращения этих нежелательных процессов предложено при омылении экстрагентов использовать концентрированные щелочные растворы [8]. В этих условиях наблюдается образование обратных мицелл. Потерь экстрагента, как установили авторы работы [8], можно также избежать при добавлении в водный раствор некоторых неорганических солей (NaCl, NaNO3, Na2SO4).
Большой цикл работ по детальному исследованию образования микроэмульсий в системах с натриевой солью ди-2ЭГФК (NaA) выполнен в РХТУ им. Д.И. Менделеева [12–16]. Микроэмульсии предложено использовать в качестве реагента для извлечения металлов из частиц твердой фазы (метод микроэмульсионного выщелачивания). Этот новый метод предназначен для извлечения металлов из техногенного сырья (концентратов, шламов, зол, пылей и т.д.) путем его контакта с микроэмульсией, содержащей экстрагент, что позволяет сочетать выщелачивание и экстракцию в одном процессе.
Целью настоящей работы являлось исследование возможности межфазного разделения компонентов органической фазы в двухфазной системе с коллоидным водным раствором натриевой соли ди-2ЭГФК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали соляную кислоту, гидроксид натрия и толуол, квалификации “х. ч.” и “ч. д. а.”, органический экстрагент ди-2ЭГФК реагентной чистоты (Bayer, Германия), дейтерированные воду (99.9%) и бензол.
Процесс разделения экстрагента на компоненты проводили при температуре 20°С, приводя в контакт органическую фазу (органический экстрагент в разбавителе) с водными растворами гидроксида натрия, обычно при равном отношении объемов водного (В) и органического (О) растворов (О : В = 1 : 1), если это не оговорено отдельно. Время контакта фаз составляло 3–5 мин. Для разделения фаз и разрушения тонких эмульсий использовали центрифугирование при относительном ускорении около 1000g.
Выделение катионообменного экстрагента из коллоидного водного раствора осуществляли подкислением раствора соляной кислотой при ее небольшом избытке относительно стехиометрического количества (pH конечной водной фазы был равен 1–2). Это обеспечивало количественный переход натриевой соли ди-2ЭГФК в кислотную форму с образованием органической фазы экстрагента и водного раствора хлорида натрия. На этой стадии расслаивание водной и органической фаз происходит без затруднений и не требует центрифугирования.
Для проведения 1Н ЯМР-исследований коллоидных растворов натриевых солей ди-2ЭГФК готовили серию водных растворов с концентрацией 0.01–0.40 моль/л, смешивая соответствующие стехиометрические количества растворов органической кислоты и гидроксида натрия в дейтерированной воде при равном отношении объемов водной и органической фаз. 1H ЯМР-спектры (600.13 МГц, температура – 25°C) регистрировали на спектрометре Bruker Avance III 600.
При кондуктометрических исследованиях готовили водные растворы натриевой соли ди-2ЭГФК с концентрацией от 0.002 моль/л до примерно 0.2 моль/л. В случае тройных систем натриевая соль экстрагента–вода–толуол каждый раствор NaA выдерживали в контакте с толуолом для достижения равновесия в мицеллярной системе, далее коллоидную водную фазу отделяли центрифугированием. Электропроводность растворов оценивали с использованием лабораторного анализатора жидкости Анион 4100 (Инфраспак-Аналит, Россия).
Эффективный гидродинамический диаметр мицелл определяли методом динамического рассеяния света (фотон-корреляционной спектроскопии) на спектрометре NanoOmni (Brookhaven, США). Автокорреляционную функцию обрабатывали с использованием мономодального анализа по методу кумулянтов. Перед измерением растворы очищали от пыли пятикратным циклическим фильтрованием через мембранный ПТФЭ-фильтр с диаметром пор 0.2 мкм (Sartorius, Германия) непосредственно в измерительную ячейку из стекла (Eppendorf, Германия). Мощность твердотельного лазера с длиной волны 640 нм составляла 35 мВт, рассеянные частицами фотоны детектировались под углом 90° к источнику излучения. Время накопления фотонов в одном измерении составляло 10–30 с; коэффициент диффузии определяли как среднее из 20–30 измерений. Эффективный гидродинамический диаметр рассчитывался из коэффициента диффузии по формуле Стокса–Эйнштейна.
Содержание органической кислоты в образующихся фазах оценивали титрованием соответствующей аликвоты в спирте раствором NaOH в присутствии фенолфталеина.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Система раствор ди-2ЭГФК в толуоле/водный раствор NaOH
При контакте растворов ди-2ЭГФК в толуоле с водными щелочными растворами формируются достаточно устойчивые эмульсии. Поэтому для разделения фаз использовали центрифугирование. Межфазное распределение натриевой соли ди-2ЭГФК в этой системе зависит, в первую очередь, от мольного соотношения органической кислоты (или ее соли с амином) и взятого для нейтрализации гидроксида натрия. При недостатке щелочи образующаяся натриевая соль частично остается в органической фазе. Это обусловлено образованием сольватированной избытком экстрагента гидрофобной соли NaA ∙ HA по реакции
(2)
${{({\text{НА}})}_{{2({\text{o}})}}} + {\text{NaO}}{{{\text{H}}}_{{({\text{в}})}}} \to {\text{NaА}} \cdot {\text{Н}}{{{\text{А}}}_{{({\text{o}})}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$При увеличении количества гидроксида натрия и снижении доли свободной кислоты несольватированная соль NaA переходит в водную фазу с образованием прямых мицелл в соответствии с реакцией
(3)
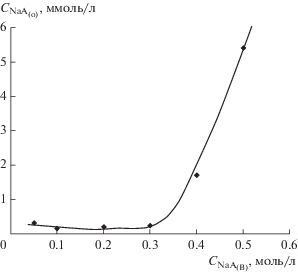
${\text{NaА}} \cdot {\text{Н}}{{{\text{А}}}_{{({\text{o}})}}} + {\text{NaO}}{{{\text{H}}}_{{({\text{в}})}}} \to 2{\text{Na}}{{{\text{А}}}_{{({\text{к - в}})}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$При достижении стехиометрического отношения кислота/щелочь натриевая соль ди-2ЭГФК практически нацело (99%, при равном отношении объемов исходных растворов О : В = 1 : 1) переходит в коллоидный водный раствор по реакции (3), а ее остаточное содержание в органической фазе не превышает 1 × 10–4–5 × 10–3 моль/л, в зависимости от содержания соли NaA в фазе коллоидного раствора. Изотерма межфазного распределения этой соли приведена на рис. 1.
Из полученных данных следует, что до концентрации соли NaA в коллоидном растворе равной приблизительно 0.3 моль/л ее содержание в фазе толуола изменяется слабо и составляет величину 1 × 10–4–2 × 10–4 моль/л. Это свидетельствует о постоянстве равновесной концентрации в коллоидном растворе соли NaA, не входящей в состав мицелл (ККМ остается постоянной). При увеличении содержания NaA в водном растворе свыше 0.3–0.4 моль/л наблюдается резкий рост ее концентрации в органической фазе, что указывает на значительные изменения в коллоидном растворе в этих условиях. Одной из причин этого является существенная перестройка структуры раствора с возможным появлением в нем, наряду со сферическими мицеллами, везикул, образование которых натриевыми солями ди-2ЭГФК исследовано в работах [17, 18].
Тем не менее, подавляющая часть NaA остается в фазе коллоидного раствора, и для концентрации соли 0.5 моль/л при отношении О : В = 1 : 1 эта величина составляет около 99%.
Экстрагент из этой фазы легко выделяется при подкислении, например, соляной кислотой по реакции
(4)
${\text{2Н}}_{{{\text{(в)}}}}^{ + } + {\text{2Na}}{{{\text{А}}}_{{({\text{к - в}})}}} \to {{({\text{НА}})}_{{{\text{2}}({\text{o}})}}} + {\text{2Na}}_{{({\text{в}})}}^{ + }.$При этом образуются, как правило, не 100% ди-2ЭГФК, а ее растворы в толуоле, что обусловлено солюбилизацией органического растворителя коллоидным раствором. Как следует из данных рис. 2, с ростом концентрации NaA в коллоидном водном растворе содержание ди-2ЭГФК в выделенном при подкислении продукте снижается за счет увеличения доли толуола. Так, из сильно разбавленных растворов натриевой соли ди-2ЭГФК (концентрация 0.02 моль/л и менее) при подкислении выделяется концентрированный раствор с содержанием ди-2ЭГФК 2.7–2.9 моль/л (90–95%). По мере роста концентрации NaA до 0.2–0.3 моль/л содержание ди-2ЭГФК в этом продукте снижается до примерно 1.7–1.5 моль/л за счет солюбилизированного толуола, а при переходе к концентрированным растворам NaA (до 1.5 моль/л) наблюдается постепенное и менее значительное снижение содержание ди-2ЭГФК до 1–1.1 моль/л.
Рис. 2.
Влияние концентрации ди(2-этилгексил)фосфата натрия (NaА) в коллоидном водном растворе на содержание экстрагента (HA) в продукте, выделенном из подкисленного раствора.

Невысокое содержание растворителя (толуола) относительно NaA в коллоидном растворе в области концентраций NaA 0.02–0.3 моль/л очевидно свидетельствует о высокой доле растворенной соли ди-2ЭГФК, не связанной с мицеллами, содержащими толуол.
В технологических процессах экстракции металлов использование концентрированных растворов ди-2ЭГФК осложнено достаточно высокой вязкостью экстрагента. Видимо, повышать ее концентрацию более чем до 1.8–2.2 моль/л нецелесообразно. Такой продукт, в соответствии с приведенными выше данными, можно получить обработкой разбавленного раствора экстрагента стехиометрическим количеством гидроксида натрия с концентрацией 0.15–0.2 моль/л в водном растворе при последующем подкислении коллоидного водного раствора.
Система соль триоктиламина и ди-2ЭГФК в толуоле/водный раствор NaOH
Значительный практический интерес представляет разделение смесей ди-2ЭГФК с третичным амином. Реализация этого процесса с получением индивидуальных растворов ди-2ЭГФК и триоктиламина позволит, как было сказано выше, существенным образом изменить условия проведения извлечения и реэкстракции металлов, используя на стадии экстракции ди-2ЭГФК, а на стадии реэкстракции – ее смесь с триоктиламином, что достигается путем добавления к экстракту амина.
Показано, что, как и в случае с растворами ди-2ЭГФК, щелочная обработка смесей ди-2ЭГФК с триоктиламином приводит к образованию коллоидного водного раствора, содержащего преимущественно натриевую соль ди-2ЭГФК, и раствора триоктиламина в толуоле. При этом для полного перевода ди-2ЭГФК в водную фазу необходимо также добавлять стехиометрическое количество гидроксида натрия.
Таблица 1.
Оценка разделения компонентов органической фазы в системе ди-2ЭГФК–триоктиламин–толуол при обработке исходного экстрагента щелочным раствором (отношение О : В = 1 : 1) и подкислении образующегося коллоидного водного раствора NaA
| Раствор | Состав раствора | |||||
|---|---|---|---|---|---|---|
| Исходный экстрагент | CНА, моль/л | 0.05 | 0.1 | 0.2 | 0.3 | 0.4 |
| ${{C}_{{{{{\text{R}}}_{{\text{3}}}}{\text{N}}}}}$, моль/л | 0.05 | 0.1 | 0.2 | 0.3 | 0.4 | |
| Cтолуол, моль/л | 9.06 | 8.70 | 8.00 | 7.28 | 6.57 | |
| ${{C}_{{{{{\text{R}}}_{{\text{3}}}}{\text{N}}}}}$/Cтолуол | 0.0055 | 0.0115 | 0.025 | 0.0412 | 0.0609 | |
| Продукт после подкисления коллоидного раствора NaA | CНА, моль/л | 2.34 | 1.7 | 1.56 | 1.42 | 1.34 |
| ${{C}_{{{{{\text{R}}}_{{\text{3}}}}{\text{N}}}}}$, моль/л | – | 0.014 | 0.046 | 0.087 | 0.17 | |
| Cтолуол, моль/л | 2.13 | 4.07 | 4.38 | 4.65 | 4.57 | |
| ${{C}_{{{{{\text{R}}}_{{\text{3}}}}{\text{N}}}}}$/Cтолуол | – | 0.0034 | 0.011 | 0.019 | 0.038 | |
| EНА, % | >98 | >98 | >98 | >98 | >98 | |
| Eтолуол, % | 0.5 | 2.75 | 7.02 | 13.5 | 20.7 | |
| ${{E}_{{{{{\text{R}}}_{{\text{3}}}}{\text{N}}}}}$, % | – | 0.82 | 2.9 | 6.12 | 12.7 | |
Рис. 3.
Влияние концентрации ди(2-этилгексил)фосфата натрия (NaА) в исходном растворе на содержание экстрагента (HA) и триоктиламина (R3N) в продукте, выделенном из подкисленного раствора.

Результаты анализа растворов на различных стадиях разделения экстрагента на компоненты приведены в табл. 1. Видно, что, как и в предыдущем случае, в области низких концентраций NaA в водном коллоидном растворе (менее 0.1 моль/л) солюбилизация толуола минимальна. Это позволяет выделить при подкислении разбавленного раствора продукт с максимальной концентрацией ди-2ЭГФК. При дальнейшем росте концентрации натриевой соли ди-2ЭГФК в водном растворе поглощение толуола значительно возрастает, а концентрация ди-2ЭГФК в продукте подкисления снижается, как это видно на рис. 3. Поведение триоктиламина качественно совпадает с поведением толуола – его поглощение минимально в разбавленных растворах NaA (менее 0.8% амина при концентрации NaA ниже 0.1 моль/л) и заметно повышается в области концентраций соли 0.1–0.4 моль/л, достигая 12% от его количества в исходном экстрагенте до щелочной обработки.
Кондуктометрические исследования
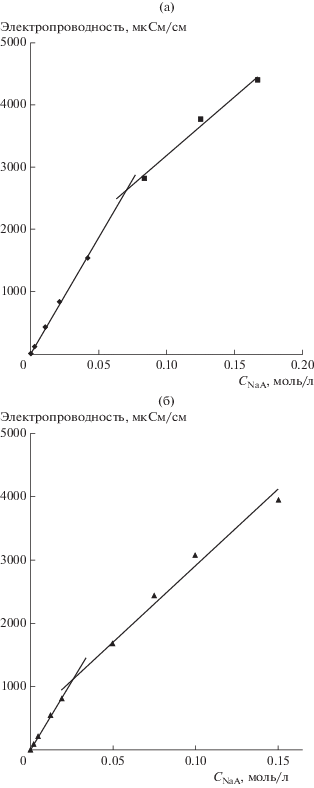
Получены данные о зависимости электропроводности коллоидного водного раствора от концентрации натриевой соли ди-2ЭГФК в воде и в растворе, насыщенном толуолом. Сопоставление рис. 4а и 4б показывает, что характер обеих зависимостей близок друг к другу. Их начальные участки совпадают и линейны до концентрации 0.02–0.025 моль/л. Затем наклон зависимостей несколько уменьшается, свидетельствуя о появлении в системе агрегатов и уменьшении подвижности ионов. Вместе с тем, различия в электропроводности исследуемых систем начинают проявляться лишь в области концентраций выше 0.04–0.05 моль/л. При этом электропроводность тройной системы снижается по сравнению с бинарной. Это свидетельствует о появлении менее подвижных заряженных частиц, что обусловлено солюбилизацией органического растворителя и укрупнением частиц. По мере роста концентрации NaA и степени солюбилизации органического растворителя различия в электропроводности этих систем заметно возрастают.
Исследование образования коллоидных растворов методом фотон-корреляционной спектроскопии
В табл. 2 представлены результаты измерений размеров прямых мицелл, выполненных методом фотон-корреляционной спектроскопии, при различной концентрации натриевых солей ди-2ЭГФК и солюбилизации мицеллами толуола и толуола с триоктиламином.
Таблица 2.
Эффективный гидродинамический диаметр (D) мицелл натриевых солей ди-2ЭГФК при обработке ди-2ЭГФК в толуоле и смесей ди-2ЭГФК и триоктиламина в толуоле водными растворами щелочи
| СNaA(к-в), моль/л | 0.05 | 0.10 | 0.20 | 0.30 | 0.45 |
| Dди-2ЭГФК + толуол, нм | 110 | 5.2 | – | 20 | 30 |
| Dди-2ЭГФК + $_{{{{{\text{R}}}_{{\text{3}}}}{\text{N}}}}$+ толуол, нм | 132 | 3.6 | 7.2 | 26 | – |
В этих системах при малой концентрации соли ди-2ЭГФК (0.05 моль/л) после ультрафильтрации раствора регистрируется появление микроэмульсии, размер капелек которой составляет 110–130 нм. С ростом концентрации натриевой соли ди-2ЭГФК микроэмульсия разрушается, раствор визуально полностью осветляется, а гидродинамический размер частиц уменьшается до значения 3–5 нм, характерного для сферических мицелл. При концентрации NaA в растворе выше 0.3 моль/л размер коллоидных частиц заметно увеличивается, что, как отмечалось выше, возможно, связано с появлением наряду со сферическими мицеллами более крупных везикул. Обращает на себя внимание тот факт, что такая перестройка не сопровождается заметным изменением солюбилизации растворителя (рис. 2) и соотношение NaA : толуол изменяется относительно незначительно в широком диапазоне концентраций NaA в растворе.
Исследование образования коллоидных растворов методом ЯМР
На рис. 5а приведены 1Н ЯМР-спектры растворов натриевой соли ди-2ЭГФК в дейтерированной воде при концентрации соли 0.01, 0.02 и 0.10 моль/л (растворы насыщены толуолом), а на рис. 5б – фрагменты спектров ЯМР 1Н (в области значений химического сдвига δ = 6.60–7.30 м.д.), отвечающих атомам водорода ароматического кольца толуола. В приведенных спектрах в области δ ≈ 0.8–0.9 м.д. находятся сигналы протонов концевых метильных групп ди-2ЭГФК, значения δ ≈ 1.3–1.5 м.д. соответствуют протонам метиленовых групп углеводородных радикалов, а δ ≈ ≈ 3.6–3.7 м.д. – протонам групп СН2–О–. Положение этих сигналов достаточно слабо изменяется с концентрацией NaA. Сигналы протонов толуола находятся в характерных для него областях, но заметно зависят от концентрации NaA: δ ≈ ≈ 6.6–7.4 м.д. (С6Н5–) и 1.8–2.3 м.д. (СН3–).
Рис. 5.
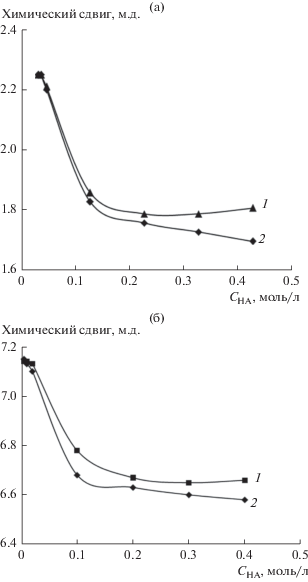
Спектры 1Н ЯМР растворов натриевой соли ди-2ЭГФК в D2O при разной их концентрации: 1 – 0.01, 2 – 0.02, 3 – 0.10 моль/л; (а) общие спектры, (б) фрагменты спектров в области значений химических сдвигов δ = 6.60–7.30 м.д.

Соответствующие зависимости приведены на рис. 6. Видно, что при значениях концентрации NaA 0.01–0.02 моль/л, т.е. меньших ККМ, сигналы от ароматических атомов водорода (протонов в пара-положении) расположены в области 7.17–7.19 м.д. (рис. 6б), а от CH3-групп – при 2.2–2.25 м.д. (рис. 6а). Таким образом, их положение близко к положению, регистрируемому для раствора толуола в дейтерированной воде. В растворе NaA с концентрацией 0.1 моль/л сигналы протонов толуола существенно сдвигаются в область сильного поля, что обусловлено изменением пространственного окружения молекул толуола при их локализации в прямых мицеллах. Величина химического сдвига в этих условиях для пара-протона ароматического кольца составляет около 6.7 м.д., а для CH3-групп – 1.8 м.д., и они слабо зависят от концентрации NaA в растворе.
Рис. 6.
Зависимости химических сдвигов CH3-групп толуола (а) и протона толуола в пара-положении (б) от концентрации натриевой соли ди-2ЭГФК: 1 – в системе без триоктиламина, 2 – с добавкой триоктиламина.
При высоком содержании соли NaA (0.4 моль/л и более) все сигналы значительно уширяются, в том числе и от углеводородных радикалов NaA, что, видимо, связано с ростом вязкости растворов и значительным снижением скорости обменных процессов в коллоидном растворе.
Следует отметить, что спектры ЯМР и их изменения идентичны для обеих систем – с триоктиламином и без него, что подтверждает низкую долю этого амина в составе мицелл и незначительное влияние амина на их формирование.
ЗАКЛЮЧЕНИЕ
Исследован процесс разделения экстрагентов на основе ди-2ЭГФК в толуоле и смеси ди-2ЭГФК и триоктиламина в толуоле на составные компоненты при переводе ди-2ЭГФК в натриевую соль с селективным переносом ее в водный раствор с образованием прямых мицелл. Установлено, что при количественном переводе ди-2ЭГФК в ее натриевую соль в коллоидный раствор переходит 95–99% ди(2-этилгексил)фосфата натрия. Органическая фаза содержит преимущественно толуол или толуольный раствор триоктиламина, при этом степень извлечения амина в нее составляет от 87 до 99.8%.
Количественное выделение концентрированной ди-2ЭГФК из водного коллоидного раствора достигается при его подкислении. Концентрация ди-2ЭГФК в выделенном продукте определяется солюбилизацией органического растворителя прямыми мицеллами натриевой соли ди-2ЭГФК и снижается с ростом концентрации этой соли в коллоидном растворе. Наиболее концентрированная ди-2ЭГФК (90–95%) может быть выделена подкислением растворов, содержащих 0.01–0.02 моль/л NaA.
Кондуктометрическим методом установлено, что ККМ ди(2-этилгексил)фосфата натрия в воде составляет 0.07 моль/л и снижается почти в 3 раза при солюбилизации толуола. По данным фотон-корреляционной спектроскопии в области малых концентраций соли (0.05 моль/л) средний размер частиц составляет 110–130 нм, что обусловлено значительной долей микроэмульсий. С ростом концентрации натриевой соли раствор осветляется, а гидродинамический размер частиц уменьшается до 3–5 нм, т.е. до величины, характерной для мицелл.
В 1Н ЯМР-спектрах толуола в растворах ди(2-этилгексил)фосфата натрия в дейтерированной воде при переходе от истинного раствора (небольшие концентрации NaA) к коллоидному наблюдается значительный сдвиг сигналов в сильное поле, отвечающий переходу толуола, растворенного в воде, в углеводородные “ядра” мицелл.
Исследованные системы перспективны для разработки новых экстракционных процессов с использованием органических кислот, в которых для улучшения показателей извлечения, целенаправленно изменяют активность экстрагента на стадиях извлечения и реэкстракции металлов.
Список литературы
Huang K., Liu H. // Proc. the 51 Annual Conference of Metallurgists of CIM (COM – 2012). Niagara, 2012. P. 251.
Hua K., Liu H. Pat. CN102382982B. 2013.
Melo K.R.O., Castro Dantas T.N., Moura M.C.P.A., Dantas Neto A.A., Oliveira M.R., Barros Neto E.L. // Braz. J. Chem. Eng. 2015. V. 32. P. 949.
Кузьмин В.И., Калякин С.Н., Лескив М.Н. // Химическая технология. 2012. Т. 13. С. 594.
Лескив М.Н., Кузьмин В.И., Калякин С.Н. // Химия в интересах устойчивого развития. 2012. Т. 20. С. 567.
Букарь Н.В., Ким В., Оленичева О.О., Свириденкова О.В., Синегрибова О.А. // Журн. неорг. химии. 1999. Т. 44. С. 1215.
Синегрибова О.А., Муравьева О.В. // Материалы IV школы по современным проблемам химии и технологии экстракции и Международного симпозиума “Экстракционные технологии в XXI в.”. М. 1999. Т. 2. С. 217.
Wang D., Li Y., Wu J., Xu G. // Solvent Extr. Ion Exch. 1996. V. 14. P. 585.
Zhou N., Wu J., Yu Z., Neuman R.D., Wang D., Xu G. // Sci. China Ser. B. 1997. V. 40. P. 61.
Fu X., Xiong Y., Xue S., Zhang S., Hu Z. // Solvent Extr. Ion Exch. 2002. V. 20. P. 331.
Fu X., Xiong Y., Qingli W., Xue S., Zhang S., Hu Z. // Colloids Surf. A. 2002. V. 211. P. 249.
Murashova N.M., Levchishin S.Yu, Yurtov E.V. // Hydrometallurgy. 2018. V. 175. P. 278.
Мурашова Н.М., Полякова А.С., Юртов Е.В. // Коллоид. журн. 2018. Т. 80. С. 541.
Murashova N.M., Levchishin S.Yu, Yurtov E.V. // J. Surfactants Deterg. 2014. V. 17. P. 1249.
Мурашова Н.М., Левчишин С.Ю., Юртов Е.В. // Химическая технология. 2011. Т. 12. С. 405.
ртов Е.В., Мурашова Н.М. // Химическая технология. 2010. Т. 11. С. 479
Юртов Е.В., Мурашова Н.М. // Коллоид. журн. 2004. Т. 66. С. 702.
Lopian T., Dourdain S., Kunz W., Zemb T. // Colloids Surf. A. 2018. V. 557. P. 2.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал