Коллоидный журнал, 2021, T. 83, № 2, стр. 150-156
Адсорбция природных 3-фенилпропеновых кислот на поверхности высокодисперсного оксида алюминия
В. Н. Барвинченко 1, Н. А. Липковская 1, *
1 Институт химии поверхности им. А.А.Чуйко Национальной академии наук Украины
1703164 Киев-164, ул. Генерала Наумова, Украина
* E-mail: lipkovska@ukr.net
Поступила в редакцию 15.07.2020
После доработки 02.09.2020
Принята к публикации 17.09.2020
Аннотация
Показано, что адсорбция 3-фенилпропеновой (коричной), 3-(4-гидроксифенил)пропеновой (кумаровой) и 3-(3-метокси-4-гидроксифенил)пропеновой (феруловой) кислот на поверхности высокодисперсного оксида алюминия характеризуется изотермами L-типа по классификации Джайлса. Величины максимальной адсорбции (примерно 3.3 × 10–4 моль/г), как и константы диссоциации (pKCOOH = 4.5 ± 0.1), практически одинаковы для всех кислот, что предполагает однотипное связывание их молекул с поверностью адсорбента с участием их карбоксильных групп. Зависимости адсорбции коричной, кумаровой и феруловой кислот от pH представляют собой куполообразные кривые, положение максимума которых по шкале pH совпадает с величинами термодинамических констант диссоциации карбоксильной группы. Найденная линейная корреляция величин адсорбции 3-фенилпропеновых кислот со значениями параметра их гидрофобности (lg P) свидетельствует о заметом вкладе гидрофобных взаимодействий в адсорбцию кислот на поверхности высокодисперсного оксида алюминия.
ВВЕДЕНИЕ
В настоящее время все чаще возникает необходимость выделения и определения фенилпропеновых кислот (ФПК) растительного происхождения, в частности, 3-фенилпропеновой (коричной), 3-(4-гидроксифенил)пропеновой (кумаровой) и 3-(3-метокси-4-гидроксифенил)пропеновой (феруловой) кислот в нативных лекарственных растениях, медицинских препаратах, пищевых продуктах [1, 2]. Растущий интерес к этому классу природных веществ, в первую очередь, связан с их антиоксидантной активностью, которая и обуславливает высокую эффективность лечения и профилактики различных заболеваний [3, 4]. Кроме того, их качественный состав и количественное содержание могут быть критериями доброкачественности при проведении стандартизации пищевых продуктов и напитков [5]. Данные 3-фенилпропеновые кислоты являются структурными звеньями лигнина и используются как модельные соединения при изучении процессов глубокой переработки растительной биомассы и лигнинсодержащих материалов, проводимой с целью получения биотоплива и других продуктов с заданными потребительскими свойствами [6]. Поскольку ФПК являются своеобразными индикаторами распада органических веществ растительного сырья, важно анализировать их содержание в технологических водах.
Для концентрирования и определения 3-фенилпропеновых кислот [7] применяют преимущественно методы сорбции и высокоэффективной жидкостной хроматографии. В качестве сорбентов используют химически модифицированные силикагели [8, 9], сополимеры на основе полистирола и дивинилбензола [10, 11], цеолиты [12, 13]. Твердофазная экстракция с помощью указанных сорбентов − это длительный и многоступенчатый процесс, требующий большого количества токсичных органических растворителей (метанола, ацетона, ацетонитрила). Следует отметить, что в последние годы в научных исследованиях все большее развитие получают принципы “зеленой” химии, направленные, в частности, на разработку экологически безопасных методов комплексного выделения биологически активных веществ из растительного сырья [14] и их количественного определения [15] с применением экологических растворителей (воды или смесей воды с этанолом). Для выделения и концентрирования индивидуальных ФПК или их смесей из полученных водных и водно-этанольных экстрактов наиболее перспективными промышленными сорбентами могут быть неорганические оксиды, в частности, диоксид кремния и оксид алюминия.
Так, ранее нами было установлено [16–18], что адсорбция коричной, феруловой и кофейной кислот из водных растворов на высокодисперсном кремнеземе крайне мала (1–2 мкмоль/г), поскольку происходит на его поверхностных группах ≡SiOН исключительно за счет водородных связей с участием карбоксильной и/или фенольной гидроксильной групп и поэтому существенно зависит от конкурирующего процесса сольватации. Величина сорбции ФПК на кремнеземе может быть увеличена только при использовании инертных токсичных растворителей с низкой полярностью и электронодонорной способностью (гексан, четыреххлористый углерод, хлороформ, дихлорэтан).
Более эффективным для адсорбции кислот из водных растворов может оказаться оксид алюминия, так как известно, что, в отличие от диоксида кремния, поверхность Al2O3 заряжена положительно в широком интервале значений рН [19]. Действительно, было показано, что динатриевая соль 4,5-дигидроксибензол-1,3-дисульфокислоты [20, 21], салициловая и сульфосалициловая кислоты [21] эффективно адсорбируются на оксиде алюминия преимущественно за счет электростатического взаимодействия с его положительно заряженной поверхностью.
Сведений об адсорбции структурно однотипных 3-фенилпропеновых кислот, содержащих карбоксильную и фенольную гидроксильную группы и различающихся реакционной способностью в процессах с переносом протона, прочностью и структурой водородных связей в их ассоциатах и комплексах с электронодонорами, что предполагает возможность нескольких механизмов связывания с поверхностью оксида алюминия, нам обнаружить в научной литературе не удалось.
Цель настоящей работы – установление закономерностей адсорбции и изменения спектральных характеристик на поверхности высокодисперсного оксида алюминия структурно однотипных 3-фенилпропеновых кислот – коричной, кумаровой и феруловой – в зависимости от их химической структуры и кислотности водных растворов в широком диапазоне значений рН.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали высокодисперсный пирогенный оксид алюминия Aeroxide Alu C с размером частиц 13 нм и удельной поверхностью 100 м2/г (Evonik Degussa AG) в форме 0.2%-ной водной дисперсии (ионная сила 0.01 н.), которую получали перемешиванием навесок сорбента (1.00 г) и NaCl (0.29 г) с водой (500 мл) магнитной мешалкой в течение 2 ч.
Исходные растворы коричной, кумаровой, феруловой кислот (Sigma-Aldrich) готовили растворением точных навесок в горячей дистиллированной воде. Рабочие растворы готовили непосредственно перед экспериментом. Растворы хлористоводородной кислоты и щелочи получали из концентрированной HCl и NaOH марки “ч. д. а.”. Кислотность растворов до и после адсорбции контролировали с помощью стеклянного электрода универсального иономера Hanna Instruments HI 221.
Электронные спектры растворов исследуемых ФПК до и после смешивания с дисперсией оксида алюминия измеряли на спектрофотометре Specord M-40 (Karl Zeiss Jena, Германия) в ячейке для мутных растворов в кварцевых кюветах. С целью устранения влияния фона на аналитический сигнал, полученный при измерении спектров поглощения исследуемых дисперсий и растворов, использовали метод гетерохроматической экстраполяции при двух длинах волн [22].
Адсорбцию ФПК из водных растворов на поверхности оксида алюминия изучали в статических условиях. Для этого 10 мл раствора исследуемой кислоты требуемой концентрации смешивали с 10 мл 0.2%-ной водной дисперсии адсорбента, задавали необходимое значение рН и перемешивали до установления равновесия (2 ч при 20°C). Затем измеряли спектр поглощения полученной дисперсии Al2O3 (оптическую плотность Адисп), поскольку при концентрации 0.1% она обладает высокой седиментационной устойчивостью и достаточной прозрачностью. Равновесный раствор отделяли центрифугированием (8000 об./мин, 15 мин) и измеряли его спектр поглощения (А[С]). Оптическую плотность адсорбированных на оксиде алюминия коричной, кумаровой и феруловой кислот (A s) определяли как арифметическую разницу
В качестве образца сравнения использовали дисперсию чистого оксида алюминия, проведенную через все те же стадии, что и исследуемые образцы.Для определения равновесной концентрации ФПК в центрифугат добавляли раствор HCl для установления рН < 2.5–3.0 (при котором светопоглощение ФПК практически не зависит от рН), измеряли оптическую плотность и рассчитывали равновесную концентрацию кислот исходя из соответствующего молярного коэффициента поглощения ε, найденного экспериментально в этих условиях. Для этого предварительно были исследованы зависимости оптической плотности растворов ФПК от их концентрации, которые были линеаризованы методом наименьших квадратов с коэффициентами корреляции r 2 ≥ 0.9997. Найденные величины молярного коэффициента поглощения (М–1 см–1) составили: ε278 нм = 2.06 × 104 (коричная кислота), ε310 нм = 1.97 × 104 (кумаровая кислота), ε324 нм = 1.78 × 104 (феруловая кислота).
Величину адсорбции (а, моль/г) рассчитывали по формуле а = (C – [C])V/m, где С и [C] – соответственно исходная и равновесная концентрации ФПК (М), V – объем раствора (л), m – масса сорбента (г).
Изотерму адсорбции анализировали с использованием уравнения Ленгмюра:
(2)
$a = {{{{a}_{\infty }}K[C]} \mathord{\left/ {\vphantom {{{{a}_{\infty }}K[C]} {\left( {1 + K[C]} \right),}}} \right. \kern-0em} {\left( {1 + K[C]} \right),}}$В линейной форме уравнение (2) имеет вид
Построеный в координатах [C]/a от [C] график представляет собой прямую линию, исходя из параметров которой рассчитывали величину максимальной адсорбции а∞ и константу равновесия адсорбционного процесса K.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кислотность среды является важным параметром процесса адсорбции для соединений, содержащих карбоксильные и гидроксильные группы. При исследовании адсорбционных взаимодействий в гетерогенной системе оксид алюминия/раствор 3-фенилпропеновой кислоты необходимо учитывать все возможные реакции, происходящие в растворе адсорбата и на поверхности адсорбента. В водных растворах одноосновная коричная и двухосновные кумаровая и феруловая кислоты в зависимости от рН раствора существуют в молекулярной и/или депротонированной формах, распределения которых (рис. 1, кривые 1 и 2) были рассчитаны исходя из значения их первых термодинамических констант диссоциации (рКСООН = 4.5 ± 0.1) [23]. Поскольку величины констант диссоциации фенольных гидроксильных групп кумаровой и феруровой кислот находятся в области 8.7–9.5, то в исследуемом интервале рН 2–7 дианионы практически не образуются.
Рис. 1.
Распределения молекулярной (1) и депротонированной (2) форм ФПК в растворе; распределения на поверхности оксида алюминия протонированных $ \equiv {\kern 1pt} {\text{AlОН}}_{2}^{ + }$ (3), недиссоциированных ≡AlOH (4) и депротонированных ≡AlO– (5) групп [25, 26]; степень адсорбции а/аmax коричной (6), кумаровой (7), и феруловой (8) кислот в зависимости от рН.

Поверхность Al2O3 амфотерна и в соответствии с положениями теории комплексообразования [24] ее заряд изменяется при взаимодействии с протонами водного раствора. Такие равновесия протонирования и депротонирования поверхностных ≡AlOH-групп описываются уравнениями
На основе приведенных значений констант были построены диаграммы распределения относительной доли (α) поверхностных групп оксида алюминия – протонированных $ \equiv {\kern 1pt} {\text{AlОН}}_{2}^{ + }$ (кривая 3), недиссоциированных ≡AlOH (кривая 4) и депротонированных ≡AlO– (кривая 5) – в зависимости от рН раствора (рис. 1). Видно, что адсорбционные кривые для коричной (6), кумаровой (7), и феруловой (8) кислот проходят через максимум, положение которого на шкале рН примерно соответствует константе диссоциации карбоксильной группы ФПК. Одинаковый вид этих зависимостей указывает на то, что адсорбция данных кислот происходит по одному и тому же механизму, что возможно только с участием группы −СООН. С ростом рН от 2 до примерно 4.5 адсорбция ФПК на оксиде алюминия увеличивается. В этом интервале рН на поверхности адсорбента доминируют протонированные группы $ \equiv {\kern 1pt} {\text{AlОН}}_{2}^{ + }$ (кривая 3), а в растворе − молекулярная форма кислоты (кривая 1). При рН > 4.5 доля депротонированных карбоксильных групп увеличивается, но, несмотря на это, величина адсорбции снижается, очевидно, вследствие уменьшения количества поверхностных групп $ \equiv {\kern 1pt} {\text{AlОН}}_{2}^{ + }$. При рН < 4 вклад в адсорбцию исследуемых ФПК образования водородных связей между карбонильной группой их молекул и нейтральными ≡AlOH-группами поверхности оксида алюминия, который доминировал в случае адсорбции ФПК на диоксиде церия [23], является сравнительно небольшим, поскольку в этой области рН концентрация групп ≡AlOH на поверхности слишком низка. При увеличении pH свыше 4.5 ситуация оказывается обратной: концентрация нейтральных групп ≡AlOH растет, а концентрация молекулярной формы кислоты в растворе уменьшается.
Дополнительная информация о механизме адсорбции была получена из сравнительного анализа спектральных характеристик ФПК, в частности, положения максимумов (λmax) в их спектрах поглощения, которые являются чувствительными маркерами кислотно-основных равновесий 3-фенилпропеновых кислот в растворах и на поверхности оксида алюминия. Следует отметить, что непосредственное измерение оптической плотности дисперсии оксида алюминия в присутствии 3-фенилпропеновых кислот позволяет исследовать в одинаковых условиях спектральные характеристики ФПК в растворах и на поверхности адсорбента.
В качестве примера на рис. 2 приведены нормированные спектры поглощения коричной (а), кумаровой (б) и феруловой (в) кислот, адсорбированных из растворов с рН 2 на поверхности оксида алюминия (кривые 1), спектры равновесных растворов с рН 2 (кривые 2) и растворов ФПК с рН 6.5 (кривые 3), в которых эти кислоты существует в молекулярной и депротонированной форме соответственно.
Рис. 2.
Нормированные спектры поглощения коричной (а), кумаровой (б) и феруловой (в) кислот, адсорбированных на поверхности оксида алюминия при рН 2 (1), и растворов этих кислот при рН 2 (2) и 6.5 (3).

Как видно на рис. 2, в результате адсорбции при рН < 4.5 в спектрах поглощения коричной и кумаровой кислот
наблюдаются однотипные изменения, а именно, происходит гипсохромный сдвиг спектров
адсорбированных кислот относительно спектров их растворов. Так, в случае феруловой
кислоты, сдвиг спектра характеризуется смещением максимума оптической плотности от
$\lambda _{{{\text{max}}}}^{'} = 323$ нм к  нм (рис. 2в, кривая 1).
нм (рис. 2в, кривая 1).
Было изучено влияние рН растворов на величину разности длин волн спектральных максимумов (Δλmax) для коричной (кривая 1), кумаровой (кривая 2) и феруловой (кривая 3) кислот, адсорбированных на поверхности Al2O3 ($\lambda _{{{\text{max}}}}^{{{{{\text{ФПК}}} \mathord{\left/ {\vphantom {{{\text{ФПК}}} {{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}$), и в соответствующих растворах ($\lambda _{{{\text{max}}}}^{{{\text{ФПК}}}}$) (рис. 3).
Рис. 3.
Разность в длинах волн, отвечающих максимуму в спектрах поглощения (Δλmax) коричной (1), кумаровой (2) и феруловой (3) кислот на поверхности Al2O3 ($\lambda _{{{\text{max}}}}^{{{{{\text{ФПК}}} \mathord{\left/ {\vphantom {{{\text{ФПК}}} {{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}$) и в соответствующих равновесных растворах ($\lambda _{{{\text{max}}}}^{{{\text{ФПК}}}}$), в зависимости от рН.

Из анализа данных рис. 3 видно, что при рН < < pKСООН величины λmax адсорбированных ФПК соответствуют λmax для этих кислот в растворах при значительно больших рН. Это указывает на бóльшую долю депротонированной формы кислоты на поверхности Al2O3 по сравнению с раствором той же кислотности. Максимальное отклонение $\lambda _{{{\text{max}}}}^{{{{{\text{ФПК}}} \mathord{\left/ {\vphantom {{{\text{ФПК}}} {{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}}$ от $\lambda _{{{\text{max}}}}^{{{\text{ФПК}}}}$ в растворах наблюдается при рН 2–3, т.е. в условиях, когда на поверхности адсорбента доминируют протонированные группы $ \equiv {\kern 1pt} {\text{AlОН}}_{2}^{ + }$ (рис. 1, кривая 3), а в растворе – кислоты в молекулярной форме (рис. 1, кривая 1). Можно предположить, что при адсорбции в интервале рН 2–3.5 происходит поляризация связей в молекуле ФПК (схема 1 ), в результате чего облегчается отщепление протона карбоксильной группы и связывание аниона с протонированной группой $ \equiv {\kern 1pt} {\text{AlОН}}_{2}^{ + }$ на поверхности оксида алюминия (схема 2 ).
С ростом рН выше 3 увеличивается содержание анионной формы кислоты в растворе и величина сдвига Δλmax уменьшается, достигая нуля при pH ≈ pKCOOH. При рН > 4.5 значения λmax в спектрах ФПК в растворах и на поверхности оксида алюминия практически совпадают, т.е. не наблюдается поляризующего действия поверхностных групп адсорбента на адсорбированные кислоты, что объясняется существованием ФПК преимущественно в депротонированной форме.
Количественные параметры адсорбции ФПК были исследованы при рН максимального извлечения кислот. На рис. 4 приведены полученные изотермы адсорбции коричной (кривая 1), кумаровой (кривая 2) и феруловой (кривая 3) кислот при рН 4.5. Максимальная концентрация ФПК в исходном растворе не превышала величину 1 × × 10–3 М, которая определялась ограниченной растворимостью этих кислот в воде.
Рис. 4.
Изотермы адсорбции коричной (1), кумаровой (2), феруловой (3) кислот на оксиде алюминия при рН 4.5.

Из рис. 4 следует, что изотермы кислот относятся к L-типу по классификации Джайлса [27] и линеаризуются в координатах уравнения Ленгмюра. Соответствующие рассчитанные значения максимальной адсорбции, константы равновесия адсорбционного процесса и коэффициенты корреляции приведены в табл. 1. Видно, что рассчитанные величины максимальной адсорбции а∞ коричной, кумаровой и феруловой кислот практически совпадают, что возможно лишь при условии их связывания с поверхностью по одному механизму, а именно через карбоксильную группу, кислотность которой не зависит от наличия заместителей (гидроксильной и метоксильной групп) в бензольном кольце. Это согласуется с изложенными выше данными, полученными при изучении влияния рН на адсорбцию ФПК (рис. 1).
Таблица 1.
Параметры сорбции 3-фенилпропеновых кислот на оксиде алюминия
| Кислота | а∞, 10–4 моль/г | K, л/моль | R | n |
|---|---|---|---|---|
| Коричная | 3.32 | 1736 | 0.968 | 9 |
| Кумаровая | 3.31 | 1756 | 0.990 | 12 |
| Феруловая | 3.25 | 3590 | 0.980 | 8 |
Следует отметить, что исследуемые ФПК характеризуются наличием в их молекулах как гидрофобных (этиленовые и фенильные радикалы), так и гидрофильных (карбоксильные группы и фенильные гидроксилы) фрагментов. Поэтому их связывание с поверхностью оксида алюминия может быть обусловлено как электростатическим взаимодействием и водородными связями (гидрофильный вклад), так и поляризационными и дисперсионными силами, действующими на арильные фрагменты (гидрофобный вклад). Общепринятым параметром гидрофобности, характеризующим лиофильные свойства веществ, является величина коэффициента их распределения P в системе вода/н-октанол (lg P). Приведенные в литературе [28] значения lg P для коричной (lg P = 2.13), кумаровой (lg P = 1.79) и феруловой (lg P = 1.51) кислот позволяют отнести их к умеренно гидрофобным соединениям (1 < lg P < 3).
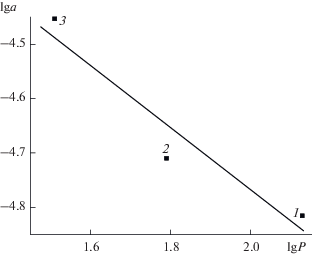
На рис. 5 представлена зависимость логарифмов величин адсорбции коричной, кумаровой, феруловой кислот на оксиде алюминия от значений их lg P при одинаковой равновесной концентрации ФПК в растворе. Полученная зависимость линейна (R = 0.980), что свидетельствует о наличии корреляции между этими двумя параметрами, т.е. о заметном вкладе гидрофобных взаимодействий в адсорбцию.
Рис. 5.
Зависимость величин адсорбции коричной (1), кумаровой (2) и феруловой (3) кислот на оксиде алюминия от lg P. [C] = 5.0 × 10–5 М.
Таким образом, установлены закономерности адсорбции на поверхности высокодисперсного оксида алюминия природных 3-фенилпропеновых кислот в зависимости от их химической структуры и кислотности водных дисперсий в широком интервале физиологических значений рН.
Совпадение для всех изученных ФПК величин их максимальной адсорбции, а также положения максимумов на кривых зависимости адсорбции от рН, совпадающих с термодинамическими константами диссоциации карбоксильной группы кислот, предполагает однотипное связывание молекул адсорбата с поверностью оксида преимущественно через карбоксильные группы.
Найденные закономерности и параметры адсорбции позволяют выработать практические рекомендации по использованию оксида алюминия в качестве сорбента для извлечения, концентрирования и определения 3-фенилпропеновых кислот.
Список литературы
El-Seedi H.R., El-Said A.M., Khalifa S.A. et al. // J. Agric. Food Chem. 2012. V. 60. P. 10 877.
Balasundram N., Sundram K., Samman S. // Food. Chem. 2006. V.99. P.191.
Razzaghi-Asl N., Garrido J., Khazraei H. et al. // Curr. Med. Chem. 2013. V. 20. P. 4436.
Яшин Я.И., Рыжнев В.Ю., Яшин А.Я., Черноусова Н.И. Природные антиоксиданты. Содержание в пищевых продуктах и влияние их на здоровье и старение человека. М.: ТрансЛит, 2009.
Яшин А.Я. // Сорбционные и хроматографические процессы. 2014. Т. 14. С. 419.
Физическая химия лигнина / Под ред. Боголицына К.Г., Лунина В.В. Архангельск: Архангельский гос. технический ун-т, 2009.
Arceusz A., Wesolowski M., Konieczynski P. // Nat. Prod. Commun. 2013. V. 8. P. 1821.
Zeng H., Liu Z., Zhao S. et al. // J. Sep. Sci. 2016. V. 39. P. 3806.
Шилько Е.А., Милевская В.В., Темердашев З.А., Киселева Н.В. // Аналитика и контроль. 2018. Т. 22. P. 303.
Silva M., Castellanos L., Ottens M. // Ind. Eng. Chem. Res. 2018. V. 57. P. 5359.
Dávila-Guzman N.E., Cerino-Córdova F.J., Diaz-Flores P.E. et al. // Chem. Eng. J. 2012. V. 183. P. 112.
Simon V., Thuret A., Candy L. et al. // Chem. Eng. J. 2015. V. 280. P.748.
Thiel A., Tippkötter N., Suck K. et al. // Eng. Life Sci. 2013. V. 13. P. 239.
Anastas P.T., Warner J.C. Green Chemistry: Theory and Practice. Oxford: Oxford University Press, 2000.
ldin A.B., Ismaiel O.A., Hassan W.E., Shalaby A.A. // J. Anal. Chem. 2016. V. 71. P. 861
Погорелый В.К., Барвинченко В.Н., Пахлов Е.М., Смирнова О.В. // Коллоид. журн. 2005. Т. 67. С. 201.
Довбий О.А., Казакова О.А., Липковская Н.А. // Коллоид. журн. 2006. Т. 68. С. 777.
Погорелый В.К., Казакова О.А., Барвинченко В.Н. и др. // Коллоид. журн. 2007. Т. 69. С. 226.
Чукин Г.Д. Строение оксида алюминия и катализаторов гидрообессеривания. Механизмы реакций. М.: Принта, 2010.
Тихомирова Т.И., Кубышев С.С, Иванов А.В. // Журн. физ. химии. 2013. Т. 87. С. 1366.
Jiang L., Gao L., Liu Y. // Colloids Surf. A. 2002. V. 211. P. 165.
Бернштейн И.Я., Каминский Ю.Л. Спектрофотометрический анализ в органической химии. Л.: Химия, 1986.
Барвинченко В.Н., Липковская Н.А., Кулик Т.В., Картель Н.Т. // Коллоид. журн. 2019. Т. 81. С. 3.
Westall J.C., Hohl H. // Adv. Colloid Interface Sci. 1980. V. 12. P. 265.
Tombácz E., Szekeres M. // Langmuir. 2001. V. 17. P. 1411.
Tombácz E., Szekeres M., Klumpp E. // Langmuir. 2001. V. 17. P. 1420.
Giles C.H., MacEwan T.H., Nakhwa S.N., Smith D. // J. Chem. Soc. 1960. V.10. P. 3973.
Chemical information resources from the National Library of Medicine http://sis.nlm.nih.gov/chemical.html.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал



