Коллоидный журнал, 2021, T. 83, № 2, стр. 230-234
Особенности физико-химических свойств поверхности дисперсного льда
В. И. Федосеева 1, 2, *, Н. Ф. Федосеев 1, М. П. Бурнашева 1
1 Институт мерзлотоведения им. П.И. Мельникова СО РАН
677010 Якутск, ул. Мерзлотная, 36, Россия
2 Северо-Восточный федеральный университет им. М.К. Аммосова
677000 Якутск, ул. Белинского, 58, Россия
* E-mail: vifgoreva@gmail.com
Поступила в редакцию 20.02.2020
После доработки 10.07.2020
Принята к публикации 21.09.2020
Аннотация
Экспериментально установлено, что существующая на поверхности частиц дисперсного льда квазижидкая пленка, которая проявляет растворяющие свойства, исчезает при длительном выдерживании образцов при температуре, близкой к –40°C, и появляется вновь при –2, –5 и –10°C. Оценена энергия ее образования, высокое значение которой (примерно 210 кДж/моль) свидетельствует о значительной инерционности процесса “возрождения” пленки. Это следует учитывать при постановке и проведении экспериментов по исследованию водосодержащих систем при отрицательной температуре.
ВВЕДЕНИЕ
Известно, что вблизи температуры плавления любого твердого тела на его поверхности формируется разупорядоченный слой, существование которого обусловлено большей подвижностью молекул или атомов, не испытывающих в полной мере удерживающее влияние родственных частиц со стороны твердой фазы. В научной литературе приводится интерпретация этого феномена [1, 2], имеются результаты его исследования разными методами [3–6]. Однако сорок-пятьдесят лет назад и даже позже фактические данные о состоянии поверхности твердых тел при значениях температуры, близких к температуре плавления вещества, встречались в литературе крайне редко.
Лед является весьма распространенной в природе твердой фазой. Естественные температуры, при которых он существует, близки к температуре его плавления, поэтому, поняв особенности свойств поверхности льда, можно делать обоснованные предположения о характере их проявления и роли в природных системах.
Как показано во многих публикациях, необычные свойства поверхности льда были отмечены еще Фарадеем в середине XIX века [1, 4], что возможно, если предположить наличие на поверхности льда разупорядоченного слоя. Однако прямые или косвенные подтверждения этого предположения появились в научной литературе спустя почти столетие, когда возобновился интерес исследователей к данному явлению и открылись новые возможности для экспериментальных исследований. Результаты экспериментов привели к выводу, что в температурном интервале, близком к температуре плавления льда, на его поверхности действительно существует разупорядоченный слой. Это было установлено физическими [7, 8], физико-химическими [9, 10] методами, а также теоретическими расчетами [4]. Позднее наличие этого явления было подтверждено, и не только для льда, но и для других твердых тел [2, 11, 12].
Надо отметить, что во второй половине ХХ века в работах по изучению поверхностного слоя твердых тел вблизи их температуры плавления появился термин “неавтономная фаза”, который дает понять, что разупорядоченный слой существует в соответствующих условиях только в присутствии самой твердой фазы. По отношению ко льду этот термин был предложен в работе [13].
Методом, дающим наиболее адекватное описание свойств разупорядоченного (квазижидкого) слоя на поверхности льда, является ядерный магнитный резонанс (ЯМР). Авторами [3, 14] были получены близкие значения времени корреляции для вращательного движения молекул воды в квазижидком слое, однако коэффициенты диффузии молекул воды, рассчитанные на основе экспериментальных данных в работе [14], в сопоставлении с соответствующими значениями для воды и льда [15] кажутся более реальными. Поэтому данные этой работы стали для нас основополагающими в постановке и проведении в последующем экспериментальных исследований.
Наличие квазижидкого слоя предполагает возможность проявления этим слоем растворяющих свойств по отношению к каким-либо веществам. Впервые свойства поверхности дисперсного льда изучались методом сорбции из растворов в гидрофобном растворителе (толуол) органических веществ разного состава и свойств. Результаты для некоторых из них приведены в работе [16]. Предполагалось, что гидрофобный растворитель позволит наблюдать в эксперименте непосредственный отклик разупорядоченного слоя на наличие в системе иных веществ. Было выявлено [16], что наиболее активно адсорбируются поверхностью льда вещества, имеющие гидроксильные или карбоксильные группы. Количества сорбированных веществ в данном случае коррелировали со значениями коэффициента их распределения между водой и гидрофобным растворителем [17, 18], что явилось подтверждением проявления квазижидкой пленкой льда растворяющих свойств.
ЭКСПЕРИМЕНТ
Для исследования физико-химических свойств поверхности льда в качестве образцов дисперсного льда в работах [16–18] и в последующих экспериментах использовали снег, отобранный за городом с подветренной стороны в конце обильного снегопада. Было принято, как и авторами [19], что неорганические компоненты, обнаруживаемые в малых количествах в воде после таяния образцов снега, не влияют на основные свойства поверхности частиц льда. Образцы снега выдерживали при естественной отрицательной температуре подземной лаборатории Института мерзлотоведения (минус 3–4°C). Часть образцов специально долго (2–2.5 мес.) выдерживали при естественной температуре воздуха (примерно ‒40°С), после чего использовали в экспериментах.
Гидрофобный растворитель (толуол), использование которого диктовалось необходимостью наблюдать в сорбционных экспериментах проявление собственно квазижидкой пленки, может содержать до ≈0.02% воды [15]. Для ее удаления вымораживанием толуол предварительно выдерживали при температуре ниже минус 20–25°C.
Для выявления веществ, активно взаимодействующих с поверхностью дисперсного льда, были опробованы 3–4 десятка разных химических соединений (карбоновые кислоты, спирты, амины и др.). Их растворы имели концентрацию 0.03 моль/л. Насыщенные растворы плохо растворимых веществ перед экспериментом разбавляли в несколько раз. Концентрацию большинства веществ до и после сорбционных экспериментов определяли по их характеристическим полосам поглощения в ИК-спектрах. Концентрацию некоторых ароматических соединений оценивали методом УФ-спектроскопии. В случае низших карбоновых кислот использовали также объемный метод нейтрализации. Перед титрованием толуольных растворов кислоты, исходного и равновесного, к аликвоте (5 мл) добавляли 5 мл дистиллированной воды.
Для детального изучения характера взаимодействия органических веществ с поверхностью частиц дисперсного льда в зависимости от концентрации и температуры, результаты которого рассматриваются в данной статье, были выбраны активно сорбирующиеся муравьиная и монохлоруксусная кислоты. Эксперименты проводили в специальной термостатирующей камере, в которой размещали эксикатор с дисперсным льдом и растворы кислот разной концентрации. После достижения температурного равновесия (спустя 3.5–4 ч) каждый раствор (25 мл) выдерживали с навеской дисперсного льда (6 г) в течение 1 ч при заданной температуре. Было установлено, что равновесие в системе раствор/лед достигается не более чем за 30 мин. При исследовании влияния температуры на сорбционное взаимодействие растворов кислот со льдом после его предварительной низкотемпературной выдержки длительность сорбционного эксперимента возрастала. Удельная поверхность частиц снега невелика, однако для обеспечения адекватного соотношения жидкость/твердая фаза максимально возможная навеска сорбента не могла быть больше 6 г.
Муравьиная и монохлоруксусная кислоты были выбраны для проведения систематических исследований, в основном, как наиболее подходящие для контроля их концентрации в растворах и последующей оценки сорбированного количества. Величины сорбции (Γ) кислот оценивались общепринятым способом с учетом снижения их концентрации в растворе, объема раствора (25 мл) и навески дисперсного льда (6 г).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выше были приведены аргументы в пользу того, что квазижидкий слой на поверхности льда в температурной области ниже его объемной температуры плавления, безусловно, существует. В соответствии с результатами изучения свойств поверхности льда разными методами квазижидкий слой (пленка) должен проявлять растворяющие свойства, поэтому вещества из раствора в органическом слое могут в той или иной мере переходить в поверхностную пленку льда.
Форма изотерм сорбции муравьиной кислоты, приведенных на рис. 1, свидетельствует о том, что начальному участку кривых действительно соответствует распределение кислоты между квазижидкой пленкой и объемом органического растворителя. Количество поглощенного вещества пропорционально его равновесной концентрации в растворе. При достижении некоторой “критической” концентрации наблюдается резкий рост сорбции, обусловленный, по-видимому, образованием объемной фазы водного раствора. (Это подтверждалось только визуально, анализ водного раствора не проводился). Процесс образования такого раствора может осуществляться через последовательное разупорядочение слоев льда, контактирующих непосредственно с квазижидким слоем поверхности с обязательным сохранением переходного слоя.
Рис. 1.
Изотермы сорбции муравьиной кислоты поверхностью льда из раствора в толуоле при –2 (1), –5 (2) и –10°C (3). Соотношение твердой и жидкой фаз равно 6 : 25.

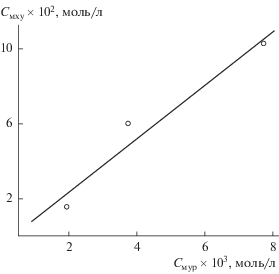
Согласно рис. 1, относительная форма изотерм сорбции для муравьиной кислоты не менялась в определенном интервале температур, что указывает на наличие разупорядоченного слоя в условиях эксперимента. Уменьшение количества вещества, переходящего в квазижидкую пленку с понижением температуры, может быть связано с уменьшением толщины разупорядоченного слоя и, соответственно, с изменением его структуры, что должно весьма существенно влиять на процесс сорбции. Значение “критической” концентрации, соответствующей началу “подплавления” льда, возрастало при понижении температуры. Соотношение “критических” концентраций для муравьиной и монохлоруксусной кислот, выявленных в работе [17], обнаружило линейную корреляцию (рис. 2), что свидетельствует о подобии факторов, обусловливающих их сорбцию.
Рис. 2.
Соотношение “критических” концентраций муравьиной (Cмур) и монохлоруксусной (Cмху) кислот в толуоле, соответствующих началу подплавления льда при значениях температуры –2 , –5 и ‒10°C.
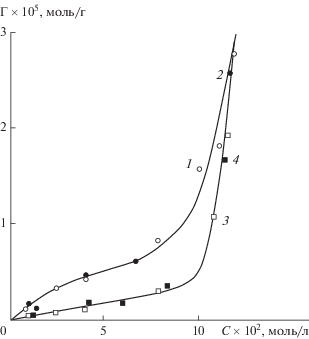
Важным результатом исследований явилось то, что разупорядоченный слой на поверхности льда исчезал при предварительном выдерживании образцов при температуре около –40°C не менее чем в течение 2–2.5 месяцев. В последующих сорбционных экспериментах, проводимых при –15, –20, –25°C с таким “низкотемпературным” льдом, наблюдались изотермы поглощения муравьиной и уксусной кислот [17] совершенно иной формы, вполне соответствующей модели адсорбции Ленгмюра, т.е. “низкотемпературный” лед проявлял себя как обычное твердое тело. В данных температурно-временны́х условиях разупорядоченный слой на поверхности льда отсутствовал. Система достигала состояния с заполнением мономолекулярного адсорбционного слоя с увеличением равновесной концентрации кислот в соответствии с изотермой адсорбции Ленгмюра. При некоторых более высоких концентрациях также наблюдался резкий рост поглощенного количества кислот [17], что могло быть обусловлено только появлением на поверхности льда разупорядоченного слоя под влиянием реагента, его сорбцией и последующим спонтанным образованием объемной фазы водного раствора.
Однако результаты экспериментов показали, что квазижидкая пленка на образцах “низкотемпературного” льда появлялась вновь в обозримое время, если их помещали в более высокотемпературные условия. Такие эксперименты были проведены с растворами монохлоруксусной кислоты при –2, –5 и –10°C (рис. 3). Время, необходимое для появления пленки после достижения температурного равновесия, составляло не более 2.5, 15 и 48 ч соответственно [17].
Рис. 3.
Изотермы сорбции монохлоруксусной кислоты дисперсным льдом при –10 °C спустя 0 (1), 25 (2), 48 (3) и 120 ч (4) после его предварительной длительной выдержки при низкой температуре [17].
На основании этих данных можно оценить энергию образования пленки в соответствии с уравнением Аррениуса [20]. Необходимая для этого зависимость относительной скорости появления пленки от обратной температуры показана на рис. 4. Надо отметить, что квазижидкая пленка появлялась при нагревании образцов, поэтому ее толщину следует считать равновесной, что очевидно также из данных, приведенных на рис. 3. В результате оценки получено значение энергии, необходимой для появления квазижидкой пленки на поверхности льда, равное 210 кДж/моль; оно вполне сопоставимо со значением 184 кДж/моль, которое рассчитано нами при анализе данных [21], полученных методом ЯМР.
Рис. 4.
Зависимость логарифма обратного времени появления жидкоподобной пленки при –2, –5, –10°C от обратной температуры (пояснения в тексте).

Таким образом, выполненные эксперименты подтвердили, что разупорядоченный неавтономный слой, существующий на поверхности льда в интервале температур, близком к температуре его плавления, проявляет растворяющие свойства. Степень сорбции некоторых модельных веществ квазижидким слоем возрастает с ростом их гидрофильности. Образование объемного водного раствора происходит при достижении “критической” концентрации вещества в гидрофобном растворителе. Это возможно только за счет подплавления слоев льда, прилегающих к квазижидкому слою. Существование в равновесии льда и водного раствора предполагает также наличие на их границе переходного слоя, что нашло экспериментальное подтверждение в работах [22–24].
Образование неавтономного разупорядоченного слоя на поверхности твердой фазы дисперсного льда, длительно хранившегося в низкотемпературных условиях, – процесс достаточно медленный. Длительность периода появления такого слоя в более высокотемпературных условиях зависит от температуры, что необходимо учитывать как при исследовании физико-химических свойств поверхности льда разными методами, так и при постановке лабораторных опытов для изучения процессов миграции растворимых веществ в замороженных системах.
Список литературы
Dash J.G., Fu H., Wettlaufer J.S. // Rep. Prog. Phys. 1995. V. 58. P. 115.
Таусон В.Л., Бабкин Д.Н., Липко С.В., Кравцова Р.Г., Гребенщикова В.И., Лустенберг Э.Е. // Докл. РАН. 2009. Т. 423. С. 801.
Mizuno Y., Hanafusa N. // J. Phys. Colloq. 1987. V. 48. P. 511.
Conde M.M., Vega C., Patrykiejew A. // J. Chem. Phys. 2008. V. 129. 014702.
Wei X., Miranda P.B., Shen Y.R. // Phys. Rev. Lett. 2001. V. 86. P. 1554.
Sazaki G., Zepeda S., Nakatsubo S., Yokomine M., Furukawa Y. // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 2.
Mantovani S., Valeri S. // Phil. Mag. 1978. V. 37A. № 1. P. 17.
Nason D., Fletcher N.H. // J. Chem. Phys. 1975. V. 62. P. 4444.
Orem M., Adamson A.W. // J. Colloid Interface Sci. 1969. V. 31. P. 278.
Adamson A.W., Shirley F.P., Kunichika K.T. // J. Colloid Interface Sci. 1970. V. 34. P. 461.
Fletcher N.H. // Surf. Sci. 1982. V. 115. P. 103.
Tasaki Y., Okada T. // Anal. Chem. 2006. V. 78. P. 4155.
Птицын А.Б. // Геохимия. 1998. № 12. С. 1291.
Ушакова Л.А. ЯМР дисперсного льда. Автореф. дис. … канд. физ.-мат. наук. М.: МГУ, 1975.
Справочник химика. Т. III. М.–Л.: Химия, 1965.
Федосеева В.И., Нечаев Е.А., Стрельцова О.А. // Коллоид. журн. 1977. Т. 39. С. 1009.
Нечаев Е.А., Федосеева В.И., Федосеев Н.Ф. // Журн. физ. химии. 1981. Т. 55. С. 1822.
Fedoseeva V.I., Nechaev E.A. // Permafrost Fourth International Conference. Washington, 1984. Final Proceedings. Washington: Nat. Acad. Press, 1984. P. 222.
Нечаев Е.А., Иванов И.А. // Коллоид. журн. 1974. Т. 36. С. 583.
Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высшая школа, 1973.
Kvlividze V.I., Kiselev V.F., Kurzaev A.B., Ushakova L.A. // Surf. Sci. 1974. V. 44. P. 60.
Федосеева В.И., Федосеев H.Ф. // Коллоид. журн. 2010. Т. 72. C. 574.
Федосеева В.И., Федосеев H.Ф., Бурнашева М.П. // Коллоид. журн. 2015. Т. 77. С. 812.
Fedoseeva V.I., Fedoseev N.F., Burnasheva M.P. // Earth’s Cryosphere. 2018. V. 22. № 1. P. 25.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


