Коллоидный журнал, 2021, T. 83, № 2, стр. 171-178
Адсорбция катехоламинов на поверхности нанокристаллического диоксида титана
Н. Н. Власова 1, *, О. В. Маркитан 1
1 Институт химии поверхности им. А.А. Чуйко Национальной академии наук Украины
03164 Киев, ул. Генерала Наумова 17, Украина
* E-mail: natalie.vlasova@gmail.com
Поступила в редакцию 14.09.2020
После доработки 28.09.2020
Принята к публикации 05.10.2020
Аннотация
Изучена адсорбция некоторых катехоламинов из водных растворов на поверхности диоксида титана в зависимости от pH и концентрации сорбента. Экспериментальные данные интерпретированы на основе теории комплексообразования на поверхности. Рассчитаны константы устойчивости внутрисферных ковалентных комплексов, образующихся в результате взаимодействия гидроксильных групп катехоламинов с функциональными группами диоксида титана.
ВВЕДЕНИЕ
Благодаря превосходной биосовместимости, физико-химической стабильности, нетоксичности диоксид титана является многообещающим материалом для широкого применения в различных областях науки, технологии и медицины [1–14]. Использование титановых имплантатов оказалось весьма успешным благодаря тому, что на их поверхности образуется слой оксида титана, совместимого с тканями организма [9, 10]. При контакте оксида и биологических систем особенно важны знания о механизме взаимодействия компонентов клеток и биомолекул с поверхностью оксида [15, 16]. Функционализация наночастиц на основе диоксида титана приводит к созданию материалов, которые обладают большим сродством к биологическим и природным системам. Одним из способов получения таких материалов является закрепление на поверхности оксида органических молекул, которые при этом играют роль якоря, например, для присоединения биополимеров.
Широкое применение в качестве модификаторов поверхности диоксида титана нашли производные пирокатехина – катехоламины [7, 11–13]. Одним из них является дофамин – гормон и нейтротрансмиттер, необходимый для нормального функционирования центральной нервной системы [15–18]. Диоксифенилаланин (ДОФА), предшественник дофамина при его синтезе в организме [19, 20], применяется в качестве лекарственного препарата. Было установлено, что именно эта аминокислота определяет биоадгезивные свойства особых белков, содержащихся в мидиях и используемых ими для прикрепления к камням [21, 22]. Это открытие стимулировало многочисленные исследования в области разработки новых клеев и противообрастающих материалов [23, 24]. Большинство имеющихся литературных данных посвящено изучению строения и физико-химических свойств материалов, полученных при закреплении биомолекул на поверхности диоксида титана [25–30]. Гораздо меньше внимания уделено процессу создания таких композитных материалов, а именно количественной характеристике адсорбционных равновесий на межфазной поверхности диоксид титана/водный раствор электролита. Замечательная работа по адсорбции диоксифенилаланина на поверхности рутила из водных растворов [31] является, скорее, исключением.
В настоящей работе изучена адсорбция некоторых катехоламинов (дофамина, норадреналина и их предшественника – ДОФА) из водных растворов на поверхности нанокристаллического диоксида титана (анатаза), и на основании теории комплексообразования определены термодинамические параметры адсорбционных равновесий.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали нанокристаллический порошок диоксида титана (Aldrich) с удельной поверхностью 62 ± 5 м2/г (NOVA 1200, Quantachrome), который по данным рентгенофазового анализа представляет собой анатаз с размером частиц 30 нм, что соответствует величине, заявленной производителем (<25 нм).
Катехоламины – 2-(3,4-диоксифенил)-этиламина гидрохлорид (дофамин, “ч. д. а.”, Sigma-Aldrich), 1-(3,4-диоксифенил)-2-аминоэтанола гидрохлорид (норадреналин, “ч. д. а”, Sigma-Aldrich), 3,4-диоксифенилаланина гидрохлорид (ДОФА, “ч.”, Reanal), аминокислоты – β-фенил-α-аланина гидрохлорид, тирозина гидрохлорид (“ч.”, Reanal) и биогенные амины – 2-(4-оксифенил)-этиламина гидрохлорид (тирамин, “ч. д. а”, Fluka) и 2-индолилэтиламин гидрохлорид (триптамин, “ч. д. а”, Fluka) использовались без дополнительной очистки. Для установления необходимых значений pH растворов и суспензий применяли стандарт-титры HCl и NaOH (Titrisol, Merck, Германия).
Все растворы и суспензии были приготовлены на бидистиллированной воде, через которую предварительно пропускали аргон для предотвращения окисления катехоламинов.
Для изучения зависимости адсорбции катехоламинов от pH были приготовлены серии суспензий с различными значениями pH на фоне 0.01 М NaCl (“ч. д. а”, Merck). Концентрация диоксида титана в таких суспензиях составляла 1 или 5 г/л, катехоламинов – 1 ммоль/л. Во время приготовления суспензий и регулирования их pH через растворы пропускали аргон. Суспензии выдерживали при температуре 20 ± 2°C в закрытых пробирках, обернутых алюминиевой фольгой для предотвращения воздействия света, в течение 1–1.5 ч. После проверки значений pH (иономер ЭВ-74) отделяли твердую фазу центрифугированием (8000 об./мин, 20 мин).
Концентрации катехоламинов в растворе определяли спектрофотометрически (Specord М-40, Carl Zeiss), предварительно изучив зависимости спектров поглощения от концентрации и pH раствора. Величины адсорбции были рассчитаны по разности концентраций в суспензии до и после адсорбции и выражены в процентах от исходной концентрации катехоламина.
Осадки, отделенные при центрифугировании, промывали 0.01 М водным раствором NaCl, промокали и высушивали в эксикаторе, заполненном аргоном, при комнатной температуре в темноте. Спектры поглощения твердых образцов диоксида титана с адсорбированными катехоламинами регистрировали в режиме диффузного отражения на спектрофотометре Specord М-40, используя специальную приставку.
Для количественной обработки экспериментальных данных по адсорбции катехоламинов в зависимости от pH в рамках теории комплексообразования на поверхности [32] нами были использованы базовая модель Штерна [33] и программа GRFIT [34]. При моделировании адсорбционных кривых по программе GRFIT составляется матрица компонентов, взаимодействие которых приводит к образованию всех частиц в системе. К материальным компонентам относятся гидроксильные группы диоксида титана, ионы фонового электролита, адсорбат (в исходной форме) и протоны. Электрические составляющие ехр0 и ехр1, которые соответствуют величинам зарядов частиц в плоскостях 0 и 1 [33], дополняют матрицу. Константы равновесия реакций протонирования и ионизации поверхностных функциональных групп и их взаимодействия с ионами Na+ и Cl– были определены нами ранее по данным потенциометрического титрования суспензий диоксида титана при разных значениях ионной силы [35]. Константы равновесия реакций образования комплексов на поверхности рассчитываются методом итерации при обработке экспериментальных данных с помощью программы GRFIT.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Дофамин, норадреналин и диоксифенилаланин, структурные формулы которых представлены в табл. 1, относятся к группе катехоламинов, т.е. являются производными 1,2-диоксибензола (пирокатехина). Эти молекулы представляют собой звенья биохимической цепи: ДОФА является предшественником дофамина, из которого затем образуется норадреналин.
Таблица 1.
Константы ионизации катехоламинов (0.01 М NaCl)
| Катехоламин | pK(OHцикл) | pK(${\text{NH}}_{3}^{ + }$) |
|---|---|---|
 дофамин
дофамин
|
8.81 | 10.52 |
 норадреналин
норадреналин
|
8.53 | 9.75 |
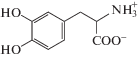 диоксифенилаланин
диоксифенилаланин
|
8.93 | 10.15 |
В молекулах дофамина и норадреналина, помимо двух гидроксильных групп в бензольном кольце, содержатся аминогруппы, склонные к протонированию, поэтому в широком интервале значений pH эти катехоламины присутствуют в водных растворах в виде катионов. ДОФА является аминокислотой, производным фенилаланина, и в водных растворах (2 < pH < 8) существует преимущественно в виде цвиттер-иона. Определение последовательности отщепления протонов при изменении pH и величин констант ионизации было предметом многочисленных исследований [36–50]. Константы ионизации гидроксильных групп в пирокатехиновом кольце, pK(OHцикл), и протонированных аминогрупп, pK(${\text{NH}}_{3}^{ + }$), близки по величине, поэтому наибольшее затруднение вызывал вопрос определения центров отщепления протонов. В настоящее время доказано, что первым отщепляется протон гидроксильной группы пирокатехина, вторым – протонированной аминогруппы. В области высоких значений pH > 12 происходит ионизация второй гидроксильной группы пирокатехина. Определение точной величины этой константы ионизации является сложной задачей, однако в наших экспериментальных условиях (интервал pH 2–9) ионизацией второй гидроксильной группы пирокатехинового кольца можно пренебречь. В случае ДОФА первым отщепляется протон карбоксильной группы (pK = 2.2–2.4), затем ионизация проходит по той же схеме, что и для других исследованных катехоламинов. В табл. 1 представлены константы ионизации изученных нами катехоламинов, перечитанные на ионную силу 0.01 М.
Ионизация катехоламинов приводит к заметным изменениям в УФ-спектрах поглощения. В спектрах водных растворов исследованных соединений наблюдается полоса поглощения средней интенсивности (коэффициент молярного поглощения 2700–2800 л/(моль см)) с максимумом вблизи 280 нм, который несколько сдвигается в сторону бóльших длин волн при pH > 8. На рис. 1 представлены спектры поглощения водных растворов дофамина и ДОФА в зависимости от pH. Изменения в спектрах поглощения соответствуют ионизации гидроксильной группы, при этом π-электронная система ароматического кольца увеличивается в результате появления дополнительной пары n-электронов [51]. Полосы поглощения в спектрах норадреналина также претерпевают батохромный сдвиг при повышении pH, подтверждая, таким образом, положение о том, что первой ионизируется гидроксильная группа пирокатехинового кольца. Эти изменения в спектрах катехоламинов – положения полосы поглощения и ее интенсивности – были учтены при определении их равновесной концентрации после адсорбции на поверхности диоксида титана.
Рис. 1.
Спектры поглощения водных растворов катехоламинов в зависимости от pH: (а) дофамина при значениях pH 3, 5, 6 (1), 7.5 (2), 8.2 (3), 8.6 (4), 9.2 (5) и (б) диоксифенилаланина при pH 3.5, 6, 7 (1), 7.9 (2), 8.2 (3), 8.5 (4).

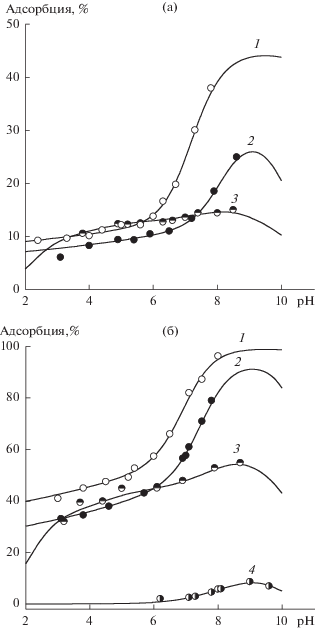
На рис. 2 показаны результаты изучения адсорбции катехоламинов из водных растворов в зависимости от pH и концентрации диоксида титана. Адсорбция всех изученных катехоламинов повышается при увеличении pH, степень извлечения сорбатов из раствора существенно возрастает при повышении концентрации диоксида титана.
Рис. 2.
Зависимости адсорбции (1) дофамина, (2) норадреналина, (3) диоксифенилаланина и (4) триптамина от pH при концентрации TiO2 1 (а) и 5 г/л (б); концентрация катехоламинов 1 ммоль/л, 0.01 М Na-Cl.
Для выбора возможных реакций комплексообразования на поверхности были проанализированы имеющиеся литературные данные по адсорбции пирокатехина и его производных [52–57]. В этих работах было установлено, что гидроксильные группы катехолов непосредственно взаимодействуют с функциональными группами поверхности диоксида титана с образованием ковалентных связей Ti–O–C. Открытым остается вопрос о точной стехиометрии реакций комплексообразования, так как принимать участие в связывании с поверхностью могут либо одна, либо обе гидроксильные группы катехолов. Результатом взаимодействия одной гидроксильной группы с одной поверхностной TiOH-группой является монодентатный комплекс. Участие в комплексообразовании двух гидроксильных групп приводит к образованию нескольких структур. При связывании двух OH-групп пирокатехина с одним и тем же атомом титана образуется хелатный комплекс; следствием взаимодействия двух OH-групп пирокатехина с двумя соседними TiOH-группами является образование бидентатного мостикового (или биядерного) комплекса. Наиболее вероятным нам представляется образование бидентатных комплексов в соответствии со следующей схемой:
Заместитель R в молекуле катехоламина представляет собой –CH2CH2${\text{NH}}_{3}^{ + }$ для дофамина, ‒CH2CH(OH)${\text{NH}}_{3}^{ + }$ для норадреналина и ‒CH2CH(COO–)${\text{NH}}_{3}^{ + }$ для ДОФА.Возможность образования таких бидентатных комплексов подтверждается соответствием расстояний между атомами кислорода соседних TiOH групп на поверхности оксида (0.32 нм) и атомами кислорода в катехолах (0.29 нм) [27]. В работе [28] методом NEXAFS было установлено, что молекула дофамина адсорбируется бидентатно на поверхности диоксида титана, при этом бензольное кольцо ориентировано относительно поверхности перпендикулярно.
Зависимость адсорбции изученных катехоламинов от pH можно объяснить следующим образом: в кислой области взаимодействию адсорбирующихся молекул и поверхностных гидроксильных групп препятствует взаимное отталкивание положительно заряженных групп $ \equiv {\kern 1pt} {\text{TiOH}}_{2}^{ + }$ диоксида титана и ${\text{NH}}_{3}^{ + }$-групп адсорбатов. При увеличении pH концентрация протонированных групп на поверхности TiO2 уменьшается и вероятность образования бидентатного комплекса повышается. На рассчитанных адсорбционных кривых наблюдаются максимумы при pH > 9, после которых величины адсорбции несколько уменьшаются. Это может быть связано с образованием в растворе анионных форм катехоламинов, которые испытывают отталкивание от отрицательно заряженной поверхности диоксида титана. Именно поэтому экспериментальные условия были ограничены значениями pH < 9, так как анионные формы катехоламинов подвергаются окислению в большей степени.
В табл. 2 приведены реакции комплексообразования катехоламинов на поверхности диоксида титана, при учете которых достигается наилучшее соответствие экспериментальных и рассчитанных адсорбционных кривых. Для воспроизведения кривой адсорбции необходимо учитывать две реакции комплексообразования, одна из которых протекает с отщеплением протона и изменением заряда частицы, связанной с поверхностью диоксида титана. Все комплексы относятся к внутрисферным, поскольку при их формировании функциональные группы адсорбатов непосредственно взаимодействуют с поверхностными группами диоксида титана с образованием ковалентных связей ≡Ti–O–C.
Таблица 2.
Константы равновесия реакций комплексообразования катехоламинов на поверхности диоксида титана (lg K ± 0.05)
| № реакции | Реакция на поверхности | Константа равновесия реакции | Дофамин | Норадреналин | ДОФА | |||
|---|---|---|---|---|---|---|---|---|
| 1 г/л | 5 г/л | 1 г/л | 5 г/л | 1 г/л | 5 г/л | |||
| 1 | 2(≡TiOH) + (HO)2LH+ ⇄ ⇄ (≡TiO)2LH+ + 2H2O | $K = \frac{{{\text{[(TiO}}{{{\text{)}}}_{{\text{2}}}}{\text{L}}{{{\text{H}}}^{ + }}{\text{]}}}}{{{\text{[TiOH][(HO}}{{{\text{)}}}_{{\text{2}}}}{\text{L}}{{{\text{H}}}^{ + }}{\text{]}}}}{\text{exp}}{{{\text{(}}F{{\Psi }_{1}}} \mathord{\left/ {\vphantom {{{\text{(}}F{{\Psi }_{1}}} {RT{\text{)}}}}} \right. \kern-0em} {RT{\text{)}}}}$ | 5.40 | 5.35 | 5.33 | 5.30 | ||
| 2 | 2(≡TiOH) + (HO)2LH+ ⇄ ⇄ (≡TiO)2L + 2H2O + H+ | $K = \frac{{{\text{[(TiO}}{{{\text{)}}}_{{\text{2}}}}{\text{L][}}{{{\text{H}}}^{ + }}{\text{]}}}}{{{\text{[TiOH][(HO}}{{{\text{)}}}_{{\text{2}}}}{\text{L}}{{{\text{H}}}^{ + }}{\text{]}}}}$ | –3.19 | –3.24 | –3.91 | –3.94 | ||
| 3 | 2(≡TiOH) + (HO)2L ⇄ ⇄ (≡TiO)2L + 2H2O | $K = \frac{{{\text{[(TiO}}{{{\text{)}}}_{{\text{2}}}}{\text{L]}}}}{{{\text{[TiOH][(HO}}{{{\text{)}}}_{{\text{2}}}}{\text{L]}}}}$ | 5.62 | 5.57 | 4.62 | 4.58 | ||
| 4 | 2(≡TiOH) + (HO)2LH± ⇄ ⇄ (≡TiO)2LH± + 2H2O | $K = \frac{{{\text{[(TiO}}{{{\text{)}}}_{{\text{2}}}}{\text{L}}{{{\text{H}}}^{ \pm }}{\text{]}}}}{{{\text{[TiOH][(HO}}{{{\text{)}}}_{{\text{2}}}}{\text{L}}{{{\text{H}}}^{ \pm }}{\text{]}}}}$ | 2.55 | 2.68 | ||||
| 5 | 2(≡TiOH) + (HO)2LH± ⇄ ⇄ (≡TiO)2L– + 2H2O + H+ | $K = \frac{{{\text{[(TiO}}{{{\text{)}}}_{{\text{2}}}}{{{\text{L}}}^{ - }}{\text{][}}{{{\text{H}}}^{ + }}{\text{]}}}}{{{\text{[TiOH][(HO}}{{{\text{)}}}_{{\text{2}}}}{\text{L}}{{{\text{H}}}^{ \pm }}{\text{]}}}}\exp ({{ - F{{\Psi }_{1}}} \mathord{\left/ {\vphantom {{ - F{{\Psi }_{1}}} {RT}}} \right. \kern-0em} {RT}})$ | –3.48 | –3.34 | ||||
| 6 | 2(≡TiOH) + (HO)2L– ⇄ ⇄ (≡TiO)2L– + 2H2O | $K = \frac{{{\text{[(TiO}}{{{\text{)}}}_{{\text{2}}}}{{{\text{L}}}^{ - }}{\text{]}}}}{{{\text{[TiOH][(HO}}{{{\text{)}}}_{{\text{2}}}}{{{\text{L}}}^{ - }}{\text{]}}}}\exp ({{ - F{{\Psi }_{1}}} \mathord{\left/ {\vphantom {{ - F{{\Psi }_{1}}} {RT}}} \right. \kern-0em} {RT}})$ | 5.35 | 5.49 | ||||
Дофамин и норадреналин адсорбируются на поверхности в виде катионов и нейтральных молекул. При исследовании методом NEXAFS [28] строения дофамина, адсорбированного на поверхности TiO2, были обнаружены два сигнала 1s электронов атомов азота, один из которых относится к NH2-группе, а второй, скорее всего, отвечает протонированной группе ${\text{NH}}_{3}^{ + }$.
Цвиттер-ионная форма ДОФА в составе поверхностного комплекса при дальнейшей ионизации превращается в анион. Авторы работы [31], посвященной изучению адсорбции ДОФА на поверхности рутила, для моделирования адсорбционной кривой также предположили образование комплексов двух типов. Один из них, так называемый “lying down”, характеризуется 4-мя центрами взаимодействия с поверхностью за счет образования трех ковалентных и одной водородной связи. Второй комплекс, названный ими “standing up”, связан с поверхностью одной ковалентной и одной водородной связями. По нашему мнению, такое строение комплексов, а именно образование связей определенного типа, ковалентных или водородных, требует дополнительного подтверждения физико-химическими методами. Следует также отметить, что предположенная нами стехиометрия реакций комплексообразования не противоречит допущениям авторов этой статьи. Образование бидентатных комплексов с участием OH-групп пирокатехинового кольца не исключает возможности формирования дополнительных связей между функциональными группами катехоламинов и поверхностью TiO2.
Комплексы аминов и аминокислоты различаются величинами заряда и вследствие этого уравнениями констант равновесия реакций. В большинстве моделей комплексообразования на поверхности в уравнение константы равновесия реакции концентрация активных групп оксида входит в такой степени, которая соответствует стехиометрии его взаимодействия с адсорбируемыми молекулами. Нам кажется более правильным, по аналогии с положениями координационной химии, рассматривать поверхность оксида как полидентатный лиганд, показатель степени концентрации которого не зависит от того, сколько активных групп принимают участие в связывании адсорбата. Необходимо принять во внимание, что наличие 2-х функциональных групп в непосредственной близости друг от друга приводит к уменьшению их концентрации на поверхности вдвое. Для расчета констант равновесия реакций комплексообразования была использована величина концентрации поверхностных групп, в два раза меньшая, чем та, что была определена путем титрования суспензий диоксида титана [35].
В табл. 2 представлены константы равновесия реакций комплексообразования, рассчитанные по программе GRFIT на основании экспериментальных данных об адсорбции катехоламинов из суспензий с концентрацией диоксида титана 1 и 5 г/л. Величины константы равновесия довольно близки для обоих значений концентрации оксида.
Константы равновесия реакций 1 и 4 можно рассматривать как константы устойчивости соответствующих комплексов, образующихся на поверхности. Логарифмы констант равновесия реакций 2 и 5, протекающих с выделением протонов, являются отрицательными величинами. Они могут быть пересчитаны в константы устойчивости соответствующих поверхностных комплексов (реакции 3 и 6) c учетом констант ионизации катехоламинов.
На рис. 3 представлены диаграммы распределения адсорбционных комплексов катехоламинов на поверхности диоксида титана в зависимости от pH, рассчитанные с использованием констант равновесия реакций комплексообразования.
Рис. 3.
Диаграммы распределения комплексов катехоламинов на поверхности диоксида титана в зависимости от pH. (а) Комплексы ≡(TiO)2LH+ (1) и ≡(TiO)2L (2) дофамина, (б) комплексы ≡(TiO)2LH+ (1) и ≡(TiO)2L (2) норадреналина, (в) комплексы ≡(TiO)2LH± (1) и ≡(TiO)2L– (2) диоксифенилаланина.

Для того чтобы подтвердить важную роль гидроксильных групп катехоламинов в реакции образования комплексов, мы изучили адсорбцию родственных соединений. Для ДОФА в качестве таковых были выбраны 2 аминокислоты – фенилаланин, не содержащий в бензольном кольце гидроксильных групп, и тирозин, в бензольном кольце которого имеется только одна гидроксильная группа. Оказалось, что эти вещества практически не адсорбируются на поверхности диоксида титана в аналогичных экспериментальных условиях, так же как и тирамин – амин, в ароматическом кольце которого в отличие от дофамина присутствует одна гидроксильная группа. Степень взаимодействия других биогенных аминов с поверхностью диоксида титана удалось оценить на примере триптамина, в состав которого входит индольное кольцо. На рис. 2б (кривая 4) показана адсорбция триптамина из водных растворов на поверхности анатаза. Адсорбционная кривая воспроизводится при условии образования внешнесферного комплекса ≡TiO–LH+ (константа устойчивости lg K = 2.08), компоненты которого связаны электростатическими взаимодействиями. Очевидно, что форма адсорбционной кривой и величины адсорбции существенно отличаются от таковых для катехоламинов.
Участие гидроксильных групп пирокатехинового кольца в комплексообразовании подтверждается спектрами поглощения твердых образцов TiO2 с адсорбированными катехоламинами: все они окрашены в желто-коричневый цвет в большей или меньшей степени. На рис. 4 представлены спектры поглощения образцов оксида с дофамином и ДОФА, адсорбированными из растворов с различными значениями pH. Окрашивание этих образцов определяется появлением полосы переноса заряда от катехоламина на ион металла. Перекрываясь с интенсивными полосами поглощения самого диоксида титана в УФ-области, эта полоса проявляется в видимой области спектра в виде “хвоста”, интенсивность которого повышается при увеличении концентрации адсорбированного катехоламина. Аналогичные полосы появляются в спектрах адсорбированного норадреналина. Полученные результаты согласуются со спектрами поглощения комплексных соединений катехолов, образующихся при их связывании с ионами титана(IV) в водных растворах [58, 59] и с наноразмерными (1 и 5 нм) частицами TiO2 [60].
Рис. 4.
Спектры поглощения порошков “чистого” диоксида титана (1), с дофамином, адсорбированным из растворов с pH 3 (2), 5 (3), 7 (4), и с диоксифенилаланином, адсорбированным из раствора с pH 7.9 (5).

Таким образом, количественно охарактеризована адсорбция некоторых катехоламинов на поверхности диоксида титана, объяснена зависимость их адсорбции от pH. Показано, что основной вклад в образование адсорбционных комплексов вносят ковалентные взаимодействия гидроксильных групп катехоламинов и поверхности оксида, хотя возможна реализация и других типов взаимодействия между функциональными группами сорбента и сорбатов. На основании полученных результатов могут быть выбраны условия синтеза новых гибридных бионеорганических материалов на основе диоксида титана, которые весьма востребованы во многих отраслях биомедицины.
Список литературы
Ye Q., Zhou F., Lin W. // Chem. Soc. Rev. 2011. V. 40. P. 4244.
Rajh N., Dimitrijevic N.M., Bissonnette M. et al. // Chem. Rev. 2014. V. 114. P. 10 177.
Wu S., Weng Z., Liu X. et al. // Adv. Funct. Mater. 2014. V. 24. P. 5464.
Langer R., Vacanti J.P. // Science. 1993. V. 260. P. 920.
Brammer K.S., Oh S., Gallagher J.O. et al. // Nano Lett. 2008. V. 8. P. 786.
Signoretto M., Ghedini E., Nichele V. et al. // Micropor. Mesopor. Mater. 2011. V. 139. P. 189.
Chen W.J., Tsai P.J., Chen Y.C. // Small. 2008. V. 4. P. 485.
Chen Z.Y., Hu Y., Liu T.C. et al. // Thin Solid Films. 2009. V. 517. P. 4998.
Tengvall P., Lundstrom I. // Clin. Mater. 1992. V. 9. P. 115.
Kasemo B., Lausmaa J. // Crit. Rev. Biocompat. 1986. V. 2. P. 335.
Lee H., Scherer N.F., Messersmith P.B. // Proc. Natl. Acad. Sci. USA. 2006. V. 103. P. 12 999.
Liu J.Q., de la Garza L., Zhang L. G. et al. // Chem. Phys. 2007. V. 339. P. 154.
Vega-Arroyo M., LeBreton P.R., Zapol P. et al. // Chem. Phys. 2007. V. 339. P. 164.
Rajh T., Saponjic Z., Liu J.Q. et al. // Nano Lett. 2004. V. 4. P. 1017.
Wightman R.M., May L.J., Michael A.C. // Anal. Chem. 1988. V. 60. P. 729.
Ellingsen J.E. // Biomaterials. 1991. V.12. P. 593.
Martin J.Y., Schwartz Z., Hummert T.W. // J. Biomed. Mater. Res. 1995. V. 29. P. 389.
Zhang A., Naumeyer J., Baldessarini R.J. // Chem. Rev. 2007. V. 107. P. 274.
Kojima K., Parvez H., Parvez S., Nagatsu T. // Techniques in the Behavioral and Neural Sciences. Ed. by Parvez S.H., Naoi M., Nagatsu T., Parvez S. 1993. V. 11. Part 1. P. 349.
Guvendiren M., Brass D.A., Messersmith P.B., Shull K.R. // J. Adhes. 2009. V. 85. P. 631.
Waite J.H. // Bioartificial Organs: Technology, Medicine, and Materials. Ed. by Hunkeler D., Prokop A., Cherrington A.D., Rajotte R.V., Sefton M. New York: Academic Sciences, 1999. V. 875. P. 301.
Lin Q., Gourdon D., Sun C.J. et al. // Proc. Natl. Acad. Sci. USA. 2007. V. 104. P. 3782.
Hwang D.S., Zeng H.B., Masic A. et al. // J. Biol. Chem. 2010. V. 285. P. 25850.
Statz A.R., Meagher R.J., Barron A.E., Messersmith P.B. // J. Am. Chem. Soc. 2005. V. 127. P. 7972.
Rajh T., Chen L.X., Lukas K. et al. // J. Phys. Chem. B. 2002. V. 106. P. 10 543.
Vega-Arroyo M., LeBreton P.R., Rajh T. et al. // Chem. Phys. Lett. 2005. V. 406. P. 306.
Anderson T.H., Yu J., Estrada A. et al. // Adv. Funct. Mater. 2010. V. 20. P. 4196.
Syres K., Thomas A., Bondino F. et al. // Langmuir. 2010. V. 26. P. 14548.
Urdaneta I., Keller A., Atabek O. et al. // J. Phys. Chem. C. 2014. V. 118. P. 20688.
Ronchi C., Seli D., Pipompong W., Di Valentin C. // J. Phys. Chem. C. 2019. V. 123. P. 7682.
Bahri S., Jonsson C.M., Jonsson C.L. et al. // Environ. Sci. Technol. 2011. V. 45. P. 3959.
Davis J.A., Kent D.B. // Rev. Mineral. 1990. V. 23. P. 177.
Westall J.C., Hohl H. // Adv. Colloid Interface Sci. 1980. V. 12. P. 265.
Ludwig C. GRFIT, a Program for Solving Speciation Problems, Evaluation of Equilibrium Constants, Concentrations, and Other Physical Parameters. Internal Report of University of Bern, 1992.
Власова Н.Н., Маркитан О.В., Головкова Л.П. // Коллоид. журн. 2015. Т. 77. С. 441.
Gorton J.E., Jameson R.F. // J. Chem. Soc. A. 1968. P. 2615.
Antikainen P.J., Witikainen U. // Acta Chem. Scand. 1973. V. 27. P. 2075.
Grgaz-Kuznar B., Simeon Vl., Weber O.A. // J. Inorg. Nucl. Chem. 1974. V. 36. P. 2151.
Gergely A., Kiss T. // Inorg. Chim. Acta. 1976. V. 51. P. 16.
Armstrong J., Barlow R.B. // Br. J. Pharmacol. 1976. V. 57. P. 501.
Rajan K.S., Davis J.M. // J. Inorg. Nucl. Chem. 1976. V. 38. P. 897.
Rajan K.S., Skripkus A., Marks G.E., Davis J.M. // Bioinorg. Chem.1976. V. 6. P. 93.
Mack F., Bönisch H. // Naunyn-Schmiedeberg’s Arch. Pharmacol. 1979. V. 310. P. 1.
Kiss T., Gergely A. // Inorg. Chim. Acta. 1979. V. 36. P. 31.
Gergely A., Kiss T., Deak G., Sovago I. // Inorg. Chim. Acta. 1981. V. 56. P. 35.
Sandmann B.J., Luk T.H. // J. Pharm. Sci. 1986. 7V. 5. P. 73.
Gerard C., Chennal H., Hugel R.P. // Polyhedron. 1994. V. 13. P. 591.
Sanchez-Rivera A.E., Corona-Avedano S., Alarcon-Angeles G. et al. // Spectrochim Acta A. 2003. V. 59. P. 3193.
Mirzahosseini A., Palla T., Orgovan G. et al. // J. Pharm. Biomed. Analysis. 2018. V. 158. P. 346.
Mirzahosseini A., Palla T., Orgovan G. et al. // J. Pharm. Biomed. Analysis. 2019. V. 170. P.215.
Штерн Э., Тиммонс К. Электронная абсорбционная спектроскопия в органической химии. М.: Мир, 1974.
Roudriguez R., Blesa M.A., Regazzoni A.E. // J. Colloid Interface Sci. 1996. V. 177. P. 122.
Vasudevan D., Stone A.T. // Environ. Sci. Technol. 1996. V. 30. P. 1604.
Araujo P.Z., Morando P.J., Blesa M.A. // Langmuir. 2005. V. 21. P. 3470.
Lana-Villarreal T., Rodes A., Perez J., Gomez R. // J. Am. Chem. Soc. 2005. V. 127. P. 12601.
Murata Y., Hori H., Taga A., Tada H. // J. Colloid Interface Sci. 2015. V. 458. P. 305.
Finkelstein-Shapiro D., Davidowski S., Lee P. et al. // J. Phys. Chem. C. 2016. V. 120. P. 23625.
Borgias B.A., Cooper S.R., Koh Y.B., Raymond K.M. // Inorg. Chem. 1984. V. 23. P. 1009.
Sever M.J., Wielker J.J. // Dalton Trans. 2004. P. 1061.
Creutz C., Chou M.H. // Inorg. Chem. 2008. V. 47. P. 3509.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал



