Коллоидный журнал, 2021, T. 83, № 4, стр. 443-448
Протомицеллы бромида тетрадецилтрифенилфосфония в водном растворе краунзамещенного фталоцианината магния
Т. Г. Мовчан 1, *, А. И. Русанов 1, 2, Е. В. Плотникова 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
2 Менделеевский центр, Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: movchan_tamara@mail.ru
Поступила в редакцию 05.03.2021
После доработки 11.03.2021
Принята к публикации 12.03.2021
Аннотация
Протомицелла – новый термин коллоидной науки, относящийся к мицеллоподобным агрегатам ПАВ в растворах. В отличие от обычных мицелл протомицеллы не имеют критической концентрации мицеллообразования (ККМ) и образуются постепенно путем адсорбции молекул или ионов ПАВ на солюбилизационном ядре при концентрациях значительно ниже ККМ. Полностью сформировавшаяся протомицелла выглядит как обычная мицелла с солюбилизатом. В настоящей работе методом спектрофотометрии исследован процесс мономеризации заданного количества краунзамещенного фталоцианината магния (I) в домицеллярном водном растворе бромида тетрадецилтрифенилфосфония (II). Показано, что в чисто водном растворе мономеры I отсутствуют, а димеры увеличивают свою численность при добавлении ПАВ II к раствору. Этот феномен строго доказывает существование в водном растворе молекулярных агрегатов I высоких порядков. Определен новый физико-химический параметр мономеризации фталоцианинов – концентрация мономеризации, т.е. концентрация II, соответствующая началу этого процесса. Показано, что мономеризация фталоцианина, начавшаяся задолго до ККМ II, продолжается и выше ККМ, но в замедленном темпе. На этой стадии мономеризация I идет исключительно за счет димеров.
ВВЕДЕНИЕ
Фталоцианины имеют широкое практическое применение. Однако вследствие гидрофобного эффекта фталоцианины в водном растворе находятся в агрегированном состоянии (преимущественно в виде кофациальных димеров), что резко снижает их хромофорную способность и функциональность в целом. Одним из способов предотвращения агрегации фталоцианинов является использование ПАВ, что приобщает мономеризацию фталоцианинов, наблюдаемую в растворах ПАВ, к коллоидной науке. В этом плане совсем недавно [1] (там же приведена литература по мономеризации фталоцианинов) была разработана термодинамическая теория этого явления, суть которого состоит в следующем. При поступлении в раствор молекулы или ионы ПАВ адсорбируются на поверхности димеров и других агрегатов фталоцианинов (роль адсорбционных сил выполняет гидрофобный эффект), причем адсорбция происходит не только на свободной поверхности. Дело в том, что в результате теплового движения все молекулярные агрегаты носят динамический характер. Каждый их них имеет свое время жизни, а также время жизни отдельной молекулы или иона внутри агрегата (о величинах этих времен можно ориентироваться по мицеллам: для них время жизни составляет 1–3 с, а время жизни одной молекулы или иона ПАВ в мицелле – 10–7–10–6 с [2–4]). Время от времени агрегат самопроизвольно распадается, чтобы образоваться вновь. В этот момент и возникает дополнительная адсорбционная поверхность. Она также существует недолго, и сколько молекул или ионов ПАВ успевает на ней адсорбироваться, зависит от концентрации ПАВ в растворе. Ясно, что с увеличением содержания ПАВ степень мономеризации фталоцианинов возрастает.
Здесь возникают два новых явления. Первое состоит в том, что, подобно мицеллообразованию, начало мономеризации характеризуется своим физико-химическим параметром – концентрацией мономеризации. Она представляет собой концентрацию ПАВ, при которой процесс мономеризации становится явным. Этот параметр фиксируется в эксперименте [5–7] и имеет теоретическое обоснование (в [1] для него выведено отдельное уравнение). В процессе мономеризации возрастает и растворимость фталоцианинов в воде. Иными словами, растворимость фталоцианинов в водном растворе ПАВ выше их растворимости в чистой воде. В термодинамике растворов это называется всаливанием, а в коллоидной науке – солюбилизацией. Таким образом, можно сказать, что в отношении фталоцианинов в водной среде ПАВ обладают солюбилизирующими свойствами.
Другое явление состоит в том, что покрытый молекулами или ионами ПАВ молекулярный агрегат фталоцианина ничем не отличается от обычной мицеллы ПАВ с солюбилизатом, роль которого играет этот агрегат. Поскольку все это происходит при концентрациях заметно ниже критической концентрации мицеллообразования (ККМ), т.е. до появления обычных мицелл, по существу речь идет об открытии нового типа мицелл-предшественниц, которых можно назвать протомицеллами. Первоначально этот термин был использован в работах [5–7] применительно к димерам краунзамещенного фталоцианината магния, покрытым ионами ПАВ. Позднее, в работе [8], было дано расширительное толкование данного термина с использованием в качестве солюбилизата любого объекта. Этого толкования мы и будем придерживаться, считая, что протомицеллы характеризуются, во-первых, отсутствием ККМ, а во-вторых – наличием некоторого солюбилизационного ядра как основы формирования протомицеллы. Хотя в наших работах в качестве солюбилизата фигурировала “мягкая материя” (soft matter), возможен и случай, когда ядром протомицеллы служит истинное твердое тело.
В связи с работой [8] отметим один нюанс. Если в растворах ПАВ существует точка начала мономеризации фталоцианинов, то завершение этого процесса также должно быть как-то отмечено. Очевидно, процесс заканчивается, когда димеры фталоцианина истощаются и все количество фталоцианина уже находится в мономерной форме. К такому состоянию система может прийти при концентрации как ниже, так и выше ККМ. В первом случае между точкой (концентрацией) завершения мономеризации и ККМ остается зазор, но первая никак не может считаться характеристическим физико-химическим параметром, ибо просто зависит от количества взятого фталоцианина. Во втором случае, процесс мономеризации продолжается и выше ККМ, но лавина возникающих мицелл быстро его гасит, поглощая мономеры и ускоряя распад остающихся димеров. Таким образом, фактически ККМ становится реперной точкой для завершения мономеризации фталоцианинов в форме протомицелл. Именно этот случай мы наблюдали в работе [8] при исследовании протомицелл додецилсульфата натрия с краунзамещенным фталоцианинатом магния. Но типично ли это для других систем – пока не ясно.
Ранее нам удалось обнаружить эффект мономеризации того же фталоцианина в растворах катионных ПАВ [7, 9, 10], в том числе в присутствии бромида тетрадецилтрифенилфосфония [10]. Данная работа продолжает начатое в [8] исследование протомицелл в системе фталоцианин–ПАВ–вода, но теперь уже на примере бромида тетрадецилтрифенилфосфония с более подробным изучением домицеллярной области ПАВ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методики
В качестве фталоцианина был взят оставшийся от предыдущего исследования [8] краунзамещенный фталоцианинат магния (для краткости будем, как и раньше, обозначать его символом I). В качестве ПАВ использовался бромид тетрадецилтрифенилфосфония (II) производства Acros Organics (содержание основного вещества 99.8%, дальнейшей очистке не подвергался). Структурные формулы веществ I и II показаны на рис. 1а и 1б соответственно. Вода готовилась в виде тридистиллята с удельной электропроводностью не выше 4 × 10–4 См/м при 27°C.
Следуя традициям коллоидной науки [2–4], при нумерации компонентов мы должны считать ПАВ первым (номер 1) как солюбилизатор, а фталоцианин – вторым (номер 2) компонентом как солюбилизат. Получается, что в данном случае символам римских цифр I и II соответствуют арабские числа 2 и 1. Так, концентрация вещества I обозначается ${{с}_{2}}.$ Это создает некоторое неудобство и побуждает читателя к внимательности при чтении формул, за что мы приносим ему извинение.
Главной методикой оставалась спектрофотометрия – измерение оптической плотности A раствора в зависимости от световой длины волны λ и наблюдение за характерными длинами волн для мономеров и димеров фталоцианина. Ранее было установлено, что в диапазоне значений λ = 550–900 нм димерам I соответствует максимум A при λ = 634 нм [8], а мономерам I в растворах II – максимум A в области 684 нм [10], часто сопровождающийся пиком небольшой интенсивности при λ = 617 нм.
Подобные исследования ставятся при постоянстве или химического потенциала фталоцианина (как мы поступали в работах [5–7]) или его массы (как в работе [8]). В данном случае мы выбрали второй вариант и проводили все эксперименты с водным раствором I концентрации с2 = = 1.17 мкМ. Спектры регистрировались по мере прибавления к раствору II и изменения концентрации II ${{с}_{1}}$ в диапазоне 0.012–2 мМ. ККМ II составляет 0.7 мМ [11] и лежит внутри указанного интервала.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 2 приведены электронные спектры поглощения системы I–II–вода. Для удобства обсуждения рис. 2 разделен на четыре части.
Рис. 2.
Электронные спектры поглощения системы I–II–вода в диапазоне длин волн 550–900 нм при концентрации фталоцианина 1.17 мкМ. (а) Область доминирования димеров при концентрации ПАВ (мМ) 0 (кривая 0), 0.012 (1), 0.085 (2), 0.135 (3) и 0.154 (4). (б) Область формирования протомицелл на мономерах фталоцианина при концентрации ПАВ (мМ) 0.204 (5) и 0.241 (6). (в) Преобладание мономеров в домицеллярной области при концентрации ПАВ (мМ) 0.315 (7), 0.357 (8) и 0.437 (9). (г) Переход через ККМ при концентрации ПАВ (снизу вверх) 0.516, 0.651, 0.811, 1.37 и 1.89 мМ. Длина оптического пути l = 1 см.

Рис. 2.
Окончание
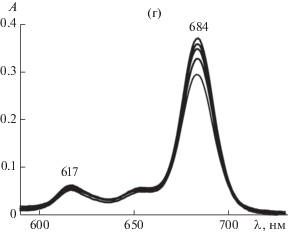
Рисунок 2а соответствует самым малым концентрациям ПАВ. Нулем отмечена кривая, отвечающая отсутствию ПАВ. Это чисто водный раствор I, и здесь мы сразу констатируем наличие димеров (максимум экстинции при λ = 634 нм) и практическое отсутствие мономеров I. Напомним, что такая форма нахождения фталоцианина в водном растворе является следствием гидрофобного эффекта. Переход от кривой 0 к кривой 1 знаменателен, ибо демонстрирует резкое (почти двойное) увеличение концентрации димеров I даже при столь малой добавке ПАВ к раствору по-прежнему в отсутствие ощутимого количества мономеров. При этом возникает вопрос: откуда берутся димеры, если все имеющееся количество I уже находится в растворенном состоянии, а ПАВ только разрушает димеры? Ответ однозначен: единственным источником возникновения новых димеров может быть только разрушение молекулярных агрегатов I более высоких порядков. А, значит, они существуют! С этим мы уже сталкивались в предыдущей публикации [8], что побудило нас отказаться от пренебрежения агрегатами I более высоких порядков [5]. И вот теперь мы сталкиваемся с этим снова. Можно сказать, что возрастание концентрации димеров при переходе от кривой 0 к кривой 1 на рис. 2 дает строгое доказательство существования в растворе молекулярных агрегатов I с числом агрегации больше двух.
Соответствующие кривым 1 и 2 значения концентрации ПАВ еще так малы, что ситуация не меняется, а дальнейшее добавление II к раствору еще больше повышает содержание димеров. На спектре 3 все еще доминируют димеры I, но уже слабо просматриваются и мономеры. Переход от кривой 3 к кривой 4 – это переход от доминирования димеров к доминированию мономеров I. Появляется максимум при λ = 669 нм, близкий к максимуму мономеров I (при λ = 684 нм), и, начиная со спектра 4, все другие спектры соответствуют преобладанию мономеров I. Заметим, что, поскольку все это происходит в растворе ПАВ и как мономеры, так и другие частицы I покрыты молекулами ПАВ, речь идет не просто о мономерах или димерах I, а о соответствующих протомицеллах на их основе.
Рисунок 2б отвечает концентрационной области ПАВ, где спектрофотометрически идентифицируется переход к увеличивающемуся содержанию мономеров I с более выраженной полосой поглощения при λ = 679 нм. Иными словами, в растворе настоящих мицелл II еще нет, но присутствуют протомицеллы II на основе димеров и мономеров I. Протомицеллы на основе мономеров находятся в стадии формирования, что вызывает дрейф их характеристической длины волны λ.
Рисунок 2в соответствует преобладанию мономеров I еще в домицеллярной области II, в которой настоящие мицеллы II также отсутствуют (строго говоря, они могут быть, но их концентрация неощутима). Данные спектрофотометрии (высокоинтенсивная полоса поглощения с максимумом при 683 нм) свидетельствуют о наличии мономеров I (т.е. протомицелл на основе мономеров I) в условиях роста их числа. Кроме того, появляется сопровождающий основную полосу мономера небольшой максимум экстинции в области λ = 617 нм.
Рисунок 2г относится к переходу через ККМ II. Данные спектрофотометрии свидетельствуют о сохранении мономеров I (т.е. протомицелл на основе мономеров I), но в условиях замедления роста их числа после ККМ. Принципиально эта область отличается тем, что в ней происходит массовое образование обычных (“пустых”, т.е. не содержащих солюбилизационных ядер I) мицелл II, которые слабо влияют на экстинцию системы.
Весь экспериментальный материал рис. 2 можно представить более компактно на одном графике зависимости оптической плотности A от концентрации II с1 (при заданной концентрации I), если оставить только точки максимумов для димеров и мономеров I. Такой график приведен на рис. 3, где точки, соответствующие димерам, изображены черными кружками, а мономерам – белыми. Строго говоря, каждому виду точек должна соответствовать одна и та же длина волны λ. Но как для черных точек димеров, так и для белых точек, как мы видели на рис. 2, характеристическая длина волны λ испытывала смещение, возможно связанное с формированием протомицелл на основе мономеров I. Поэтому представление материала на рис. 3 весьма условно, хотя наиболее удобно для обсуждения.
Рис. 3.
Зависимость оптической плотности (A) в максимумах поглощения для димеров (черные кружки) и мономеров (белые кружки) от концентрации II (с1) по спектроскопическим данным рис. 2, т.е. при концентрации I с2 = 1.17 мкМ.

На рис. 3 видно, что при самых малых концентрациях II, когда мономеры I практически отсутствуют и господствуют димеры, их число возрастает с прибавлением II. Разрушительная сила ионов ПАВ направлена на молекулярные агрегаты I более высоких порядков, а димерам пока ничего не угрожает. Однако скоро этому приходит конец. Появление белых точек на рис. 3 означает переход к мономеризации I при распаде его димеров. Еще в работах [5–7] мы писали о возможности введения специального физико-химического параметра “концентрация мономеризации” (с обозначением $с_{1}^{*}$), знаменующего “запуск” процесса мономеризации фталоцианинов в растворах ПАВ. Очевидно, этот параметр можно найти как координату точки пересечения линий, образуемых черными и белыми точками на рис. 3. Эту операцию можно провести алгебраическим путем, используя в качестве первого приближения прямые линии.
Прямая линия, наиболее точно проходящая через черные точки на рис. 3 (линия 1), характеризуется уравнением
где R 2 – квадрат смешанной корреляции, отражающий качество подбора (методом наименьших квадратов) линии для группы точек (в идеале R 2 = 1). Указанное значение 0.8556 – конечно, невелико. Но ведь мы работаем в первом приближении. Что касается белых точек на рис. 3, то в целом они располагаются далеко не на прямой линии. Однако достаточно разбить их на две группы, чтобы уравнения отвечающих им прямых выглядели приемлемо. Для линий 2 и 3, отображающих интенсивную и замедленную мономеризацию I, соответственно получаем хорошие аппроксимации Решая совместно уравнения (1) и (2), находим значение концентрации мономеризации $с_{1}^{*}$ = = 0.12 мМ. Совместное же решение уравнений (2) и (3) приводит к значению ${{с}_{{1к}}}$ = 0.56 мМ, но мы его не будем и комментировать. Ведь мы сами сконструировали этот излом на линии, образуемой белыми точками, в действительности ход линии в этом месте весьма плавный, как это видно на рис. 3. Тем не менее, полученная величина $с_{1}^{*}$ остается в нашем активе, так что с началом мономеризации все в порядке. Как же быть с концом мономеризации? А никакого конца и нет. На рис. 3 видно, что увеличение концентрации мономеров I продолжается весьма стабильно, хотя уже и малыми темпами даже при концентрации ПАВ выше ККМ (которая, как уже указывалось, составляет для II в отсутствие I около 0.7 мМ). Источником мономеров I теперь уже могут быть только димеры, которые, таким образом, существуют и в мицеллярном растворе.Заметим, что график такого вида, как на рис. 3 с прямыми 2 и 3, уже исследовался в литературе, а точка излома интерпретировалась как ККМ [12]. В работе [8] было установлено, что точка излома и на графике оптической плотности, непосредственно связанной с состоянием фталоцианина, а не ПАВ, также близка к ККМ. Полученное значение ${{с}_{{1к}}}$ практически совпало со значением ККМ додецилсульфата натрия в присутствии I (7.83 мМ), измеренным методом кондуктометрии (оно было немного меньше значения ККМ = 8.34 мМ для чистого додецилсульфата натрия). Однако в работах [8, 12] излом кривой мономеров выглядел более реалистично, тогда как в нашем случае его просто нет.
ЗАКЛЮЧЕНИЕ
Данное исследование подтверждает, что концентрация мономеризации фталоцианина I в растворе ПАВ II ($с_{1}^{*}$ = 0.12 мМ при довольно грубой оценке) имеет значение, существенно меньшее ККМ (0.7 мМ). Это подтверждает, что протомицеллы образуются сами по себе и не обязательно связаны с обычными мицеллами, хотя выше ККМ протомицеллы в принципе могут формироваться и через обычные мицеллы путем солюбилизации. Несомненно, в этой нашей работе величина $с_{1}^{*}$ упрочила свое положение важного физико-химического параметра мономеризации фталоцианинов, чего нельзя сказать о величине ${{с}_{{1к}}},$ которой мы уделили много внимания в предшествующей публикации [8]. Фактически здесь этой величины у нас не было, а мономеризация продолжалась и выше ККМ. Вообще нужно отметить, что экспериментального материала по протомицеллам слишком мало для широких обобщений. Мы находимся на этапе формирования базы данных и приглашаем коллег-коллоидников принять в этом участие.
Список литературы
Русанов А.И. // Коллоид. журн. 2021. Т. 83. С. 205.
Русанов А.И. Мицеллообразование в растворах поверхностно-активных веществ. СПб.: Химия, 1992.
Rusanov A.I. Micellization in Surfactant Solutions. Chemistry Reviews. Vol’pin, M.E., Ed. V. 22, Part 1. Reading: Harwood Academic Publ., 1996. ISBN 90-5702-297-4.
Русанов А.И., Щёкин А.К. Мицеллообразование в растворах поверхностно-активных веществ. 2-е изд., доп. СПб.: Лань, 2016.
Русанов А.И., Мовчан Т.Г., Плотникова Е.В. // Докл. РАН. Химия, науки о материалах. 2020. Т. 425. С. 60.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. С. 75.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. С. 187.
Мовчан Т.Г., Русанов А.И. Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. С. 335.
Мовчан Т.Г., Аверин А.А., Баулин Д.В., Плотникова Е.В., Баулин В.Е., Цивадзе А.Ю. // Коллоид. журн. 2018. Т. 80. С. 528.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Аверин А.А., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2018. Т. 80. С. 694.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В., Соболева И.В. // Коллоид. журн. 2018. Т. 80. С. 308.
Гольдшлегер Н.Ф., Черняк А.В., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю. // Журн. общей химии. 2012. Т. 82. С. 856.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал