Коллоидный журнал, 2021, T. 83, № 4, стр. 436-442
Адсорбция дезоксирибонуклеиновой кислоты на поверхности нанокристаллических диоксидов титана и церия
О. В. Маркитан 1, Н. Н. Власова 1, *
1 Институт химии поверхности им. А.А. Чуйко Национальной академии наук Украины
03164 Киев, ул. Генерала Наумова, 17, Украина
* E-mail: natalie.vlasova@gmail.com
Поступила в редакцию 28.12.2020
После доработки 18.01.2021
Принята к публикации 26.01.2021
Аннотация
Изучена адсорбция дезоксирибонуклеиновой кислоты из водных растворов на поверхности наноразмерных диоксидов титана и церия в зависимости от pH и концентрации адсорбата. Сопоставление данных по адсорбции ДНК, неорганического фосфата и нуклеотидов, которые являются составными звеньями молекул нуклеиновых кислот, и состояния поверхностных функциональных групп оксидов металлов показало, что адсорбция двухцепочечной ДНК осуществляется в основном с участием фосфатного остова молекулы. Гетероциклические основания нуклеотидов не участвуют в адсорбции. Приближение ДНК к поверхности оксидов за счет электростатического притяжения делает возможным и другие типы взаимодействий, например, дисперсионные и образование водородных связей.
ВВЕДЕНИЕ
В последнее время наноразмерные материалы благодаря их уникальным свойствам все чаще применяются в различных областях техники, науки и медицины. Они становятся основой для разработки новых каталитических систем и сенсоров, которые широко используются в биотехнологической сфере, медицине и химии окружающей среды [1–5].
Благодаря низкой токсичности и высокой биосовместимости одними из самых перспективных материалов для таких целей являются нанокристаллические диоксиды титана и церия. Известно, что частицы диоксида церия размером менее 10 нм проявляют специфические окислительно-восстановительные свойства, а именно: они могут действовать как рецепторы свободных радикалов и ингибиторы активных форм кислорода [6–9]. Для использования таких наночастиц в медико-биологических целях были разработаны специальные методы их синтеза [10]. В настоящее время в биомедицине широко используют наноразмерный диоксид титана. Следовательно, понимание природы взаимодействия поверхности оксидов металлов с биообъектами [11–13] является весьма важным вопросом. При использовании сорбентов на основе диоксида титана для хроматографического разделения белков, углеводов, нуклеиновых и жирных кислот [14–18] было выявлено, что наибольшим сродством к диоксиду титана обладают молекулы, содержащие в своем составе фосфатные группы.
Дезоксирибонуклеиновая кислота (ДНК) в последние годы стала доминирующей молекулой в нанобиотехнологии [19–22]. Наиболее интересными и востребованными для разработки биосенсоров, аналитического разделения и доставки генов являются материалы, способные сорбировать нуклеиновые кислоты. Нативная двухцепочечная молекула ДНК представляет собой отрицательно заряженный стержень, что обеспечивает возможность электростатического взаимодействия с поверхностью оксидов.
Ранее нами были установлены механизмы взаимодействия нуклеотидов, которые являются составными звеньями ДНК, с поверхностью нанокристаллических диоксидов титана и церия, а также рассчитаны количественные характеристики их адсорбции на поверхности оксидов [23–25]. Было показано, что адсорбция нуклеотидов на поверхности обоих оксидов определяется электростатическим взаимодействием анионных форм их молекул с протонированными группами сорбентов.
Целью данного исследования было изучение адсорбции ДНК на поверхности нанокристаллических диоксидов титана и церия из водных растворов в зависимости от pH и концентрации сорбата и установление механизма взаимодействия ДНК с поверхностью этих сорбентов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования использовали нанокристаллический порошок диоксида титана (Aldrich) с удельной поверхностью 62 ± 5 м2/г который по данным рентгенофазового анализа представляет собой анатаз, и нанокристаллический порошок диоксида церия (Aldrich) с удельной поверхностью 60 ± 5 м2/г (Nova 1200, Quantachrome), имеющий кубическую кристаллическую решетку флюорита. Размеры частиц обоих оксидов, рассчитанные по уравнению Шеррера, составляют 30 нм, что соответствует размерам, указанным фирмой-производителем (25 нм).
Дезоксирибонуклеиновая кислота из спермы рыб (ДНК, “ч. д. а.”, Sigma-Aldrich), пуриновые и пиримидиновые нуклеотиды в виде натриевых солей: аденозин-5'-монофосфат (АМФ), гуанозин-5'-монофосфат (ГМФ), цитидин-5'-монофосфат (ЦМФ), уридин-5′-монофосфат (УМФ) (“ч.”, Reanal), а также фосфат натрия (Na2HPO4·12H2O, “ч.”, Миранда) были использованы без дополнительной очистки.
Для установления требуемых значений pH растворов и суспензий применяли стандарт-титры HCl и NaOH (Titrisol, Merck, Германия). Для поддержания требуемых значений ионной силы использовали хлорид натрия (“ч. д. а.”, Merck). Все растворы и суспензии готовили на бидистиллированной воде.
Адсорбцию изучали при комнатной температуре (≈20°С) и постоянной ионной силе 0.01 М NaCl. Смешивали равные объемы суспензии одного из диоксидов TiO2 или CeO2 (2 г/л) и раствора ДНК (0.05 г/л). Таким образом, концентрация диоксида в суспензиях составляла 1 г/л, концентрация ДНК – 0.025 г/л. Значение pH растворов доводили до необходимых величин в интервале 2–8 добавлением растворов кислоты или щелочи. Суспензии выдерживали, периодически перемешивая при комнатной температуре, в течение 2 ч. Предварительно было установлено, что этого времени достаточно для установления адсорбционного равновесия. После проверки значений pH (ионометр ЭВ-74) отделяли твердую фазу центрифугированием (8000 об./мин, 20 мин). Для изучения концентрационной зависимости адсорбции ДНК были приготовлены серии суспензий с разной концентрацией ДНК, от 0.005 до 0.05 г/л, концентрацией диоксида 1 г/л и постоянным значением pH, равным 4.5 в случае диоксида титана и 5.3 для диоксида церия. Такие значения pH были выбраны потому, что они устанавливались в суспензии при смешивании равных объемов суспензии оксида и раствора ДНК без добавления буферных растворов.
Концентрацию адсорбированной ДНК определяли по разнице интенсивностей поглощения в УФ-спектре исходного раствора и раствора после адсорбции (спектрофотометр Specord М-40). Для растворов ДНК характерна полоса поглощения с максимумом при 260 нм. Для пересчета концентрации ДНК, адсорбированной на поверхности сорбентов, в моль/г принимали, что для исходного раствора ДНК молярный коэффициент экстинкции ε = 6600 М–1 см–1 при pH 7 [26]. Предварительно были определены зависимости положения и интенсивности максимума поглощения от pH и концентрации раствора. Детали изучения адсорбции нуклеотидов и неорганического фосфата описаны в [24, 27, 28].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Нуклеиновые кислоты или полинуклеотиды представляют собой цепь последовательно связанных между собой нуклеотидов. Нуклеотид, в свою очередь, состоит из гетероциклического основания, связанного с пятичленным углеводом, одна из гидроксильных групп которого соединена с фосфорной кислотой сложноэфирной связью. В зависимости от того, какой из сахаров, 2-дезокси-D-рибоза или D-рибоза, входит в состав нуклеотида, соединения называются соответственно дезоксирибонуклеотидами или рибонуклеотидами. Ковалентно связанные между собой дезоксирибонуклеотиды образуют дезоксирибонуклеиновые кислоты (ДНК), а рибонуклеотиды – рибонуклеиновые кислоты (РНК). В состав ДНК входят два пуриновых дезоксинуклеотида – аденозин- и гуанозинмонофосфат, и два пиримидиновых – цитидин- и тимидинмонофосфат. В молекуле РНК одним из пиримидиновых нуклеотидов является уридинмонофосфат вместо тимидинмонофосфата [29].
ДНК и РНК характеризуются многими общими химическими и физическими свойствами, поскольку представляют собой цепи мононуклеотидних единиц, связанных с помощью фосфодиэфирных мостиков, соединяющих 3'-положение одного мононуклеотида с 5'-положением его соседа. Молекула ДНК состоит из двух правозакрученных полинуклеотидных цепей с общей осью, которые образуют двойную спираль. Эти две полинуклеотидные цепи является антипараллельными, т.е. их 3',5'-фосфодиэфирные межнуклеотидные мостики ориентированы в противоположных направлениях.
Плоскости пуриновых и пиримидиновых оснований направлены внутрь двойной спирали перпендикулярно ее оси и параллельно друг другу. Таким образом, каждое основание одной цепи является спаренным с основанием второй цепи, лежащей в одной с ней плоскости. При этом только определенные пары оснований встраиваются в структуру так, что между ними образуются водородные связи. Три водородные связи образуется в паре аденин–цитозин и две таких связи в паре гуанин–тимин (или урацил). Такая укладка делает систему максимально стабильной [27, 30]. Устойчивость комплементарных пар оснований в двухцепочечной ДНК является функцией pH. Пары оснований наиболее устойчивы при значениях pH от 4 до 11. За пределами этого интервала pH двухцепочечная спираль ДНК постепенно теряет устойчивость и раскручивается [29–31]. Дополнительно стабилизируют систему и гидрофобные взаимодействия между основаниями, расположенными вдоль оси молекулы. Гидрофобные, сравнительно плохо растворимые в воде основания плотно упакованы внутри спирали и недоступны для молекул воды, тогда как ионизированные вторичные фосфатные группы и гидрофильные остатки пентозы локализованы на поверхности молекулы ДНК и контактируют с молекулами воды. Вторичные фосфатные группы, соединяющие соседние мононуклеотиды, характеризуются низким значением pK. Поэтому ДНК является достаточно сильной многоосновной кислотой, которая полностью ионизирована при любом значении pH > 4 [31].
На поверхности диоксидов титана и церия в водных растворах электролитов образуется двойной электрический слой в результате взаимодействия функциональных групп ≡MOH с протонами и ионами электролита [32]. Методом потенциометрического титрования водных суспензий оксидов были определены константы протолитических равновесий поверхностных функциональных групп (протонирования, ионизации и взаимодействия с ионами электролитов) и точки нулевого заряда [24, 27]. Точка нулевого заряда диоксида титана находится при pH 6.5, диоксида церия – при pH 6.3. В кислой среде гидроксильные группы в основном протонированы. При pH выше точки нулевого заряда преобладают ионизированные группы. В точке нулевого заряда концентрации протонированных и ионизированных групп одинаковы, а суммарный заряд поверхности при этом равен нулю.
Адсорбция ДНК, как показано на рис. 1 и 2, постепенно уменьшается при повышении pH и снижении концентрации протонированных поверхностных групп. Сопоставление состояния групп ≡MOH на поверхности оксидов и ДНК в растворе позволяет предположить, что движущей силой адсорбции является электростатическое взаимодействие между противоположно заряженными частицами – протонированными поверхностными группами оксидов и анионами ДНК. Для выяснения вопроса о возможных центрах связывания молекул ДНК с поверхностью оксида было проведено сравнение адсорбционных кривых ДНК, нуклеотидов, которые составляют ДНК, и неорганического фосфата.
Рис. 1.
Адсорбция на поверхности диоксида титана в зависимости от pH: (а) ортофосфата (1) и ДНК (2), (б) нуклеозидмонофосфатов – ГМФ (1), АМФ (2), ЦМФ (3), УМФ (4). ${{С}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 1 г/л, 0.01 M NaCl, CДНК = 76 мкМ, CНМФ = = 100 мкМ.
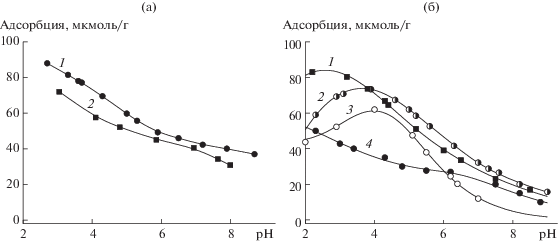
Рис. 2.
Адсорбция на поверхности диоксида церия в зависимости от pH: (а) ортофосфата (1) и ДНК (2), (б) нуклеозидмонофосфатов – ГМФ (1), АМФ (2), ЦМФ (3), УМФ (4). ${{С}_{{{\text{Се}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 1 г/л, 0.01 M NaCl, CДНК = 76 мкМ, CНМФ = = 100 мкМ.

Ранее нами была изучена адсорбция пуриновых и пиримидиновых нуклеотидов [24, 25] на поверхности диоксидов титана и церия (рис. 1, 2). В состав молекул исследуемых нами нуклеотидов входит рибоза, а не дезоксирибоза, как в ДНК. Однако, по нашему мнению, это не является препятствием для сравнения адсорбционных характеристик рибонуклеотидов и ДНК, поскольку углеводная часть молекулы не задействована в образовании фосфодиэфирных мостиков в процессе формирования цепи нуклеиновой кислоты.
Гетероциклические основания в составе нуклеотидов значительно различаются по основности атомов азота. Протонирование активных центров оснований в аденозин-5'-монофосфате и цитидин-5'-монофосфате наблюдается при pH < 4, в гуанозин-5'-монофосфате – при pH < 2.3. Гетероциклические основания тимидин- и уридин-5'-монофосфата в исследуемом интервале pH являются нейтральными [30, 33]. Первичная ионизация фосфатной группы в составе нуклеозидмонофосфатов (НМФ) происходит при pH < 2, а ионизация вторичных групп наблюдается при pH > 6.1 [30, 31]. Формулы и константы ионизации изученных НМФ приведены в табл. 1.
Таблица 1.
Структурные формулы и константы ионизации нуклеотидов [33]
| Формулы нуклеотидов | Константы ионизации, pKn (0.01 M) |
|---|---|
| пуриновые нуклеотиды | |
 Аденозин-5'-монофосфат |
3.83 (N1–H+) 6.46 (–PO3H–) |
 Гуанозин-5'-монофосфат |
2.47 (–N7H+) 6.48 (–PO3H–) |
| пиримидиновые нуклеотиды | |
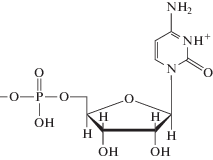 Цитидин-5'-монофосфат |
4.31 (N3–H+) 6.15 (–PO3H–) |
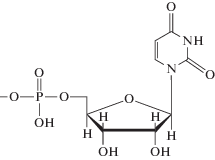 Уридин-5'-монофосфат |
6.04 (–PO3H–) 9.39 (N3–H) |
Рост адсорбции НМФ наблюдается при значениях pH выше того, которое примерно соответствует константе депротонирования атома азота нуклеинового основания. При pH > 6 за счет отталкивания одноименно заряженных анионов и ионизированных поверхностных групп оксидов адсорбция уменьшается. Таким образом, установлено, что на поверхности диоксидов титана и церия образуются устойчивые комплексы за счет электростатического взаимодействия между поверхностными группами $ \equiv {\kern 1pt} {\text{MOH}}_{2}^{ + }$ и анионными формами нуклеотидов, образующимися в результате ионизации фосфатного остатка.
На кривых зависимости адсорбции ДНК от pH отсутствуют какие-либо максимумы, наблюдаемые при адсорбции нуклеотидов и отражающие влияние pH на основность атомов азота нуклеиновых оснований. Исследуемая нами ДНК является двухцепочечной молекулой, следовательно, нуклеиновые основания плотно упакованы внутри спирали и связаны водородными связями между собой, поэтому их депротонирование не оказывает влияния на адсорбцию ДНК.
Адсорбционные кривые ДНК гораздо больше напоминают кривые адсорбции неорганического фосфата [27]. Величины адсорбции ортофосфата выше, поскольку исходные концентрации сорбатов несколько различаются по величине. Кроме того, при адсорбции ДНК возникают определенные стерические препятствия, так как ее молекулы достаточно объемные и, согласно литературным данным [19, 22, 34], принимают не вертикальное положение при адсорбции, а как бы оборачиваются вокруг частичек сорбентов. Сравнение ИК-спектров в работе [35] тоже подтверждает участие в адсорбции фосфатного остова молекул ДНК, тогда как нуклеиновые основания, которые являются составными частями нуклеотидных звеньев нуклеиновых кислот, не задействованы в этом процессе. При исследовании адсорбции нуклеиновых кислот различной природы и длины на поверхности глинистых минералов также было установлено, что связывание полиэлектролита минералами происходит в результате электростатического взаимодействия фосфатных групп остова [36–40].
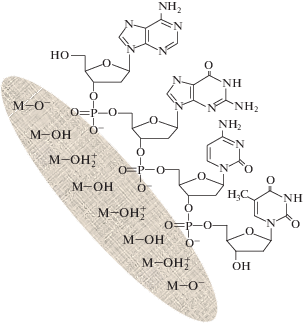
Сближение ДНК с поверхностью оксидов за счет электростатического притяжения делает возможными и другие типы взаимодействий, например, образование водородных связей. На рис. 3 схематически изображено взаимодействие полинуклеотидного фрагмента одной из цепей ДНК с поверхностью оксида металла.
Рис. 3.
Схема адсорбционного взаимодействия полинуклеотидного фрагмента цепи ДНК с поверхностью оксида металла.
Адсорбция ДНК на поверхности обоих оксидов была изучена в зависимости от ее концентрации в растворе. На рис. 4 представлены изотермы адсорбции, которые удовлетворительно описываются уравнением Ленгмюра (R2 = 0.998). Таким образом, в системе существует равновесие адсорбция/десорбция, и процесс адсорбции останавливается на образовании мономолекулярного слоя. Величины максимальной адсорбции (Amax) ДНК составляют: на поверхности TiO2 при адсорбции из водных растворов с pH 4.5–68 мкмоль/г, а на поверхности CeO2 при адсорбции из растворов с pH 5.3–126 мкмоль/г.
Рис. 4.
Изотермы адсорбции ДНК на поверхности CeO2 при pH 5.3 (1) и поверхности TiO2 при pH 4.5 (2). Cоксид = 1 г/л, 0.01 М NaCl.

Были рассчитаны константы образования (K) поверхностных комплексов ДНК–TiO2 и ДНК–CeO2. Полученные значения lg K = 7.06 и 7.67 соответственно, характеризуют связывание ДНК с поверхностью обоих оксидов как очень прочное многоцентровое взаимодействие. Константа адсорбционного равновесия и величина максимальной адсорбции ДНК на поверхности диоксида церия несколько больше, чем те же параметры адсорбции ДНК на поверхности диоксида титана. Это можно объяснить тем, что по данным потенциометрического титрования [24, 27] концентрация активных центров, а, следовательно, и протонированных функциональных групп, на поверхности диоксида церия больше, чем на поверхности диоксида титана.
ВЫВОДЫ
В результате сопоставления данных о влиянии pH на адсорбцию ДНК, ортофосфата и нуклеотидов, которые являются составными звеньями молекул нуклеиновых кислот, и состояние поверхностных функциональных групп диоксидов титана и церия показано, что адсорбция двухцепочечной ДНК осуществляется в основном с участием фосфатного остова молекулы. Приближение молекул ДНК к поверхности оксидов за счет электростатического притяжения фосфат-анионов протонированными группами $ \equiv {\kern 1pt} {\text{МОН}}_{2}^{ + }$ делает возможными и другие типы взаимодействий, например, дисперсионные и образование водородных связей. Гетероциклические основания нуклеотидов не участвуют в процессе адсорбции. Реализация электростатического взаимодействия между молекулами ДНК и поверхностью оксидов способствует возможности нуклеиновой кислоты взаимодействовать с ароматическими соединениями благодаря интеркаляции последних между цепями ДНК. Это, в свою очередь, открывает перспективы для использования таких гибридных систем как компонентов сенсоров и биосовместимых носителей для доставки генов и лекарственных средств.
Список литературы
Moyano D.F., Rotello V.M. // Langmuir. 2011. V. 27. P. 10376.
Lee J., Mahendra S., Alvarez P.J.J. // ACS Nano. 2010. V. 4. P. 3580.
Moghimi S.M., Hunter A.C., Murray J.C. // FASEB J. 2005. V. 19. P. 311.
Fisher J., Egerton T.A. // Inorganic Kirk-Othmer Encyclopedia of Chemical Technology. N.Y.: Wiley-Interscience, 2001. https://doi.org/10.1002/0471238961.0914151805070518. a01.pub2.
Ai J., Biazar E., Jafarpour M., Montazeri M., Majdi A., Aminifard S., Zafari M., Akbari H.R., Rad H.G. // Int. J. Nanomed. 2011. V. 6. P. 1117.
Иванов В.К., Щербаков А.Б., Усатенко А.В. // Успехи химии. 2009. Т. 78. С. 924.
Иванов В.К., Щербаков А.Б., Жолобак Н.М., Иванова О.С. // Природа. 2011. № 3. С. 47.
Щербаков А.Б., Жолобак Н.М., Иванов В.К., Третьяков Ю.Д., Спивак Н.Я. // Биотехнология. 2011. Т. 4. С. 9.
Asati A., Santra S., Kaittanis C. //Angew. Chem. Int. Ed. 2009. V. 48. P. 2308.
Иванов В.К., Полежаева О.С., Шапорев А.С. // Журн. неорг. химии. 2010. Т. 55. С. 368.
Stark W.J. // Angew. Chem. Int. Ed. 2011. V. 50. P. 1242.
Shemetov A.A., Nabiev I., Sukhanova A. // ACS Nano. 2012. V. 6. P. 5668.
Gagner J.E., Shrivastava S., Qian X., Dordick J.S., Siegel R.W. // J. Phys. Chem. Lett. 2012. V. 3. P. 3149.
Engholm-Keller K., Larsen M.R. // J. Proteomics. 2011. V. 75. P. 317.
Matsuda H., Nakamura H., Nakajima T. // Anal. Sci. 1990. V. 6. P. 911.
Kawahara M., Nakamura H., Nakajima T. // Anal. Sci. 1989.V. 5. P. 763.
Ikeguchi Y., Nakamura H. // Anal. Sci. 1997. V. 13. P. 479.
Nawrocki J., Dunlap C., McCormick A., Carr P.W. // J. Chromatogr. A. 2004. V. 1028. P. 1.
Suzuki H., Amano T., Toyooka T. // Environ. Sci. Technol. 2008. V. 42. P. 8076.
Abu-Salah K., Ansari A.A., Alrokayan S.A. // J. Biomed. Biotechn. 2010. https://doi.org/10.1155/2010/715295
Sun Y., Kiang C.-H. // Handbook of Nanostructured Biomaterials and Their Applications in Nanobiotechnology. Vol. 2. Ed. by Nalwa H.S. Houston: American Scientific Publ., 2005. Ch. 5.
Pautler R., Kelly E.Y., Huang P-J.J., Cao J., Liu B., Liu J. // ACS Appl. Mater. Interfaces. 2013. V. 5. P. 6820.
Власова Н.Н., Маркитан О.В. // Поверхность. 2017. Вып. 9(24). С. 96.
Власова Н.Н., Маркитан О.В. // Коллоид. журн. 2019. Т. 81. С. 16.
Власова Н.Н., Маркитан О.В. // Коллоид. журн. 2018. Т. 80. С. 379.
Aslanoglu M. // Anal. Sci. 2006. V. 22. P. 439.
Власова Н.Н. // Коллоид. журн. 2016. Т. 78. С. 700.
Власова Н.Н., Маркитан О.В. // Коллоид. журн. 2020. Т. 82. С. 202.
Ленинджер А. Биохимия: молекулярные основы структуры и функций клетки. М.: Мир, 1976.
Зенгер В. Принципы структурной организации нуклеиновых кислот. М.: Мир, 1987.
Thaplyal P., Bevilacqua P.C. // Methods Enzymol. 2014. V. 549. P. 189.
Davis J.A., Kent D.B. // Rev. Mineral. 1990. V. 23. P. 177.
Smith R.M., Martell A.E., Chen Y. // Pure Appl. Chem. 1991. V. 63. P. 1015.
Zhu R.-R., Wang S.-L., Zhang R., Sun X.-Y., Yao S.-D. // Chin. J. Chem. 2007. V. 25. P. 958.
Zhang X., Wang F., Liu B. // Langmuir. 2014. V. 30. P. 839.
Ferris J.P., Ertem G., Agarwal V.K. // Orig. Life Evol. Biosph. 1989. V. 19. P. 153.
Khanna M., Stozky G. // Appl. Environ. Microbiol. 1992. V. 58. P. 1930.
Ogram A.V., Mathot M.L., Harsh J.B., Boyle J., Pettigrew C.A. // Appl. Environ. Microbiol. 1994. V. 60. P. 393.
Franchi M., Bramanti E., Bonti L.M., Bonzi L.M., Orioli P.L., Vettori C., Gallori E. // Orig. Life Evol. Bi-osph. 1999. V. 29. P. 297.
Cleaves H.J., Grapster-Pregont E., Jonsson C.J., Jonsson C.L., Sverjensky D.A., Hazen R.A. // Chemosphere. 2011. V. 83. P. 1560.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


