Коллоидный журнал, 2021, T. 83, № 5, стр. 572-581
Процессы дезагрегации алкилфосфорилзамещенного фталоцианина в водных системах бромида тетрадецилтриметиламмония
Т. Г. Мовчан 1, *, А. Ю. Чернядьев 1, Е. В. Плотникова 1, А. Ю. Цивадзе 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
* E-mail: movchan_tamara@mail.ru
Поступила в редакцию 13.03.2021
После доработки 18.03.2021
Принята к публикации 19.03.2021
Аннотация
Проведен анализ растворимости в диметилсульфоксиде и дезагрегации в воде под влиянием бромида тетрадецилтриметиламмония (С14ТАБ) безметального фталоцианина, модифицированного четырьмя алкилфосфорильными группами (I). Методами электронной спектроскопии поглощения и люминесцентной спектроскопии установлено, что в диметилсульфоксиде соединение I находится не только в ассоциированном состоянии, как считалось ранее, но и в мономерном, причем в количестве, обеспечивающем излучение высокой интенсивности. В водных же средах в интервале pH 7–9 доминируют агрегаты I, которые разрушаются на отдельные молекулы под влиянием введенного в систему С14ТАБ. По данным электронной спектроскопии поглощения и люминесцентной спектроскопии соединение I в мицеллярном растворе С14ТАБ при рН 7.4 устойчиво к агрегированию не только при 298 К, но и при быстром замораживании до 77 К.
ВВЕДЕНИЕ
Фталоцианины, как известно, относятся к классу циклических тетрапирролов, которые являются близкими структурными аналогами порфиринов. Фталоцианины могут применяться в качестве красителей, пигментов красок, активных компонентов электронно-оптических устройств, термо- и электрохромных материалов. Они также представляют интерес как фотосенсибилизаторы (ФС) генерации синглетного кислорода в фотодинамической терапии (ФДТ)11 [1–4] в силу того, что Q-полосы поглощения фталоцианинов обычно совпадают по энегетическому положению с фототерпевтичеким окном, которое соответствует красному и ближнему ИК-диапазону электромагнитных волн. В настоящее время известны и уже применяются на практике ФС для ФДТ, созданные на основе порфиринов, фталоцианинов, хлоринов и бактериохлоринов – соединений, способных эффективно генерировать синглетный молекулярный кислород и другие активные формы кислорода (см., например, [1–5]). Cенсибилизаторы на основе порфиринов (гематопорфирин и его производные, а также применяемые в настоящее время препараты Фотофрин II, Фотосан-3, Фотогем) относят к ФC первого поколения. Хотя они и отвечают определенным критериям идеального сенсибилизатора [1], однако имеют и ряд недостатков. В частности, в растворах они существуют в виде смеси индивидуальных молекул и их агрегатов, что снижает эффективность генерации синглетного кислорода по сравнению с молекулярным раствором. Поглощение света этими препаратами в диапазоне фототерапевтического окна является недостаточным для поражения обширных и глубоко расположенных опухолей.
Хлорины, бактериохлорины и фталоцианины, как известно, интенсивно поглощают свет в области фототерапевтического окна и поэтому являются более перспективными фотосенсибилизаторами ФДТ по сравнению с препаратами на основе порфиринов. Однако в водных растворах и в живых тканях (pH ≈ 7.4) порфирины, хлорины и фталоцианины обычно существуют в виде агрегатов [1–4], которые в отличие от неагрегированных молекул красителя очень слабо генерируют синглетный молекулярный кислород [1–6].
Проблему агрегации фталоцианинов, порфиринов и хлоринов в воде можно решить путем их растворения в присутствии ПАВ. Этот метод оказался эффективным при использовании как неионогенных [3, 5–7], так и ионогенных ПАВ: анионных [5, 6, 8, 14, 15] и катионных [5, 6, 8, 12–17]. Так, в мицеллярных растворах классических ПАВ (додецилсульфата натрия, бромида гексадецил-триметиламмония, тритона X-100) и сравнительно новых (бромидов алкилтрифенилфосфония – СnТФФБ, где n = 12, 14, 16) нам удалось добиться стабилизации катионных хлоринов в мономолекулярной (мономерной) форме при концентрации 2.5 мкМ [5]. При этом эффект мономеризации хлоринов в присутствии СnТФФБ наблюдался уже в домицеллярном диапазоне концентраций ПАВ, а в мицеллярном усиливался. Под влиянием СnТФФБ дезагрегирует в водных растворах и краунзамещенный фталоцианинат магния (Mgcr8Pc), а регистрируемые в них высокоинтенсивные полосы поглощения (λmax = 683 нм) и флуоресценции (λmax = 694 нм) Mgcr8Pc указывают на существование его именно в виде мономеров [14, 16]. Ранее [13, 17] нами было установлено, что за счет применения катионных ПАВ (бромидов алкил-триметиламмония – СnТАБ с n = 12, 14, 16) в водных средах в интервале pH 6–9 достигается эффект распада на отдельные молекулы агрегатов тетра(4-карбоксифенокси)фталоцианината цинка, ZnPc(COOH)4 [17] и тетра(2-фосфорил)феноксифталоцианината цинка, ZnPc(РO(OH)2)4 [13].
Цель данной работы состоит в изучении процессов дезагрегации под влиянием ПАВ безметального фталоцианина с 4 алкилфосфорильными группами. Соединения этого класса в мономерном состоянии могут эффективно генерировать синглетный кислород, обладают улучшенными лиофильными характеристиками по сравнению с фталоцианинами с кислотными заместителями и могут локализоваться как в лиофильных, так и в лиофобных участках живых тканей. Кроме того, алкильные группы могут обеспечить достаточно прочное связывание молекул красителя с мицеллой (за счет проникновения в ее ядро), а также, возможно, и с мембраной живых клеток.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы
Исследуемый 2,(3),9,(10),16,(17),23,(24)-тетра-[2-пентоксифосфорил)]феноксифталоцианин (I) [11] был получен согласно методикам [10, 11], его структурная формула приведена на рис. 1. В качестве типичного катионного ПАВ применяли бромид тетрадецилтриметиламмония, С14ТАБ (Acros Organics, содержание основного вещества 99.8%). Для приготовления буферных растворов с pH 4, 6.86, 7.4 и 9.18 использовали стандарт-титры, соответствующие ГОСТ 8.135–2004.
Методика измерений
Растворы соединения I готовили из его кристаллов в диметилсульфоксиде (ДМСО), трижды дистиллированной воде (pH 6) и буферных системах с pH 4, 6.86, 7.4 и 9.18. Низкое значение pH воды обусловлено ее способностью легко сорбировать углекислый газ из воздуха даже при кратковременном контакте.
С14ТАБ вводили в эти растворы в виде сухого порошка. При отсутствии полного растворения I (в воде и кислой среде с pH 4) исследовались пробы над осадком, который находился в равновесии с растворенным веществом. Образцы для исследования в домицеллярной области ПАВ готовили разбавлением раствора I. Концентрацию I (c2) варьировали от 1 до 10 мкМ в экспериментах с его фиксированными значениями, а в его насыщенных растворах вплоть до 55 мкМ.
Свежеприготовленные растворы I без ПАВ и в его присутствии выдерживали в закрытых емкостях в защищенном от света месте в течение нескольких суток (в зависимости от рН среды), наблюдая за изменением их окраски (визуально) и степени растворения I (путем анализа электронных спектров поглощения (ЭСП)).
ЭСП регистрировали с помощью однолучевого сканирующего спектрофотометра UV-2800 (UNICO, США) по методике, изложенной в [16, 17]. Спектры флуоресценции соединения I измеряли на модульном спектрофлуориметре Fluorolog 3 (Horiba Jobin Yvon S.A.S., Япония) по методике, использованной в работе [13], при длине волны возбуждения 627 нм. При этом ширина щелей каналов возбуждения и регистрации составляла 4 нм. Для регистрации спектров флуоресценции ZnPc(PO(OH)2)4 с низкой интенсивностью (в водных растворах без ПАВ) ширину обеих щелей увеличивали до 7 нм. Измерения кривых затухания флуоресценции были выполнены методом счета единичных фотонов с помощью модуля FluoroHub, управляемого программой DataStation 2.6. Использовали импульсный диод (NanoLED) с λmax = 370 нм в качестве источника возбуждения и ФЭУ R928 в качестве детектора, ширина щели канала эмиссии составляла 3 нм для всех измерений кривых затухания и определения аппаратной функции. Времена жизни флуоресценции определяли путем моделирования экспериментальных кривых одноэкспоненциальной функцией в программе DAS 6.6.
Все эксперименты проводили при комнатной температуре (25°С).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Растворение фталоцианина I в ДМСО
Известно, что фталоцианины характеризуются двумя основными полосами поглощения, которые возникают в результате π–π*-переходов в сопряженной 18 π-электронной системе кольца [2]: B-полосой (или полосой Сорэ) с максимумом в области примерно 300–400 нм и Q-полосой в области 550–750 нм. При этом между спектрами поглощения безметальных фталоцианинов H2Рc и фталоцианинатов металлов MPc существует большое различие. В случае MPc из-за более высокой D4h- или C4v-симметрии и вырожденного характера LUMO в Q-диапазоне есть только один разрешенный переход. Поэтому характерной чертой спектров поглощения их мономеров является наличие одной интенсивной и узкой полосы в области 650–750 нм [8–19].
В спектре же безметальных H2Рc наблюдается расщепление Q-полосы поглощения [11, 15, 18, 19] по причине их более низкой по сравнению с MPc симметрии D2h. Для H2Рc наблюдаются два разрешенных электронных перехода (благодаря двум протонам в ядре кольца) в области Q-полосы. С коротковолновой стороны эти полосы сопровождаются менее интенсивными вибронными полосами [18, 19].
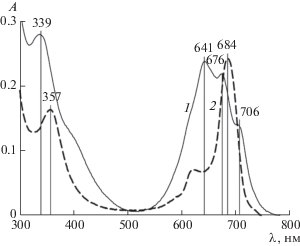
На рис. 2 приведены ЭСП соединения I в ДМСО. Они содержат интенсивную полосу Сорэ при 339 нм, а в Q-диапазоне – широкую полосу со слабо выраженными максимумами при 641, 676 и 706 нм. Они, естественно, отличаются от спектра мономера MPc – (ZnPc(PO(OH)2)4) [13] (кривая 2 на рис. 3), измеренного нами ранее. В Q-диапазоне ЭСП соединения I (рис. 2 и кривая 1 на рис. 3) просматривается расщепленная полоса его мономера [11]. Однако с увеличением содержания (c2) I поглощение усиливается в большей степени при 339 и 641 нм, чем при 675 и 706 нм.
Рис. 2.
ЭСП соединения I в ДМСО при концентрации c2 = 3.75 (1), 5.39 (2), 7.53 (3) и 10 мкМ (4). l = 1 см.
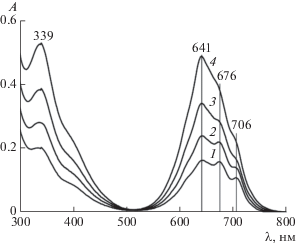
Рис. 3.
ЭСП соединения I (1) и ZnPc(PO(OH)2)4 (2) [13] в ДМСО при их концентрации c2 = 5.39 (1) и 2 мкМ (2). l = 1 см.
В интервале c2 = 1–10 мкМ наблюдается линейная зависимость оптической плотности (A) в указанных максимумах от концентрации раствора I в ДМСО. Рассчитанные из зависимости A(c2) коэффициенты экстинкции (значения lg ε) иллюстрируют тенденцию снижения интенсивности поглощения в ряду максимумов 339 → 641 → → 676 → 706 нм (табл. 1). Для мономеров I (в смеси 5% NaOH и метанола), напротив, проявляется тенденция повышения относительной интенсивности поглощения (Amax/A704, %) в ряду максимумов 404.9 → 641 → 666.7 → 704.2 нм (табл. 1). Исходя из изложенного выше, можно предположить, что полученные спектры поглощения I в растворах ДМСО включают компоненты, отражающие присутствие этого фталоцианина как в агрегированном виде, так и в виде отдельных молекул.
Таблица 1.
Характеристики спектров поглощения соединения I в органических растворителях: положение максимумов, λmax, с коэффициентами экстинкции lg ε (в скобках) и оптическая плотность A/A704 (относительно оптической плотности при 704 нм, %) при соответствующих длинах волн (в скобках)
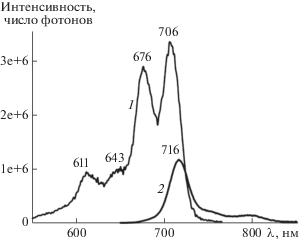
Спектр возбуждения флуоресценции I в ДМСО (кривая 1 на рис. 4), близкий к спектру поглощения мономеров I в смеси 5% NaOH и метанола [11], по-видимому, коррелирует со спектром поглощения мономеров I в ДМСО (соответствующей компонентой в его общем спектре поглощения). Наличие мономеров I подтверждает и наблюдаемая для него в ДМСО интенсивная полоса флуоресценции (кривая 2 на рис. 4), поскольку агрегаты и Н-димеры I практически не излучают [2, 12–17]. Спектр испускания (с максимумом при 716 нм) смещен относительно спектра возбуждения (с максимумом при 706 нм) на 10 нм.
Рис. 4.
Спектры возбуждения (1) и флуоресценции (2) соединения I (c2 = 10 мкМ) в ДМСО при длине волны возбуждения 486 и 627 нм соответственно.
Таким образом, установлено, что при растворении в ДМСО соединение I находится не только в ассоциированном состоянии, как считалось ранее [11], но и в мономерном, причем в количестве, способном вызывать высокоинтенсивное излучение. Отсутствие в молекуле I атома металла, координирующего молекулы ДМСО, не обеспечивает его практически полного растворения до мономеров, которое мы наблюдали в случае ZnPc(PO(OH)2)4 [13].
Растворимость соединения I в водной среде при изменении pH
Визуальные наблюдения (в ходе которых бесцветный водный раствор становился изумрудно-зеленым) и регистрация ЭСП показали, что соединение I практически не растворяется в кислой водной среде (pH 4 и 6). Измеренные спектры поглощения I в буферных системах с pH в интервале 6.86–9.18 (рис. 5) имеют полосу Сорэ (λ = 332 нм) и Q-полосу (с максимумом в области 622–632 нм), характерные для безметальных фталоцианинов, присутствующих преимущественно в агрегированном состоянии [11, 15]. При этом скорость растворения I увеличивается с ростом pH, но она меньше, чем металлсодержащего ZnPc(PO(OH)2)4 с большим числом кислотных групп [13]. Рассчитанные для диапазона концентраций c2 = 1–20 мкМ коэффициенты экстинкции (значения lg ε) в максимумах полосы поглощения агрегатов I равны 4.56, 4.6 и 4.63 при pH 6.86, 7.4 и 9.18 соответственно. Полученные значения отражают небольшое повышение интенсивности поглощения агрегатов с увеличением pH в указанном диапазоне.
Рис. 5.
Спектры поглощения (1–3) и флуоресценции при длине волны возбуждения 627 нм (4) соединения I (c2 = 10 мкМ) в водных средах с pH 6.86 (1), 7.4 (2) и 9.18 (3, 4). l = 1 см.
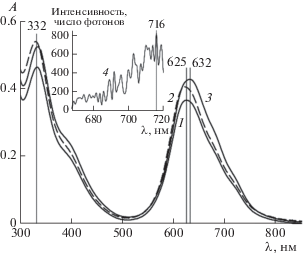
Слабоинтенсивный спектр флуоресценции соединения I (кривая 4 на вставке рис. 5) подтверждает незначительное присутствие мономеров I в водной среде даже при pH 9.18.
Наблюдаемое в буферных средах в интервале pH 6.86–9.18 растворение I обусловлено диссоциацией его кислотных групп по аналогии с фталоцианинатом цинка с аналогичными заместителями [12], а образование агрегатов – π–π-взаимодействиями ароматических систем электронов и гидрофобными взаимодействиями алкилфосфорильных групп соседних молекул I.
Незначительные изменения оптической плотности растворов I в диапазоне pH 6.86–9.18 свидетельствует о том, что после диссоциации всех кислотных групп дальнейшее повышение pH не влияет на процесс его растворения. По сравнению с I в молекуле ZnPc(PO(OH)2)4 больше кислотных групп, что, вероятно, способствует ускорению процесса растворения последнего.
Низкая растворимость I при pH 4 и 6, по-видимому, обусловлена слабой диссоциацией его фосфорильных групп в таких кислых средах.
Агрегационное состояние фталоцианина I в водных растворах ПАВ
Как уже отмечалось, соединение I хорошо растворяется в интервале pH 6.86–9.18, но до агрегатов. Рассмотрим сначала возможность их разрушения с помощью ПАВ в среде с pH 7.4. На рис. 6 приведены ЭСП I при его постоянной концентрации (c2 = 1.83 мкМ) и варьируемой концентрации ПАВ (c1).
Рис. 6.
ЭСП соединения I (с2 = 1.83 мкМ) в водных растворах с pH 7.4: (а) в диапазоне длин волн 300–850 нм при концентрации С14ТАБ c1 = 0 (1), 0.16 (2) и 1 мМ (3); (б) в диапазоне длин волн 550–800 нм при c = 1.7 (4), 4.9 (5) и 12 мМ (6). l = 1 см.
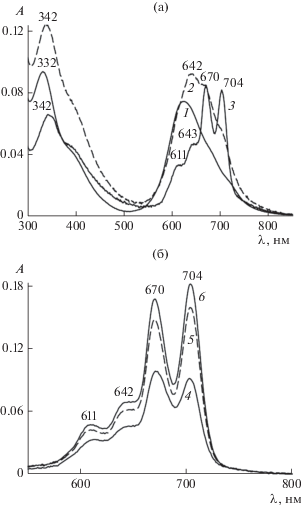
Рисунок 6а соответствует домицеллярной области концентрации С14ТАБ. По мере увеличения содержания ПАВ его влияние на спектр поглощения I становится все более заметным. Так, максимум полосы Соре смещается в сторону бóльших значений λ: от 332 нм в отсутствие ПАВ (кривая 1) до 342 нм уже при c1 = 0.16 мМ (кривая 2). В диапазоне длин волн 550–800 нм, в котором С14ТАБ не поглощает, на кривой 2 можно заметить маленький пик вблизи 670 нм и плечо около 704 нм. При c1 = 1 мМ в спектре поглощения наблюдается расщепленная Q-полоса I с выраженными максимумами при 670 и 704 нм (кривая 3 на рис. 6а). Интенсивность в обоих максимумах Q-полосы превышает интенсивность полосы Сорэ при λ = = 342 нм.
Рисунок 6б отвечает переходу концентрации С14ТАБ через ККМ. Влияние ПАВ на спектры поглощения I в основном проявляется в Q-диапазоне, поэтому приведенные на этом рисунке данные ограничены интервалом длин волн 550–800 нм. Можно заметить, что по мере увеличения содержания С14ТАБ не только усиливается интенсивность расщепленной Q-полосы, но и изменяется соотношение интенсивностей в ее максимумах, приближаясь к таковому для полосы мономера. Действительно, при c1 = 1.7 мМ интенсивность поглощения в Q-полосе при λ = 704 нм еще меньше, чем при λ = 670 (кривая 4), а при c1 ≥ 4.9 мМ – наоборот, она становится большей, чем при λ = 670 нм (кривые 5, 6).
Обнаруженные изменения в спектрах поглощения при переходе от низких концентраций С14ТАБ к значениям близким к ККМ и выше свидетельствуют о появлении мономеров I и постепенном росте их количества, который замедляется после достижения ККМ С14ТАБ. Они обусловлены процессами солюбилизации, в которых ПАВ играет роль солюбилизатора в ионной или мицеллярной форме [13, 17, 20]. При увеличении концентрации ПАВ солюбилизация и мономеризация I идут до тех пор, пока весь I не перейдет в мономерную форму. С этим связано замедление и прекращение роста оптической плотности солюбилизата в растворе ПАВ после ККМ.
Для большей наглядности результатов мономеризации I на рис. 7 приведена зависимость оптической плотности A при λ = 704 нм от концентрации С14ТАБ (c1) при постоянном содержании I (c2 = 1.83 мкМ). Видно, что увеличение c1 приводит к росту A, а значит, пропорциональному ей количеству мономеров I. Наибольшие изменения A происходят в области, близкой к ККМ С14ТАБ, а после ККМ рост A продолжается, но уже малыми темпами.
Рис. 7.
Зависимость оптической плотности при λmax = 704 нм соединения I (с2 = 1.83 мкМ) от концентрации С14ТАБ в среде с pH 7.4.

Заметим, что график такого вида, как на рис. 7 с прямыми 1 и 2, уже исследовался [21, 22], а точка излома интерпретировалась как ККМ. Точка пересечения прямых 1 и 2 на рис. 7 дает значение ${{с}_{{1к}}}$ = 3.3 мМ. Оно меньше ККМ С14ТАБ (3.8 мМ) в отсутствие I и буфера и близко к значению 3.25 мМ, полученному нами для водного раствора С14ТАБ с солюбилизированным краунзамещенным фталоцианинататом магния Mgcr8Pc [20]. Как известно, солюбилизат всегда понижает значение ККМ ПАВ [23]. Замена водной среды на буферную (pH 7.4) также приводит к снижению ККМ ионных ПАВ [24, 25]. Поэтому полученное значение ${{с}_{{1к}}}$ = 2.9 мМ может быть ККМ С14ТАБ в среде с pH 7.4 в присутствии I.
Для I (в интервале концентраций c2 = 1–10 мкМ) в системе I–С14ТАБ–буфер (pH 7.4) при с1 = 6.3 мМ, отвечающей полному растворению фталоцианина, рассчитаны коэффициенты экстинкции в максимумах Q-полосы (табл. 2). Полученное для λ = 704 нм значение ε704 = 0.91 × 105 М–1 см–1 (lg ε = 4.96) отражает высокую интенсивность поглощения, что важно с точки зрения применения I в ФДТ.
Таблица 2.
Фотофизические параметры мономеров I в буферном растворе с pH 7.4, содержащем С14ТАБ, при 298 и 77 К: положение максимумов поглощения (λmax, abs), возбуждения флуоресценции (λmax, ext) и флуоресценции (λmax, fl), молярные коэффициенты экстинкции (lg ε) и времена жизни флуоресценции (τ)
| Параметр | T = 298 К | T = 77 К | ||||||
|---|---|---|---|---|---|---|---|---|
| λmax, abs, нм (lg ε) | 610 (4.47) | 642 (4.65) | 670 (4.93) | 704 (4.96) | – | – | – | – |
| λmax, ext, нм | 606 | 641 | 670 | 704 | 606 | 641 | 669 | 710 |
| λmax, fl, нм | 715 | 711 | ||||||
| τ, нс | 7.31 | 8.2 | ||||||
Влияние С14ТАБ на дезагрегацию I в интервале pH 6.86–9.18 аналогично влиянию этого ПАВ в среде с pH 7.4. Спектры поглощения I в мицеллярных растворах С14ТАБ (при c1 = 2 ККМ) также отвечают его мономерному состоянию, при этом с ростом pH наблюдается небольшое повышение интенсивности поглощения.
При pH 6 после введения С14ТАБ в насыщенный раствор I система начинает медленно окрашиваться в зеленовато-изумрудный цвет в результате перехода небольшого количества I из твердого состояния в раствор. Для установления равновесного состояния требуется не менее 5 суток. При c1 = 6 мМ в спектре поглощения I в пробе раствора над осадком наблюдается полоса поглощения (кривая 1 на рис. 8), свидетельствующая о наличии мономеров I. При увеличении содержания С14ТАБ происходит не только усиление интенсивности поглощения в максимумах расщепленной Q-полосы, но и изменение соотношения интенсивностей в этих максимумах (кривые 2 и 3 на рис. 8).
Рис. 8.
ЭСП соединения I в его водном насыщенном растворе при pH 6 в присутствии С14ТАБ (c1 = 6 мМ) спустя 5 сут после приготовления (1) и после установления равновесного состояния при c1 = 6 (2) и 33.2 мМ (3). l = 0.1 см.
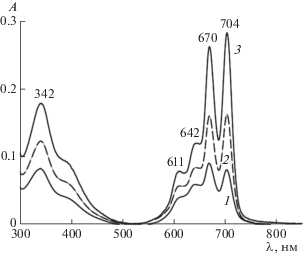
Используя закон Ламберта–Бера, определяющий связь оптической плотности A с концентрацией поглощающего свет вещества, c2 = A/lε, а также значение коэффициента экстинкции (ε704 = 0.91 × 105 М–1 см–1), полученное для I в растворах С14ТАБ при pH 7.4, мы оценили содержание молекулярно растворенного I по данным спектров 1–3 на рис. 8. Для значений A704 0.079 (кривая 1), 0.178 (кривая 2) и 0.283 (кривая 3) при c1 = 6, 15.5 и 33.2 мМ соответственно и l = 0.1 см получили значения c2 = 8.68, 19.6 и 31.1 мкМ (или 24, 54 и 86% от исходной концентрации 36 мкМ).
В присутствии мицелл С14ТАБ растворение I наблюдается и при pH 4. Однако процесс установления равновесного состояния – более длительный, чем при pH 6, а количество растворенного вещества также зависит от содержания ПАВ. На рис. 9 показаны спектры поглощения I в пробах надосадочной жидкости в его насыщенных растворах при c1 = 7 и 12 мМ спустя 10 суток после введения ПАВ. Судя по форме Q-полосы, можно предположить, что они отвечают смеси агрегатов и мономеров I. По данным спектров 1 и 2 на рис. 9 значения оптической плотности при 704 нм и l = 0.1 см равны А704 = 0.0924 и 0.277 для c1 = 7 и 12 мМ соответственно. Рассчитанные аналогично тому, как это было сделано выше, величины c2 равны 10.2 мкМ (при c1 = 7 мМ) и 30.4 мкМ (при c1 = 12 мМ), что соответственно составляет 18 и 55% от исходной концентрации (c2 = 55 мкМ) фталоцианина.
Рис. 9.
ЭСП соединения I в буферном (pH 4) насыщенном растворе при концентрации С14ТАБ c1 = 7 (1) и 12 мМ (2). l = 0.1 см.
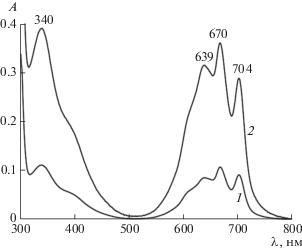
Таким образом, методом спектрофотометрии установлено, что в водных средах, содержащих агрегаты I, под влиянием С14ТАБ происходит их разрушение вплоть до мономеров в широком диапазоне значений pH (4–9.18). Количество образующихся мономеров I зависит от времени, pH среды и концентрации С14ТАБ.
Характеристики флуоресценции фталоцианина I в водных растворах ПАВ и устойчивость его мономерной формы при замораживании
Предположение о дезагрегации безметального фталоцианина I в водных мицеллярных растворах С14ТАБ, сделанное на основе данных спектрофотометрии, подтверждают результаты исследований его флуоресценции, спектры которой отражают содержание именно мономерной формы фталоцианина.
Исследования люминесцентных свойств безметального фталоцианина I в растворе С14ТАБ при pH 7.4 проводили не только при комнатной температуре (298 К), но и после замораживания раствора при 77 К. На рис. 10 показаны спектры возбуждения флуоресценции I, а на рис. 11 – спектры его флуоресценции при этих значениях температуры. Обсудим сначала результаты флуоресцентных измерений, полученные при 298 К, и сопоставим их с данными спектроскопии поглощения.
Рис. 10.
Спектр возбуждения флуоресценции фталоцианина I при 298 (1) и 77 К (2). Длина волны возбуждения 780 нм.
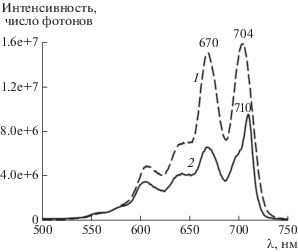
Рис. 11.
Спектр флуоресценции фталоцианина I при температуре 298 (1) и 77 К (2). Длина волны возбуждения 605 нм.
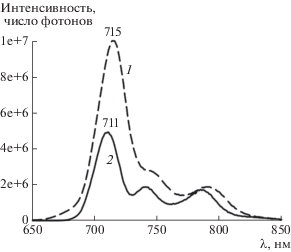
Форма спектра возбуждения флуоресценции I, приведенного рис. 10 (кривая 1), практически совпадает с формой спектров поглощения мономера I в аналогичной среде (кривые 5, 6 на рис. 6б). Спектр флуоресценции с максимумом при 715 нм (кривая 1 на рис. 11) имеет высокую интенсивность и хорошо соответствует правилу зеркальной симметрии по отношению к спектрам поглощения и возбуждения флуоресценции I в присутствии мицелл С14ТАБ при pH 7.4. Это указывает на наличие большого числа неагрегированных молекул фталоцианина в растворе, так как его агрегаты не флуоресцируют. Спектр испускания (кривая 1 на рис. 11) смещен относительно спектра поглощения (рис. 6б) на 11 нм. Небольшое значение сдвига Стокса в растворе ПАВ говорит о том, что величина поглощенной энергии близка к величине энергии релаксации синглетного состояния и при возбуждении молекул I не происходит существенных изменений их конформации.
Кривая затухания флуоресценции I в растворе С14ТАБ при рН 7.4 (нижняя кривая на рис. 12), измеренная методом счета единичных фотонов, характеризуется близким к моноэкпоненциальному спаду интенсивности, что свидетельствует об одинаковом микроокружении всех центров флуоресценции в таком растворе. При этом время жизни флуоресценции (τ) составило 7.31 нс. Заметим, что измеренное ранее [13] в аналогичной среде время τ для ZnPc(PO(OH)2)4 составило 3.11 нс. Большее значение τ для раствора I по сравнению с раствором ZnPc(PO(OH)2)4 может указывать на более глубокое проникновение молекулы I, содержащей алкильные группы, внутрь мицеллы ПАВ.
На рис. 10 приведены спектры возбуждения флуоресценции I в системе I–С14ТАБ–буфер с pH 7.4 при 77 и 298 К. Видно, что они близко соответствуют друг другу, однако спектр при 77 К имеет более высокое разрешение вследствие того, что заселенность колебательных спутников электронных уровней молекул красителя уменьшается. В замороженной до 77 К системе также удается наблюдать свечение (кривая 2 на рис. 11). Сравнение кривых 1 и 2 на рис. 11 показывает, что после замораживания наблюдается гипсохромный сдвиг спектра флуоресценции и уменьшение полуширины полос эмиссии. Сопоставление кривых на рис. 10 и 11 выявляет уменьшение значения сдвига Стокса между крайней полосой в спектре возбуждения (с максимумом на 710 нм при 77 К и на 704 нм при 298 К, рис. 10) и крайней полосой в спектре эмиссии (с максимумом на 711 нм при 77 К и на 715 нм при 298 К, рис. 11). Обнаруженные различия во флуоресценции I при 77 и 298 К типичны для растворов органических красителей, охлажденных до температуры жидкого азота [26].
Таким образом, близкие по форме спектры возбуждения флуоресценции (рис. 10), а также спектры флуоресценции (рис. 11), зарегистрированные при 77 и 298 К, указывают на то, что молекулы красителя остаются в дезагрегированном состоянии и при быстром замораживании системы жидким азотом. Эмиссия агрегатов I при 77 К и 298 К в области 850–1200 нм полностью отсутствует, что указывает на сохранение всех молекул красителя в растворе в присутствии ПАВ в мономерном состоянии.
Кривые затухания флуоресценции I в аналогичной системе при 77 и 298 К, измеренные методом счета единичных фотонов, характеризуются близким к моноэкпоненциальному спаду интенсивности. При этом времена жизни флуоресценции составляют 7.31 и 8.20 нс при 298 и 77 К соответственно, что указывает на близкий характер микроокружения молекул красителя при этих значениях температуры, то есть на сохранение структуры мицелл, содержащих молекулы красителя, и при быстром охлаждении до температуры жидкого азота.
Полученные результаты указывают на возможность применения мицеллярных растворов фталоцианина I в качестве препаратов ФДТ совместно с методом криотерапии новообразований. При таком сочетании мицеллярный раствор фталоцианина может наноситься по контуру новообразования перед процедурой криотерапии для последующей качественной обработки контура опухоли сразу после завершения процедуры вымораживания ее основного тела.
ЗАКЛЮЧЕНИЕ
Методами спектроскопии поглощения и флуоресценции установлено, что в водных растворах в интервале pH 6.86–9.18 безметальный алкил-фосфорилзамещенный фталоцианин I присутствует в основном в виде агрегатов, а в растворах диметилсульфоксида – в виде смеси агрегатов с мономерами I. Под влиянием бромида тетрадецилтриметиламмония (С14ТАБ) агрегаты соединения I разрушаются до мономерного состояния. Количество разрушенных агрегатов в водных средах зависит от времени, pH среды и концентрации С14ТАБ.
Полученные методами флуоресцентной спектроскопии результаты исследований по устойчивости к агрегации безметального фталоцианина I в водном растворе С14ТАБ с pH 7.4 при замораживании до температуры 77 К указывают на возможность использования этого соединения для ФДТ в сочетании с методом криотерапии новообразований.
Список литературы
Кудинова, Березов // Биомедицинская химия. 2009. Т. 55. С. 558.
Nackiewicz J., Kliber M. // ARKIVOC. 2015 (i). P. 269. https://doi.org/10.3998/ark.5550190.p008.923
Якубовская Р.И., Плютинская А.Д., Лукьянец. Е.А. // Российский биотерапевтич. журн. 2014. Т. 13. С. 65.
Церковский Д.А., Протопович Е.Л., Ступак Д.С. // Онкологический журн. 2019. Т. 13. № 2. С. 79.
Градова М.А., Мовчан Т.Г., Худяева И.С., Чернядьев А.Ю., Плотникова Е.В., Лобанов А.В., Белых Д.В. // Макрогетероциклы. 2020. Т. 13. С. 23.
Jadhao M., Mukherjee S., Joshi R., Kumar H., Kumar G.S. // RSC Adv. 2016. V. 6. P. 77161.
Motloung B.M., Babu B., Prinsloo E., Nyokong T. // Polyhedron. 2020. V. 188. 114683.
Lapshina M., Ustyugov A., Baulin V., Terentiev A., Tsivadze A., Goldshleger N. // J. Photochem. Photobiol. B. 2020. V. 202. P. 111722.
Komissarov A.N., Makarov D.A., Yuzhakova O.A., Savvina L.P., Kuznetsova N.A., Kaliya O.L., Lukyanets E.A., Negrimovsky V.M. // Macroheterocycles. 2012. V. 5. P. 169.
Баулин В.Е., Овсянникова Е.В., Калашникова И.П., Гирина Г.П., Андреев В.Н., Алпатова Н.М., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2013. Т. 49. С. 7.
Калашникова И.П., Баулин Д.В., Баулин В.Е., Цивадзе А.Ю. // Журн. общей химии. 2018. Т. 88. С. 1510.
Гольдшлегер Н.Ф., Гак В.Ю., Лапшина М.А., Баулин В.Е., Ширяев А.А., Цивадзев А.Ю. // Изв. Академии наук. Серия хим. 2018. С. 2205.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2020. Т. 82. С. 26.
Мовчан Т.Г., Аверин А.А., Баулин Д.В., Плотникова Е.В., Баулин В.Е., Цивадзе А.Ю. // Коллоид. журн. 2018. Т. 80. С. 528.
Гольдшлегер Н.Ф., Гак В.Ю., Калашникова И.П., Е. Баулин В.Е., Иванчихина А.В., Смирнов В.А., Ширяев А.А., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 4. Приложение. С. S3.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Аверин А.А., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2018. Т. 80. С. 694.
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2019. Т. 81. С. 750.
Phthalocyanines Properties and Applications. V. 1. Ed. by Leznoff C.C., Lever A.B.P. N.Y.: Wiley-VCH, 1989. P. 139.
Phthalocyanines Properties and Applications. V. 3. Ed. by Leznoff C.C., Lever A.B.P. N.Y.: Wiley-VCH, 1993. P. 5.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. С. 187.
Гольдшлегер Н.Ф., Черняк А.В., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю. // Журн. общей химии. 2012. Т. 82. С. 856.
Мовчан Т.Г., Русанов А.И., Плотникова Е.В. // Коллоид. журн. 2021. Т. 83. № 3. С.
Русанов А.И. // Коллоид. журн. 2021. Т. 83. С. 98.
Werawatganone P., Wurster D.E. // J. Pharm. Sci. 2007. V. 96. P. 448.
Yagui C.O.R, Hsu H.W.L., Pessoa A., Tavares L.C. // Braz. J. Pharm. Sci. 2005. V. 41. P. 237.
Лакович Дж. Основы флуоресцентной спектроскопии. М.: Мир, 1986.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал