Коллоидный журнал, 2021, T. 83, № 5, стр. 611-619
Влияние 1,1-диметилгидразина на индукцию пептидов гемолимфы Galleria mellonella
К. Е. Полунин 1, О. С. Федоткина 2, И. А. Полунина 1, А. К. Буряк 1, *
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
2 ООО “СамараНИПИнефть”
443010 Самара, Вилоновская ул., 18, Россия
* E-mail: akburyak@mail.ru
Поступила в редакцию 26.04.2021
После доработки 04.05.2021
Принята к публикации 07.05.2021
Аннотация
Методами жидкостной хроматографии и масс-спектрометрии МАЛДИ изучено влияние 1,1-диметилгидразина и его гидразона с ацетоном на пептидный состав гемолимфы личинок гусеницы Galleria mellonella. Обнаружено появление в гемолимфе индуцированных низкомолекулярных пептидных продуктов массой 1–3 кДа, фрагментов и метилированных модификаций ранее известных антибактериальных пептидов Galleria mellonella, а также шести неизвестных пептидов, проявляющих бактерицидную активность по отношению к грамотрицательным бактериям Escherichia coli.
ВВЕДЕНИЕ
Алкилгидразины – токсичные вещества первого класса опасности, обладают нейро- и гепатотоксическими свойствами, воздействуют на иммунную систему человека и способны полностью подавлять синтез иммуноглобулинов [1]. Развитие иммунодефицитов – основная причина увеличения инфекционной патологии и паразитарных болезней у населения территорий вблизи космодромов [2, 3]. Метаболизм алкилгидразинов в организме животных и человека до конца не изучен, поэтому в рекомендациях ВОЗ, касающихся гигиенических критериев состояния окружающей среды, проблема изучения и предотвращения токсичного воздействия гидразинов и других компонентов ракетного топлива на человека и экосистему определена как приоритетная. Несмотря на достаточно большой объем исследований, проведенных с несимметричным диметилгидразином (НДМГ) и его производными, все еще остается ряд невыясненных вопросов, касающихся механизма взаимодействия гидразинов с биополимерами и взаимосвязи состава биологических жидкостей организма с их физико-химическими свойствами.
Насекомые, в частности, личинки гусениц Galleria mellonella L (GM) широко используются в качестве модельных живых организмов при исследовании иммунного ответа на воздействие токсичных соединений [4–6]. В ответ на внешний раздражитель в организме насекомых образуется целый букет разнообразных веществ, которые немедленно нейтрализуют бактерии, грибки или вирусы. Врожденная иммунная система GM производит множество пептидов бактерицидного и противогрибкового действия, которые действуют на клеточную мембрану агрессоров, вызывая ее проницаемость или даже распад благодаря сорбции на поверхностности мембраны и порообразующему действию [5–7]. Биоактивные пептидные продукты, получаемые на основе иммунных реакций насекомых, являются основой для разработки новых фармакологических средств [7].
В работах [3–6, 8] проводилось исследование иммунного ответа GM на воздействие различных грамотрицательных и грамположительных бактерий и грибов, были идентифицированы пептиды в гемолимфе гусениц. Работы авторов [9–13] посвящены оптимизации условий разделения и идентификации пептидных смесей GM. Была разработана методология хроматографического разделения индуцированных пептидов и их масс-спектрометрической идентификации, обнаружены новые антимикробные пептиды, оказывающие влияние на скорость метаболических процессов. Комбинация методов обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ) и масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией (МАЛДИ-МС) при исследовании пептидов существенно облегчает их поиск в сложных смесях, поскольку позволяет проводить фракционирование целенаправленно, устанавливать аминокислотные последовательности полипептидов путем интерпретации масс-спектров по базам данных и на веб-сервисах [14–17].
Целью данной работы являлось изучение влияния НДМГ, 1,1-диметилгидразина, и его гидразона с ацетоном на пептидный состав гемолимфы личинок гусеницы GM путем обнаружения и идентификации пептидных продуктов, индуцированных организмом в ответ на воздействие токсикантов. Результаты экспериментальных исследований могут внести существенный вклад в понимание механизма токсичного действия гидразинов и в разработку средств повышения иммунитета населения, проживающего в экологически неблагоприятных районах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объекта исследования использовали личинки гусениц GM, выращенные в питомнике Института теоретической и экспериментальной биофизики РАН по методике [18]. Иммунизацию личинок (38–50 особей) проводили, вводя в брюшную полость личинки по 5 мкл 1%-ного водного раствора НДМГ или его гидразона с ацетоном (группа № 1) или по 0.5 мкл 0.01%-ного раствора НДМГ или его гидразона с ацетоном (группа № 2). Через сутки после иммунизации к охлажденной гемолимфе выживших личинок GM добавили кристаллик фенилтиомочевины, ингибитор протеаз (Inducible serine protease inhibitor 1) и дистиллированную воду. Затем осадили клетки и дебрис полученных образцов гемолимфы в центрифуге (10 000 об/мин, 15 мин). Белки осаждали трифторуксусной кислотой (ТФУ) (группа № 1) или ее 0.4%-ным раствором в метаноле (группа № 2). Суспензии разделяли в центрифуге (13 000 об./мин, 15 мин) и отбирали супернатант (надосадочную жидкость) для проведения ВЭЖХ. Супернатант группы № 2 дополнительно упаривали до 100 мкл на вакуумной центрифуге. Так же была получена гемолимфа контрольной группы неиммунизированных гусениц. Супернатант гемолимфы личинок GM, обработанных аналогичным образом бактериальными иммунизирующими агентами, по данным [11–13] обогащен преимущественно антимикробными пептидами. Способы получения гемолимфы личинок, подготовки образцов к биохимическим и физико-химическим исследованиям подробно описаны в [11]. В настоящей работе в качестве образца сравнения использовали пептидную смесь, полученную из неиммунизированных или раненных стерильной иглой гусениц.
Разделение антибактериальных пептидов методом ОФ ВЭЖХ проводили на колонке Zorbax Eclipse XDB-С18 (Agilent Technologies, США) размером 150 мм × 4.6 мм, заполненной SiO2-С18 (размер зерна 5 мкм, диаметр пор 80 Å) и упакованной в жидкостной хроматограф Agilent 1200 с диодно-матричным детектором и программным обеспечением ChemStation А.10.02. УФ-спектры регистрировали при 210–224 и 280 нм. Подвижная фаза: А – 0.04% ТФУ в воде (V/V), В – 0.04% ТФУ в ацетонитриле; режим градиентного элюирования: 10% B в диапазоне 0–5 мин, 10–80% B в диапазоне 5–40 мин, скорость потока 0.5 мл/мин, температура колонки 25°C, объем вводимой пробы 20 мкл, сбор фракций через каждые 0.5–1.5 мин.
Масс-спектрометрическое исследование фракций гемолимфы методом МАЛДИ-МС проводили с помощью масс-спектрометра UltraFlex II TOF (Bruker Daltonics, Германия) с азотным лазером (рабочая длина волны 337 нм, частота импульса 20 Гц, энергия ионизации 110 кДж), времяпролетным масс-анализатором с рефлектоном и программным обеспечением для сбора и обработки масс-спектров FlexControl 3.4 и FlexAnalysis 3.4. Ускоряющее напряжение и напряжение на рефлектроне – 25 и 26.5 кВ соответственно. Масс-спектры получали в режиме регистрации положительных ионов в массовом диапазоне 0–250 кДа. Для изучения фрагментации исходных метастабильных протонированных молекул пептидов применяли режим распада за пределами ионного источника. Масс-спектры ионов-продуктов регистрировали с помощью метода FAST (Bruker Daltonics). Точность измеренных моноизотопных масс [M + H]+ в режиме рефлектрона составляла 0.007%, точность измеренных усредненных масс в линейном режиме – 0.05–0.1%, точность измеренных масс фрагментов – 1–2 Да (0.02–0.1%).
Образцы для МАЛДИ готовили на мишенях AnchorChip с матрицей (2,5-дигидроксибензойной кислотой) от Bruker Daltonics (Германия). Смешивали 10 мкл пептидного раствора и 0.3 мкл раствора матрицы (10 мг/мл) в 20%-ном растворе ацетонитрила в воде с добавкой 0.5%-ного раствора ТФУ. Полученную смесь высушивали на воздухе при атмосферном давлении.
Для увеличения достоверности идентификации новых антибактериальных пептидов проводили их гидролиз трипсином. Идентификацию пептидов осуществляли при помощи программного пакета Mascot [16]. Поиск проводили по данным спектров фрагментации метастабильных протонированных молекул пептидов [M + H]+, полученным в работе [9], и присутствующих в базе данных NCBI [17] среди белков всех организмов без указания типа гидролиза или с указанием на трипсин. При помощи программного обеспечения Biotools 3.0 (опция rapid de-novo sequencing [15, 19]) сделана разметка спектров по возможным аминокислотным последовательностям.
Использовали коммерческие реактивы без дополнительной очистки: 1,1-диметилгидразин (98%, Merck, Германия), ацетонитрил (HPLC-gradient grad, Aldrich, США), ТФУ (99%, Alfa Aesar, Германия), метанол, ацетон (Реахим, Россия, “ч. д. а”), а также тридистиллированную воду, дополнительно очищенную на фильтрах Millipore (Milli-P QG, Waters). Фенилтиокарбамид, трипсин, низин, цекропин B от Sigma (США) имели квалификацию “для биохимических исследований”. Гидразон синтезировали по методике [20].
Антибактериальная активность пептидов по отношению к бактериям Escherichia coli (E. coli), штамм М17 определялась по размерам зон ограниченного роста тестовых микроорганизмов (наличие единичных точечных колоний или отсутствие колоний) вокруг бумажных дисков диаметром 6 мм, пропитанных фракциями гемолимфы по сравнению с контрольными фильтрами, пропитанными буферным раствором, не содержащим бактерицидных компонентов [11]. Диски (8 шт. для каждого образца) предварительно стерилизовали с помощью бактерицидных ламп, пропитывали анализируемыми фракциями и помещали на суточные посевы E. coli во влажном состоянии. Посев проводили в микробиологическом боксе на чашки Петри, которые помещали в термостат при 37°C на сутки.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Аддитивная модель удерживания пептидов на сорбентах основана на предположении, что характер их взаимодействия с поверхностью сорбентов определяется суммарным эффектом всех взаимодействующих участков молекул [21].
Контакт пептидных продуктов гемолимфы GM с гидрофобной неподвижной фазой C18 протекает с преобладанием дисперсионных взаимодействий и аналогичен процессу сорбции пептидов на липофильной клеточной мембране. На рис. 1 приведены хроматограммы пептидных смесей GM до иммунизации и после иммунизации гидразоном НДМГ с ацетоном (группа № 2), полученные в условиях градиентного режима ОФ ВЭЖХ. Разделение пептидов происходит за счет взаимодействий растворенного вещества с неподвижной фазой С18 и водно-органическим элюентом. Изменение состава элюента – добавление ТФУ в ацетонитрил – оказывает значительное влияние на селективность разделения пептидов в гемолимфе (рис. 1), способствует постоянному значению pH в течение всего процесса разделения и приводит к увеличению времени удерживания пептидов. При этом порядок их элюирования из колонки не изменяется. Установлено, что антимикробные пептиды, являющиеся объектами исследования, элюируются в диапазоне концентраций ацетонитрила 45–75%.
Рис. 1.
Хроматограммы пептидных смесей гемолимфы Galleria mellonella без иммунизации (а, в) и после иммунизации 0.01%-ным водным раствором гидразона НДМГ с ацетоном (б, г) в режимах градиентного элюирования растворами, содержащими ацетонитрил (1, 3) или ацетонитрил с добавкой 0.04% ТФУ (2, 4). Детектирование при 214 нм.
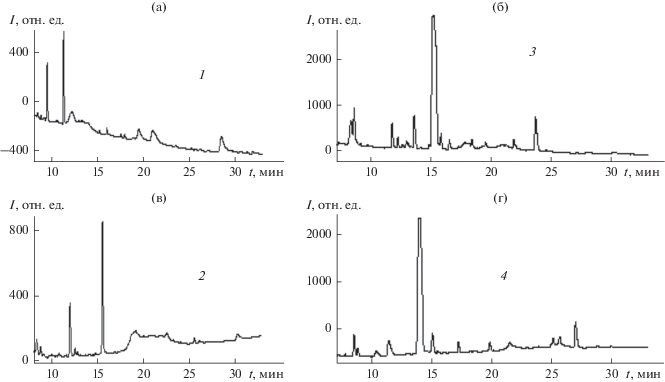
В результате иммунизации GM усложняется хроматографический профиль пептидных смесей гемолимфы, появляются новые пики и увеличивается интенсивность прежних сигналов, т.е. иммунизация личинок приводит к возникновению иммунного ответа и появлению множества новых пептидных компонентов в составе гемолимфы. Это может быть обусловлено как синтезом новых соединений, так и деструктивными процессами. Оптимизация условий хроматографирования позволила получать хроматограммы гемолимфы с достаточно хорошо разделенными пиками (рис. 2).
Рис. 2.
Хроматограммы пептидных смесей гемолимфы Galleria mellonella: 1 – без иммунизации, 2 – иммунизация 1%-ным водным раствором гидразона НДМГ с ацетоном. Детектирование при 210 нм.
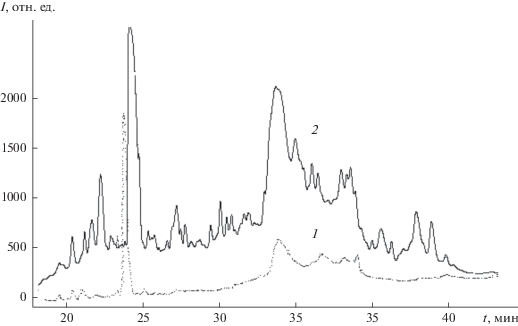
В контрольных и иммунизированных смесях гемолимфы детектированы известные антимикробные пептиды GM (табл. 1), которые являются, как правило, дифильными катионными молекулами с массой около 5000 Да, а также фермент лизоцим (14027 Да) и белок аполипофорин-3 (18075 Да).
Таблица 1.
Антибактериальные пептиды, обнаруженные в составе гемолимфы Galleria mellonella
| Номер | Пептид | Аминокислотная последовательность пептида* | Масса, Да | N** | pI*** |
|---|---|---|---|---|---|
| 1 | Proline-rich antimicrobial peptide 1 | DIQIPGIKKPTHRDIIIPNWNPNVRTQ- PWQRFGGNKS | 4320 | 37 | 10.99 |
| 2 | Lebocin-like anionic peptide 1 | EADEPLWLYKGDNIERAPTTADHPIL- PSIIDDVKLDPNRRYA | 4816 | 42 | 4.51 |
| 3 | Defensin (Galiomicin) 1 | DTLIGSCVWGATNYTSDCNAECK- RRGYKGGHCGSFLNVNCWCE | 4715 | 43 | 7.25 |
| 3а | Defensin (Galiomicin) 2 | DTLIGRCVWGATNYTSDCNAE- CKRRGYKGGHCGSFLNVNCWCE | 4786 | 43 | 7.25 |
| 4 | Proline-rich antimicrobial peptide 2 | EIRLPEPFRFPSPTVPKPIDIDPILPHP- WSPRQTYPIIARRS | 4929 | 42 | 9.97 |
| 5 | Cecropin-D-like peptide | ENFFKEIERAGQRIRDAIISAAPAVE- TLAQAQKIIKGGD | 4253 | 39 | 6.45 |
| 6 | Anionic antimicrobial peptide 2 | ETESTPDYLKNIQQQLEEYTKNFNT-QVQNAFDSDKIKSEVNNFIESLGKIL- NTEKKEAPK | 6975 | 60 | 4.80 |
| 7 | Defensin-like peptide | DKLIGSCVWGATNYTSDCNAE- CKRRGYKGGHCGSFWNVNCWCEE | 4949 | 44 | 7.46 |
| 8 | Cecropin-B-analog | WKVFKKIEKIGRNIRNGIVKAG- PLIAVLGEAKAL | 3728 | 34 | 11.02 |
Экспериментально установлено, что в диапазоне 1.7–5 мин элюируются слабоудерживаемые низкомолекулярные компоненты антикоагулянта в составе образца гемолимфы (ЭДТА и фенилтиокарбамид), имеющие максимумы поглощения в области 210–240 нм, и соединения пептидной природы, появление которых связано с прохождением хроматографического процесса по эксклюзионному механизму на макропористом сорбенте С18 [9, 10].
В диапазоне 5–40 мин появляются сигналы новых веществ пептидной природы, усиливаются или исчезают сигналы, характерные для гемолимфы контрольной группы гусениц GM (табл. 1). При разделении образцов гемолимфы иммунизированных и неиммунизированных личинок в этом диапазоне были отобраны фракции через каждые 2 мин. Далее эти фракции были сконцентрированы и протестированы на биологическую активность, а их пептидный состав охарактеризован масс-спектрометрически (табл. 2).
Таблица 2.
Пептидный состав фракций гемолимфы Galleria mellonella, иммунизированных 0.01%-ным раствором гидразона НДМГ с ацетоном (методы анализа МАЛДИ-МС и ОФ ВЭЖХ), а также ширина зоны задержки роста Е. coli на фильтрах, пропитанных пептидами фракций (антимикробный тест)
| Номер | Пептиды в составе антибактериальных фракций | Масса молекул [М + Н]+, Да | Время
удерживания, tR, мин |
Размер зоны задержки роста E. coli, мм |
|---|---|---|---|---|
| 5 | Cecropin-D-like peptide Индуцированный пептид |
1626 3485 |
18–20 | 9.5 ± 1.5 |
| Индуцированный пептид Индуцированный пептид | 6320 9188 |
22–24 | 9.5 ± 2.0 | |
| 4 5 |
Proline-rich antimicrobial peptide 2 Cecropin-D-like peptide Индуцированный пептид Индуцированный пептид |
1825 2078 6320 9170 9188 |
24–26 | 10.3 ± 1.7 |
| 1 | Proline-rich antimicrobial peptide 1 | 4321 8400 |
26–28 | 8.8 ± 0.5 |
| 2 4 |
Lebocin-like anionic peptide 1 Proline-rich antimicrobial peptide 2 Индуцированный пептид Индуцированный пептид |
4817 4930 4970 4898 |
28–30 | 9.0 ± 0.8 |
| 3 4 |
Defensin 1 Proline-rich antimicrobial peptide 2 |
4716 4930 |
30–32 | 9.8 ± 1.7 |
| 5 6 |
Cecropin-D-like peptide Anionic antimicrobial peptide 2 Lysozyme |
4254 6976 14 028 |
34–36 | 9.5 ± 0.5 |
| 5 6 |
Cecropin-D-like peptide Anionic antimicrobial peptide 2 Apolipophorin-3 |
4254 6980 18 076 |
36–38 | 9.8 ± 1.5 |
| Inducible serine protease inhibitor 1 Apolipophorin-3 |
5380 18 076 |
38–40 | 9.0 ± 0.8 |
Обнаружено, что все фракции, полученные после обработки личинок НДМГ и его гидразоном, содержали смеси пептидов, активных против E. coli (табл. 2). Причем ширина зоны ограничения роста Е. coli была больше при использовании гемолимфы иммунизированных личинок, чем неиммунизированных.
Хроматограммы и качественный состав фракций, полученных после иммунизации гусениц GM 0.01%-ными растворами НДМГ и его гидразона с ацетоном (группа № 2), оказались практически одинаковы. В пептидных смесях преобладает пептид № 4, содержится большое количество пептидов №№ 1–3, 6, лизоцима и аполипофорина-3 (табл. 2). Наличие одноименных пептидов во фракциях может быть обусловлено близкими адсорбционными характеристиками биомолекул и степенью их гидрофобности, химическим сродством к другим молекулам, образованием пептидных ассоциатов, а также вкладом межмолекулярного взаимодействия малых и больших пептидов. Следует отметить, что после обработки GM гидразоном НДМГ с ацетоном среди пептидных продуктов была обнаружена протонированная молекула массой 5380 Да, которая может быть фрагментом ингибитора протеаз, использованного при подготовке гемолимфы к исследованиям.
Преимущество метода МАЛДИ-МС состоит в возможности анализа сложных смесей биоактивных компонентов без их разделения. В гемолимфе личинок GM обнаружены фрагменты известных пептидов и новые индуцированные пептиды с массами 3484, 4897, 4969, 6319, 9169 и 9187 Да, проявляющие антибактериальные свойства по отношению к Е. coli (рис. 3, табл. 2). Фрагменты протонированных молекул пептидов № 4 (1825 Да), № 5 (1626, 2078 Да) и № 6 (6976 Да), обнаруженные в гемолимфе после обработки гусениц НДМГ и его гидразоном, были детектированы в [9] после иммунизации личинок GM бактериями B. cereus и E. coli.
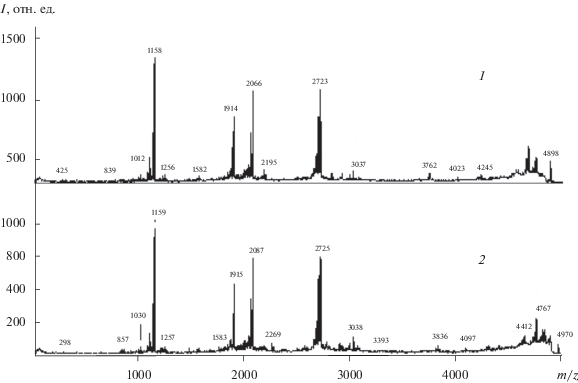
Рис. 3.
Масс-спектры МАЛДИ фрагментации индуцированных пептидов [М + Н]+ массой 3485 (а) и 9188 Да (б), обнаруженных в гемолимфе Galleria mellonella, иммунизированных 0.01%-ным раствором гидразона НДМГ с ацетоном.

В составе антимикробных фракций пептидных продуктов (табл. 2) присутствуют два неизвестных ранее пептида с массами 4897 и 4969 Да, отличающиеся концевым фрагментом 72 Да (аланин). Спектры фрагментации этих протонированных молекул (рис. 4) имеют сходство с фрагментацией пептида № 2 (Lebocin-like anionic peptide 1). Определяются три разрыва пептидной связи, обусловленные, по-видимому, аспарагиновыми и глутаминовыми кислотами. Однако разрывы локализованы в иных положениях первичной структуры, чем у пептида № 2, поэтому данные пептиды не являются его производными.
Рис. 4.
Масс-спектры МАЛДИ фрагментации индуцированных пептидов [М + Н]+ массой 4898 и 4970 Да, в гемолимфе Galleria mellonella, иммунизированных 0.01%-ным раствором гидразона НДМГ с ацетоном.
В случае иммунизации высокими концентрациями НДМГ и его гидразона с ацетоном (группа № 1) методом МАЛДИ-МС детектирована индукция известных антибактериальных пептидов (табл. 1) и их фрагментов, а также большое количество неизвестных пептидов массой до 3000 Да (табл. 3). Количество низкомолекулярных пептидов уменьшается при введении меньших количеств НДМГ и его гидразона (группа № 2). Образование большого числа неизученных пептидов, а также фрагментов известных антимикробных пептидов связано, по-видимому, с окислительно-восстановительной деструкцией пептидов и иммунным ответом гемолимфы GM на воздействие токсикантов.
Таблица 3.
Аминокислотный состав пептидов массой 1–3 кДа, обнаруженных в гемолимфе Galleria mellonella, иммунизированных 0.01%-ным раствором гидразона НДМГ с ацетоном
| Масса пептида [М + Н]+, Да | Аминокислотная последовательность пептидов |
|---|---|
| 1105 | PTDERLGYR |
| 1211 | CAELEKWWF |
| 1241 | GLSVAQGRDALPG |
| 1359 | RRGNDNFRLDP |
| 1590 | HPTVVAYYCPMYF |
| 1927 | RMNYAASPFPSAHPHFV |
| 1948 | LYYKKKYKSNYHPNT |
| 2108 | DWPTTHTWLFHGKTWPP |
| 2340 | GGASGHFNPYDYSYPNSPKWP |
| 2559 | CMSMWMCGKSSRIRYMMIHAH |
| 2563 | DHWWLSRVNEGCVRSKDLEHP |
| 3256 | PGAYYMMKAEMSVTYTACDEAKNYKRFS |
| 3731 | PVCGKCSHWAPNDFGNTTHLWVDPDWELKALHG |
Исследование процессов распада метастабильных протонированных молекул пептидов, ускоренных в ионном источнике, дает информацию об их фрагментации. Спектры фрагментации очень характерны и позволяют идентифицировать пептиды как по базам данных, так и путем применения правил фрагментации и поиска соответствия масс обнаруженных ионов различным аминокислотным остаткам и пептидным фрагментам [15–17, 22]. На этой основе можно идентифицировать последовательность аминокислот в пептиде. Результаты определения аминокислотной последовательности новых пептидов по метастабильным протонированным молекулам [М + Н]+ в спектрах МАЛДИ-МС после распада в ионном источнике представлены в табл. 3.
При ионизации пептидных молекул их распад происходит вдоль скелета по пептидным связям, и заряд локализуется на N- или С-конце (на амино- или карбоксильной группе). Для МАЛДИ-МС в режиме рефлектона наиболее характерным является разрыв амидной связи CO–NH в пептидах, что позволяет при анализе масс-спектров их фрагментов сделать выводы не только о молекулярной массе пептида, но и о его составе и структуре. Кислотно-индуцированные фрагменты, которые являются результатом разрыва амидной связи на С-конце аспарагиновой кислоты D (и, в меньшей степени, глутаминовой кислоты E), доминируют в МАЛДИ масс-спектрах аргининсодержащих пептидов.
Для увеличения достоверности идентификации каждая полученная аминокислотная последовательность была протестирована на соответствие экспериментально определенного времени удерживания tR и времени удерживания, рассчитанного на основании суммарной степени их гидрофобности [23, 24]. Найденные корреляции подтвердили потенциальную возможность пептидов, указанных в табл. 3, удерживаться на сорбенте в соответствии со своей относительной гидрофобностью. Критерий гидрофобности пептидов был определяющим при оценке надежности их идентификации при проведении de novo секвенирования [19]. Аминокислотные последовательности, не соответствующие данному критерию, в табл. 3 не приводятся. Использование экспериментальной хроматографической информации (в частности, значений tR) позволяет из нескольких кандидатов на возможные аминокислотные последовательности, полученных из спектров фрагментации метастабильных протонированных молекул пептидов, выбрать те, которые надежно описывают аминокислотный состав пептида.
Исследование методом МАЛДИ-МС первичной структуры Cecropin-D-like peptide и Anionic antimicrobial peptide 2 позволило установить, что после иммунизации GM токсикантами появляется несколько модификаций этих пептидов с разницей в молекулярной массе 14–15 Да (рис. 5), т.е. происходит метилирование первоначальных пептидов, а не их окисление, которое приводило бы к увеличению массы на 16 Да. Кроме того, в первичной структуре аминокислот №№ 5 и 6, содержащих соответственно 6 и 10 остатков глутаминовой и аспарагиновой кислот, отсутствуют метионин М, гистидин Н и триптофан W, по которым возможно их окисление [17, 21].
Рис. 5.
Масс-спектры МАЛДИ модификаций антибактериальных пептидов Cecropin-D-like peptide (а) и Anionic antimicrobial peptide 2 (б).
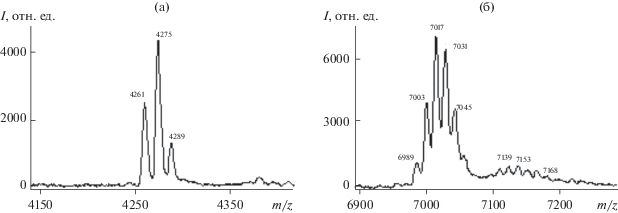
Биотрансформация гидразина и его производных, как известно [1, 2], протекает в печени и кишечнике организмов с участием цитохрома Р450 и флавинсодержащих монооксигеназ, что сопровождается образованием диазометана, метильного радикала и ионов метилдиазония, которые могут реагировать с биомолекулами [25]. Вероятно, в результате метаболизма НДМГ в организме гусеницы метилирование пептидов ее гемолимфы протекает по остаткам глутаминовой D и аспарагиновой E кислот, а также по C-концевым аминокислотам. Это предположение связано с первичными структурами пептидов, так как наблюдается зависимость между количеством мест метилирования (D и E) и числом модификаций одного антибактериального пептида (рис. 5).
Окислительная деструкция белковых молекул в результате воздействия НДМГ хорошо известна и качественно наблюдалась в [25] спектрофотометрическими методами. Методом МАЛДИ-МС подтверждено, что воздействие НДМГ и его гидразона приводит к существенному изменению состава гемолимфы GM: появлению большого количества низкомолекулярных пептидов, фрагментов и метилированных модификаций исходно присутствующих антимикробных компонентов. Появляются также новые антибактериальные пептиды, выделение и изучение которых позволит в дальнейшем разработать способы защиты человека от воздействия НДМГ и его токсичных производных.
ЗАКЛЮЧЕНИЕ
Методами ОФ ВЭЖХ и МАЛДИ-МС охарактеризован пептидный состав гемолимфы личинок гусениц GM после воздействия НДМГ и его гидразона с ацетоном. Обнаружено большое число индуцированных пептидных продуктов массой 1–3 кДа, ранее известных для GM антибактериальных пептидов массой 5–30 кДа, их фрагментов, а также появление новых пептидных компонентов, не представленных в базах данных. Эти пептиды массой 3484, 4897, 4969, 6319, 9169 и 9187 Да проявляют антимикробную активность в отношении грамотрицательной бактерии Е. coli. Качественный состав пептидов гемолимфы после использования НДМГ и его гидразона с ацетоном практически одинаков, их количественный состав зависит от концентрации токсикантов. Предположено, что воздействие НДМГ на антибактериальные пептиды гемолимфы GM сопровождается протеканием не только деструктивных процессов, но и метилированием пептидов продуктами метаболизма НДМГ в организме гусениц по остаткам глутаминовой и аспарагиновой кислот и C-концевым аминокислотам.
Список литературы
Кречетов П.П., Королева Т.В., Кондратьев А.Д. Несимметричный диметилгидразин как фактор воздействия на окружающую природную среду при осуществлении ракетно-космической деятельности. М.: Пеликан, 2008.
Экологическая безопасность ракетно-космической деятельности / Под ред. Касимова Н.С. М.: Спутник, 2015.
Sheehan G., Farrell G., Kavanagh K. // Virulence. 2020. V. 11. P. 238.
Champion O.L., Wagley S., Titball R.V. // Virulence. 2016. V. 7. P. 840.
Cutuli M.A., Petronio J.P., Vergalito F., Magnifico I., Pietrangelo L., Venditti N., Di Marco R. // Virulence. 2019. V. 10. P. 527.
Tsai C. J-Y., Loh J.M.S., Proft T. // Virulence. 2016. V. 7. P. 214.
Нолтинг Б. Новейшие методы исследования биосистем. М.: Техносфера, 2005.
Cytrynska M., Mak P., Zdybicka-Barabas A., Suder P., Jakubowicz T. // Peptides. 2007. V. 28. P. 533.
Пурыгин П.П., Срибная О.С., Кленова Н.А., Буряк А.К., Парамонов С.А., Литвинова Е.Г., Серебрякова М.В. // Сорбционные и хроматографические процессы. 2011. Т. 11. С. 42.
Буряк А.К., Срибная О.С., Пурыгин П.П. // Биомедицинская химия. 2010. Т. 56. С. 387.
Срибная О.С., Пурыгин П.П., Клёнова Н.А., Буряк А.К., Литвинова Е.Г. // Биохимия. 2010. Т. 75. С. 1305.
Срибная О.С., Пурыгин П.П., Буряк А.К. // Хим.-фарм. журнал. 2010. Т. 44. № 1. С. 51.
Буряк А.К., Пурыгин П.П., Срибная О.С. // Биомедицинская химия. 2009. Т. 55. С. 713.
Aebersold R., Goodlett D.R. // Chem. Rev. 2001. V. 101. P. 269.
Лебедев А.Т., Артеменко А.Т., Самгина Т.Ю. Основы масс-спектрометрии белков и пептидов. М.: Техносфера, 2012.
http://www.matrixscience.com/search_form_select.html
http://www.ncbi.nlm.nih.gov/guide/proteins/
Пaтeнт PФ 2038086, 1995.
Артеменко К.А., Самгина Т.Ю., Лебедев А.Т. // Масс-спектрометрия. 2006. Т. 3. С. 225.
Китаев Ю.П., Бузыкин Б.И. Гидразоны. М.: Наука, 1974. С. 17.
Уилсон К., Уолкер Дж. Принципы и методы биохимии и молекулярной биологии. М.: Бином. Лаборатория знаний, 2015.
Lange A, Beier S, Huson D.H, Parusel R., Iglauer F., Frick J.S. // Genome Announc. 2018. V. 6. № 2. P. e01220.
Тарасова А.И., Зубарев Р.А., Голобородько А.А., Горшков А.В., Горшков М.В. // Масс-спектрометрия. 2008. Т. 5. С. 7.
Krokhin O.V., Craig R.V., Spicer V., Ens W., Standing K.G., Beavis R.C., Wilkins J.A. // J. Mol. Cell. Proteomics. 2004. V. 3.9. P. 908.
Кулмагамбетов И.Р., Муравлева Л.Е., Койков В.В., Абдрахманова Ю.Э. // Биомедицинская химия. 2007. Т. 53. С. 276.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


