Коллоидный журнал, 2021, T. 83, № 5, стр. 602-610
Изучение криоструктурированИЯ полимерных систем. 59. Влияние криогенной обработки предварительно деформированных криогелей поливинилового спирта на их физико-химические свойства
Е. А. Подорожко 1, М. И. Бузин 1, Е. К. Голубев 2, М. А. Щербина 2, В. И. Лозинский 1, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
2 Институт синтетических полимерных материалов им. Н.С. Ениколопова РАН
117393 Москва, ул. Профсоюзная, 70, Россия
* E-mail: loz@ineos.ac.ru
Поступила в редакцию 27.04.2021
После доработки 12.05.2021
Принята к публикации 13.05.2021
Аннотация
Исследовано влияние повторной криогенной обработки (–20°C в течение 12 ч и затем размораживание нагреванием со скоростью 0.03 град/мин) на образцы криогелей поливинилового спирта (КГПВС), находящиеся в принудительно деформированном (изгиб, сжатие, кручение) состоянии. Показано, что такое воздействие на первичный КГПВС может быть охарактеризовано как процесс вторичного формования, поскольку криогель приобретает и далее сохраняет заданную деформацией новую геометрическую форму. При этом, чем больше деформирующая механическая нагрузка, в частности компрессионное усилие, тем выше жесткость КГПВС, получаемого в результате вторичного формования. Исследование таких криогелей методами ДСК и рентгеновского рассеяния в больших углах продемонстрировало, что в результате вторичного формования повышается упорядоченность структуры микрокристаллитов ПВС, уже присутствовавших в узлах физической сетки первичных криогелей, и возникают дополнительные зоны микрокристалличности. В совокупности эти образования фиксируют новую геометрию образцов вторичного КГПВС.
ВВЕДЕНИЕ
Макропористые физические криогели поливинилового спирта (КГПВС) образуются в результате замораживания растворов высокодезацилированных марок этого полимера (растворитель – вода, диметилсульфоксид), их выдерживания в замороженном состоянии и последующего оттаивания [1–6]. Эти упруговязкие гелевые материалы нетоксичны и биосовместимы, что позволяет использовать их в медицине (имплантаты, раневые повязки [7–11]) и в биотехнологии (носители иммобилизованных ферментов, иммуноаффинных лигандов и целых клеток [12–17]). За последние два десятилетия накоплен большой опыт направленного регулирования физико-механических, теплофизических и функциональных свойств КГПВС. Это достигается, например, варьированием характеристик гелеобразующего полимера (в частности, его молекулярной массы, степени дезацилирования и тактичности цепей), концентрации ПВС в исходном растворе и природы используемого растворителя, введением растворимых добавок или дисперсных наполнителей, а также, что имеет принципиальное значение, тонкой настройкой режимов криогенной обработки [3, 4, 10, 18–26]. В отношении этих последних факторов, наиболее существенное влияние на свойства и макропористую морфологию КГПВС оказывают динамика оттаивания замороженных образцов, т.е. скорость их нагрева на этой стадии процесса, и количество циклов замораживания–оттаивания. Чем медленнее нагревается образец на заключительном этапе криогенной обработки, тем выше жесткость и теплостойкость получающегося криогеля [2, 27–30]. При многократном замораживании–оттаивании модуль упругости и температура плавления КГПВС возрастают с увеличением числа циклов криогенной обработки [1–5, 17, 31–36].
КГПВС относятся к физическими (т.е. нековалентным) гелям кристаллизационного типа [3, 4, 34, 37, 38]. Роль узлов надмолекулярной полимерной сетки выполняют в них зоны микрокристалличности, где цепи ПВС соединены водородными связями между боковыми гидроксильными группами макромолекул [3, 39–43]. При этом как медленное оттаивание замороженных образцов, так и, особенно, рост числа циклов криогенной обработки, способствуют повышению степени кристалличности соответствующих КГПВС [3, 4, 38, 44, 45].
В принципе возможно формирование КГПВС самой разнообразной геометрии: начиная от простых блоков, пластин, гранул, трубок, и до сложных изделий типа биопротеза клапана сердца [46, 47] или искусственного мениска [48]. Для этого необходимы специальные емкости (литьевые формы, часто имеющие непростую конструкцию), заполняемые исходным раствором гелеобразующего полимера, обработка которого замораживанием–оттаиванием приводит к получению криогелей требуемых размера и формы. В случае формирования КГПВС в виде гранул криогенному структурированию обычно подвергается дисперсия сферических капель исходного водного раствора полимера в холодной гидрофобной жидкости [12, 49]. Все вышеперечисленные варианты в общем случае можно назвать “первичным формованием”, когда геометрия и размеры получаемых КГПВС определяется внутренним пространством литьевой формы. При механическом воздействии (например, изгибом стержнеобразного образца) такие криогели после снятия механической нагрузки опять принимают исходный вид благодаря своей высокоэластичности. Однако если деформировать образец первичного криогеля, а затем каким-либо приемом, в частности ковалентной сшивкой [50, 51], зафиксировать его в этом состоянии, то после снятия механической нагрузки получается гелевый объект, имеющий уже измененную геометрию. Подобный вариант фактически является примером “вторичного формования”.
Ранее нами было показано [52], что вторичное формование КГПВС можно осуществить и без использования химической фиксации деформированного первичного криогеля посредством повторного криогенного воздействия на образцы в деформированном состоянии. После оттаивания соответствующие криогели сохраняли вторичную форму, измененную в результате механического воздействия того или иного типа (изгиб, сжатие, скручивание и др.) на первичный КГПВС. В этой связи, целью данной работы являлось выяснение и изучение механизмов такого вторичного формования нековалентных (физических) криогелей ПВС, т.е. ответ на вопрос: почему после повторной криогенной обработки КГПВС, находящегося в принудительно деформированном состоянии, и последующего снятия механической нагрузки соответствующий образец не возвращается к геометрии первичного криогеля?
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе без дополнительной очистки был использован поливиниловый спирт с молекулярной массой 86 кДа и степенью дезацетилирования 100% (Acros Organics, США).
Водный раствор ПВС (концентрация полимера 120 г/л) готовили по методике, аналогичной ранее опубликованной [28, 29]. Полученным раствором заполняли соответствующие формы, которые помещали в камеру программируемого ультракриостата FP 45 HP (Julabo, Германия), где образцы замораживали при –20°C, выдерживали в замороженном состоянии 12 ч и далее оттаивали нагреванием со скоростью 0.03 град/мин [28, 36]. Такие первичные образцы КГПВС получали в разных литьевых формах: пластиковых пробирках (внутренний диаметр 15 мм), пластиковых чашках Петри (внутренний диаметр 50 мм), разъемных цилиндрических дуралюминовых контейнерах (внутренний диаметр 15 мм, высота 10 мм). В результате сформированные первичные криогели имели форму стержня (15 мм × 80 мм), диска (50 мм × 3 мм) и цилиндрического блока (15 мм × × 10 мм) соответственно. Такие блоки и вторичные криогели на их основе после криогенной обработки деформированных сжатием образцов далее использовали для проведения физико-механических испытаний, термических и рентгеноструктурных исследований.
Повторную криогенную обработку образцов КГПВС, деформированных изгибом или сжатием, проводили в условиях, аналогичных формированию первичных криогелей.
Условно-мгновенный модуль сдвига (G0) образцов первичных и вторичных КГПВС определяли при 21 ± 1°C с помощью динамометрических весов Каргина–Соголовой методом пенетрации в гель сферического индентора диаметром 5 мм при постоянной нагрузке 19.62 × 10–3 Н в соответствии с ранее описанной процедурой [18, 27].
Исследования методом дифференциальной сканирующей калориметрии (ДСК) проводили на приборе DSC-3 (Mettler-Toledo, Швейцария) при скорости нагревания 10 град/мин.
Рентгеноструктурный анализ образцов осуществляли с использованием съемок на просвет с помощью дифрактометра Bruker Advance D8 (Bruker, Германия); CuKα-излучение, λ = 1.5408 Å.
Для анализа общей картины рассеяния использовали рентгенограммы, полученные на плоскокассетной камере с точечной коллимацией пучка (CuKα-излучение, Ni-фильтр); время экспозиции составляло 12–16 ч.
Параметры кристаллической решетки определяли из соответствующих межплоскостных расстояний, полученных из уравнения Брэгга–Вульфа:
где n – порядок отражения, λ – длина волны падающего рентгеновского излучения, 2θ – угол дифракции.Средний эффективный размер кристаллитов Lhkl в кристаллографическом направлении hkl определяли из интегральной полуширины линии соответствующего рентгеновского рефлекса Δhkl(2θ) с помощью формулы Селякова–Шеррера
(2)
${{\Delta }_{{hkl}}}\left( {2{{\theta }}} \right) = \frac{{{\lambda }}}{{{{l}_{{hkl}}}\cos {{\theta }}}},$Объемные доли кристаллитов того или иного типа пропорциональны составляющим интегральной интенсивности соответствующего рентгенографического рефлекса [53]. Выражение для интегральной интенсивности рассеяния E в сферических координатах обратного пространства имеет вид
(3)
$E = \iiint {I(s,{{\varphi }},{{\varepsilon }}){{s}^{2}}dsd{{\varepsilon }}\sin {{\varphi }}d{{\varphi }}}.$Кривую рентгеновского рассеяния перестраивали в координатах Is2(s), после вычета инструментального рассеяния разделяли аморфное гало и кристаллические рефлексы и определяли кристалличность исследованных образцов как долю кристаллического рассеяния в общей интенсивности.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Феноменология процесса вторичного формования криогелей ПВС
Как указано во введении к данной статье, вторичное формование криогелей ПВС заключается в деформации первичного КГПВС приложением определенного механического воздействия с последующей криогенной обработкой образца, находящегося в таком принудительно деформированном состоянии. Некоторые примеры феноменологии подобного вторичного формования криогелей ПВС иллюстрируются фотографиями на рис. 1–3.
Рис. 1.
Фотографические изображения полученных и исследованных в данной работе стержнеобразных криогелей ПВС (см. текст для отнесения обозначений и пояснений).

Рис. 2.
Фотографические изображения исследованных в данной работе криогелей ПВС, сформированных в виде дисков (см. текст для отнесения обозначений и пояснений).

Рис. 3.
Схема эксперимента при деформировании образца первичного КГПВС сжатием (а) и фотография полученных и исследованных криогелей (б) (см. текст для отнесения обозначений и пояснений).
В частности, первичный КГПВС, полученный в виде стрежня (рис. 1а), был на этапе I изогнут и помещен в пластиковую чашку Петри (рис. 1б), где был либо подвергнут повторной криогенной обработке, либо в течение такого же времени просто выдерживался при комнатной температуре. В результате после оттаивания и извлечения замороженного образца (этап II) он приобрел изогнутую форму (рис. 1в), т.е. деформированное изгибом состояние первичного криогеля было зафиксировано в ходе второго цикла замораживания–оттаивания. В то же время, аналогичный стержень, выдержанный в принудительно деформированном виде без замораживания, после излечения из чашки Петри (этап III), полностью “самостоятельно” распрямился (рис. 1г) вследствие упругости, свойственной криогелям ПВС.
Другой, несколько более сложный вариант вторичного формования криогеля ПВС с использованием деформации изгибом приведен на рис. 2. В этом случае после цикла замораживания–оттаивания (этап I) исходного раствора ПВС (а) в пластиковой чашке Петри криогель был получен в виде диска (б). Этот диск после его свертывания (деформации) (этап II) в небольшой рулон (в) был обмотан липкой лентой для предотвращения упругого развертывания (этап III) и в таком виде (г) был подвергнут повторной криогенной обработке (IV) или выдерживался при комнатной температуре (V). После удаления липкой ленты размороженный КГПВС сохранил вид рулона (д), тогда как первичный криогель, выдержанный то же время в принудительно деформированном состоянии без криогенного воздействия, после снятия липкой ленты быстро самопроизвольно восстановил свою первоначальную форму (е). Эти результаты наглядно свидетельствуют, что деформированная форма криогелей ПВС фиксируется именно в ходе второго цикла замораживания–оттаивания.
Из-за анизотропии формы показанных на рис. 1 и 2 криогелей вторичное формование вызывало неравномерное распределение напряжений при деформации и соответственно распределение изменений в матрице таких КГПВС после их повторной криогенной обработки. Поэтому для выявления конкретных изменений далее в качестве первичных криогелей мы использовали образцы, приготовленные в цилиндрических контейнерах, а затем подвергнутые криогенному воздействию в деформированном состоянии с приложением компрессионной нагрузки в 500 или 1000 г (рис. 3а). В этом случае достигалось достаточно равномерное (за исключением краевых эффектов) деформирование криогеля ПВС по всему объему цилиндрического блока, и экспериментальная ошибка была незначительной. Данные о размерах соответствующих образцов и значения их условно-мгновенного модуля сдвига, характеризующего упругие свойства материала [54], приведены в табл. 1.
Таблица 1.
Геометрические размеры и жесткость КГПВС, полученных в данной работе
| Номер образца на рис. 3 |
Компрессионная нагрузка при вторичном формовании, г |
Диаметр образца, мм |
Высота образца, мм | G0, кПа |
|---|---|---|---|---|
| 1 | – | 15.0 | 10.0 | 11.7 ± 1.3 |
| 3 | 0 | 14.5 | 9.9 | 34.4 ± 3.0 |
| 4 | 500 | 23.6 | 4.8 | 59.8 ± 3.9 |
| 5 | 1000 | 25.0 | 4.0 | 73.5 ± 0.6 |
В результате такого вторичного формования геометрия образцов изменялась – цилиндры первичного криогеля “расплющивались”, тогда как форма и размеры контрольного недеформированного КГПВС после второго цикла замораживания–оттаивания оставались практически неизменными (рис. 3б). При этом чем существеннее было деформирующее компрессионное усилие, тем, естественно, в большей степени уменьшалась толщина/высота этих криогелей (образцы 3, 4 и 5 на рис. 3б и в табл. 1), а также симбатно повышался и модуль упругости образцов. Повторный цикл замораживания–оттаивания недеформированного КГПВС 1 приводил к хорошо известному эффекту [2–4, 10, 19, 36, 55] возрастания жесткости криогеля 3 (в данном случае – примерно в 3 раза, табл. 1). Вторичное же формование, т.е. криогенная обработка первичного криогеля в принудительно деформированном состоянии, вызывала дополнительное повышение значения G0 еще (в зависимости от усилия сжатия) в 1.74 и 2.14 раз по сравнению с контрольным образцом – недеформированным криогелем также после двукратного замораживания–оттаивания (образец 3, табл. 1).
Таким образом, из приведенных выше результатов следует, что повторное криогенное воздействие на криогель ПВС, который находится в принудительно деформированном (изгибом, сжатием и др. [52]) состоянии, не только фиксирует вызванную деформацией геометрию образца, но и заметно влияет на его физико-механические характеристики. Это с очевидностью указывает на существенные перестройки в полимерной фазе этих макропористых гелей, а именно на образование новых связей (скорее всего, дополнительного количества водородных связей) между цепями ПВС, а также, вероятно, на дополнительные кристаллизационные процессы с участием полимера. Для подтверждения этих предположений подобные КГПВС были далее исследованы с помощью дифференциальной сканирующей калориметрии и рассеяния рентгеновских лучей.
Исследование теплофизических характеристик криогелей ПВС
Тепловые эффекты, сопровождающие нагревание полученных в данной работе криогелей, были определены с помощью ДСК (рис. 4, табл. 2).
Рис. 4.
Кривые ДСК (скорость нагревания 10 град/мин) для исследованных в данной работе криогелей ПВС (см. текст для отнесения обозначений и пояснений).

Таблица 2.
Полученные методом ДСК термические характеристики КГПВС
| Номер образца на рис. 3 |
Компрессионная нагрузка при вторичном формовании, г |
Tm,* °C | ΔHm, Дж/г | Температурный диапазон плавления криогеля, °C |
|---|---|---|---|---|
| 1 | – | 65 | 0.24 | 64–69 |
| 3 | 0 | 70 | 0.32 | 61–76 |
| 4 | 500 | 71 | 0.51 | 62–78 |
| 5 | 1000 | 72 | 1.92 | 57–80 |
Нагревание исследуемых КГПВС в калориметрической ячейке приводило к появлению на ДСК-термограммах эндотермических пиков в интервале 55–80°C, положение максимумов которых смещалось в высокотемпературную область при усилении деформирующего воздействия (т.е. компрессионной нагрузки) на образец криогеля при его вторичном формовании. Также возрастало и значение энтальпии плавления (ΔHm), что может указывать на повышение количества межмолекулярных водородных связей и на рост степени кристалличности в узлах сетки криогеля. При этом для образцов 1 и 3, т.е. соответственно для первичного криогеля и КГПВС после повторного замораживания–оттаивания в недеформированном состоянии, регистрировались одиночные пики плавления, соответствующие значениям температуры плавления (Tm) 65 и 70°C. В то же время на термограммах образцов 4 и 5, деформированных при нагрузках 500 и 1000 г и подвергнутых в таком виде вторичной криогенной обработке, наблюдались множественные эндотермические пики плавления, причем в этих случаях температурный интервал плавления криогелей был заметно шире (рис. 4, табл. 2).
Расширение температурного интервала плавления таких криогелей ПВС, по-видимому, связано с изменением как доли аморфной фазы, так и количества надмолекулярных образований ближнего порядка. В частности, криогель ПВС, сформированный однократным замораживанием–оттаиванием (образец 1), плавится при 65°C в достаточно узком температурном интервале 64–69°C (рис. 4, табл. 2). В результате повторной криогенной обработки реализуется более плотная и упорядоченная упаковка цепей полимера в узлах сетки криогеля (образец 3), что, как известно, приводит к повышению степени кристалличности гелевой системы [3, 4, 37, 38, 44, 45]. Поэтому имеет место смещение температурного интервала плавления криогеля в область более высоких (61–76°C) значений Tm (табл. 2), но пик плавления остается мономодальным. Для КГПВС, подвергнутых вторичному формованию, наблюдалось значительное повышение температуры плавления (рис. 4, образцы 4 и 5), и при этом, чем значительнее была деформирующая образец компрессионная нагрузка, тем выше оказывалась температура плавления соответствующего криогеля (табл. 2).
Также отличительной особенностью термограмм образцов 4 и 5 было расширение температурного интервала плавления и, кроме того, снижение температуры начала плавления. Последний факт свидетельствует об образовании в результате вторичного формования некоторого количества новых менее термостойких узлов в массе таких криогелей. Можно предположить, что сжатие первичного криогеля перед повторным замораживанием приводит к частичному сближению и, по-видимому, к дополнительному зацеплению макромолекулярных цепей. Это, свою очередь, способствует образованию новых водородных связей, уплотнению и повышению упорядоченности структуры микрокристаллитов в узлах сетки, фиксируемой затем в ходе второй криогенной обработки принудительно деформированного образца. В итоге, на термограммах ДСК для образцов 4 и, особенно, 5 (рис. 4) появляются множественные пики (в последнем случае – при 63, 69, 72°C), соответствующие различной степени организации микрокристаллитов, как уже присутствовавших в первичном криогеле, так и дополнительно образовавшихся во вторичном криогеле. Мы полагаем, что именно эти дополнительные кристаллиты служат физическими “фиксаторами” измененной формы образцов после их криогенной обработки в принудительно деформированном состоянии.
Поэтому для оценки изменений степени кристалличности вторичных криогелей ПВС по сравнению с первичным КГПВС соответствующие образцы далее были исследованы с помощью рентгеноструктурного анализа.
Рентгеноструктурный анализ образцов КГПВС
На рис. 5 приведены дифрактограммы рентгеновского рассеяния в больших углах для ряда образцов КГПВС. Дифрактограмма 1 отвечает первичному криогелю, т.е. полученному однократным замораживанием–оттаиванием. Дифрактограмма 3 соответствует образцу после двух циклов криогенной обработки, когда повторное замораживание проводилось без принудительной деформации первичного криогеля, а дифрактограммы 4 и 5 – образцам, полученным вторичным формованием путем криогенной обработки первичного криогеля под нагрузкой 500 и 1000 г соответственно.
Рис. 5.
Дифрактограммы рентгеновского рассеяния исследованных образцов криогелей ПВС (см. текст для отнесения обозначений и пояснений).
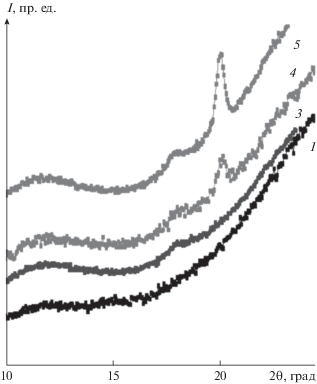
Характерные пики, свидетельствующие о наличии кристаллической фазы, для ПВС [56], а также и для КГПВС [32, 57, 58], обычно наблюдаются на рентгенограммах в области 2θ = 20°. В последнем случае степень кристалличности обычно невысока, в частности, для КГПВС, сформированных однократным замораживанием–оттаиванием, она не превышает 0.4–0.6%, а размер микрокристаллитов составляет порядка 30 Å, что выявляется только с помощью очень высокочувствительной техники и в основном для образцов с высокой концентрацией полимера [57].
В нашем исследовании рентгенограммы криогелей, сформированных в результате одного и двух (без принудительного деформирования) циклов замораживания–оттаивания (соответственно 1 и 3 на рис. 5), содержали фактически широкое бимодальное аморфное гало лишь со слабым пиком для криогеля 3 при 2θ ≈ 18.5°.
В то же время, для образцов КГПВС после вторичного формования (4 и 5, рис. 5) помимо такого же небольшого пика, скорее всего, связанного с формированием бахромчатых мицелл из пачек проходных цепей, детектировался четкий кристаллический рефлекс ПВС при 20°, появление которого однозначно свидетельствует о формировании складчатых кристаллитов ламеллярного типа. При этом средний размер кристаллитов, рассчитанный из интегральной полуширины рефлекса с помощью формулы Селякова–Шеррера (2), был довольно значительным и составлял около 180 Å в обоих этих образцах. В случае криогеля 4, вторичное формование которого проводилось под нагрузкой в 500 г, степень кристалличности, вычисленная как соотношение интегральных интенсивностей аморфной и кристаллической составляющих рассеяния, не превышала примерно 1%. Для криогеля 5, когда нагрузка вторичного формования было вдвое выше, т.е. 1000 г, степень кристалличности возрастала уже примерно до 2%.
Таким образом, результаты рентгеноструктурного анализа свидетельствуют о хорошей их корреляции с данными ДСК и механических испытаний. Совокупность этих данных показывает, что при криогенном воздействии на принудительно деформированный (в частности, сжатием) первичный КГПВС индуцируются процессы дополнительной кристаллизации полимера. Чем значительнее при этом компрессионная нагрузка на образец, тем выше доля микрокристаллитов и более упорядочена их организация в криогеле, получающемся после такого вторичного формования. В результате возрастает жесткость гелевого материала, а сам он приобретает и далее сохраняет заданную деформацией новую геометрическую форму, фиксированную суммой вновь образовавшихся зон микрокристалличности и увеличившихся в размерах микрокристаллитов, уже существовавших в первичном криогеле.
ЗАКЛЮЧЕНИЕ
В работе были получены и исследованы криогели поливинилового спирта, полученные приемом вторичного формования, т.е. повторной криогенной обработкой (замораживание/выдерживание в замороженном состоянии/оттаивание) первичных криогелей, находящихся в принудительно деформированном состоянии под действием механической нагрузки (изгиб, сжатие, скручивание и др.). Установлено, что физико-механические и теплофизические свойства, а также степень кристалличности подвергнутых вторичному формованию криогелей, в существенной мере зависят от величины приложенного деформирующего усилия. Чем под более высокой нагрузкой деформированный первичный криогель подвергался повторному замораживанию–оттаиванию, тем большей жесткостью и теплостойкостью обладал получающийся в результате образец вторичного КГПВС. При этом результаты исследования таких криогелей с помощью дифференциальной сканирующей калориметрии и рентгеноструктурного анализа указывают как на повышение упорядоченности структуры микрокристаллитов ПВС, уже присутствовавших в узлах физической надмолекулярной сетки первичных криогелей, так на появление дополнительных зон микрокристалличности. В совокупности эти образования фиксируют новую геометрию, “приобретенную” сформированным таким образом вторичным КГПВС.
Список литературы
Nambu M. // Kobunshi Ronbunshu. 1990. V. 47. P. 695.
Peppas N.A., Stauffer S.R. // J. Control. Release. 1991. V. 16. P. 305.
Лозинский В.И. // Успехи химии. 1998. Т. 67. С. 641.
Hassan C.M., Peppas N.A. // Adv. Polym. Sci. 2000. V. 153. P. 37.
Gun’ko V.M., Savina I.N., Mikhalovsky S.V. // Adv. Colloid Interface Sci. 2013. V. 187–188. P. 1.
Lozinsky V.I. // Gels. 2018. V. 4. Article 77.
Holloway J.L., Lowman A.M., Palmese G.R. // Acta Biomater. 2010. V. 6. P. 4716.
Millon L.E., Nieh M.-P., Hutter J.L., Wan W. // Macromolecules. 2007. V. 40. P. 3655.
Gajra B., Pandya S.S., Vidyasagar G., Rabari H., Dedania R.R., Rao S. // Int. J. Pharm. Res. 2012. V. 4. P. 20.
Wan W., Bannerman A.D., Yang L., Mak H. // Adv. Polym. Sci. 2014. V. 263. P. 283.
Lytkina D.N., Fedorishin D.A., Kalachikova P.M., Plyaskina A.A., Babeshin A.R., Kurzina I.A. // J. Func. Biomater. 2021. V. 12. Article 18.
Lozinsky V.I., Plieva F.M. // Enzyme Microb. Technol. 1998. V. 23. P. 227.
Bacheva A.V., Plieva F.M., Lysogorskaya E.N., Filipova I.Yu., Lozinsky V.I. // Bioorg. Med. Chem. Lett. 2001. V. 11. P. 1005.
Plieva F.M., Galaev I.Y., Noppe W., Mattiasson B. // Trends Microbiol. 2008. V. 16. P. 543.
Mattiasson B. // Adv. Polym. Sci. 2014. V. 263. P. 245.
Андрюшина В.А., Карпова Н.В., Дружинина А.В., Стыценко Т.С., Подорожко Е.А., Рябев А.Н., Лозинский В.И. // Прикл. биохим. микробиол. 2015. Т. 51. С. 472.
Lozinsky V.I. // Gels. 2020. V. 6. Article 29.
Lozinsky V.I., Vainerman E.S., Domotenko L.V., Mamtsis A.M., Titova E.F., Belavtseva E.M.,Rogozhin S.V. // Colloid Polym. Sci. 1986. V. 264. P. 19.
Watase M., Nichinari K. // Macromol. Chem. 1989. V. 190. P. 155.
Mori Y., Tokura H., Yoshikawa M. // J. Mater. Sci. 1997. V. 32. P. 491.
Yamaura K., Fukuda M., Tanaka T., Tanigami T. // J. Appl. Polym. Sci. 1999. V. 74. P. 1298.
Fukae R., Yoshimura M., Yamamoto T., Nishinari K. // J. Appl. Polym. Sci. 2011. V. 120. P. 573.
Curley C., Hayes J.C., Rowan N.J., Kennedy J.E. // J. Mech. Behav. Biomed. Mater. 2014. V. 40. P. 13.
Baptista J.G.C., Rodriogues S.P.J., Matsushita A.F.Y., Vitorino C., Maria T.M.R., Burrows H.D., Pais A.A.C.C., Valente A.J.M. // J. Mol. Liq. 2016. V. 222. P. 287.
Kolosova O.Yu., Kurochkin I.N., Kurochkin I.I., Lozinsky V.I. // Eur. Polym. J. 2018. V. 102. P. 169.
Kurochkin I.I., Kurochkin I.N., Kolosova O.Yu., Lozinsky V.I. // Molecules. 2020. V. 25. Article 4480.
Домотенко Л.В., Лозинский В.И., Вайнерман Е.С., Рогожин С.В. // Высокомолек. соед. А. 1988. Т. 30. С. 1661.
Лозинский В.И., Дамшкалн Л.Г., Шаскольский Б.Л., Бабушкина Т.А., Курочкин И.Н., Курочкин И.И. // Коллоид. журн. 2007. Т. 69. С. 798.
Лозинский В.И., Дамшкалн Л.Г., Курочкин И.Н., Курочкин И.И. // Коллоид. журн. 2012. Т. 74. С. 343.
Lozinsky V.I., Okay O. // Adv. Polym. Sci. 2014. V. 263. P. 49.
Nagura M., Nagura M., Ishikawa H. // Polym. Comm. 1984. V. 25. P. 313.
Yakoyama F., Masada I., Shimamura K., Ikawa T., Monobe K. // Colloid Polym. Sci. 1986. V. 264. P. 595.
Nagura M., Hamano T., Ishikawa H. // Polymer. 1989. V. 30. P. 762.
Stauffer S.R., Peppas N.A. // Polymer. 1992. V. 18. P. 3932.
Masci G., Husu I., Murtas S., Piozzi A., Crescenzi V. // Macromol. Biosci. 2003. V. 3. P. 455.
Лозинский В.И., Дамшкалн Л.Г., Курочкин И.Н., Курочкин И.И. // Коллоид. журн. 2008. Т. 70. С. 212.
Auriemma F., De Rosa C., Triolo R. // Macromolecules. 2006. V. 39. P. 9429.
De Rosa C., Auriemma F., Di Girolamo R. // Adv. Polym. Sci. 2014. V. 263. P. 159.
Lozinsky V.I., Domotenko L.V., Vainerman E.S., Mamtsis A.M., Rogozhin S.V. // Polym. Bull. 1986. V. 15. P. 333.
Gusev D.G., Lozinsky V.I., Vainerman E.S., Bakhmutov V.I. // Magn. Res. Chem. 1990. V. 28. P. 651.
Nishinari K., Watase M., Tanaka F. // J. Chim. Phys. (Paris). 1996. V. 93. P. 880.
Kobayashi M., Ando I., Ishii T., Amiya S. // J. Mol. Struct. 1998. V. 440. P. 155.
Kanekiyo M., Kobayashi M., Ando I., Kurosu H., Ishii T., Amiya S. // J. Mol. Struct. 1998. V. 447. P. 49.
Hassan C.M., Peppas N.A. // Macromolecules. 2000. V. 33. P. 2472.
Ricciardi R., Auriemma F., Gaillet C. De Rosa C., Lauprêtre F. // Macromolecules. 2004. V. 37. P. 9510.
Wan W.R., Campbell F., Zhang Z.F., Hui A.J., Boughner D.R. // J. Biomed. Mater. Res. 2002. V. 63. P. 854.
Jiang H., Campbell G., Boughner D., Wan W., Quantz M. // Med. Eng. Phys. 2004. V. 26. P. 269.
Kobayashi M., Chang Y., Oka M. // Biomaterials. 2005. V. 26. P. 3243.
Savina I.N., Hanora A., Plieva F.M., Galaev I.Yu., Mattiasson B., Lozinsky V.I. // J. Appl. Polym. Sci. 2005. V. 95. P. 529.
Hirai T., Maruyama H., Suzuki T., Hayashi S. // J. A-ppl. Polym. Sci. 1992. V. 45. P. 1849.
Hirai T., Maruyama H., Suzuki T., Hayashi S. // J. A-ppl. Polym. Sci. 1992. V. 46. P. 1449.
Лозинский В.И., Подорожко Е.А. // Патент РФ № 2561120. 2014. Б.И. 2015. № 23.
Guinier A. Théorie et technique de la radiocristallophie. Paris: Dunod, 1956.
Hrouz J., Ilavsky M., Havliček J., Dušek K. // Collect. Czechoslov. Chem. Commun. 1978. V. 43. P. 1999.
Sweeszkowski W., Ku D.N., Bersee H.E.N., Kurzcydlowski K.J. // Biomaterials. 2006. V. 27. P. 1536.
Pritchard J.G. Poly(vinyl alcohol): Basic Properties and Uses. London: Gordon & Beach Sci. Publ., 1970. P. 38.
Ricciardi R., Auriemma F., De Rosa C., Laupretre F. // Macromolecules. 2004. V. 37. P. 1921.
Auriemma F., De Rosa C., Ricciardi R., Celso F.L., Triolo R., Pipich V. // J. Phys. Chem. B. 2008. V. 112. P. 816.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


