Коллоидный журнал, 2021, T. 83, № 6, стр. 623-633
Синтез бифункциональных частиц-контейнеров из кремнезема на мицеллах антисептика с солюбилизированным куркумином и оценка их биологической активности
О. В. Дементьева 1, *, К. А. Наумова 1, Е. М. Шишмакова 1, И. Н. Сенчихин 1, С. К. Жиглецова 2, М. В. Клыкова 2, И. А. Дунайцев 2, Д. А. Козлов 3, В. М. Рудой 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, корп. 4, Россия
2 Государственный научный центр прикладной микробиологии и биотехнологии,
142279 Московская обл., Оболенск, Территория “Квартал А”, 24, Россия
3 Московский государственный университет им. М.В. Ломоносова,
химический факультет
119992 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: dema_ol@mail.ru
Поступила в редакцию 10.07.2021
После доработки 16.07.2021
Принята к публикации 19.07.2021
Аннотация
Исследованы особенности синтеза мезопористых частиц-контейнеров (МЧК) из SiO2 с использованием гибридного темплата, представляющего собой мицеллы антисептика мирамистина с солюбилизированным в них куркумином − гидрофобным биологически активным соединением широкого спектра действия. Определено влияние pH реакционной системы на структурно-морфологические характеристики МЧК и содержание в них биологически активных соединений. Установлено, в частности, что в нейтральной среде формируются сферические МЧК, а в щелочной – стержневидные. Получены количественные данные о кинетике перехода капсулированных соединений из объема частиц-контейнеров в окружающую среду с заданным значением pH. Установлено, что скоростью этого процесса можно дополнительно управлять путем формирования на поверхности МЧК оболочки из биосовместимого полимера полидопамина. На примере синтезированных в щелочной среде МЧК показано, что такие контейнеры проявляют высокую активность в уничтожении как грамположительных, так и грамотрицательных микроорганизмов.
ВВЕДЕНИЕ
Данная статья является продолжением серии работ, посвященных проблеме золь–гель синтеза мезопористых частиц-контейнеров (МЧК) из кремнезема с использованием в качестве темплатов мицелл или везикул дифильных функциональных соединений (в том числе, биологически активных), подлежащих загрузке в такие наноконтейнеры. Как свидетельствуют имеющиеся в литературе данные и результаты наших исследований (см. обзор [1] и приведенные в нем ссылки), этот подход позволяет совместить стадии синтеза МЧК и их загрузки целевым веществом. При этом получаемые частицы характеризуются не только чрезвычайно высоким содержанием целевого вещества (1 г и более в расчете на 1 г SiO2), но и чувствительностью к pH среды. Последний эффект, напрямую связанный с влиянием pH на гидролитическую стабильность кремнеземной матрицы, открывает возможность управления скоростью перехода капсулированного соединения из объема МЧК в окружающую среду без какой-либо их дополнительной модификации, что весьма важно для решения различных задач.
В этом направлении возможен и следующий логический шаг, позволяющий одновременно загрузить в МЧК несколько целевых соединений. Он основан на применении при синтезе частиц гибридных темплатов, представляющих собой мицеллы дифильного функционального соединения, содержащие гидрофобный солюбилизат [1–3]. В этой связи значительный интерес вызывает куркумин. Этот природный полифенол характеризуется широким спектром биологической активности, включая ранозаживляющее, иммуномодулирующее действие и др. [4, 5]. Основным препятствием для его активного использования в медицине является низкая растворимость в воде и, как следствие, ограниченная биодоступность.
Солюбилизация куркумина в мицеллах ПАВ (в том числе биологически активных) позволяет в значительной мере решить эту проблему (см., например, [3, 6–8]). Так, согласно нашим данным [3], при выборе в качестве солюбилизатора дифильного антисептика широкого спектра действия – мирамистина − растворимость куркумина в воде возрастает примерно в 80 раз. Использование таких гибридных темплатов при золь–гель синтезе МЧК позволяет загрузить в кремнеземную матрицу сразу два лекарственных препарата, скоростью высвобождения которых можно управлять, варьируя pH среды. Результаты [3] позволяют также предположить, что одним из основных факторов, влияющих как на емкость МЧК, так и на их структурно-морфологические характеристики, является pH реакционной системы. Анализ этого влияния – главная цель данной работы. Кроме того изучены особенности высвобождения капсулированных соединений из МЧК, полученных в разных условиях, и проведена оценка биологической активности частиц, синтезированных в щелочной среде, по отношению к двум типам микроорганизмов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и методы исследования
В работе использовали тетраэтоксисилан (ТЭОС), куркумин, водный раствор аммиака с концентрацией 28 мас. %, допамина гидрохлорид, фторид натрия (все реагенты марки ACS Reagent, Sigma-Aldrich, Германия), абсолютированный этанол, 37%-ную соляную кислоту (“х. ч.”, Компонент-Реактив, Россия), дигидрофосфат калия, тригидрат гидрофосфата калия (“х. ч.”, Химммед, Россия), а также лекарственный препарат мирамистин (ООО Инфамед, Россия).
Растворителями служили свежеперегнанный 96%-ный этанол и дистиллированная вода, дополнительно деионизированная на установке Arium 611 (Sartorius, Германия).
Всю химическую посуду перед проведением экспериментов обрабатывали хромовой смесью, а затем многократно ополаскивали дистиллированной водой.
Синтезированные частицы осаждали в центрифуге 320R (Hettich, Германия); их редиспергирование проводили в ультразвуковой ванне.
pH растворов измеряли с помощью ионометра I-500 (Аквилон, Россия).
Размеры и структуру частиц определяли методом просвечивающей электронной микроскопии высокого разрешения (ПЭМВР) на приборах Leo-912 AB Omega и Libra 200 (K. Zeiss, Германия) с ускоряющим напряжением 100 или 200 кВ соответственно. Образцы готовили, помещая каплю водной дисперсии на медную сеточку, покрытую формваром, выдерживая ее в течение 1 мин, а затем удаляя фильтровальной бумагой.
Для определения количества капсулированных в МНК препаратов использовали термогравиметрический анализ (ТГА). Эксперименты проводили на приборе TGA Q500 (TA Instruments, США) в открытых платиновых тиглях в атмосфере аргона в температурном диапазоне 25–600°C; скорость нагрева составляла 10 град./мин. Предварительно образцы высушивали в течение суток при комнатной температуре в вакуумном шкафу VD 23 (Binder, Германия).
Спектры поглощения исследованных дисперсий и растворов регистрировали на двухлучевом спектрофотометре Evolution 300 (Thermo Electron Corp., США) в диапазоне длин волн 190–1100 нм, используя кварцевые или пластиковые кюветы с длиной оптического пути 1 см. В луч сравнения помещали кювету, содержащую соответствующий растворитель.
Количество капсулированного в МЧК куркумина и скорость его выхода в дисперсионную среду определяли методом спектрофлуориметрии. Спектры регистрировали на приборе Cary Eclipse (Agilent, США) в кварцевой кювете с длиной оптического пути 1 см при длине волны возбуждения 430 нм.
Нагрев дисперсий, содержащих МЧК, покрытые полидопаминовой оболочкой, осуществляли путем их облучения непрерывным лазером с длиной волны генерации 808 нм. Мощность лазера – 0.5 Вт, максимальное время облучения – 30 мин. Температуру дисперсии определяли с помощью термопары.
Темплатный синтез МЧК и модификация их поверхности полидопамином
Солюбилизацию куркумина в мицеллах мирамистина проводили при комнатной температуре по схеме, описанной в [3]. Концентрация водных растворов мирамистина составляла 3 или 6 мМ, что в несколько раз выше его критической концентрации мицеллообразования, равной примерно 1 мМ.
Синтез МЧК проводили в щелочной или нейтральной среде. В первом случае схема синтеза частиц (далее они будут обозначаться МЧК-1) была аналогична описанной в [3]. К 25 мл 6 мМ раствора мирамистина с солюбилизированным куркумином добавляли 1.2 мл аммиачной воды и 1.12 мл раствора ТЭОС в абсолютированном этаноле с концентрацией примерно 15 об. %. Реакционную систему перемешивали в течение заданного времени (17–24 ч), а затем отделяли полученные частицы путем осаждения центрифугированием [3] и использовали их в дальнейших экспериментах.
Синтез МЧК в нейтральной среде осуществляли по следующей схеме. К 25 мл водного мицеллярного раствора мирамистина (3 мМ) с солюбилизированным куркумином добавляли 2 мл раствора NaF с концентрацией 25 мг/мл, а затем порциями по 50 мкл с интервалом 5 мин вводили 1 мл спиртового раствора ТЭОС (15 об. %). После этого реакционную смесь выдерживали при постоянном перемешивании в течение суток и отделяли полученные частицы (обозначим их МЧК-2) центрифугированием. Аналогичным образом были синтезированы МЧК на “пустых” (т.е. не содержащих куркумина) мицеллах антисептика.
Для оценки возможности более тонкого управления кинетикой высвобождения капсулированных соединений, а также перспектив дальнейшей функционализации МЧК на поверхности частиц, синтезированных в щелочной среде, формировали оболочку из полидопамина. Для этого к дисперсии МЧК-1, полученной путем однократного осаждения/редиспергирования частиц после синтеза, добавляли водный раствор допамина с концентрацией 1 мг/мл таким образом, чтобы массовое соотношение SiO2/допамин составило 1.7/1. Реакционную систему выдерживали в течение 3 ч при постоянном перемешивании, а затем отмывали частицы от непрореагировавшего допамина путем многократного повторения процедуры их осаждения/редиспергирования.
Изучение кинетики перехода капсулированных в МЧК соединений в дисперсионную среду
Кинетику перехода капсулированных соединений из МЧК в дисперсионную среду с заданным значением pH изучали в квазидинамических условиях. Для этого навеску МЧК диспергировали в дистиллированной воде или фосфатном буферном растворе (ФБР) с pH 4.9 и перемешивали при комнатной температуре. По истечении заданного промежутка времени (от 30 мин до 3-х суток) дисперсию центрифугировали и регистрировали спектры поглощения и флуоресценции надосадочной жидкости. Осадок редиспергировали в свежей порции соответствующей дисперсионной среды и продолжали перемешивание. Количества высвободившихся из МЧК мирамистина и куркумина определяли по полученным ранее калибровочным зависимостям.
Для изучения фототермического выхода капсулированных препаратов на дисперсию МЧК воздействовали светом лазера с длиной волны 808 нм в течение 30 мин, после чего частицы осаждали центрифугированием, анализировали надосадочную жидкость, а осадок редиспергировали в свежей порции дисперсионной среды и проводили повторный сеанс облучения. Эту процедуру повторяли 3 раза.
Определение бактерицидной активности МЧК-1
Культуры Staphylococcus aureus 93R и Salmonella enteritidis 237 из Государственной коллекции патогенных микроорганизмов и клеточных культур “ГКПМ-Оболенск” выращивали в течение 24 ч на ГРМ-агаре (Питательные среды, Оболенск, Россия) при 37°C. Бактериальные суспензии готовили путем диспергирования выращенных клеток в физиологическом растворе с фосфатным буфером (pH ≈ 4.9) до оптической плотности 1.5 и 1.7 единиц Макфарланда для S. enteritidis и Staphylococcus aureus 93R соответственно. Оптическую плотность измеряли на денситометре DEN-1B (BioSan, Латвия). В полученные бактериальные суспензии добавляли суспензию МЧК, не содержащих бактерицидов (SiO2), суспензию МЧК-1 или водный раствор смеси мирамистина и куркумина (М + К) в концентрации, соответствующей их содержанию в МЧК-1. Сразу после этого, а также спустя 3 и 6 ч из бактериальных суспензий отбирали пробы для определения числа КОЕ/мл методом последовательных 10-кратных разведений. Кроме того, по 5 мкл суспензии каждого разведения по каплям наносили на ГРМ-агар в чашках Петри. Все чашки инкубировали при 37°C в течение 24 ч. Повторность опытов трехкратная. Достоверность различий проверяли методом дисперсионного анализа с помощью программы Excel.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние pH реакционной системы на морфологию и емкость МЧК
Структурные формулы мирамистина и куркумина приведены на рис. 1. Мирамистин относится к классу катионных ПАВ и в водных растворах с концентрацией, превышающей критическую концентрацию мицеллообразования, формирует мицеллы диаметром около 5 нм, несущие положительный заряд. Куркумин проявляет слабые кислотные свойства и характеризуется тремя значениями pKa, отвечающими диссоциации двух фенольных и одной гидроксильной (енольной) групп, и равными 8.38, 9.88 и 10.51 [6].
При добавлении щелочи к мицеллярному раствору мирамистина с солюбилизированным куркумином его молекулы депротонируются, что приводит к частичной нейтрализации заряда головных групп ПАВ, т.е. к уменьшению их электростатического отталкивания. Это способствует увеличению радиуса кривизны мицелл и отклонению их формы от сферической. Нельзя исключить, что взаимодействие депротонированных молекул куркумина с головными группами ПАВ повлияет и на перестройку мицелл при взаимодействии с олигомерами кремниевой кислоты.
Как уже отмечалось [3], синтез МЧК в таких условиях приводит к образованию стержневидных частиц с гексагонально упорядоченной пористой структурой (рис. 2). Кроме того, при детальном рассмотрении микрофотографий видно, что частицы имеют спиралевидную “хиральную” структуру (обозначена стрелками на рис. 2б). Похожий результат – хиральные МЧК, синтезированные на ахиральном темплате, − наблюдали в работе [9]. По мнению авторов, он обусловлен тем, что плотная упаковка молекул темплата – бромида 1-октадецил-3-метилимидазолия – в цилиндрической мицелле приводит к тому, что плоские имидазольные фрагменты в составе головных групп ПАВ организуются ступенчато, способствуя закручиванию стержневидной мицеллы в спираль. Аналогичный эффект может иметь место и в нашем случае, когда депротонированные в щелочной среде молекулы куркумина приближаются к положительно заряженным головным группам мирамистина в мицелле. При этом неизбежно взаимодействие жестких ароматических колец, присутствующих как в молекуле мирамистина, так и в молекуле куркумина, результатом которого может быть образование хиральных частиц.
Рис. 2.
Полученные с разным увеличением микрофотографии МЧК-1 (а, б) и распределение таких частиц по размеру (в).

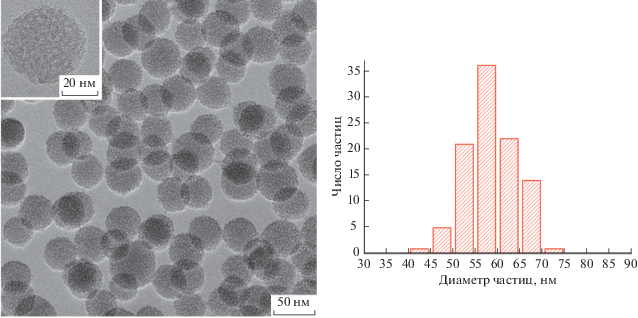
В нейтральной среде депротонирования молекул куркумина не происходит. В результате в процессе золь–гель синтеза образуются сферические частицы со средним диаметром около 60 нм (рис. 3). При этом сравнение ПЭМВР-изображений МЧК, синтезированных на “пустых” и содержащих куркумин мицеллах ПАВ-антисептика, показало, что наличие солюбилизата не влияет на структурно-морфологические характеристики частиц. Детальный анализ пористой структуры таких МЧК выходит за рамки данной работы, однако очевидно, что она существенно отличается от регистрируемой для частиц, полученных в щелочной среде. Как уже отмечалось [3, 10], для щелочной среды характерно образование МЧК с гексагонально-упорядоченной пористой структурой, тогда как в случае нейтральной среды можно, скорее, говорить о радиальном расположении пор. На наш взгляд, основной причиной такого различия является разный характер взаимодействия мицелл темплата с олигомерами кремниевой кислоты в этих условиях.
Рис. 3.
Микрофотография МЧК-2 и соответствующее распределение частиц по размеру. На вставке приведено ПЭМ-ВР-изображение с большим увеличением.
Результаты дальнейших экспериментов показали, что содержание обоих капсулированных в МЧК соединений существенно зависит от условий получения частиц. Так, согласно данным флуоресцентной спектроскопии, в нейтральной среде в МЧК встраиваются примерно 13 мас. % куркумина. В щелочной среде это количество значительно меньше (≈6 мас. %) из-за частичной гидролитической деструкции куркумина в процессе синтеза [3].
Иначе обстоит ситуация с емкостью частиц по мирамистину. На рис. 4 приведены ТГА-кривые для образцов МЧК, полученных в разных условиях. Поскольку массовое соотношение мирамистина и куркумина в гибридном темплате составляет примерно 26 : 1, основной вклад в потерю массы частицами вносит именно термическая деструкция мирамистина. Видно, что в случае МЧК-1 (кривая 1) количество капсулированного мирамистина составляет около 60 мас. % (или примерно 1.5 г темплатирующего ПАВ в расчете на 1 г SiO2), тогда как для МЧК-2 (кривая 2) это количество не превышает 30 мас. % (≈0.4 г/г). Такая картина в целом согласуется с литературными данными [11], согласно которым синтез частиц в нейтральной среде с использованием в качестве катализатора фторид-ионов способствует уменьшению количества встроенного в кремнеземную матрицу ПАВ.
При анализе ТГА-кривых обращает на себя внимание еще один факт – существенное различие в значениях температуры деструкции мирамистина в составе МЧК-1 и МЧК-2. С учетом полученных ранее данных (см. работу [10] и приведенные в ней ссылки) можно предположить, что оно обусловлено разными механизмами термодеструкции темплатирующего ПАВ в этих двух случаях.
Обратимся теперь к результатам экспериментов по изучению особенностей перехода капсулированных соединений в окружающую среду.
Изучение кинетики перехода капсулированных соединений из МЧК в дисперсионную среду с разным значением pH
Контролируемое высвобождение капсулированных препаратов – одно из важнейших свойств наносистем, применяемых для доставки лекарств. Следует отметить, что особенности этого процесса для МЧК, получаемых с использованием гибридных темплатов в щелочной среде, были подробно изучены нами ранее [3]. Показано, в частности, что скорость перехода мирамистина и куркумина из SiO2-матрицы в дисперсионную среду значительно возрастает при понижении ее pH. При этом степень высвобождения куркумина и скорость этого процесса сильно зависят от содержания в дисперсионной среде мирамистина, увеличиваясь по достижении им критической концентрации мицеллообразования. Этот эффект обусловлен солюбилизацией переходящих в водную среду молекул куркумина в мицеллах ПАВ [3].
На данном этапе мы планировали проанализировать влияние размера и формы частиц на кинетику выхода капсулированных соединений, а также оценить возможность более тонкого управления скоростью этого процесса путем формирования на поверхности МЧК оболочки из полидопамина (ПДА). Основной особенностью этого биосовместимого полимера является его структура, подобная структуре меланина, благодаря которой молекулы ПДА способны поглощать излучение ближнего ИК-диапазона, отвечающего окну прозрачности биологических тканей, и трансформировать его в тепло. Это свойство представляет интерес не только с точки зрения обеспечения дистанционного “вскрытия” частиц-контейнеров под действием лазерного излучения (и, следовательно, управления скоростью их разгрузки), но и применительно к фототермической терапии опасных заболеваний [12, 13].
Эксперименты по кинетике разгрузки МЧК проводили в квазидинамическом режиме, т.е. при периодической замене дисперсионной среды (см. Экспериментальную часть).
Результаты экспериментов показали, что характер перехода капсулированных соединений в дисперсионную среду сильно и не очень тривиально зависит от структурно-морфологических характеристик частиц (а точнее, от условий их получения). Это утверждение справедливо для МЧК, синтезированных как на “пустых” (т.е. не содержащих куркумина) мицеллах мирамистина, так и на гибридном темплате.
На рис. 5 приведена кинетическая кривая, описывающая переход мирамистина из МЧК, синтезированных в нейтральной среде на “пустых” мицеллах этого антисептика, в воду в сравнении с аналогичной кривой, полученной нами ранее [10] для частиц, синтезированных в щелочной среде11. Видно, что в первом случае имеет место очень быстрый (“взрывной”) выход значительной части капсулированного препарата на начальном этапе процесса, а затем его скорость существенно замедляется. Спустя 7 сут доля мирамистина, перешедшего в дисперсионную среду (W), достигает примерно 32 мас. % от его количества, встроенного в кремнеземную матрицу, и в дальнейшем слабо изменяется. Следует также подчеркнуть, что понижение pH среды до 4.9 практически не влияет на скорость процесса. Например, значения W, достигаемые за сутки в нейтральной и слабокислой средах составляют 10 и 9 мас. % соответственно.
Рис. 5.
Кинетическая кривая выхода мирамистина из МЧК, синтезированных на “пустых” мицеллах этого ПАВ в нейтральной среде, в воду. На вставке приведена аналогичная кинетическая кривая для МЧК, полученных в щелочной среде [10].

Для МЧК, полученных в щелочной среде (см. вставку на рис. 5), стадия “взрывного” выхода капсулированного антисептика отсутствует, а сам процесс протекает достаточно равномерно. В результате спустя 8 суток в дисперсионную среду переходит около 80 мас. % загруженного в частицы препарата. При этом, как показано в [10], понижение pH среды до 4.9 приводит к увеличению скорости десорбции мирамистина в 1.5–2 раза.
Обнаруженные расхождения в кинетике выхода этого антисептика обусловлены, в первую очередь, различиями в морфологии МЧК (т.е. в их размере и пористой структуре), плотности упаковки катионов ПАВ в порах и характере их взаимодействия со стенками пор, а также в гидролитической стабильности кремнеземной матрицы частиц, синтезированных в разных средах. Для определения основной причины необходимы дальнейшие эксперименты. Однако, на наш взгляд, доминирующими являются последние два фактора.
Действительно, согласно данным, полученным нами ранее [10], размер и пористая структура МЧК не оказывают принципиального влияния на ход кинетической кривой. В то же время известно, что золь–гель синтез кремнезема в нейтральной среде в присутствии ионов F− способствует формированию более плотной сетки связей Si–O–Si по сравнению с образующейся в щелочной среде [11, 14] при использовании, например, ионов ${\text{NH}}_{4}^{ + }.$ Поскольку выход капсулированных в МЧК соединений в значительной мере определяется деструкцией кремнеземной матрицы частиц под действием проникающей в нее воды [1], упрочнение сетки силоксановых связей может привести к уменьшению скорости этого процесса. Кроме того, способность ионов F− встраиваться в кремнеземную матрицу [11] может повлиять как на плотность упаковки катионов мирамистина в порах, так и на характер их взаимодействия со стенками пор22, а, следовательно, и на переход этих катионов в окружающую среду.
Очевидно, что для МЧК, полученных на гибридном темплате, представляющем собой мицеллы мирамистина с солюбилизированным в них куркумином, характер перехода капсулированных соединений в дисперсионную среду окажется не менее сложным. Как уже отмечалось, особенности этого процесса для МЧК-1 были подробно рассмотрены нами в [3]. Для обоих препаратов наблюдалось увеличение как скорости их выхода, так и значений W при понижении pH среды. Этот эффект особенно ярко выражен для куркумина.
Для МЧК-2, синтезированных в нейтральной среде, имеет место несколько иная картина. На рис. 6 приведены кинетические зависимости, описывающие переход мирамистина и куркумина из МЧК-2 в воду. Видно, что наличие куркумина в порах частиц способствует переходу мирамистина в дисперсионную среду (сравните рис. 5 и кривую 1 на рис. 6). Это касается как начального (“взрывного”) участка кинетической кривой, так и области пролонгированного выхода. В результате количество вышедшего из МЧК-2 антисептика значительно увеличивается, достигая в течение 5 суток примерно 55 мас. %. Это – весьма неожиданный результат, противоположный полученному в работе [3], когда присутствие в порах куркумина, напротив, приводило к уменьшению скорости выхода мирамистина. На наш взгляд, основная причина таких расхождений кроется в разной степени ионизации молекул куркумина в МЧК двух типов (и/или их локализации в мицеллах ПАВ-антисептика) и, как следствие, разном характере взаимодействий мирамистин–куркумин–кремнеземная матрица.
В свою очередь, выход из МЧК-2 куркумина подчиняется установленным в [3] закономерностям. В нейтральной среде этот процесс протекает очень медленно (кривая 2 на рис. 6). При этом концентрация куркумина в дисперсионной среде не превышает значения его равновесной растворимости. Это вполне ожидаемо, поскольку в условиях данного эксперимента мирамистин не образует мицелл. Подчеркнем, что уменьшение pH среды до ≈5 не оказывает сколько-нибудь заметного влияния на скорость и механизм перехода обоих капсулированных соединений в окружающую среду, что достаточно хорошо согласуется с результатами, полученными для МЧК, синтезированных в нейтральной среде на “пустых” мицеллах мирамистина.
Суммируя сказанное в этом разделе, отметим, что из двух типов рассмотренных МЧК наибольший интерес с точки зрения управления выходом капсулированных соединений в окружающую среду представляют частицы, синтезированные в щелочной среде. Более того, согласно предварительным данным, на поверхности таких МЧК достаточно легко может быть сформирован слой ПДА, что позволяет значительно расширить их функциональность.
Основным способом получения ПДА является окислительная полимеризация допамина в щелочной среде [12, 13]; как правило, с этой целью используют Трис буфер с pH ≈ 8.5. Общая схема этой реакции приведена на рис. 7. В нашем случае требуемое значение pH обеспечивалось за счет присутствия в системе остаточного количества аммиачной воды (см. Экспериментальную часть).
О формировании на поверхности МЧК-1 оболочки из ПДА свидетельствует изменение цвета частиц с кирпично-красного на темно-коричневый. По данным ПЭМВР толщина этой оболочки составляет 23 ± 2 нм. Как следует из представленных на рис. 8 данных, способность ПДА трансформировать излучение ближнего ИК-диапазона в тепло обеспечивает достаточно эффективный нагрев дисперсии модифицированных этим полимером МЧК-1 под действием лазера с длиной волны генерации 808 нм. Отметим, что дисперсия исходных МЧК-1 в тех же условиях нагревается всего на 2–3°C.
Рис. 8.
Кривые нагрева дисперсии МЧК-1, покрытых оболочкой из ПДА, под действием лазера с длиной волны генерации 808 нм (1) и ее последующего охлаждения (2); концентрация МЧК-1 равна примерно 1.5 мг/мл.

Дальнейшие эксперименты показали, что наличие на поверхности частиц ПДА-оболочки приводит к значительному уменьшению скорости перехода капсулированных соединений в дисперсионную среду (рис. 9). Так, в частности, скорость выхода мирамистина как в воду, так и в ФБР с pH ≈ 5 уменьшается примерно в два раза по сравнению с зарегистрированной для исходных МЧК-1 [3]. При этом влияние pH среды для модифицированных частиц выражено несколько слабее, чем для исходных. Отметим, что воздействие лазера на дисперсию способствует переходу антисептика в окружающую среду (рис. 10). Этот результат открывает возможность сочетания фототермической и лекарственной терапии при борьбе с бактериальными инфекциями.
Рис. 9.
Кинетические кривые выхода мирамистина из МЧК-1, покрытых ПДА оболочкой, в воду (1) и в ФБР с pH ≈ 5 (2). На вставке приведены кинетические кривые выхода мирамистина из исходных МЧК-1, полученные в аналогичных условиях [3].
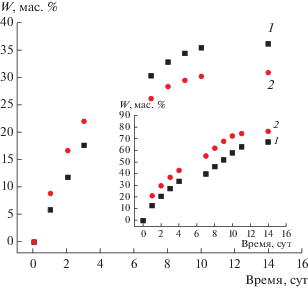
Рис. 10.
Кинетические кривые самопроизвольного (1) и индуцированного лазерным излучением (2) выхода мирамистина из МЧК-1, покрытых ПДА-оболочкой, в воду.

Таким образом, использованный нами подход позволяет получать бифункциональные МЧК с регулируемыми структурой, емкостью и скоростью разгрузки. Ниже на примере МЧК-1 будет рассмотрена эффективность действия таких частиц применительно к двум бактериальным культурам.
Определение бактерицидной активности МЧК-1
Как показано на рис. 11, МЧК-1 проявляют эффективное бактерицидное действие в отношении грамположительной культуры S. aureus и грамотрицательной культуры S. enteritidis, которое, естественно, зависит от времени и концентрации частиц. Аналогичные результаты были получены ранее для сходных по строению и составу частиц [15, 16] в отношении тех же бактериальных культур. МЧК-1 менее эффективны против сальмонеллы по сравнению со стафилококком, очевидно, потому, что основной бактерицидный компонент МЧК-1 – мирамистин также в целом менее эффективен в отношении грамотрицательных культур [17].
Рис. 11.
Гибель клеток S. aureus и S. enteritidis в зависимости от дозы МЧК-1 и времени их воздействия. Фотографии капель, полученных последовательным 10-кратным разведением, на агаре (в каждом ряду справа налево от 100 до 10–6 обработанных культур).

МЧК-1 показали примерно на порядок меньшую бактерицидную активность в отношении обоих микроорганизмов по сравнению с раствором смеси мирамистина и куркумина (рис. 12). Из данных по кинетике высвобождения мирамистина и куркумина из МЧК [3] следует, что в течение 6 ч инкубации частиц в среде с рН ≈ 5 высвобождается не более 10 мас. % мирамистина и примерно 2 мас. % куркумина, а спустя 3 ч эти значения составляют не более 5 и 1 мас. % соответственно. Очевидно, что величина бактерицидного эффекта МЧК-1, зависящая не только от дозы, но и от времени воздействия, после 3 и 6 ч инкубации должна уступать величине эффекта смешанного водного раствора этих двух соединений значительно больше, чем на порядок. Таким образом, наблюдается более высокая бактерицидная активность МЧК-1, чем можно было бы ожидать из данных по кинетике высвобождения из них мирамистина и куркумина при соответствующем значении рН. При этом пустые частицы SiO2 не обладают бактерицидным действием (рис. 12), что отмечалось и ранее [15, 16].
Рис. 12.
Выживаемость S. aureus (а) и S. enteritidis (б) в течение 0, 3 и 6 ч при воздействии: (a) 5 мг/л SiO2, 10 мг/л смеси мирамистина и куркумина (М + К) или 15 мг/л МЧК-1; (б) 25 мг/л SiO2, 50 мг/л смеси М + К или 75 мг/л МЧК-1.

Как следует из данных, приведенных на рис. 12, для сальмонеллы повышение бактерицидной активности МЧК-1 по сравнению с раствором смеси мирамистина и куркумина менее выражено, чем для стафилококка, по-видимому, из-за наличия микрокапсулы вокруг ее клеток.
Повышенную бактерицидную активность нагруженных бактерицидом МЧК по сравнению с ожидаемой на основании данных о кинетике высвобождения из них бактерицида наблюдали и в [16]. В этой работе полученный эффект объяснили специфическим повышением бактерицидной активности темплата внутри кремнеземных контейнеров. Нам же представляется, что данные по кинетике высвобождения бактерицида из МЧК в чистую воду или буферный раствор могут не соответствовать кинетике его высвобождения в клеточной суспензии. В присутствии клеток высвобождение бактерицида из МЧК может происходить быстрее не только вследствие сдвига равновесия из-за поглощения бактерицида клетками, но и из-за возможного разрушения кремнеземных контейнеров при контакте с клетками и их метаболитами. Кроме того, нельзя исключить присутствия в порах некоторого количества продуктов щелочного гидролиза куркумина [3], которые также могут проявлять биологическую активность [18]. Для выяснения причины наблюдаемого эффекта требуются дальнейшие исследования.
В целом полученные результаты позволяют говорить о том, что мирамистин и куркумин не теряют своей бактерицидной активности в МЧК и могут быть весьма эффективными в уничтожении как грамположительных, так и грамотрицательных микроорганизмов.
ЗАКЛЮЧЕНИЕ
Представленные результаты свидетельствуют о том, что одностадийный подход к синтезу и загрузке МЧК может быть адаптирован для одновременного капсулирования нескольких функциональных соединений путем использования гибридных темплатов, представляющих собой мицеллы функционального ПАВ, содержащие гидрофобный солюбилизат. При этом, варьируя условия золь−гель процесса, можно управлять не только структурно-морфологическими характеристиками и емкостью получаемых МЧК, но, отчасти, и кинетикой их разгрузки. Такая возможность появляется, в частности, вследствие влияния условий синтеза частиц на гидролитическую стабильность кремнеземной матрицы.
Кроме того показано, что модификация поверхности МЧК фоточувствительным полимером ПДА позволяет обеспечить их “вскрытие” под действием излучения ближнего ИК-диапазона.
Продемонстрирована перспективность использования МЧК, синтезированных на мицеллах мирамистина с солюбилизированным куркумином, для борьбы с различными патогенными микроорганизмами.
Список литературы
Дементьева О.В. // Коллоид. журн. 2020. Т. 82. С. 523.
He Q., Gao Y., Zhang L., Zhang Z., Gao F., Ji X., Li Y., Shi J. // Biomaterials. 2011. V. 32. P. 7711.
Naumova K.A., Dement’eva O.V., Senchikhin I.N., Rudoy V.M. // Micropor. Mesopor. Mater. 2021. V. 316. 110911.
Hussain Z., Thu H.E., Ng S.-F., Khan S., Katas H. // Colloids Surf. B. 2017. V. 150. P. 223.
Salehi B., Stojanović-Radić Z., Matejić J., Sharifi-Rad M., Anil Kumar N.V., Martins N., Sharifi-Rad J. // Eur. J. Med. Chem. 2019. V. 163. P. 527.
Leung M.H.M., Colangelo H., Kee T.W. // Langmuir. 2008. V. 24. P. 5672.
Sahu A., Kasoju N., Goswami P., Bora U. // J. Biomater. Appl. 2011. V. 25. P. 619.
Наумова К.А., Дементьева О.В., Зайцева А.В., Рудой В.М. // Коллоид. журн. 2019. Т. 81. С. 478.
Trewyn B.G., Whitman C.M., Lin V.S.Y. // Nano Lett. 2004. V. 4. P. 2139.
Дементьева О.В., Сенчихин И.Н., Карцева М.Е., Огарев В.А., Зайцева А.В., Матушкина Н.Н., Рудой В.М. // Коллоид. журн. 2016. Т. 78. С. 539.
Voegtlin A.C., Ruth F., Guth J.L., Patarin J., Huve L. // Micropor. Mater. 1997. V. 9. P. 95.
Wang Z., Duan Y., Duan Y. // J. Control. Release. 2018. V. 290. P. 56.
Shao M., Chang C., Liu Z., Chen K., Zhou Y., Zheng G., Huang Z., Xu H., Xu P., Lu B. // Colloids Surf. B. 2019. V. 183. 110427.
Colloidal Silica. Fundamentals and Applications / Ed. by Bergna H.E., Roberts W.O. Boca Raton: Taylor & Francis Group, 2006.
Dement’eva O.V., Naumova K.A., Zhigletsova S.K., Klykova M.V., Somov A.N., Dunaytsev I.A., Senchikhin I.N., Volkov V.V., Rudoy V.M. // Colloids Surf. B. 2020. V. 185. 110577.l
Dubovoy V., Ganti A., Zhang T., Al-Tameemi H., Cerezo J.D., Boyd J.M., Asefa T. // J. Am. Chem. Soc. 2018. V. 140. P. 13534.
Мирамистин. Результаты клинических исследований в терапии, педиатрии, оториноларингологии. М.: ООО “Лига-Принт”, 2013.
Shen L., Ji H.-F. // Trends Mol. Med. 2012. V. 18. P. 138.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал






