Коллоидный журнал, 2022, T. 84, № 1, стр. 34-41
Наноэмульсии с амарантовым и облепиховым маслами
Я. О. Иванова 1, М. М. Костромичева 1, Е. Н. Офицеров 1, М. Ю. Королева 1, *
1 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., д. 9, Россия
* E-mail: m.yu.kor@gmail.com
Поступила в редакцию 20.12.2021
После доработки 27.12.2021
Принята к публикации 30.12.2021
- EDN: XBLXJK
- DOI: 10.31857/S0023291222010049
Аннотация
Наноэмульсии (НЭ), содержащие природные компоненты, представляют особый интерес для использования в фармацевтической и пищевой промышленности, в том числе и при капсулировании гидрофобных действующих веществ. В данной работе исследованы свойства НЭ, содержащих в качестве дисперсной фазы амарантовое и облепиховое масло или смесь этих масел. В НЭ, стабилизированных смесью Tween 80 и Span 80, средний диаметр капель дисперсной фазы составлял 18–33 нм. При стабилизации смесью Tween 60 и Span 60 средний диаметр капель был равен 25–40 нм. При этом НЭ с Tween 80 и Span 80 были неустойчивыми к флокуляции и обратной седиментации. С течением времени формировалась сетчатая структура из флокул капель дисперсной фазы в объеме дисперсионной среды НЭ, что сопровождалось отслаиванием части водной фазы. Доля дисперсной фазы в таких НЭ увеличивалась, практически достигала соответствующей плотной упаковке капель, а затем изменялась незначительно. НЭ с Tween 60 и Span 60 были значительно более устойчивы к флокуляции, так как данные ПАВ образовывали на поверхности капель дисперсной фазы твердую оболочку. Флокуляция в этих НЭ протекала чрезвычайно медленно, обратная седиментация отсутствовала. Таким образом, были получены НЭ амарантового и облепихового масел, устойчивые к флокуляции и обратной седиментации в течение длительного времени.
1. ВВЕДЕНИЕ
Наноэмульсии (НЭ) являются перспективными материалами для использования в фармацевтической и пищевой промышленности [1, 2]. НЭ активно исследуются для целевой доставки лекарственных и биологически активных соединений в организм человека, показана возможность их использования при создании вакцин, противовирусных и дезинфицирующих средств [3]. Одним из направлений применения НЭ является капсулирование в дисперсной фазе природных соединений для трансдермального транспорта. На основе НЭ могут быть созданы противовоспалительные, ранозаживляющие, антибактериальные средства при включении в состав дисперсной фазы биологически активных облепихового и амарантового масел. В состав облепихового масла входят каротиноиды, ненасыщенные и насыщенные жирные кислоты (пальмитолеиновая, линолевая, олеиновая, α-линоленовая, пальмитиновая, стеариновая), фосфолипиды [4, 5]. Концентрация фосфолипидов в амарантовом масле достигает 10%. Кроме того, в амарантовом масле, помимо перечисленных выше соединений, содержатся тритерпеноиды, β-ситостерол и сквален, причем содержание последнего достигает 8%, что выделяет масло амаранта в ряду других широко распространенных масел. Благодаря сквалену амарантовое масло проявляет противоопухолевую активность, антимикробное и фунгицидное действие [6].
В настоящее время опубликовано ограниченное количество работ по изучению эмульсий с облепиховым и амарантовым маслом. Так, в работе [7] методом гомогенизации под высоким давлением были получены эмульсии с облепиховым маслом, стабилизированные казеинатом натрия. Размер капель дисперсной фазы был равен 160 нм. Полученные эмульсии были стабильны, средний диаметр изменялся незначительно в течение 30 сут благодаря высокому ζ-потенциалу капель, достигавшему –50 мВ в нейтральной среде.
Метод гомогенизации под давлением также был использован в работе [8] для получения эмульсий с облепиховым маслом, стабилизированных казеинатом натрия. При повышении давления при гомогенизации от 20 до 80 МПа диаметр капель дисперсной фазы уменьшался от 282 до 205 нм. С увеличение концентрации дисперсной фазы от 5 до 20% диаметр капель возрастал от 282 до 355 нм при гомогенизации при 20 МПа.
Наноструктурированные липидные носители со скваленом, амарантовым и тыквенным маслами, стабилизированные смесью эмульгаторов (холат натрия, Tween 20, Synperonic PE/F68), были получены гомогенизацией под давлением [9]. Размер липидных частиц со скваленом или с амарантовым маслом был равен 95 нм. С тыквенным маслом получались более крупные частицы размером 108 нм.
Для фармацевтического применения активно исследуются различные липидные системы со скваленом: эмульсии и НЭ [10–13], твердые липидные наночастицы [14, 15], наноструктурированные носители [9, 16], эмульсии Пикеринга [17]. Запатентованы эмульсионные адъюванты со скваленом MF59® и AddaVaxTM с каплями дисперсной фазы размером 120–170 нм, стабилизированными Tween 80 и Span 85.
Были получены устойчивые эмульсии сквалена и оливкового масла, стабилизированные Tween 80 и Span 80. При добавлении в состав эмульсий куркумы размер капель дисперсной фазы уменьшался от 400 до 200 нм [11]. В эмульсиях сквалена растительного и животного происхождения, стабилизированных Tween 80 и Span 85, размер капель различался незначительно и составлял 140–150 нм [12]. В НЭ сквалена и α-токоферола, стабилизированных Tween 80, средний размер капель не превышал 100 нм [13].
НЭ других растительных и эфирных масел исследованы в большей степени [18]. Такие НЭ получали методами температурной инверсии фаз [19, 20] и инверсии фаз при изменении состава [21, 22], гомогенизацией под давлением [23, 24], ультразвуковым диспергированием [25, 26], диспергированием при повышенной температуре [27].
Чаще всего НЭ растительных масел стабилизировали Tween 80. Были получены НЭ коричного масла с диаметром капель дисперсной фазы d = 23.5 нм [19], масла тимьяна с размером капель d < 70 нм [21], лимонного или тимьянового масла и рыбьего жира (d ≈ 100 нм) [24], масла виноградных косточек и апельсинового масла (d ≈ ≈ 100 нм) [22], масла тмина и перечного масла (d = 30–95 нм) [25].
В НЭ бергамотового и апельсинового масел с долей дисперсной фазы 5%, стабилизированных смесью Tween 80 и лецитина, размер капель составлял 30 и 65 нм [23]. При увеличении доли дисперсной фазы до 15% размер капель значительно возрастал и превышал 100 нм. Размер капель дисперсной фазы из масла нима при стабилизации Tween 20 составлял 15–31 нм [26]. При стабилизации НЭ кокосового масла полиоксиэтилированным гидрированным касторовым маслом RH40 размер капель варьировал от 20 до 100 нм [20]. НЭ с d = 20–30 нм и долей дисперсной фазы 40% были получены из оливкового масла [27].
Таким образом, в литературе имеются ограниченные сведения о НЭ, содержащих амарантовое и облепиховое масла. В данной работе исследовано влияние поверхностно-активных веществ (ПАВ) на дисперсность и устойчивость НЭ амарантового и облепихового масел, а также их смеси. В качестве ПАВ использованы смеси Tween 80/Span 80 или Tween 60/Span 60, при адсорбции которых на поверхности капель дисперсной фазы образуется либо жидкая, либо твердая оболочка [28].
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Реактивы и материалы
Для получения НЭ были использованы амарантовое масло (ООО “Русская Олива”, Россия) и облепиховое масло (ЗАО Алтайвитамины, Россия). Использовали также следующие реактивы от Sigma-Aldrich: моноолеат полиоксиэтиленсорбитана – Tween 80 (≥95%), моностеарат полиоксиэтиленсорбитана – Tween 60, сорбитанмоноолеат – Span 80 (≥95%), сорбитанмоностеарат – Span 60 (≥95%), NaCl (≥99.5%). Дополнительной очистке вещества не подвергали.
2.2. Получение наноэмульсий
НЭ были получены методом температурной инверсии фаз. Сосуд, содержащий 5.0 мл амарантового или облепихового масла, 2.5 мл смеси Tween 80 и Span 80, 12.5 мл водного раствора NaCl с концентрацией 0.15 М, нагревали до 80°C. Затем смесь охлаждали на ледяной бане при интенсивном перемешивании. Мольное соотношение ПАВ в смеси составляло 0.76 [29].
2.3. Исследование наноэмульсий
Для определения размера капель НЭ использовали лазерный анализатор Zetasizer Nano ZS (Malvern Instruments). Измерения проводились при температуре 25°C.
Морфологию и размер капель в НЭ определяли с помощью просвечивающей электронной микроскопии (ПЭМ). Для негативного контрастирования образцов использовали 2%-ный раствор фосфорновольфрамовой кислоты. Микроизображения образцов НЭ получали с помощью ПЭМ LEO 912 AB OMEGA при ускоряющем напряжении 100 кВ.
Устойчивость НЭ к флокуляции и седиментации определяли с помощью прибора MultiScan MS 20 (DataPhysics Instruments GmbH). Измерения интенсивности проходящего света и обратного светорассеяния проводили при сканировании образца по высоте с шагом 20 мкм, скорость сканирования составляла 12.5 мм/c. Длина волны монохроматического излучения была равна 880 нм. На основе полученных данных были построены зависимости пропускания и обратного светорассеяния от высоты, т.е. от расстояния от дна сосуда с НЭ, выраженного в относительных величинах – от 0 до 1.
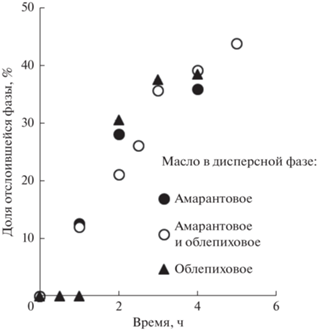
Также устойчивость НЭ определяли визуально по скорости отслаивания фаз. Приблизительно 5–7 мл НЭ помещали в градуированную пробирку сразу же после получения, пробирку герметично закрывали. НЭ хранили при температуре 25°C. Через определенные промежутки времени регистрировали объем водной фазы, отслоившейся из НЭ. Органическая фаза не отслаивалась из НЭ в течение времени проведения исследований.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1. Наноэмульсии, стабилизированные Tween 80 и Span 80
НЭ являются кинетически стабильными системами. С течением времени в них могут протекать такие же процессы, как и в макроэмульсиях: флокуляция, коалесценция, обратная седиментация. Исследованные в данной работе прямые НЭ содержали в качестве дисперсной фазы амарантовое масло, облепиховое масло или смесь этих масел в объемном соотношении 1 : 1. Для стабилизации НЭ использовали смесь неионогенных ПАВ Tween 80 и Span 80 в мольном соотношении 0.7. Данные ПАВ являются производными олеиновой кислоты и при комнатной температуре находятся в жидком состоянии.
Сразу же после получения средний диаметр капель дисперсной фазы был равен примерно 18, 24 и 33 нм в НЭ амарантового масла, смеси масел и облепихового масла соответственно (рис. 1).
Рис. 1.
Распределения капель по размерам в НЭ природных масел, стабилизированных смесью Tween 80 и Span 80, сразу же после получения.
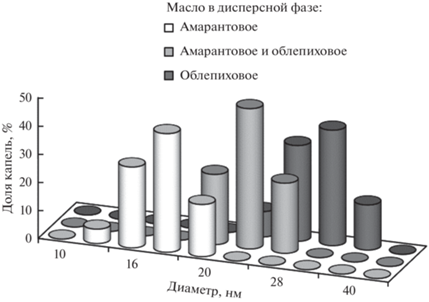
Распределения капель по размерам были мономодальными, т.е. в НЭ практически отсутствовали флокулы капель дисперсной фазы. В течение примерно 0.5 ч НЭ сохраняли свою стабильность, распределения капель по размерам изменялись незначительно. Поскольку НЭ были стабилизированы неионогенными ПАВ, поверхностный заряд капель был низким [30]. Такие дисперсные системы, как правило, неустойчивы к флокуляции и коалесценции. Несмотря на то, что природные масла представляют собой смесь компонентов с разной растворимостью в водной фазе, в таких системах может протекать оствальдово созревание [31].
Как видно на рис. 2, через 4 ч после получения НЭ облепихового масла состояла из крупных флокул капель дисперсной фазы. Во флокулах присутствовали как капли с d = 25–35 нм, т.е. капли исходного размера (рис. 1), так и более крупные капли, образовавшиеся в результате коалесценции.
Рис. 2.
ПЭМ-фотография НЭ облепихового масла, стабилизированной смесью Tween 80 и Span 80, через 4 ч после получения.

О флокуляции капель дисперсной фазы свидетельствуют профили обратного светорассеяния, т.е. зависимости рассеяния от расстояния, отсчитываемого от дна сосуда с НЭ. На рис. 3а приведены такие зависимости, характерные для НЭ облепихового масла. Аналогичные зависимости были получены и для НЭ амарантового масла и смеси амарантового и облепихового масел. В нижней части сосуда с НЭ достаточно быстро появлялась зона с меньшим обратным светорассеянием. С течением времени эта зона расширялась, а в верхней части сосуда появлялась зона более высокого светорассеяния. Это свидетельствует о неоднородности структуры НЭ и протекании флокуляции. Образовавшиеся флокулы объединялись с образованием сетчатой структуры в объеме дисперсионной среды НЭ. Постепенно сетчатая структура уплотнялась, что сопровождалось отслаиванием части водной фазы и увеличением концентрации дисперсной фазы в нерасслоившейся части НЭ.
Рис. 3.
Профили обратного светорассеяния (а) и пропускания (б) по высоте столба НЭ облепихового масла, стабилизированной смесью Tween 80 и Span 80, через разные интервалы времени после получения.
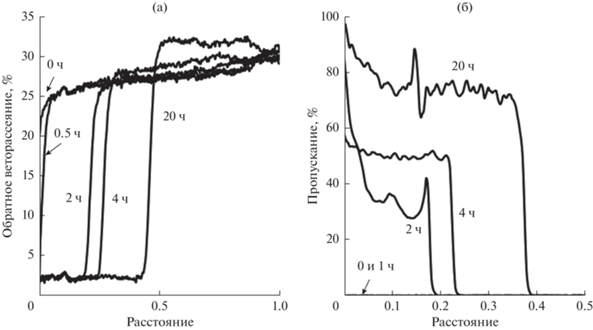
Величины пропускания света по всей высоте столба НЭ сразу же после получения и спустя 1 ч были практически равны нулю (рис. 3б), т.е. НЭ не расслаивались. С течением времени из НЭ частично отслаивалась водная фаза, и в нижней части сосуда появлялась зона высокого пропускания света. В верхней части сосуда пропускание было практически равным нулю, т.е. органическая фаза из НЭ не отслаивалась.
Процесс отслаивания водной фазы из НЭ протекал достаточно быстро (рис. 4). Скорость отслаивания водной фазы практически не зависела от природы растительного масла, образующего дисперсную фазу. Несмотря на присутствие фосфолипидов в амарантовом и облепиховом маслах их количество было недостаточным для дополнительной стабилизации, и НЭ с Tween 80 и Span 80 были неустойчивыми к флокуляции и обратной седиментации. Однако следует отметить, что исследованные НЭ не расслаивались полностью, а концентрировались. В результате отслаивания части дисперсионной среды, доля дисперсной фазы в НЭ увеличивалась до 65–75%, а затем оставалась неизменной в течение длительного времени.
3.2. Наноэмульсии, стабилизированные Tween 60 и Span 60
Неионогенные ПАВ Tween 60 и Span 60 являются производными стеариновой кислоты. Температура плавления Tween 60 составляет 24.5°C, Span 60–52°C. При получении НЭ методом температурной инверсии фаз данные ПАВ образуют на поверхности капель дисперсной фазы смешанный адсорбционный слой, представляющий собой твердую оболочку с температурой плавления, равной примерно 37°C [28].
Образование твердой оболочки на поверхности капель, безусловно, влияет на устойчивость НЭ. На рис. 5 показаны распределения капель по размерам в НЭ амарантового и облепихового масел и их смеси. Распределение капель по размерам в НЭ амарантового масла было мономодальным. Средний диаметр капель составлял примерно 40 нм. Распределение по размерам оставалось мономодальным более одной недели. Средний диаметр капель практически не изменялся, однако через 14 сут в НЭ появились флокулы капель дисперсной фазы размером 250–300 нм (рис. 5а).
Рис. 5.
Изменение распределений капель по размерам в НЭ амарантового масла (а), смеси амарантового и облепихового масел (б) и облепихового маслом (в) с течением времени. НЭ стабилизированы смесью Tween 60 и Span 60.
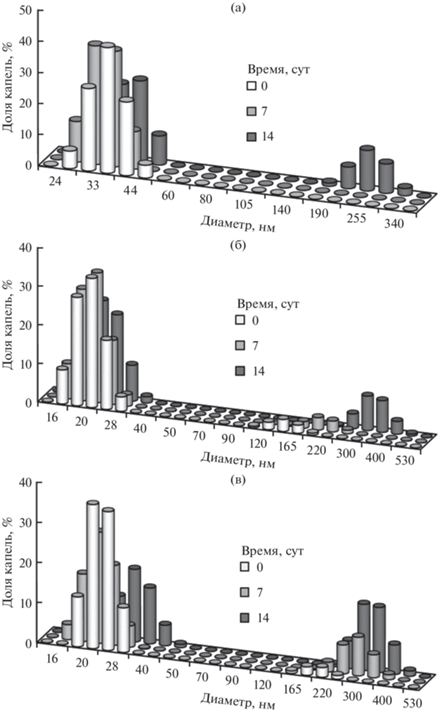
В НЭ смеси амарантового и облепихового масел средний диаметр капель составлял примерно 25 нм. Однако в системе сразу же после получения присутствовало небольшое количество флокул капель дисперсной фазы размером примерно 165 нм. В течение 14 сут средний размер одиночных капель практически не изменялся. Количество флокул медленно возрастало, а их размер увеличился до 350–400 нм (рис. 5б).
Распределение капель по размерам в НЭ облепихового масла было бимодальным сразу же после получения. Средний диаметр капель составлял 25–30 нм. Количество флокул капель дисперсной фазы возрастало с течением времени. Размер флокул за 14 сут увеличился от 200 до 300–350 нм (рис. 5в).
Значения ζ-потенциала капель в НЭ, стабилизированных Tween 60 и Span 60, были отрицательными и достаточно низкими: –1.2 ± 0.3 мВ для капель облепихового масла, –2.7 ± 0.3 мВ для капель смеси амарантового и облепихового масел и –3.2 ± 0.3 мВ для капель амарантового масла. Тем не менее, большее по абсолютной величине значение ζ-потенциала в случае амарантового масла по сравнению с облепиховым маслом могло быть одной из причин более высокой стабильности к флокуляции НЭ амарантового масла.
Как видно на рис. 6, в НЭ облепихового масла через 4 ч после получения практически все капли дисперсной фазы находились в изолированном состоянии, агрегаты отсутствовали. Размер капель дисперсной фазы соответствовал размерам, определенным с помощью динамического рассеяния света.
Рис. 6.
ПЭМ-фотография НЭ облепихового масла, стабилизированной смесью Tween 60 и Span 60, через 4 ч после получения.

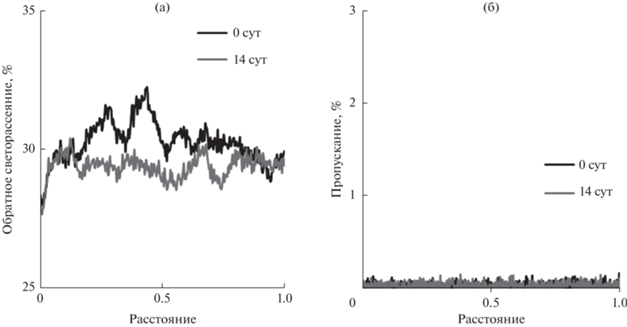
Отметим, что, несмотря на флокуляцию капель дисперсной фазы, все исследованные НЭ, стабилизированные смесью Tween 60/Span 60, не расслаивались в течение длительного времени. В НЭ облепихового масла, в несколько большей степени склонных к флокуляции по сравнению с остальными, обратное светорассеяние немного уменьшилось за 14 сут (рис. 7а). Если не учитывать флуктуации рассеяния света, то его величина была относительно постоянной по высоте столба НЭ. Это свидетельствует об однородности структуры НЭ. Пропускание света было чрезвычайно низким (рис. 7б) и не изменялось в течение 14 сут, что демонстрирует высокую устойчивость НЭ.
Рис. 7.
Профили обратного светорассеяния (а) и пропускания (б) по высоте столба НЭ облепихового масла, стабилизированной смесью Tween 60 и Span 60.
Таким образом, формирование твердой оболочки из Tween 60 и Span 60 на каплях дисперсной фазы в НЭ природных масел способствовало значительному повышению их устойчивости. Вследствие малого размера капли в НЭ подвержены интенсивному броуновскому движению. При упругих столкновениях капель, покрытых твердой оболочкой, в большинстве случаев не происходила их агрегация. Поэтому такие дисперсные системы сохраняли агрегативную устойчивость в течение длительного времени.
4. ЗАКЛЮЧЕНИЕ
Наноэмульсии с природными маслами в качестве дисперсной фазы перспективны для использования в фармацевтической и пищевой промышленности, поэтому они активно исследуются в последнее время. Эмульсии с амарантовым и облепиховым маслом исследованы в значительно меньшей степени, сведения о НЭ данных масел с диаметром капель менее 100 нм практически отсутствуют. В данной работе проведено изучение дисперсности и устойчивости НЭ, содержащих в качестве дисперсной фазы амарантовое или облепиховое масло, а также их смесь в объемном соотношении 1 : 1.
При стабилизации смесью неионогенных ПАВ Tween 80 и Span 80 средний диаметр капель дисперсной фазы в НЭ составлял 18–33 нм. Однако такие дисперсные системы были неустойчивыми к флокуляции и обратной седиментации. С течением времени флокулы капель объединялись, образуя сетчатую структуру в объеме дисперсионной среды. Уплотнение сетчатой структуры приводило к отслаиванию части водной фазы и увеличению концентрации дисперсной фазы в нерасслоившейся части НЭ до 65–75%, что практически соответствует плотной упаковке капель, а затем оставалась неизменной в течение длительного времени.
Средний диаметр капель в НЭ, стабилизированных смесью Tween 60 и Span 60, был равен 25–40 нм. НЭ на основе амарантового и облепихового масел и их смеси были значительно устойчивее к флокуляции, так как данные ПАВ образовывали на поверхности капель твердую оболочку. Флокуляция в этих НЭ протекала чрезвычайно медленно, особенно в НЭ амарантового масла. Обратная седиментация капель и флокул в таких системах отсутствовала в течение длительного времени, и НЭ сохраняли однородную структуру.
Список литературы
McClements D.J. // Prog. Lipid Res. 2021. V. 81. 101081.
Augustin M.A., Hemar Y. // Chem. Soc. Rev. 2009. V. 38. P. 902.
Koroleva M.Yu., Yurtov E.V. // Russ. Chem. Rev. 2012. V. 81. P. 21.
Yang B., Kallio H.P. // J. Agric. Food Chem. 2001. V. 49. P. 1939.
Ren R., Li N., Su C., Wang Y., Zhao X., Yang L., Li Y., Zhang B., Chen J., Ma X. // RSC Adv. 2020. V. 10. P. 44654.
Reddy L.H., Couvreur P. // Adv. Drug Deliv. Rev. 2009. V. 61. P. 1412.
Chang M., Guo Y., Jiang Z., Shi L., Zhang T., Wang. Y., Gong M., Wang T., Lin R., Liu R., Wang Y., Jin Q., Wang X. // J. Food Eng. 2020. V. 287. 110129.
Zheng H., Mao L., Yang J., Zhang C., Miao S., Gao Y. // J. Food Qual. 2020. V. 2020. P. 1540925.
Lacatusu I., Niculae G., Badea N., Stan R., Popa O., Oprea O., Meghea A. // Chem. Eng. J. 2014. V. 246. P. 311.
Ho H.-M., Huang C.-Y., Cheng Y.-J., Chen I-H., Liu S.-J., Huang C.-H., Huang M.-H. // Biomed. Pharmacother. 2021. V. 141. P. 111799.
Charoenkul K., Phromyothin D. // Mater. Today: Proc. 2017. V. 4. P. 6105.
Brito L.A., Chan M., Baudner B., Gallorini S., Santo G., O’Hagan D.T., Singh M. // Vaccine. 2011. V. 29. P. 6262.
Cao W., Davis W.G., Kim J.H., De La Cruz J.A., Taylor A., Hendrickson G.R., Kumar A., Ranjan P., Lyon A., Katz J.M., Gangappa S., Sambhara S. // Nanomedicine. 2016. V. 12. P. 1909.
Stelzner J.J., Behrens M., Behrens S.-E., Mäder K. // Vaccine. 2018. V. 36. P. 2314.
Gogoll K., Stein P., Lee K.D., Arnold P., Peters T., Schild H., Radsak M., Langguth P. // Cell. Immunol. 2016. V. 308. P. 35.
Gao X., Gong J., Cai Y., Wang J., Wen J., Peng L., Guo D. // Int. J. Biol Macromol. 2021. V. 188. P. 855.
Persson K.H., Blute I.A., Mira I.C., Gustafsson J. // Colloids Surf. A. 2014. V. 459. P. 48.
Harwansh R.K., Deshmukh R., Rahman M.A. // J. Drug Deliv. Sci. Technol. 2019. V. 51. P. 224.
Chuesiang P., Siripatrawan U., Sanguandeekul R., McClements D.J., McLandsborough L. // Food Control. 2019. V. 98. P. 405.
Jintapattanakit A., Hasan H.M., Junyaprasert V.B. // J. Drug Deliv. Sci. Technol. 2018. V. 44. P. 289.
Ryu V., McClements D.J., Corradini M.G., McLandsborough L. // Food Chem. 2018. V. 245. P. 104.
Davidov-Pardo G., McClements D.J. // Food Chem. 2015. V. 167. P. 205.
Yang Y., Zhao C., Tian G., Lu C., Li C., Bao Y., Tang Z., McClements D.J., Xiao H., Zheng J. // Food Res. Int. 2018. V. 109. P. 149.
Walker R.M., Gumus C.E., Decker E.A., McClements D.J. // J. Food Eng. 2017. V. 211. P. 60.
Amrutha B., Sundar K., Shetty P.H. // LWT – Food Sci. Technol. 2017. V. 79. P. 152.
Rinaldi F., Hanieh P.N., Longhi C., Carradori S., Secci D., Zengin G., Ammendolia M.G., Mattia E., Del Favero E., Marianecci C., Carafa M. // J. Enzym. Inhib. Med. Chem. 2017. P. 32. P. 1265.
Yukuyama M.N., Oseliero P.L.F., Kato E.T.M., Lobënberg R., Oliveira C.L.P., Araujo G.L.B., Bou-Chacra N.A. // Colloids Surf. A. 2018. V. 554. P. 296.
Koroleva M., Portnaya I., Mischenko E., Abutbul-Ionita I., Kolik-Shmuel L., Danino D. // J. Colloid Interface Sci. 2022. V. 610. P. 61.
Koroleva M.Yu., Nagovitsina T.Yu., Yurtov E.V. // Mendeleev Commun. 2015. V. 25. P. 389.
Koroleva M., Nagovitsina T., Yurtov E. // Phys. Chem. Chem. Phys. 2018. V. 20. P. 10369.
Koroleva M.Yu., Yurtov E.V. // Russ. Chem. Rev. 2021. V. 90. P. 293.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал