Коллоидный журнал, 2022, T. 84, № 3, стр. 363-372
Самосборка нанотрубок галлуазита как инструмент для формирования трехмерных структур
Ю. В. Чередниченко 1, *, С. А. Коннова 1, Р. Ф. Фахруллин 1, **
1 Институт фундаментальной медицины и биологии Казанского (Приволжского)
федерального университета
420008 РТ, Казань, ул. Кремлевская, д. 18, Россия
* E-mail: serova.yuliya87@gmail.com
** E-mail: kazanbio@gmail.com
Поступила в редакцию 10.03.2022
После доработки 11.04.2022
Принята к публикации 11.04.2022
- EDN: CGVKUN
- DOI: 10.31857/S0023291222030028
Аннотация
В обзоре систематизированы результаты последних лет по применению межфазной самосборки наночастиц галлуазита в трехмерные структуры. Нанотрубки галлуазита могут быть использованы для стабилизации эмульсий Пикеринга, микрокапсуляции живых микроорганизмов и самосборки на поверхности волос человека и шерсти млекопитающих. Охарактеризованы механизмы кинетических и физических свойств подобных структур, и возможные пути их применения в медицине, косметологии, биологии и ветеринарии.
ВВЕДЕНИЕ
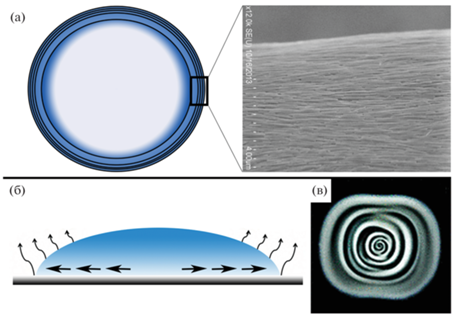
Одним из наиболее востребованных и перспективных методов получения наноструктур является самосборка коллоидных частиц. Процесс самосборки обусловлен формированием организованных структур путем спонтанного взаимодействия наночастиц, при этом стабилизация структур чаще всего базируется на “слабых” взаимодействиях, включая, электростатические, гидрофобные, капиллярные, Ван-дер-Ваальсовые силы, водородные связи. В результате, частицы формируют упорядоченные структуры, концентрируясь на границе раздела двухфазной системы, такой как вода/воздух или вода/масло [1, 2]. Так, в 1907 году, Пикеринг установил, что мелкодисперсные коллоидные твердые частицы могут адсорбироваться на границе раздела двух жидкостей, при стабилизации эмульсии парафина в воде с основаниями сульфата меди и железа [3]. Самосборка наночастиц на границе раздела воды и воздуха приводит к формированию концентрических кольцеподобных структур, известных как “кофейные кольца” (рис. 1), при этом линия контакта между воздухом, суспензией и твердой подложкой остается неподвижной, а жидкость, испаряясь, выталкивает частицы из центра к периферии [4–7].
Рис. 1.
а – Схема и микрофотография сканирующей электронной микроскопии, показывающие конфигурацию расположения модифицированных полистиролсульфонатом ГНТ, после высыхания жидкости; б – схематическое изображение высыхающей капли с дисперсией ГНТ, где показано направление потока жидкости в процессе испарения; в – изображение структуры концентрических колец, полученных после высыхания дисперсии ГНТ с металлической сферой. Взято из источника [6] с разрешения Американского химического общества, 2019 г.
Известно, что в зависимости от размера и формы наноразмерные материалы обладают широким спектром физических свойств (оптическими, каталитическими, магнитными, биологическими и т.д.) [8]. Поэтому довольно популярными стали методы, позволяющие контролировать особенности их поверхности, такие как фотолитография, электронно-лучевая литография, послойная сборка, микроконтактная печать и капельная микрофлюидика [9–11]. Указанные методы достаточно просты и доступны для создания наноструктурных материалов и могут применяться в промышленных масштабах [12–17].
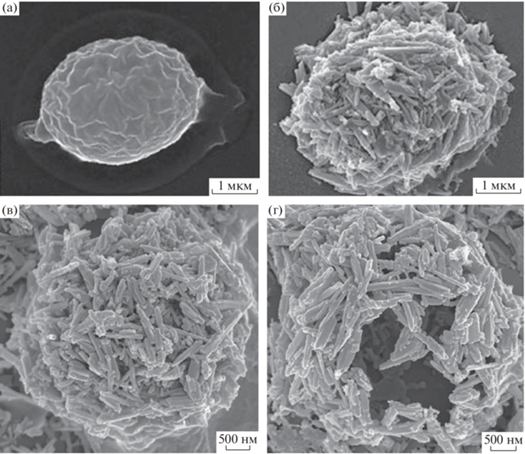
Нанотрубки галлуазита (ГНТ) – природные трубчатые частицы, обладают высоким соотношением сторон, адсорбционной способностью, биосовместимостью и биобезопасностью [18]. Благодаря отрицательно заряженной поверхности и гидрофильности, ГНТ могут быть легко диспергированы в воде, а уникальная стержневая структура и свойства поверхности позволяют осуществлять их самосборку в упорядоченные иерархические структуры [19]. Самосборка ГНТ вызывает большой интерес, т.к. находит применение при разделении и очистке нефти и сточных вод, в косметических препаратах и пищевой промышленности, для инкапсуляции и контролируемого высвобождения различных веществ в медицине, фармацевтике и сельском хозяйстве [7, 20, 21]. Использование ГНТ для создания клеточных матриц привели к появлению организации наночастиц в двухмерные (2D) и трехмерные (3D) системы. Так, гибридные системы на основе ГНТ, формирующие гибридные трехмерные структуры, нашли применение в качестве биокомпозитов для изготовления “бронированных” микроорганизмов (рис. 2). Для получения подобных структур используют послойную сборку (Layer-by-layer assembly) ГНТ на микроорганизмах с их последующим термическим разложением, что приводит к образованию полых керамических микрокапсул с высокой пористостью [22–26].
Рис. 2.
а – Изображение сканирующей электронной микроскопии нативной дрожжевой клетки; б – изображение сканирующей электронной микроскопии дрожжевой клетки, покрытой полиэлектролитами и галлуазитом методом послойного нанесения; в и г – изображение сканирующей электронной микроскопии полых микрокапсул из галлуазита. Взято из источника [26] с разрешения Королевского химического общества (Великобритания), 2013 г.
В обзоре представлены морфологические особенности ГНТ и способы самосборки их для создания новых 3D структур, включая методы инкапсуляции микроорганизмов, обеспечивающие сохранение их жизнеспособности и защиту от воздействий окружающей среды. Одним из весьма перспективных практических применений самосборки ГНТ стала методика формирования слоев модифицированных нанотрубок на поверхности волос человека и шерсти сельскохозяйственных и диких животных. Рассмотрены потенциальные пути применения систем на основе галлуазита и указаны возможные направления в этой области исследования.
ХАРАКТЕРИСТИКА ГАЛЛУАЗИТА
Галлуазит впервые был описан и назван по имени бельгийского геолога Омалиуса дэАллуа (Omalius dэHalloy) в 1826 г. [27]. Исследование галлуазита как минерала началось в 1940 г., но только в последние 20 лет материал в виде коллоидных частиц стал широко доступен в качестве недорогой альтернативы углеродным нанотрубкам. С 2008 г. модификация поверхности галлуазита, значительно расширила сферы его использования [28].
Галлуазит – глинистый минерал, представляет собой двухслойный алюмосиликат, по химической структуре (Al2Si2O5(OH)4) он близок к каолиниту. Однако алюмосиликатные слои в галлуазите разделены молекулами воды. Прослойка воды дает расстояние около 10 Å между слоями, а при дегидратации – она уменьшается до 7 Å. Частицы галлуазита могут принимать различные структуры (сфероидные и пластинчатые), самой распространенной из которых является трубчатая, образующаяся в результате деформации, вызванной несоответствием решеток между тетраэдрическим и октаэдрическим слоями [29–32]. Внешний слой ГНТ представлен диоксидом кремния (SiO2), а внутренний – гидроксидом алюминия Al(OH)3, поэтому в воде его наружная поверхность несет отрицательный (–30 мВ) заряд, а внутренняя - положительный. Галлуазит стабилен при нагревании до 460°С, а его трубчатая структура сохраняется при температуре до 900°С. Линейные размеры (длина, внутренний и внешний диаметр) и морфология ГНТ зависят от месторождения. В большинстве случаев длина составляет 0.5–1.5 мкм, внешний диаметр нанотрубок – 50–70 нм, внутренний диаметр просвета – 10–20 нм. Крупные месторождения галлуазита находятся в Новой Зеландии и США, также имеются месторождения в Китае, Бразилии, Турции и Австралии [33, 34].
Биосовместимость ГНТ подтверждена исследованиями токсичности на различных клеточных линиях человека, дрожжах, бактериях, водорослях и нематодах [35–37]. Кроме того, по сравнению с кремнеземом, графеном, монтмориллонитом, каолином и бентонитом, галлуазит относится к наиболее биологически безопасным глинистым минералам [38–40].
ИСПОЛЬЗОВАНИЕ ГАЛЛУАЗИТА В МЕТОДЕ ПОСЛОЙНОГО НАНЕСЕНИЯ
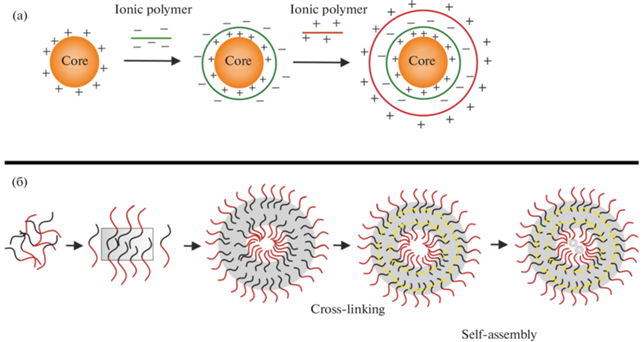
В биомедицинской области микрокапсулы используют как систему для доставки лекарств, биосенсоров, клеток и в качестве микрореакторов. Метод послойного нанесения нашел свое применение в качестве простого и эффективного способа получения микрокапсул [41–44]. Такие капсулы обладают высокой стабильностью в отношении изменений pH, растворителя и температуры [45, 46]. Формирование композитных слоев осуществляется путем последовательной адсорбции противоположно-заряженных полиэлектролитов на матрице (коллоидной частице) (рис. 3а). Так как поверхность галлуазита в воде заряжена отрицательно, поликатионы формируют первичный слой на его поверхности. Эта оболочка покрывает всю поверхность, включая концы трубок, и действует как диффузный барьер для загруженного в полость вещества [47, 48]. Последующие слои полиэлектролитов могут быть нанесены для модуляции заряда и толщины слоев. Использование определенных полиэлектролитов в качестве оболочки микрокапсулы позволяет изменять ее биосовместимость и проницаемость [49].
Рис. 3.
Схематическое изображение формирования трехмерных структур. а – Метод послойного нанесения; б – процесс самосборки.
Метод послойного нанесения используется и при изготовлении сложных микрокапсул, где может быть использовано неограниченное количество слоев с контролируемым размером, формой, текстурой и толщиной мембраны [50, 51]. Кроме того, между слоями могут быть расположены биополимеры и коллоидные частицы, в том числе белки, нуклеиновые кислоты, наночастицы, органические и неорганические микрокристаллы и т.д. [52–58]. Включение ГНТ как компонента полиэлектролитных покрытий дает преимущество в модификации их оптических, электрических и некоторых других свойств. Наночастицы в составе оболочек микрокапсул можно рассматривать как функциональные (катализ, высвобождение биологически-активных макромолекул) и структурные (улучшение адгезии) элементы [59]. Таким образом, применение галлуазита позволяет изменять физико-химические свойства многослойной оболочки [60]. Метод послойного нанесения полиэлектролитов непосредственно на ГНТ широко используется для адресной доставки и получения микрокапсул с длительным высвобождением активных веществ. С помощью галлуазита и полиэлектролитов изготавливают покрытия для бактериальных, грибковых и дрожжевых клеток с сохранением их метаболической активности [61–63].
САМОСБОРКА ГАЛЛУАЗИТА
Наночастицы способны образовывать упорядоченные структуры под действием поверхностного натяжения, электростатических и капиллярных взаимодействий. Тип и структура сборки зависят от условий синтеза, диаметра частиц, природы поверхностно-активного вещества и дисперсионной среды [64] (рис. 3б). Особый интерес представляют межфазные сборки из неорганических (металл, оксиды металлов, полупроводники, нанотрубки), биополимерных (белки, вирусы, ДНК, микрогели, целлюлоза, полисахариды) и органических полимерных материалов (полимеры, линейные сополимеры). Интерес вызван тем, что органические и полимерные материалы можно сделать чувствительными к определенным факторам внешней среды, а использование неорганических веществ повышает прочность и термостойкость композитных материалов [65–68].
Структурные особенности галлуазита (высокая удельная поверхность, ионообменная емкость, различный химический состав наружной и внутренней поверхности) способствуют формированию их в упорядоченные структуры под действием поперечной и электростатической силы, сил Ван-дер-Ваальса, водородных связей и капиллярных взаимодействий [19, 69, 70]. Дисперсия ГНТ на твердой подложке при высыхании образует осадок в форме кольца на линии трехфазного контакта. Галлуазит при этом концентрируется и выравнивается параллельно друг другу вдоль линии контакта воздуха, жидкости и твердой подложки (рис. 1а, 1б). Подобная пространственная ориентация усиливается при увеличении заряда, температуры и длины нанотрубок. Еще больший интерес представляет способность галлуазита образовывать концентрические кольца на твердой подложке. Для создания подобных структур используют металлическую сферу, которую помещают на каплю жидкости с полиэлектролит-модифицированными ГНТ и высушивают (рис. 1в). Такие микроструктуры позволяют избирательно адсорбировать клетки и простейших в определенном направлении [6, 17, 33, 71].
В последнее время интерес в области фармацевтики вызывают эмульсии Пикеринга, получаемые без применения поверхностно-активных веществ для их стабилизации, т.к. последние часто оказывают токсический, гемолитический и ирритативный эффекты [72, 73] Подобные эмульсии стабилизируются твердыми, часто неорганическими частицами с размерами в нано- или субмикрометровом масштабе и имеют сферическую форму для минимизации поверхностной энергии [74–76]. Установлено, что нанотрубки галлуазита могут быть использованы для стабилизации эмульсий Пикеринга, т.к. они обладают различными свойствами (электро- и теплопроводностью, упругостью и т.д.) [77, 78]. Кроме того, свойства и структура неорганического материала ГНТ, позволяют проводить модификацию его внешней поверхности гидрофобными веществами, контролировать размер и стабильность эмульсий масла в воде, и заключать масляные микропузырьки в капсулу. Микроэмульсии Пикеринга с галлуазитом используют в двухфазном катализе и при биоремедиации разливов нефти [71].
Преимуществами использования самосборки ГНТ являются: их биосовместимость, возможность модификации поверхности, контролирование проницаемости и управление процессом высвобождения веществ, увеличение механической прочности соединений и инкапсулирование чувствительных и нестабильных веществ. Таким образом, с помощью, направленной самосборки ГНТ можно синтезировать новые мембраны, капсулы и материалы с различными функциональными возможностями [79].
САМОСБОРКА ГАЛЛУАЗИТА В ТРЕХМЕРНЫЕ СТРУКТУРЫ
Интерес в качестве 3D структур представляет самосборка наночастиц в виде капсул, которые находят применение в материаловедении и биомедицине. Использование небольшого количества жидкости на твердых поверхностях имеет универсальное значение для применения на микро- или наноуровнях в химической и биологической сферах. Капля жидкости (водный раствор или суспензия) при помещении на гидрофильную сухую плоскую твердую поверхность, может растекаться, образуя тонкий слой, однако на гидрофобных покрытиях она остается полусферической или сферической формы [80]. Те же процессы наблюдаются при осаждении капли жидкости на слой коллоидных твердых частиц: она может смачивать твердые частицы, или твердые частицы могут собираться на поверхности, покрывая ее [81, 82]. Частицы, в свою очередь, могут быть как гидрофобными, так и олеофобными одновременно, а выбор материала оболочки определяет свойства микрокапсулы или микрочастицы [60, 83]. Таким образом, использование неорганических частиц и их функционализация полимерами приводит к созданию материалов с новыми характеристиками и свойствами [82].
Самосборка гидрофобных частиц на границе раздела воздух/жидкость приводит к стабилизации капель жидкости, которые используют для измерения уровня газа и pH в микрореакторах, микрожидкостных системах, биотехнологии и фармацевтике [84–92]. Подобные структуры можно получить, используя супергидрофобные частицы, такие как порошок ликоподия, поливинилиденфторид, частицы кремнезема и т.д. Однако, для микрокапсуляции живых систем важным критерием является не только стабильность водных суспензий, но и биосовместимость самого покрытия [93]. Существуют различные методы инкапсуляции эукариотических и прокариотических клеток для защиты их от внешних воздействий, например, заключение в полые полимерные капсулы, созданные на основе эмульсий Пикеринга или частиц Януса с различной гидрофобностью, покрытие микробных клеток диоксидом кремния, карбонатом кальция и амфифилами.
Известно, что галлуазит обладает свойством самосборки в двумерные и трехмерные слоистые структуры на плоских, изогнутых и объемных поверхностях [78, 94, 95]. Разработка стабильных 3D структур путем стабилизации водных капель гидрофобно-модифицированными ГНТ является актуальным и новым направлением в области исследования. Увеличение гидрофобных свойств галлуазита, его малые размеры и способность к самосборке на границе раздела воздуха и жидкости приводит к тому, что наночастицы концентрируются вокруг, капли жидкости и формируют слой на ее поверхности. Такие конструкции представляют собой капли воды, покрытые гидрофобным ГНТ, который способствует сохранению их сферической формы и формирует стабильную глиняную оболочку, защищающую ее от воздействий внешней среды (рис. 4). Размер получаемых структур зависит от объема используемой водной суспензии. При инкапсуляции суспензии бактериальной культуры, рост бактерий способствует образованию экзополимера на внутренней поверхности оболочки из галлуазита, которые дополнительно укрепляют полученную капсулу. Слой экзополимера (или биопленки) обеспечивает механическую прочность и уменьшает испарение водной среды, таким образом, стабилизируя и завершая синергию связи между активными биологическими организмами и неорганическим галлуазитом [93].
Рис. 4.
а – Изображение сканирующей электронной микроскопии нанотрубок галлуазита; б – темнопольное изображение трехмерной структуры капли воды покрытой гидрофобным галлуазитом и окрашенной метиленовым синим; в – изображение стабилизированной капли воды гидрофобно-модифицированными наночастицами галлуазита. Взято из источника [93] с разрешения Американского химического общества, 2019 г.

Подобные микрокапсулы из ГНТ применяют для сохранения жизнеспособности микроорганизмов при работе с небольшими объемами в окружающей среде, для транспортировки частиц, обнаружения и ликвидации загрязнения водных систем, обнаружения газов, в качестве микронасосов и микрореакторов для химических реакций и биотестов. Подобные системы могут значительно сократить время реакции, объем реагентов и образующихся отходов [82].
САМОСБОРКА ГАЛЛУАЗИТА НА ВОЛОСАХ
Достижения в области нанотехнологий получили широкое применение при создании косметических средств ухода за кожей и волосами [96]. Самосборка нано- и биоматериалов, зависит от спонтанной сборки наноразмерных элементов в пленки, нити, трубки или более сложные формы на какой-либо поверхности [97–99]. Методы исследования самосборки ГНТ на волосах стали изучаться сравнительно недавно. Этот метод сочетает в себе возможность загрузки просвета нанотрубок для длительного высвобождения различных веществ и самосборки галлуазита на внешней поверхности волоса [100].
Самосборка осуществляется за счет мезопористой структуры волос, в частности благодаря наличию кератиновых чешуек на кутикуле толщиной 1 мкм. В водной среде чешуйки кутикулы раскрываются, создавая условия для проникновения ГНТ, а после высыхания они возвращаются в исходное положение, фиксируя галлуазит между кутикулой и поверхностью, прилегающей к ней [101, 102]. При высыхании ГНТ образуют более толстый слой и остаются устойчивыми к мытью шампунем за счет стабилизации межтрубных сил притяжения [99] (рис. 5). Шероховатость поверхности галлуазита при смачивании остается неизменной, поэтому связывание происходит преимущественно за счет сил Ван-дер-Ваальса. Кроме того, структура его поверхности делает трубки хорошо диспергируемыми в водной среде, способствуя их сборке на волосах [103]. Гидрофобный галлуазит демонстрирует лучшую (более объемную) самосборку.
Рис. 5.
а – Иллюстрация механизма самосборки галлуазита на волосах; б – изображение сканирующей электронной микроскопии волоса человека, покрытого нанотрубками галлуазита; в – изображение атомно-силовой микроскопии нанотрубок галлуазита. Взято из источника [99] с разрешения Королевского химического общества (Великобритания), 2018 г.

Таким образом, обработка волос 1% водной дисперсией галлуазита в течение 3 мин приводит к формированию покрытия толщиной 2–3 мкм. Метод самосборки применим ко всем типам волос, не повреждает их структуру и не оказывает токсического воздействия на кожу головы. Техника основана на межмолекулярных силах притяжения и специфической структуре волос и применима как к волосам человека, так и к шерсти животных, поскольку явления раскрытия чешуек кутикулы при намокании аналогичны и являются определяющими параметрами при самосборке ГНТ. Покрытие является достаточно эластичным и стойким, выдерживает до 10 циклов мытья головы с шампунем [103]. Кроме того, можно контролировать плотность и толщину покрытия на волосах с помощью оптимизации концентрации суспензии, pH и гидрофобности галлуазита. Самосборка нанотрубок на волосах позволяет создавать покрытия, которые обладают пролонгированным действием и улучшают проникновение различных веществ через кожу, увеличивают эффективность препаратов при лечении дерматологических заболеваний кожи головы, волос и шерсти, и позволяют создавать эффективные и безопасные методы окрашивания волос [104, 105].
ЗАКЛЮЧЕНИЕ
В обзоре систематизированы последние исследования в области самосборки ГНТ на границе раздела двух жидкостей и на границе раздела жидкости и воздуха в трехмерных измерениях. Это уникальное свойство твердых частиц используют при создании фильтрующих мембран, для инкапсуляции лекарственных препаратов и активных веществ. В связи с этим в последнее время интерес к подобным исследованиям вырос, и разработки в этой области продолжаются. Стало возможно модифицировать наночастицы и придавать им новые свойства, а также контролировать и исследовать процесс самосборки. Подобные работы являются весьма актуальными среди исследователей, поскольку позволяют изменять химический состав, размер и форму частиц и модулировать их взаимодействие друг с другом, используя современные достижения в области коллоидной химии [2].
Исследование процесса самосборки наночастиц и создание новых трехмерных структур открывает новые возможности для применения их в области химии, физики, биологии и материаловедения [79]. Так на примере ГНТ показано, что при модификации поверхности наночастицы могут использоваться для стабилизации эмульсий Пикеринга и для создания микрокапсул. Нанотрубки галлуазита обладают свойством самосборки и обеспечивают прочную и стабильную неорганическую внешнюю оболочку, в отличие от наночастиц кремнезема. Глиняные капсулы с жизнеспособными микроорганизмами внутри являются перспективной системой для ремедиации окружающей среды и в дальнейшем в качестве биореакторов для доставки пробиотических штаммов, а также в косметологиии и фармацевтике для контролируемой доставки лекарственных препаратов [83, 93]. Применение нового подхода к лечению и окрашиванию волос путем покрытия нанотрубками с лекарственными препаратами или красителями обеспечивают длительное действие, стабильность, позволяют избежать прямого контакта волоса с красителем и обеспечивают возможность применения водонерастворимых веществ путем загрузки их в полость нанотрубок. Описанная методика является универсальной и может быть применена как к волосам человека, так и к шерсти млекопитающих [103].
Список литературы
Rahimi M., Roberts T.F., Armas-Pérez J.C., Wang X., Bukusoglu E., Abbott N.L., de Pabloa J.J. // PNAS. 2015. V. 112. № 17. P. 5297–5302.
Binks B.P. // Langmuir. 2017. V. 33. № 28. P. 6947–6963.
Pickering S.U. // J. Chem. Soc., Trans. 1907. V. 91. P. 2001–2021.
Deegan R.D., Bakajin O., Dupont T.F., Huber G., Nagel S.R., Witten T.A. // Nature. 1997. V. 389. P. 827–829.
Deegan R.D., Bakajin O., Dupont T.F., Huber G., Nagel S.R., Witten T.A. // Physical Review. E. 2000. V. 62. P. 756.
Lvov Y., Panchal A., Fu Y., Fakhrullin R., Kryuchkova M., Batasheva S., Stavitskaya A., Glotov A., Vinokurov V. // Langmuir. 2019. V.35. № 26. P. 8646–8657.
Mondal R., Basavaraj M.G. // Phys. Chem. Chem. Phys. 2019. P. 1–10. https://doi.org/10.1039/C9CP03008E
He X., Song X., Qiao W., Li Z., Zhang X., Yan S., Zhong W., Du Y. // J. Phys. Chem. C. 2015. V. 119. № 17. P. 9550–9559.
Ariga K., Hill J.P., Ji Q. // Macromol. Biosci. 2008. V. 8. P. 981–990.
Ariga K., Minami K., Ebara M., Nakanishi J. // Polymer Journal. 2016. V. 48. P. 371–389.
Ermis M., Antmen E., Hasirci V. // Bioactive Materials. 2018. V. 3. № 3. P. 355–369.
Xu J., Xi, J., Lin Z. // Angew. Chem. 2007. V. 119. P. 1892–1895.
Han W., Lin Z. // Angew. Chem. Int. Ed. 2012. V. 51. № 7. P. 1534–1546.
Wang L., Asghar W., Demirci U., Wan Y. // Nano Today. 2013. V. 8. № 4. P. 374–387.
Liu M., He R., Yang J., Zhao W., Zhou C. // ACS Appl. Mater. Interfaces. 2016. V. 8. № 12. P. 7709–7719.
He R., Liu M., Shen Y., Long Z., Zhou C. // J. Mater. Chem. B. 2017. V. 5. P. 1712–1723.
Kryuchkova M., Batasheva S., Naumenko E., Rozhina E., Akhatova F., Panchal A., Lvov Y., Fakhrullin R. // Applied Clay Science. 2020. V. 195. 105707.
Liu M., Fakhrullin R., Novikov A., Panchal A., Lvov Y. // Macromol. Biosci. 2019. V. 19. 1800419.
Zhao X., Zhou C., Liu M. // J. Mater. Chem. B. 2020. V. 8. P. 838–851.
Vriezema D.M., Aragones M.C., Elemans J.A.A.W., Cornelissen J.J.L.M., Rowan A.E., Nolte R.J.M. // Chem. Rev. 2005. V. 105. № 4. P. 1445–1490.
Trantum J.R., Wright D.W., Haselton F.R. // Langmuir. 2011. V. 28. P. 2187–2193.
Joussein E., Petit S., Churchman J., Theng B., Righi D., Delvaux B. // Clay Miner. 2005. V. 40. P. 383–426.
Cho K.-H., Jan B.-S.g, Kim K.-H., Park D.-W. // React. Kinet. Catal. Lett. 2006. V. 88. P. 43.
Du M., Guo B., Jia D. // Polym. Int. 2010. V. 59. P. 574–582.
Vergaro V., Lvov Y., Leporatti S. // Macromol. Biosci. 2012. V. 12. P. 1265–1271.
Konnova S.A., Sharipova I.R., Demina T.A., Osin Y.N., Yarullina D.R., Ilinskaya O.N., Lvov Y.M., Fakhrullin R.F. // Chem. Commun. 2013. V. 49. P. 4208–4210.
Bethier P. // Ann. Chim. Phys. 1826. V. 32. P. 332–335.
Massaro M., Lazzara G., Milioto S., Noto R. and Riela S. // J. Mater. Chem. B. 2017. V. 5. P. 2867–2882.
Vergaro V., Abdullayev E., Lvov Y.M., Zeitoun A., Cingolani R., Rinaldi R., Leporatti S. // Biomacromolecules. 2010. V. 11. P. 820–826.
Joussein E., Petit S., Churchman J., Theng B., Righi D., Delvaux B. // Clay Minerals. 2005. V. 40. P. 383–426.
Tari G., Bobos I., Gomes C., Ferreira J. // J. Colloid Interface Sci. 1999. V. 210. P. 360–369.
Рожина Э.В., Данилушкина А.А., Науменко Е.А., Львов Ю.М., Фахруллин Р.Ф. // Гены и клетки. 2014. Т. 9. №3. С. 25–28.
Lvov Y., Wang W., Zhang L., Fakhrullin R. // Adv. Mater. 2016. V. 28. P. 1227–1250.
Glotov A., Stavitskaya A., Novikov A., Semenov A., Ivanov E., Gushchin P., Darrat Y., Vinokurov V., Lvov Y. // Nanomaterials from Clay Minerals. 2019. P. 203–256.
Lazzara G., Riela S., Fakhrullin R.F. // Therapeutic Delivery. 2017. V. 8. № 8. P. 633–646.
Patel S., Jammalamadaka U., Sun L., Tappa K., Mills D.K. // Bioengineering. 2016. V. 3. P. 1–14.
Fakhrullina G.I., Akhatova F.S., Lvov Y.M., Fakhrullin R.F. // Environ Sci. 2015. V. 2. P. 54–59.
Kryuchkova M., Danilushkina A., Lvov Y., Fakhrullin R. // Environ Sci. 2016. V. 3. P. 442–452.
Santos A.C., Ferreira C., Veiga F., Ribeiro A.J., Panchal A., Lvov Y., Agarwal A. // Advances in Colloid and Interface Science. 2018. V. 257. P. 58–70.
Lvov Yu., Decher G., Sukhorukov G. // Macromolecules. 1993. V. 26. № 20. P. 5396–5399.
Bastos D.S., Gonçalves M.P., Andrade C.T., Lima Arau’jo K.G., Rocha Lea˜o M.H.M. // Food Bioprod. Process. 2012. V. 90. № 4. P. 683–692.
Bekhit M., Sánchez-González L., Messaoud G.B., Desobry S. // LWT–Food Sci. Technol. 2016. V. 68. P. 446–453.
Akyuz L., Sargin I., Kaya M., Ceter T., Akata I. // Mater. Sci. Eng. C. 2017. V. 71. P. 937–942.
Wang Y., Zhou J., Guo X., Hu Q., Qin C., Liu, Dong M., Chen Y. // Mater. Sci. Eng. C. 2017. V. 81. P. 13–19.
Gao C., Leporatti S., Donath E., Möhwald H. J. // Phys. Chem. B. 2000. V. 104. P. 7144–7149.
Sukhorukov G.B., Antipov A.A., Voigt, A., Donath E., Möhwald H. // Macromol. Rapid Commun. 2001. V. 22. P. 44–46.
Abdullayev E., Lvov Y. // J. Nanoscience and Nanotechnology. 2011. V. 11. P. 10007–10026.
Lvov Y.M., Shchukin D.G., Möhwald H., Price R.R. // ACS Nano. 2008. V. 2. № 5. P. 814–820.
Diaspro A., Silvano D., Krol S., Cavalleri O, Gliozzi A. // Langmuir. 2002. V. 18. P. 5047–5050.
Tong W., Song X., Gao C. // Chem. Soc. Rev. 2012. V. 41. № 18. P. 6103–6124.
Jaganathan M., Madhumitha D., Dhathathreyan A. // Adv. Colloid Interface Sci. 2014. V. 209. P. 1–7.
Panhuis M., Paunov V.N. // Chem. Commun. 2005. V. 13. P. 1726–1728.
Park M.K., Deng S., Advincula R.C. // Langmuir. 2005. V. 21. № 12. P. 5272–5277.
Paunov V.N., Panhuis M. // Nanotechnology. 2005. V.16. P. 1522–1525.
Wang Y., Yu A., Caruso F. // Angew. Chem. Int. Ed. 2005. V. 44. P. 2888–2892.
Gheith M.K., Pappas T.C., Liopo A.V., Sinani V.A., Shim B.S., Motamedi M., Wicksted J.P., Kotov N.A. // Adv. Mater. 2006. V. 18. P. 2975–2979.
Zhao L., Liu H., Hu N. // Anal. Bioanal. Chem. 2006. V. 384. P. 414–422.
Agarwal M., Xing Q., Shim B.S., Kotov N., Varahramyan K., Lvov Y. // Nanotechnology. 2009. V. 20. 215602.
Fakhrullin R.F., Zamaleeva A.I., Morozov M.V, Tazetdinova D.I., Alimova F.K., Hilmutdinov A.K., Zhdanov R.I., Kahraman M., Culha M. // Langmuir. 2009. V. 25. № 8. P. 4628–4634.
Bah M.G., Bilal H.M., Wang J. // Soft Matter. 2020. V. 16. P. 570—590.
Bäumler H., Neu B., Voigt A., Mitlöhner R., Leporatti S., Gao C.Y., Donath E., Kiesewetter H., Möhwald H., Meiselman H.J. // Microencapsulation. 2001. V. 18. P. 385–395.
Krol S., Nolte M., Diaspro A., Mazza D., Magrassi R., Gliozzi A., Fery A. // Langmuir. 2005. V.21. P. 705–709.
Kahraman M., Zamaleeva A.I., Fakhrullin R.F., Culha M. // Anal. Bioanal. Chem. 2009. V. 395. P. 2559–2567.
Poole Ch.P., Jr, Owens F.J. Introduction to Nanotechnology. NJ: John Wiley & Sons, Inc., Hoboken, 2003. P. 388.
Green D.W., Mann S., Oreffo R.O.C. // Soft Matter. 2006. V. 2. P.732–737.
Cai Y., Pan H., Xu X., Hu Q., Li L., Tang R. // Chem. Mater. 2007. V. 19. P. 3081–3083.
Hermanson K.D., Hümmerich D., Scheibel T., Ba-usch A.R. // Adv. Mater. 2007. V. 19. P. 1810–1815.
Sukhorukov G.B., Möhwald H. // Trends Biotechnol. 2007. V. 25. P. 93–98.
Giermanska-Kahn J., Schmitt V., Binks B.P., Leal-Calderon F. // Langmuir. 2002. V. 18. P. 2515–2518.
Ali M., Bora S., Ghosh S.K. // Langmuir. 2014. V. 30. P. 10449–10455.
Lazzara G., Cavallaro G., Panchal A., Fakhrullin R., Stavitskaya A., Vinokurov V., Lvov Y. // Current Opinion in Colloid & Interface Science. 2018. V. 35. P. 42–50.
Jafari S.M., Assaidpoor E., Bhandari B., He Y.H. // Food Res. Int. 2008. V.41. P. 172–183.
Chevalier Y., Bolzinger M.A. // Colloids Surf. A: Physicochem. Eng. Asp. 2013. V. 439. P. 23–34.
Aveyard R., Binks B.P., Clint J.H. // Adv. Colloid Interface. 2003. V. 100. P. 503–546.
Hashizaki K., Kageyama T., Inoue M., Taguchi H., Ueda H., Saito Y. // Chem. Pharm. Bull. 2007. V. 55. № 11. P. 1620–1625.
Wu L., Liao Z., Liu M., Yin X., Li X., Wang M., Lu X., Lv N., Singh V., He Z., Li H., Zhang J. // Colloids and Surfaces A: Physicochem. Eng. Aspects. 2016. V. 490. P. 163–172.
Panchal A., Swientoniewski L.T., Omarova M., Yu T., Zhang D., Blake D.A., John V., Lvov Y.M. // Colloids Surf., B. 2018. V. 164. P. 27–33.
Owoseni O., Nyankson E., Zhang Y., Adams S.J., He J., Mcpherson G.L., Bose A., Gupta R.B., John V.T. // Langmuir. 2014. V. 30. P. 13533−135441.
Ghosh S.K., Böker A. // Macromol. Chem. Phys. 2019. V. 220. № 17. 1900196.
Quéré D. // Annu. Rev. Mater. Res. 2008. V. 38. P. 71–99.
Chander S., Hogg R., Fuerstenau D.W. // KONA. 2007. V. 25. P.59–75.
Tyowua A.T., Mooney J. M., Binks B.P. // Colloids and Surfaces. A. 2019. V. 560. P. 288–297.
Wu H., Watanabe H., Ma W., Fujimoto A., Higuchi T., Uesugi K., Takeuchi A., Suzuki Y., Jinnai H., Takahara A. // Langmuir. 2013. V. 29. P. 14971–14975.
Dorvee J.R., Derfus A.M., Bathia S.N., Sailor M.J. // Nat. Mater. 2004. V. 3. P. 896–899.
Gao L., MacCarthy T.J. // Langmuir. 2007. V. 23. P. 10445–10447.
Fujii S. Kameyama S., Armes S.P., Dupin D., Suzaki M., Nakamura Y. // Soft Matter. 2010. V. 6. P. 635–640.
Bormashenko E., Bormashenko Y., Pogreb R., Gendelman O. // Langmuir. 2011. V. 27. P. 7–10.
Fujii S., Suzaki M., Armes S.P., Dupin D., Hamasaki S., Aono K., Nakamura Y. // Langmuir. 2011. V. 27. P. 8067–8074.
Matsukuma D., Watanabe H., Yamaguchi H., Takahara A. // Langmuir. 2011. V. 27. P. 1269–1274.
Fujii S., Aono K., Suzaki M., Hamasaki S., Yusa S.I., Nakamura Y. // Macromolecules 2012. V. 45. P. 2863–2873.
Tian J., Fu N., Chen X.D., Shen W. // Colloid Surf. B. 2013. V. 106. P. 187–190.
Fernandes A.M., Gracia R., Leal G.P., Paulis M., Mecerreyes D. // Polymer. 2014. V. 55. № 16. P. 3397–3403.
Panchal A., Rahman N., Konnova S., Fakhrullin R., Zhang D., Blake D., John V., Ivanov E., Lvov Y. // ACS Applied Nano Materials. 2020. V. 3. № 2. P. 1263–1271.
Velev O.D., Prevo B.G., Bhatt K. H. // Nature. 2003. V. 426. P. 515–516.
Fakhrullin R.F., Lvov Y.M. // ACS Nano. 2012. V. 6. P. 4557–4564.
Santos A.C., Morais F., Simões A., Pereira I., Sequeira J.A.D., Pereira-Silva M., Veiga F., Ribeiro A. // Expert Opin. Drug Delivery. 2019. V. 16. P. 313−330.
Liu M., Huo Z., Liu T., Shen Y., He R., Zhou C. // Langmuir. 2017. V. 33. P. 3088–3098.
Lazzara G., Cavallaro G., Panchal A., Fakhrullin R., Stavitskaya A., Vinokurov V., Lvov Y. // Curr. Opin. Colloid Interface Sci. 2018. V. 35. P. 42–50.
Panchal A.G., Fakhrullina G.I., Fakhrullin R.F., Lvov Y.M. // Nanoscale. 2018. V. 10. P. 18205–18216.
Cavallaro G., Lazzara G., Milioto S., Parisi F., Sanzillo V. // ACS Appl. Mater. Interfaces. 2014. V. 6. P. 606–612.
Lodge R.A., Bhushan B. // J. Appl. Polym. Sci. 2006. V. 102. P. 5255–5265.
Popescu C., Höcker H. // Chem. Soc. Rev. 2007. V. 36. P. 1282–1291.
Santos A.C., Panchal A., Rahman N., Pereira-Silva M., Pereira I., Veiga F., Lvov Y. // Nanomaterials. 2019. V. 9. P. 903.
Wollina U., Pabst F., Kuss H., Tilp M., Runge J. // J. Clin. Aesthetic Dermatol. 2013. V. 6. P. 45–48.
Cavallaro G., Milioto S., Konnova S., Fakhrullina G., Akhatova F., Lazzara G., Fakhrullin R., Lvov Y. // ACS Appl. Mater. Interfaces. 2020. V. 12. P. 24348–24362.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


