Коллоидный журнал, 2022, T. 84, № 5, стр. 555-573
Супрамолекулярные системы на основе производных тиакаликсарена и биополимеров
О. А. Мостовая 1, А. А. Вавилова 1, И. И. Стойков 1, *
1 Казанский (Приволжский) федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлёвская, д. 18, Россия
* E-mail: ivan.stoikov@mail.ru
Поступила в редакцию 05.05.2022
После доработки 17.06.2022
Принята к публикации 20.06.2022
- EDN: TMUENU
- DOI: 10.31857/S0023291222600109
Аннотация
Настоящий обзор посвящeн особенностям образования супрамолекулярных систем на основе производных тиакаликсарена. В нeм подробно обсуждены образующиеся в водной среде надмолекулярные структуры. Даeтся детальное описание ассоциатов производных тиакаликсарена с важными биологическими молекулами, такими как аминокислоты, белки и ДНК. Также в обзоре отражено применение получаемых коллоидных систем в разработке электрохимических сенсоров.
ВВЕДЕНИЕ
В настоящее время супрамолекулярные наносистемы находятся на пике исследовательского интереса. Строго говоря, к ним относятся системы, имеющие размеры в области от 1 до 100 нм [1]. Однако огромное практическое применение имеют и, как следствие, интересны коллоидные системы более широкого размерного диапазона, вплоть до субмикронного, наиболее применимые для медицинских целей, с размерами составляющих их частиц 30–200 нм (в ряде случаев до 500 нм), поскольку именно такие частицы не атакуются макрофагами, но в то же время они достаточно велики, чтобы не фильтроваться в почках [2, 3]. Такие коллоидные системы находят применение в качестве систем доставки лекарств. Удобство подобных систем для терапевтических целей обусловлено сочетанием достаточно большой поверхности, объeма, а также наличия большого числа связывающих фрагментов. Всe это открывает возможности для инкапсуляции как лекарственных препаратов, так и биомолекул, таких как белки, ДНК, нейромедиаторы и т.п. [4]. Полученные системы могут применяться в системах доставки лекарственных препаратов для терапии онкологических, нейродегенеративных, воспалительных заболеваний, в доставке генов [5].
Отдельно нужно отметить, что большие перспективы имеет разработка подобных систем на основе макроциклов. Как правило, макроциклы представляют собой соединения, которые можно модифицировать целым рядом функциональных фрагментов, что позволяет внедрять в их структуру большое количество центров связывания, способствующих эффективному комплексообразованию с целевыми субстратами с образованием супрамолекулярных систем. Кроме того, привлекает внимание к макроциклам тот факт, что сама макроциклическая платформа может быть способна к инкапсуляции ряда соединений за счeт сформированного, как правило, гидрофобного, кольца как некая наногубка [6]. Особенно широко применяются в качестве таких наногубок циклические олигосахариды [7]. Так, циклодекстриновые производные исследованы в качестве инкапсулирующего средства для препаратов Алендронат и Доксорубицин [8, 9]. Краун-эфиры, обладающие одновременно гидрофобными и гидрофильными фрагментами, являясь ионофорами, привлекают внимание для получения на их основе систем доставки лекарственных средств [10, 11].
Несомненно привлекательными конструкционными материалами для систем доставки являются и циклофановые производные [12, 13]. Например, показано образование коллоидных систем на основе производного пиллар[5]арена с витамином D3 с размерами дисперсных частиц 50–200 нм [14]. И, конечно же, нельзя упустить из виду (тиа)каликсареновые производные, также являющиеся перспективными соединениями для этих целей [15–18]. В Казанском федеральном университете на протяжении более 20 лет ведутся исследования (тиа)каликс [4]аренов: изучаются подходы к синтезу, физико-химические свойства, исследуются разнообразные коллоидные системы на основе этих макроциклов. В настоящем обзоре представлены обобщeнные результаты проводимых исследований. Привлекательность тиакаликсаренов обусловлена сразу несколькими причинами. Функционализация нижнего обода макроцикла различными фрагментами позволяет легко получать самые разнообразные соединения, в том числе амфифильные. Сама платформа (тиа)каликс [4]арена имеет слишком малый размер полости [12], чтобы инкапсулировать достаточно крупные биологически активные молекулы, однако взаимодействие с субстратом достигается за счeт множественных связей между последним и функциональными группами циклофана. При этом макроциклическая платформа, способная находиться в нескольких пространственных конфигурациях, выступает в качестве шаблона, позволяющего фиксировать в пространстве сайты связывания, обеспечивая проявление мультивалентного эффекта [19, 20]. Также неоспоримым достоинством названного макроцикла является его способность снижать токсичность разных токсичных молекул при ковалентном связывании с ними [21, 22]. И наконец сочетание выше перечисленных свойств с относительно небольшой молекулярной массой (тиа)каликсареновой платформы при возможности варьирования гидрофильно-гидрофобного баланса посредством еe функционализации открывает перспективы этих макроциклов в качестве лекарственных средств [23], например, патентом защищено применение каликсаренов в качестве противоопухолевых препаратов [18, 24].
САМОСБОКА ТИАКАЛИКСАРЕНОВ
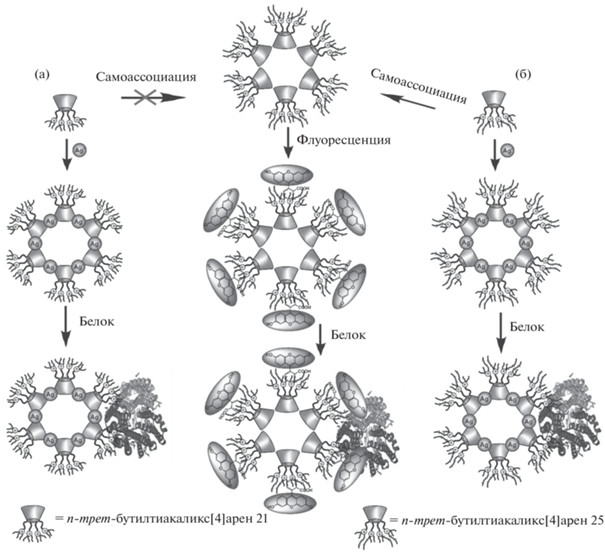
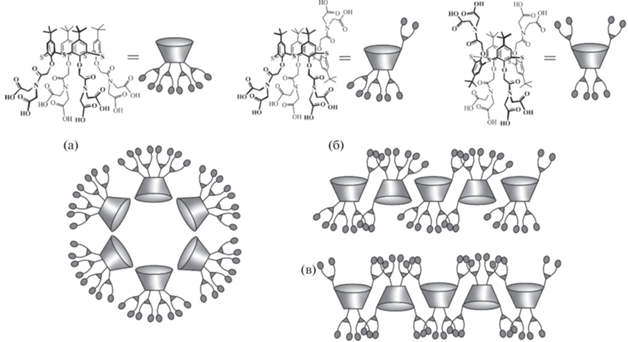
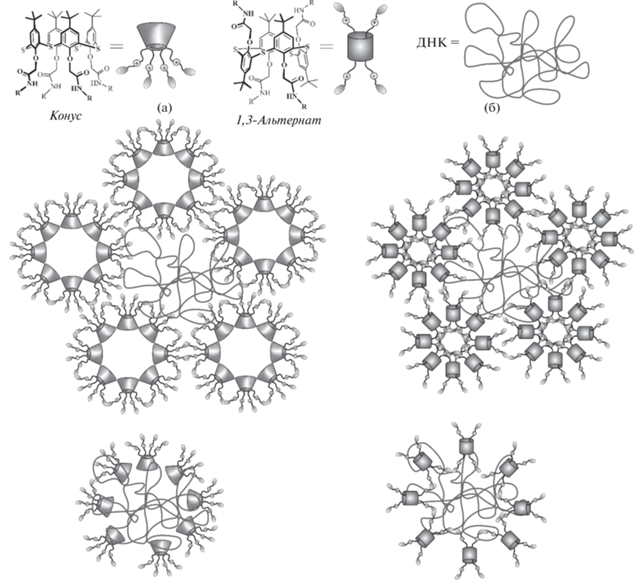
Наличие у тиакаликсаренов ароматической макроциклической платформы и лeгкость еe функционализации различными группировками приводят к возможности создания на их основе амфифильных систем: гидрофильные полярные заместители, часто несущие на себе заряженные фрагменты, сочетаясь с гидрофобной платформой, приводят к возможности самосборки соединений в водной среде с образованием таких надмолекулярных структур, как мицеллы и везикулы [12, 25]. При замещении нижнего обода п-трет-бутилтиакаликс [4]арена иминодиуксусными фрагментами полученные соединения в воде формируют достаточно крупные частицы [26]. Оказалось, что образующиеся системы имеют высокую полидисперсность, причeм наибольшие значения оказываются в случае соединения, в котором макроциклическая платформа находится в конфигурации конус (рис. 1). И действительно, для этой конфигурации логично ожидать образование мицеллярных структур (рис. 1а), поскольку молекулы такого соединения дифильны: имеются ярко выраженные гидрофобные (макроцикл) и гидрофильные (заместители) фрагменты, чeтко разграниченные в пространстве. Молекулы соединений, находящихся в конфигурациях частичный конус и 1,3-альтернат, имеют принципиально другое строение: в них гидрофобные части заключены между полярными заместителями, в результате чего образуются протяжeнные везикулы (рис. 1б и 1в).
Рис. 1.
Схематичное изображение возможных путей образования самоассоциатов (тиа)каликсаренов в водных растворах стереоизомерами в конфигурациях конус (а), частичный конус (б) и 1,3-альтернат (в).
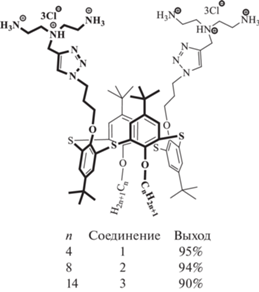
Влияние гидрофобных взаимодействий между молекулами амифифильных тиакаликсаренов на размер образующихся в растворе агрегатов было изучено на примере различнозамещeнных катионных макроциклов 1–3 с фрагметами диэтилентриамина (рис. 2) [27]. Гидрофобность соединений варьировалась посредством изменения длины алкильных цепей. Оказалось, что в воде минимальный размер ассоциатов (50 нм) достигается в случае наиболее длинных тетрадецильных цепей (соединение 3), что авторы связывают с увеличением плотности упаковки образующихся везикул за счет усиления гидрофобных взаимодействий между липофильными фрагментами молекулы.
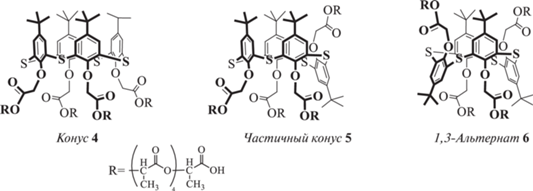
Модифицированные пентамолочной кислотой стереоизомеры п-трет-бутилтиакаликс [4]арена (конус, частичный конус и 1,3-альтернат) 4–6 (рис. 3) также способны образовывать супрамолекулярные ассоциаты [28]. Для этих соединений прослеживается влияние полярности дисперсионной среды на размер образующих коллоидную систему частиц, а также еe полидисперсность. В целом, с ростом полярности растворителя (при переходе от самосборки в дихлорметане к самосборке в ацетоне и нанопреципитации в воде) наблюдается уменьшение размеров ассоциатов, что связано с различной упаковкой образующихся самоассоциатов. Вероятно, данные ассоциаты набухают в дихлорметане и ацетоне, образуя рыхлую упаковку, но практически не набухают в воде, что и приводит к значительному снижению размеров частиц вследствие более плотной упаковки молекул сополиэфиров в мицеллах. Полидисперсность образующихся систем также оказывается минимальна в водном растворе.
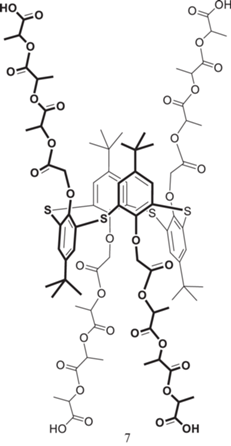
В случае более коротких, димерных, фрагментов молочной кислоты агрегационные свойства тиакаликсареновых производных заметно меняются [29]. Вследствие увеличения гидрофобности молекулы за счeт укорочения гидрофильных лактидных цепей в неполярном хлороформе самоассоциации не наблюдается: соединение 7 образует истинные растворы (рис. 4). С увеличением полярности растворителей (ацетонитрил и метанол), судя по данным динамического светорассеяния и электронной спектроскопии, образуются супрамолекулярные ассоциаты. В апротонном ацетонитриле образуются монодисперсные системы с размерами частиц порядка 200 нм, тогда как в протонном метаноле образуется полидисперсная система с размерами частиц более 900 нм. Методом спектроскопии ЯМР была установлена ключевая роль водородных связей дилактидных фрагментов в образовании ассоциатов. Метанол, способный сам к образованию водородных связей, нивелирует роль лактидных группировок в самосборке. В результате определяющими становятся взаимодействия крупных липофильных макроциклических фрагментов.
Рис. 4.
Модифицированный дилактидными фрагментами п-трет-бутил(тиа)каликс [4]арен в конфигурации 1,3-альтернат.
Природа органического растворителя оказывает влияние и на размерное и зарядовое распределение наночастиц с фрагментами молочной кислоты в водных системах, образуемых посредством нанопреципитации. Так, протонодонорный метанол способен частично компенсировать отрицательный заряд частиц с карбоксильными терминальными группами, в результате чего в воде ассоциаты, полученные нанопреципитацией из ацетона, несут на себе больший отрицательный заряд [30]. Конфигурация макроциклической платформы также влияет на значения электрокинетических потенциалов: наиболее велики они в случае конфигурации 1,3-альтернат, минимальны для конуса. Очевидно, это влияние обусловлено различным расположением карбоксильных групп относительно границы раздела фаз “частица–буферный раствор”.
При существенном увеличении длины олиголактидных фрагментов гидрофильно/гидрофобный баланс макроциклических соединений меняется настолько, что они становятся способны образовывать коллоидные растворы в воде либо при диспергировании [31], либо самопроизвольно [32]. Так, макроцикл, содержащий более 30 фрагментов молочной кислоты, растворяется в 50 мМ фосфатном буфере (рН 7.4) без какой-либо обработки, формируя частицы с размером 15 и 620 нм в зависимости от конфигурации макроциклического кольца. Полимолочные производные тиакаликс [4]арена в водных средах образуют различные структуры в зависимости от конфигурации макроциклического ядра: в случае стереоизомера конус наблюдается образование мицелл с гидрофобной макроциклической внутренней областью и поверхностным слоем из полилактидных фрагментов; 1,3-альтернат и частичный конус образуют протяжeнные везикулы [31]. Здесь нужно отметить, что наиболее компактные частицы (70 нм) формирует стереоизомер конус. Олиго- и полилактиды на основе тиакаликсарена были предложены в качестве компонентов электрохимических сенсоров и успешно применены для определения лекарственных средств и токсинов [33, 34].
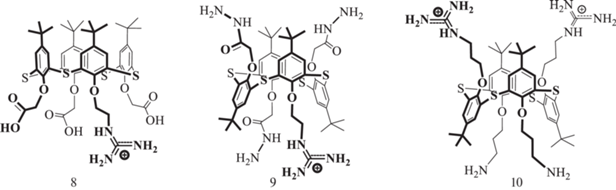
К самоассоциации с образованием наночастиц способны и производные тиакаликс [4]арена 8–10, функционализированные гуанидиновыми группами (рис. 5) [35].
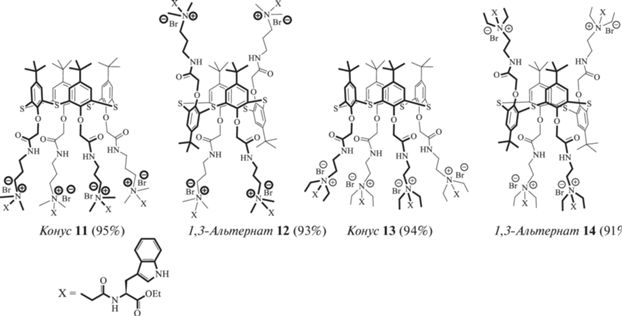
Любопытную особенность самосборки тиакаликсаренов удалось установить для оптически активных макроциклов 11–14. Введение в нижний обод тиакаликс [4]арена фрагментов L-триптофана (рис. 6) приводит к формированию в воде стабильных хиральных флуоресцентно активных наночастиц с размерами 86–134 нм, заряженных положительно [36]. Важно отметить, что в спиртовом растворе названные соединения не образуют стабильных ассоциатов и не проявляют необычных свойств, имея практически идентичные спектры кругового дихроизма и флуоресценции. В воде же спектральная картина резко меняется, сохраняя сходство между парами соединений с одинаковой длиной линкера между макроциклом и триптофановой группировкой. Можно предположить, что пары соединений 11, 12 и 13, 14 образуют в воде по аналогии с белками некую вторичную структуру с различной упаковкой триптофановых фрагментов внутри молекул тиакаликсаренов. Удлинение линкера на одну метиленовую группу приводит к уменьшению отталкивания положительно заряженных аммонийных групп, вследствие чего триптофановые фрагменты приобретают возможность к упаковыванию в димеры. Неожиданным оказался тот факт, что в данном случае пространственная конфигурация макроцикла не оказывает значимого влияния на оптические свойства систем.
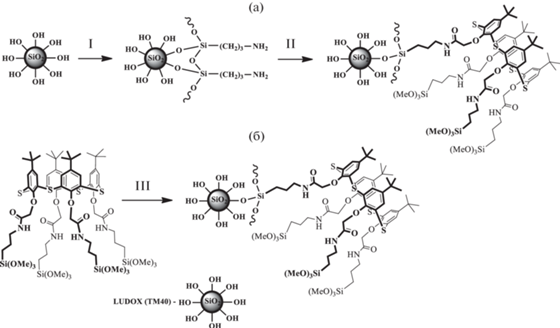
Помимо чисто органических соединений, в качестве компонентов коллоидных систем могут быть использованы и более сложные структуры. Так, на основе тиакаликс [4]арена были получены гибридные органо-неорганические частицы с кремниевым ядром (рис. 7) [37]. Здесь важно отметить, что размер и дисперсность получаемых частиц варьируются в широком диапазоне и напрямую зависят от метода получения гибридов. Наночастицы (с размером порядка 20–30 нм) с низкой и малой полидисперсностью образуются в результате модификации поверхности кремниевых частиц силилированным макроциклом (метод б, рис. 7). Ацилирование же аминированного диоксида кремния хлорангидридами тетракислот тиакаликс [4]арена приводит к получению частиц микрометрового размера (до 4300 нм) с высокой полидисперсностью (метод а, рис. 7), причeм полидисперсность и размер частиц в системах существенно зависят от конфигурации макроцикла: в случае 1,3-альтерната наблюдается тенденция к укрупнению частиц вследствие коагуляции более мелких. В то же время соединения с макроциклической частью в конфигурации конус благодаря чeткому разграничению полярных и гидрофобных фрагментов в молекуле образуют наиболее монодисперсные системы – мицеллы. Таким образом, для конфигурации 1,3-альтернат наблюдается усиление тенденции кластеризации за счeт более свободного пространственного расположения высокореакционных хлорангидридных групп.
Рис. 7.
Схема синтеза гибридных органо-неорганических частиц с кремниевым ядром. Метод а: ацилирование аминированного диоксида кремния хлорангидридами тетракислот тиакаликс [4]арена. Метод б: модификация поверхности кремниевых частиц силилированным макроциклом.
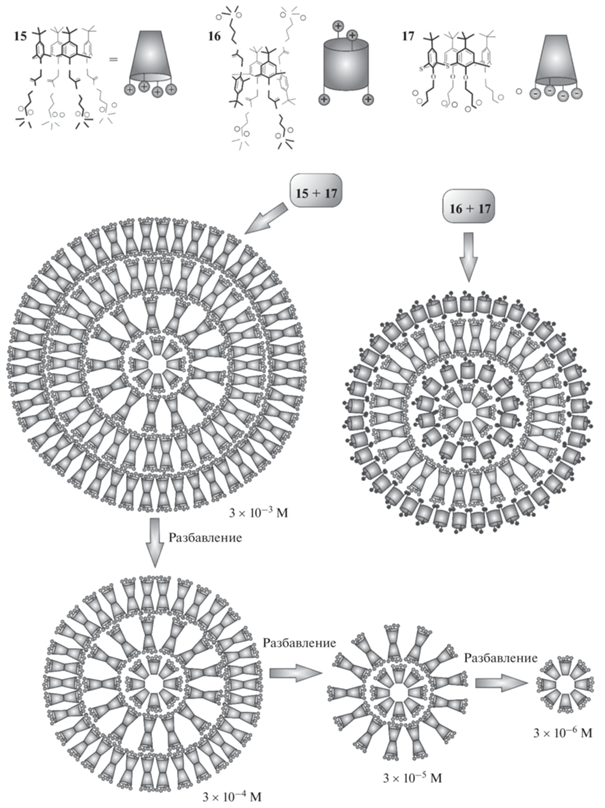
Часто производные тиакаликс [4]арена без добавления дополнительных компонентов образуют полидисперсные системы вследствие наличия целого ряда функциональных фрагментов, способных образовывать связи между первичными самоассоциатами. Однако дополнительное введение компонентов, способных связываться с макроциклическим соединением, как правило, приводит к получению монодисперсных систем. Наиболее часто в роли таких компонентов выступают катионы металлов [38–42]. Однако существует масса примеров, в которых монодисперсные системы получаются в присутствии самых разных органических соединений. Так, интересные результаты получены для систем, состоящих одновременно из положительно заряженных аммонийных производных тиакаликс [4]арена 15 и 16, находящихся в конфигурациях конус и 1,3-альтернат, и отрицательно заряженных сульфонатных (конус) 17 (рис. 8) [43]. В индивидуальном виде изученные соединения образуют нестабильные полидисперсные системы, однако при одновременном присутствии в растворе они формируют монодисперсные системы. Структура полученных интерполиэлектролитных ассоциатов зависит от концентрации компонентов. Формирование мицелл начинается с соединения 17, далее вокруг ядра ориентируются за счeт электростатических взаимодействий противоположно заряженные соединения 15 либо 16. Причeм в случае нахождения аммонийного соединения в конфигурации конус сборка осуществляется бислоями благодаря дополнительным гидрофобным взаимодействиям с промежуточным образованием обратных мицелл. Таким образом, собираются многослойные структуры. При последовательном разбавлении растворов наблюдается послойное снятие оболочек, что сопровождается чередованием положительных и отрицательных значений электрокинетических потенциалов частиц.
Рис. 8.
Структура интерполиэлектролитных комплексов на основе катионных и анионных производных тиакаликсарена (вверху). Послойное снятие оболочек при последовательном разбавлении растворов (внизу). Публикуется из [43] копирайт (2019) с разрешения Elsevier Ltd.
СУПРАМОЛЕКУЛЯРНЫЕ СИСТЕМЫ С АМИНОКИСЛОТАМИ
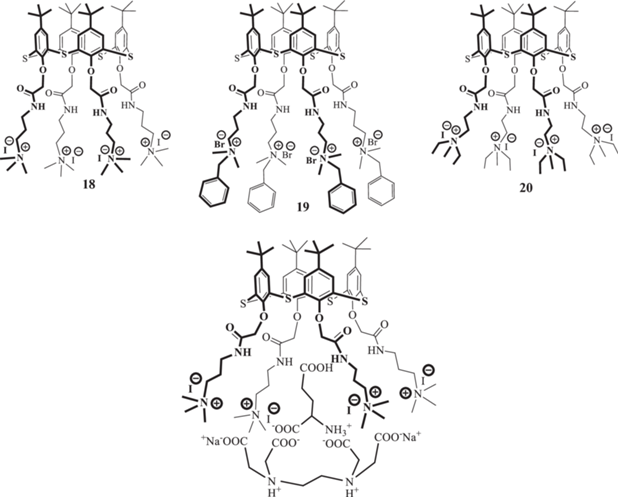
Функционализация (тиа)каликсаренов группами, способными к водородным взаимодействиям, обеспечивает возможность связывания макроциклами аминокислот [44–46]. В 2014 году были получены супрамолекулярные системы, состоящие из частиц нано- и субмикронных размеров, на основе положительно заряженных аммонийных производных тиакаликс [4]арена, находящихся в конфигурации конус, способных связываться с двунатриевой солью этилендиаминтетрауксусной кислоты, а также гидрокси- и аминокислотами (рис. 9) [47]. Взаимодействие с солью осуществляется за счeт электростатических сил между четвертичными аммониевыми группами макроциклов и анионом ЭДТА. Было установлено, что тиакаликсарен 18 образует с ЭДТА системы с размером частиц порядка 190 нм, а с глутаминовой кислотой – порядка 170 нм. Изучение же трeхкомпонентных систем (тиакаликсарен/ЭДТА/глутаминовая кислота) показало, что только в случае тиакаликсарена 18 с ЭДТА по каскадному типу образуются димерные капсулы (диаметр ассоциатов составляет около 1 нм), включающие внутрь себя в качестве гостя молекулу аминокислоты (рис. 9). Соединение 20 с кислотами и ЭДТА образует наносистемы по коммутативному типу, с размерами порядка 170–190 нм, что соответствует мицеллярной структуре агрегатов.
Рис. 9.
Аммонийные производные п-трет-бутилтиакаликс [4]арена в конфигурации конус. Внизу представлено образование димерной капсулы с ЭДТА.
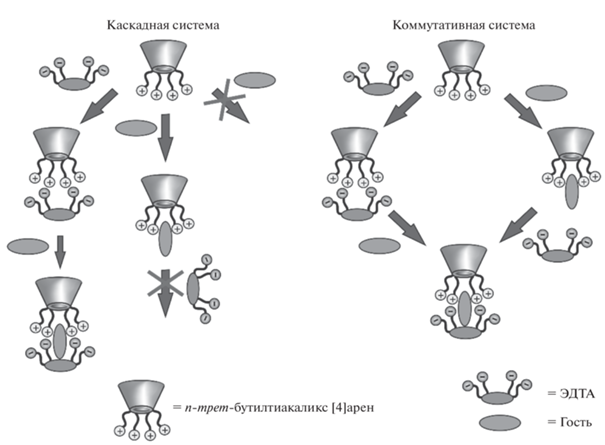
Важно отметить, что в случае мультикомпонентных супрамолекулярных ассоциатов тиакаликсаренов с различными субстратами возможно образование как каскадных, так и коммутативных систем (рис. 10) [48, 49]. Разделение их на такие типы основано на характере взаимодействия: в случае коммутативных систем одинаковые наноразмерные частицы образуются независимо от последовательности связывания субстратов. Для каскадных систем решающее значение имеет порядок связывания: образование их объясняется наличием множества центров связывания в тиакаликсаренах (функциональные группы заместителей, мостиковые атомы серы), в результате взаимодействия с которыми субстрата может наблюдаться положительный или отрицательный аллостерический эффект [50, 51]. В итоге изменения конформации связывающих центров после взаимодействия с первым субстратом, они становятся недоступными для связывания последующего (отрицательный аллостерический эффект), либо напротив, появляются дополнительные возможности для связывания (положительный эффект). Наиболее заметно аллостерический эффект для тиакаликсаренов проявляется в конфигурации конус, в которой при связывании первого субстрата возможна блокировка сразу всех связывающих центров для последующего взаимодействия, именно поэтому для этой стереоизомерной формы характерно образование каскадных систем. Нужно отметить и существование промежуточных систем, в которых при связывании субстратов в различном порядке образуются различные трeхкомпонентные наносистемы, что проявляется в разных размерах составляющих их частиц [48].
Рис. 10.
Схематичное изображение формирования каскадной и коммутативной систем на основе тиакаликсаренов.
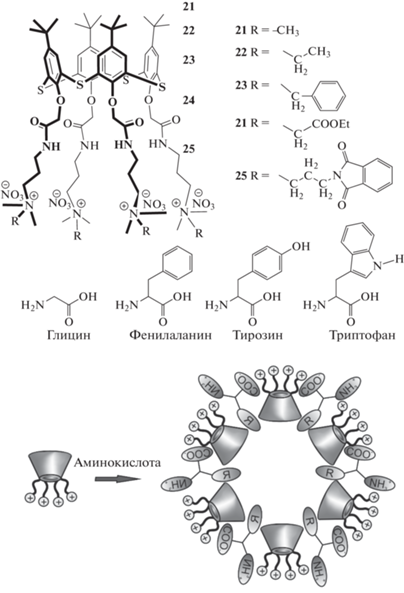
Позже [52] было установлено, что амфифильные тиакаликсарены 21–25, замещeнные четвертичными аммонийными группами, способны к связыванию глицина, фенилаланина, тирозина и триптофана с образованием наночастиц (рис. 11). Наиболее эффективно протекает образование комплексов с ароматическими аминокислотами, причeм размер и масса надмолекулярных структур напрямую зависят от величины заместителей макроцикла: возрастают с удлинением их цепи. Методом двумерной спектроскопии ядерного эффекта Оверхаузера было показано, что мицеллы, из которых образованы системы, представляют собой ассоциаты тиакаликс [4]аренов с включенными между ними молекулами аминокислот (рис. 11).
Рис. 11.
Связывание аминокислот аммонийными производными п-трет-бутилтиакаликс [4]арена. Внизу изображена структура образующихся мицелл.
СУПРАМОЛЕКУЛЯРНЫЕ СИСТЕМЫ С БЕЛКАМИ
Установленное взаимодействие тиакаликсареновых производных с аминокислотами подразумевает возможность их агрегации и с полимерами последних – белками. Белки являются важнейшими биологическими молекулами, обеспечивающими функционирование организма, в результате чего находят и широкое терапевтическое применение. В работе [31] было изучено взаимодействие полимолочных производных п-трет-бутилтиакаликс [4]арена в трeх пространственных конфигурациях с транспортными белками (лизоцимом, гемоглобином и БСА) при физиологическом значении рН. Оказалось, что в присутствии всех белков наблюдается некоторое снижение стабильности систем, образованных макроциклическими соединениями, на что указывает уменьшение электрокинетических потенциалов образующих их частиц. В случае положительно заряженного в условиях эксперимента лизоцима система оказывается нестабильной – происходит коагуляция ассоциатов белок/полиэфир с образованием частиц микронных размеров. При взаимодействии с гемоглобином и БСА размеры частиц полимолочных производных п-трет-бутилтиакаликс [4]арена лишь незначительно возрастают, не превышая для стереоизомеров конус и частичный конус 200 нм. Необходимо отметить, что в случае олигомолочной кислоты, не связанной ковалентно с тиакаликс [4]ареновой платформой, ни с одним из белков не наблюдается образования монодисперсных систем. Таким образом, определяющим фактором способности к получению стабильных монодисперсных коллоидных систем, состоящих из частиц нано- и субмикронных размеров, является наличие макроциклической платформы в структуре сополиэфира, а также еe конфигурация.
Склонность к ассоциации с БСА была обнаружена у сульфобетаиновых производных п-трет-бутилтиакаликсарена [43], а также аммонийных 21 и 25 [52]. В результате ассоциации стабилизируется мономерная форма белка, на что указывает формирование монодисперсных систем с размерами частиц порядка 7 нм. Надо отметить, что с лизоцимом стабильных коллоидных систем сульфобетаины не образуют. Напротив, интерполиэлектролитные частицы образуют монодисперсные системы с лизоцимом, размер результирующих ассоциатов не превышает 140 нм [43].
Способность макроциклических соединений к взаимодействию с белками может быть успешно использована для модулирования каталитической активности ферментов [53–55]. Причeм следствием взаимодействия часто является существенное изменение размеров частиц, составляющих систему. Например, при ассоциации триптофанового производного тиакаликс [4]арена 11 с α-химотрипсином наблюдается образование полидисперсных систем с размерами частиц, значительно превышающими размеры исходных компонентов (более 1000 нм) [55].
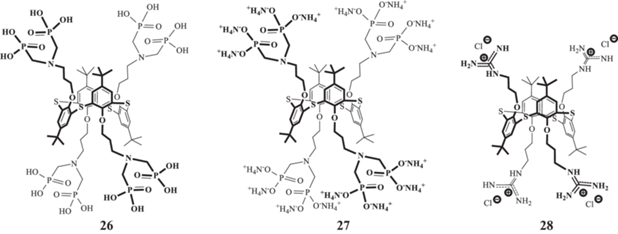
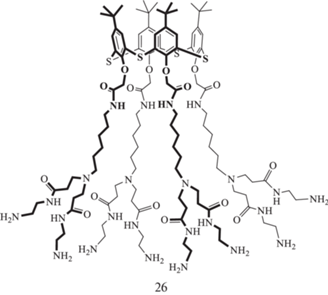
Весьма перспективной для образования супрамолекулярных ансамблей комбинацией представляется сочетание макроциклической платформы (тиа)каликсаренов с фосфонатными фрагментами, которые широко применяются для комплексообразования как с аминокислотами, так и с белками [44, 56, 57]. Однако оказалось, что производное тиакаликс [4]арена с аминобисфосфоновыми фрагментами 26 и его аммонийная соль 27 (рис. 12) образуют в воде полидисперсные системы [58], вследствие чего на их основе были получены успешно зарекомендовавшие себя в связывании биополимеров интерполиэлектролитные частицы [43], где в качестве второго, катионного компонента, было выбрано гуанидиновое производное циклофана 28. Полученные интерполиэлектролиты в воде заряжены отрицательно, и из ряда лизоцим/гемоглобин/БСА образуют монодисперсные системы только с положительно заряженным при нейтральном значении рН среды лизоцимом, причeм размер образующихся частиц не превышает 200 нм, а их положительное значение электрокинетического потенциала указывает на поверхностное расположение белка в мицеллах.
Помимо интерполиэлектролитных частиц, возможно получение коллоидных систем с белками на основе предварительно сформированных комплексов аммонийных тиакаликсаренов, находящихся в конфигурации конус, с катионом серебра либо флуоресцеином (рис. 13) [59]. Как уже отмечалось выше, полидисперсность коллоидных систем, образуемых соединениями на основе тиакаликс[4]аренов, часто заметно снижается в присутствии дополнительных компонентов [38–40]. Так, соединение 25 образует в воде самоассоциаты с размерами порядка 15 нм, в то время как 21 не способно образовывать стабильные ассоциаты. Введение в систему Ag (I) приводит к формированию наночастиц для соединения 21 (рис. 13). Интересно, что связывание с белком систем 21/Ag(I), 25/флуоресцеин и 25/Ag(I) сопровождается образованием наночастиц, близких по размеру к мономерной форме БСА (6–8 нм). Размерное распределение указывает на вероятную перестройку первоначально сформированных ассоциатов, поскольку ассоциаты с белком оказываются меньше, чем исходные, однако крупнее, чем белок в индивидуальном состоянии.
СУПРАМОЛЕКУЛЯРНЫЕ СИСТЕМЫ С ДНК
Бесспорно, актуальной задачей является поиск соединений, способных связывать другой важный биополимер – ДНК. Такие вещества находят широкое применение в медицинских технологиях: связывание с ДНК, нарушающее еe структуру и снижающее транскрипцию, используется при лечении онкологических заболеваний, препараты на основе ДНК предложены и для лечения целого ряда неопухолевых заболеваний [60]. Доставка генетического материала в клетку также осуществляется благодаря связыванию ДНК и еe компактизации [61]. В последние годы развитие получило и создание на основе ДНК вакцин [62].
Учитывая полианионную структуру ДНК, как правило, в качестве связывающих еe агентов используют катионные соединения. Таким образом, катионные производные (тиа)каликсаренов, являясь амфифильными молекулами, имеют широкие перспективы в качестве трансфекционных агентов, поскольку помимо групп, ответственных за электростатическое связывание с ДНК, имеют гидрофобную макроциклическую платформу, способную обеспечить транспорт биомолекулы через клеточные мембраны. В 2006 году была показана способность гуанидиновых производных классического каликсарена, содержащих заряженные группы на верхнем ободе, конденсировать ДНК [63]. Была также протестирована способность образующихся ассоциатов к трансфекции, и выявлены перспективы каликсаренов как средства доставки генов. Нужно отметить, что в случае классического каликсарена наиболее интересны достаточно жeсткие конформационно макроциклы, платформа которых включает в себя четыре ароматических кольца (каликс [4]арены), находящиеся в конфигурации конус, способные наиболее заметно компактизовать биополимер (рис. 14, а) [64].
Для тиакаликс [4]аренов столь заметных различий в компактизации ДНК в зависимости от конфигурации не наблюдается. Так, были получены коллоидные системы с ДНК из молок лосося на основе аммонийных производных тиакаликс [4]арена в конфигурациях конус и 1,3-альтернат, состоящие из частиц размером 100–200 нм [65]. Причeм нужно отметить, что, в отличие от классического каликсарена, его серосодержащий аналог в случае конфигурации конус (а) формирует частицы более крупного размера, чем 1,3-альтернат (б) (рис. 15). Аналогичные результаты были получены и для полиамидоаммонийных дендримеров первой генерации с ядром на основе тиакаликс[4]арена, причeм с использованием спектроскопии кругового дихроизма было выявлено отсутствие существенного влияния ассоциации на структуру ДНК [66]. Наиболее крупные частицы (однако не превышающие 200 нм в диаметре) формируются с ДНК из молок лосося стереоизомером 26, находящимся в конфигурации конус (рис. 16). Интересной особенностью этого стереоизомера является то, что при ассоциации с ДНК только он способен предохранять еe от деградации. Очевидно, такая способность связана с его структурой: благодаря гидрофобности макроциклической платформы происходит изоляция ею биополимера от водной среды и растворeнных в ней компонентов, вызывающих деградацию. Позже на основе именно этого дендримера с макроциклическим ядром, находящимся в конфигурации конус, был разработан электрохимический ДНК-сенсор, позволяющий определять доксорубицин [67].
Рис. 15.
Схематичное изображение компактизации ДНК из молок лосося аммонийными производными тиакаликс [4]арена в конфигурации конус (а и а′), и в конфигурации 1,3-альтернат (б и б′).
Существенно более крупная ДНК из тимуса телeнка также способна при связывании с производными тиакаликсарена образовывать нано- и субмикронные ассоциаты. Так, в работе [27] было показано, что при добавлении к ДНК замещeнных диэтилентриаммонийными фрагментами макроциклов 1–3, находящихся в конфигурации 1,3-альтернат, происходит образование липоплексов размером от 57 нм, в которых ДНК “обматывает” агрегат. Вывод о структуре полученных везикул авторы делают на основании существенного уменьшения размеров частиц в системе по сравнению с чистой ДНК и возрастания величин поверхностных отрицательных зарядов. Нужно также добавить, что максимальное сжатие (в пять раз) ДНК из тимуса телeнка достигается в случае наиболее гидрофобного тиакаликсарена 3.
Способностью к компактизации ДНК обладают и имидазолиевые производные п-трет-бутилтиакаликc [4]арена [68], но в этом случае размеры ДНК меняются в меньшей степени. Образующиеся ассоциаты положительно заряжены и имеют высокую стабильность (значения электрокинетических потенциалов достигают величины +68 мВ). Однако несмотря на это полидисперсность систем оказывается высока.
В работе [43] описано взаимодействие ДНК из тимуса телeнка с полиэлектролитными частицами, также приводящее к компактизации биополимера в составе комплекса до размера порядка 140 нм. Интересно, что катионный компонент интерполиэлектролитного комплекса оказался не способен образовывать с ДНК монодисперсные системы. Образуемый добавлением к анионному производному тиакаликсарена (тетрасульфокислота в конфигурации 1,3-альтернат) в качестве катиона деказамещeнного аммонийными фрагментами пиллар [5]арена интерполиэлектролитный комплекс также способен образовывать системы, состоящие из частиц субмикронного размера, не превышающих в диаметре 200 нм [69]. Смена в присутствии ДНК заряда образуемых частиц с положительного на отрицательный позволила авторам предположить, что молекула ДНК оплетает интерполиэлектролитные ассоциаты (рис. 17).
Рис. 17.
Схематичное изображение ассоциации ДНК из тимуса телeнка с интерполиэлектролитными частицами на основе тиакаликсаренов.
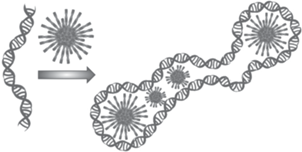
Помимо катионных соединений, образуют ассоциаты с ДНК и нейтральные соединения, способные к образованию водородных связей (рис. 18). В качестве таких соединений были выбраны производные п-трет-бутилтиакаликс [4]арена 27–37, содержащие первичные, вторичные и третичные аминные и/или гидроксильные группы [70, 71]. Оказалось, что все они способны связывать ДНК из тимуса телeнка, в ряде случаев (соединения 27, 30, 31, 35) компактизуя еe до наноразмеров (диаметры полученных ассоциатов менее 100 нм). Однако изучение различных стереоизомеров полученных азотсодержащих тиакаликсаренов не позволило выявить чeткого влияния пространственной структуры макроциклической платформы на размер образующихся ассоциатов. Таким образом, для конструирования потенциально связывающих ДНК агентов на платформе тиакаликс [4]арена необходимо учитывать целый комплекс параметров: структуру фрагментов полиаминов, число аминогрупп, длину алкильных линкеров, наличие/отсутствие гидроксильных групп, степень разветвленности заместителей, а также их пространственное расположение относительно тиакаликс [4]ареновой платформы.
Рис. 18.
Структуры нейтральных аминопроизводных п-трет-бутилтиакаликс [4]арена, способных к связыванию с ДНК.
ЗАКЛЮЧЕНИЕ
Итак, на сегодняшний день производные тиакаликсарена интенсивно изучаются в качестве компонентов супрамолекулярных систем. Амфифильная структура данного макроцикла позволяет получать на его основе надмолекулярные структуры как в водной среде, так и в органических растворителях. Сочетание гидрофобной платформы с полярными заместителями позволяет использовать производные циклофана для связывания как полярных, так и липофильных соединений. Особенно интересна ассоциация тиакаликс [4]аренов с биополимерами, приводящая в ряде случаев к существенному изменению структуры последних вплоть до снижения в случае ферментов их каталитической активности. ДНК в присутствии макроциклических производных часто становится более компактной, однако структура еe не претерпевает существенных изменений. Способность тиакаликсаренов к образованию супрамолекулярных систем с ДНК успешно применяется при создании электрохимических сенсоров. Получение новых знаний, касающихся коллоидной химии циклофанов, может способствовать совершенствованию сельскохозяйственных технологий, а также медицинских в плане создания новых диагностических средств и мультитаргетных лекарственных препаратов.
Список литературы
Сумм Б.Д., Иванова Н.И. Объекты и методы коллоидной химии в нанохимии // Успехи химии. 2000. Т. 69. № 11. С. 995–1008.
Kamaly N., He J.C., Ausiello D.A. et al. Nanomedicines for renal disease: current status and future applications // Nat. Rev. Nephrol. 2016. V. 12. P. 738–753.
Hao M., Chen B., Zhao X. et al. Organic/inorganic nanocomposites for cancer immunotherapy // Mater. Chem. Front. 2020. V. 4. P. 2571–2609.
Ezzati Nazhad Dolatabadi J., Omidi Y. Solid lipid-based nanocarriers as efficient targeted drug and gene delivery systems // Trends Anal. Chem. 2016. V. 77. P. 100–108.
Jain S., Doshi A.S., Iyer A.K. et al. Multifunctional nanoparticles for targeting cancer and inflammatory diseases // J. Drug Target. 2013. V. 21. № 10. P. 888–903
Bhowmik H., Venkatesh D.N., Kuila A. et al. Nanosponges: A Review // Int. J. App. Pharm. 2018. V. 10. № 4. P. 1–5.
van de Manakker F., Vermonden T., van Nostrum C.F. et al. Cyclodextrin-based polymeric materials: synthesis, properties, and pharmaceutical/biomedical applications // Biomacromolecules. 2009. V. 10. № 12. P. 3157–3175.
Golmohamadpour A., Bahramian B., Shafiee A. et al. Slow released delivery of alendronate using β-cyclodextrine modified Fe–MOF encapsulated porous hydroxyapatite // Journ. of Inorganic and Organometallic Polymers and Materials. 2018. V. 28. № 5. P. 1991–2000.
Shafiei-Irannejad V., Rahimkhoei V., Molaparast M. et al. Synthesis and characterization of novel hybrid nanomaterials based on β-cyclodextrine grafted halloysite nanotubes for delivery of doxorubicin to MCF-7 cell line // J. Mol. Struct. 2022. V. 1262. Article 133004.
Chehardoli G., Bahmani A. The role of crown ethers in drug delivery // Supramol. Chem. 2019. V. 31. № 4. P. 221–238.
Cano A., Sánchez-López E., Ettcheto M. et al. Current advances in the development of novel polymeric nanoparticles for the treatment of neurodegenerative diseases // Nanomedicine. 2020. V. 15. № 12. P. 1239–1261.
Da Silva E., Lazar A.N., Coleman A.W. Biopharmaceutical applications of calixarenes // J. Drug Del. Sci. Tech. 2004. V. 14. № 1. P. 3–20.
Kashapov R., Razuvayeva Yu., Ziganshina A. et al. Effect of preorganization and amphiphilicity of calix[4]arene platform on functional properties of viologen derivatives // J. Mol. Liq. 2022. V. 345. Article 117801.
Shurpik D.N., Aleksandrova Yu.I., Zelenikhin P.V. et al. Towards new nanoporous biomaterials: selfassembly of sulfopillar[5]arenes with vitamin D3 into supramolecular polymers // Org. Biomol. Chem. 2020. V. 18. № 22. P. 4210–4216.
Morohashi N., Narumi F., Iki N. et al. Thiacalixarenes // Chem. Rev. 2006. V. 106. № 12. P. 5291–5316.
Español E.S., Villamil M.M. Calixarenes: generalities and their role in improving the solubility, biocompatibility, stability, bioavailability, detection, and transport of biomolecules // Biomolecules. 2019. V. 9. № 3. Article 90.
Родик Р., Побережник Н., Кальченко В. Производные каликсаренов для (нано)биотехнологий // Macroheterocycles. 2017. V. 10. № 4–5. P. 421–431.
Dings R.P.M., Miller M.C., Nesmelova I. et al. Antitumor agent calixarene 0118 targets human galectin-1 as an allosteric inhibitor of carbohydrate binding // J. Med. Chem. 2012. V. 55. № 11. P. 5121–5129.
Fasting C., Schalley C.A., Weber M. al. Multivalency as a chemical organization and action principle // Angew. Chem. Int. Ed. 2012. V. 51. № 42. P. 10472–10498.
Антипин И.С, Алфимов М.В, Арсланов В.В. и др. Функциональные супрамолекулярные системы: дизайн и области применения // Успехи химии. 2021. Т. 90. № 8. С. 895–1107.
Basilotta R., Mannino D., Filippone A. et al. Role of calixarene in chemotherapy delivery strategies // Molecules. 2021. V. 26. № 13. Article 3963.
Shurpik D.N., Padnya P.L., Stoikov I.I. et al. Antimicrobial activity of calixarenes and related macrocycles // Molecules. 2020. V. 25. № 21. Article 5145.
Lipinski C.A. Rule of five in 2015 and beyond: target and ligand structural limitations, ligand chemistry structure and drug discovery project decisions // Adv. Drug Delivery Rev. 2016. V. 101. P. 34–41.
Mayo K.H., Hoye T.R., Levine J.I. et al. Pat. WO 2012/U61395 A2 USA. 2012.
Solovyov A.V., Cherenok S.O., Kalchenko O.I. et al. Synthesis and complexation of amphiphilic calix[4]arene phosphonates with organic molecules in solutions and Langmuir−Blodgett films // J. Mol. Liq. 2011. V. 159. № 2. P. 117–123.
Мостовая О.А., Падня П.Л., Шурпик Д.Н. и др. Иминодиуксусные производные п-трет-бутилтиакаликс[4]арена: синтез и влияние конформации на агрегацию с Бисмарком коричневым Y // Macroheterocycles. 2017. Т. 10. № 2. С. 154–163.
Ибрагимова Р.Р., Бурилов В.А., Айметдинов А.Р. и др. Поликатионные производные п-трет-бутилтиакаликc[4]арена в стереоизомерной форме 1,3-альтернат: новые вещества для компактизации ДНК // Macroheterocycles. 2016. Т. 9. № 4. С. 433–441.
Горбачук В.В., Мостовая О.A., Евтюгин В.Г. и др. Модификация олигомолочной кислоты тетракарбоксильными производными п-трет-бутилтиакаликс[4]арена: влияние конфигурации макроциклического фрагмента на агрегационные и термические свойства сополиэфиров // Macroheterocycles. 2017. Т. 10. № 2. С. 174–181.
Vavilova A.A., Gorbachuk V.V., Shurpik D.N. et al. Synthesis, self-assembly and the effect of the macrocyclic platform on thermal properties of lactic acid oligomer modified by p-tert-butylthiacalix[4]arene // J. Mol. Liq. 2019. V. 281. P. 243–251.
Вавилова А.А., Горбачук В.В., Шурпик Д.Н. и др. Сополиэфиры молочной кислоты с карбоксильными производными п-трет-бутилтиакаликс[4]арена: синтез и влияние конфигурации макроцикла на физико-химические свойства // Изв. АН. Сер. хим. 2019. № 11. С. 2098–2104.
Mostovaya O.A., Gorbachuk V.V., Bazanova O.B. et al. Thiacalixarene ‘‘knot’’ effect on protein binding by oligolactic acid particles // Mater. Chem. Front. 2019. V. 3. № 2. P. 292–300.
Gorbachuk V.V., Padnya P.L., Mostovaya O.A. et al. Towards novel functional polymers: Ring-opening polymerization of L-lactide with p-tert-butylthiacalix[4]arene derivatives // React. Funct. Polym. 2020. V. 150. Article 104546.
Stepanova V., Smolko V., Gorbatchuk V. et al. DNA-Polylactide Modified Biosensor for Electrochemical Determination of the DNA-Drugs and Aptamer-Aflatoxin M1 Interactions // Sensors. 2019. V. 19. № 22. Article 4962.
Kuzin Yu.I., Gorbatchuk V.V., Rogov A.M. et al. Electrochemical Properties of Multilayered Coatings Implementing thiacalix[4]arenes with oligolactic fragments and DNA // Electroanalysis. 2020. V. 32. № 4. P. 715–723.
Andreyko E.A., Puplampu J.B., Ignacio-De Leon P.A. et al. p-tert-Butylthiacalix[4]arenes containing guanidinium groups: synthesis and self-assembly into nanoscale aggregates // Supramol. Chem. 2019. V. 31. № 7. P. 473–483.
Padnya P.L., Khripunova I.A., Mostovaya O.A. et al. Self-assembly of chiral fluorescent nanoparticles based on water-soluble L-tryptophan derivatives of p-tert-butylthiacalix[4]arene // Beilstein J. Nanotechnol. 2017. V. 8. № 1. P. 1825–1835.
Stoikov I.I., Vavilova A.A., Badaeva R.D. et al. Synthesis of hybrid nano- and microsized particles on the base of colloid silica and thiacalix[4]arene derivatives // J. Nanopart. Res. 2013. V. 15. № 5. Article 1617.
Yakimova L.S., Padnya P.L., Kunafina A.F. et al. Sulfobetaine derivatives of thiacalix[4]arene: synthesis and supramolecular self-assembly of submicron aggregates with AgI cations // Mendeleev Commun. 2019. V. 29. № 1. P. 86–88.
Yushkova E.A., Stoikov I.I. p-tert-Butyl thiacalix[4]arenes functionalized with amide and hydrazide groups at the lower rim in cone, partial cone, and 1,3-alternate conformations are “smart” building blocks for constructing nanosized structures with metal cations of s-, p-, and d-elements in the organic phase // Langmuir. 2009. V. 25. № 9. P. 4919–4928.
Stoikov I.I., Yushkova E.A., Zhukov A.Yu. et al. The synthesis of p-tert-butyl thiacalix[4]arenes functionalized with secondary amide groups at the lower rim and their extraction properties and self-assembly into nanoscale aggregates // Tetrahedron. 2008. V. 64. № 30–31. P. 7112–7121.
Wang Z., Su H.-F., Gong Y.-W. et al. A hierarchically assembled 88-nuclei silver-thiacalix[4]arene nanocluster // Nat. Commun. 2020. V. 11. № 11. Article 308.
Wang S., Gao X., Hang X. et al. Calixarene-based {Ni18} coordination wheel: highly efficient electrocatalyst for the glucose oxidation and template for the homogenous cluster fabrication // J. Am. Chem. Soc. 2018. V. 140. № 20. P. 6271−6277.
Yakimova L., Padnya P., Tereshina D. et al. Interpolyelectrolyte mixed nanoparticles from anionic and cationic thiacalix[4]arenes for selective recognition of model biopolymers // J. Mol. Liq. 2019. V. 279. P. 9–17.
Mostovaya O.A., Agafonova M.N., Galukhin A.V. et al. Phosphorylated amino derivatives of thiacalix[4]arene as membrane carriers: synthesis and host–guest molecular recognition of amino, hydroxy and dicarboxylic acids // J. Phys. Org. Chem. 2014. V. 27. № 1. P. 57–65.
Андрейко Е.А., Стойков И.И., Антипин И.С. и др. Энантиоселективное распознавание аминокислот энантиомерно чистыми каликс[4]аренкарбоновыми кислотами или их диастереомерно чистыми N-(1-фенил)этиламидами // Macroheterocycles. 2013. Т. 6. № 3. С. 227–233.
Agafonova M.N., Mostovaya O.A., Antipin I.S. et al. Selective transmembrane carriers for hydroxycarboxylic acids: influence of a macrocyclic calix[4]arene platform // Mendeleev Commun. 2012. V. 22. № 2. P. 80–82.
Andreyko E.A., Padnya P.L., Daminova R.R. et al. Supramolecular “containers”: self-assembly and functionalization of thiacalix[4]arenes for recognition of amino- and dicarboxylic acids // RSC Adv. 2014. V. 4. № 7. P. 3556–3565.
Yushkova E.A., Stoikov I.I., Puplampu J.B. et al. Cascade and Commutative Self-Assembles of Nanoscale Three-Component Systems Controlled by the Conformation of Thiacalix[4]arene // Langmuir. 2011. V. 27. № 23. P. 14053–14064.
Yushkova E.A., Stoikov I.I., Zhukov A.Yu. et al. Heteroditopic p-tert-butyl thiacalix[4]arenes for creating supramolecular self-assembles by cascade or commutative mechanisms // RSC Adv. 2012. V. 2. № 9. P. 3906–3919.
Schneider H.-J. Efficiency parameters in artificial allosteric systems // Org. Biomol. Chem. 2016. V. 14. № 34. P. 7994–8001.
Mostovaya O.A., Padnya P.L., Shurpik D.N. et al. Novel lactide derivatives of p-tert-butylthiacalix[4]arene: directed synthesis and molecular recognition of catecholamines // J. Mol. Liq. 2021. V. 327. Article 114806.
Andreyko E.A., Padnya P.L., Stoikov I.I. Amphiphilic p-tert-butylthiacalix[4]arenes containing quaternary ammonium groups: from small molecules toward water-soluble nanoscale associates // J. Phys. Org. Chem. 2015. V. 28. № 8. P. 527–535.
Vovk A.I., Kononets L.A., Tanchuk V.Yu. et al. Thiacalix[4]arene as molecular platform for design of alkaline phosphatase inhibitors // J. Incl. Phenom. Macrocycl. Chem. 2010. V. 66. № 3. P. 271–277.
Padnya P.L., Bayarashov E.E., Zueva I.V. et al. Water-soluble betaines and amines based on thiacalix[4]arene scaffold as new cholinesterase inhibitors // Bioorg. Chem. 2020. V. 94. Article 103455.
Mostovaya O.A., Valiullina Yu.A., Chan Ch.T. et al. Synthetic modulator of chymotrypsin activity based on p-tert-butylthiacalix[4]arene // Mendeleev Commun. 2019. V. 29. № 5. P. 520–522.
Cherenok S.O., Miroshnichenko S.I., Drapailo A.B. et al. Supramolecular chemistry of phosphorus-containing (thia)calixarenes // Phosphorus, Sulfur Silicon Relat. Elem. 2011. V. 186. № 4. P. 878–883.
Mucha A., Kafarski P., Berlicki Ł. Remarkable potential of the α-aminophosphonate/phosphinate structural motif in medicinal chemistry // J. Med. Chem. 2011. V. 54. № 17. P. 5955–5980.
Yakimova L., Vavilova A., Shibaeva K. et al. Supramolecular approaches to the formation of nanostructures based on phosphonate-thiacalix[4]arenes, their selective lysozyme recognition // Colloids Surf., A: Physicochem. Eng. Aspects. 2021. V. 611. Article 125897.
Andreyko E.A., Padnya P.L., Stoikov I.I. Supramolecular self-assembly of water-soluble nanoparticles based on amphiphilic p-tert-butylthiacalix[4]arenes with silver nitrate and fluorescein // Colloids Surf., A: Physicochem. Eng. Aspects. 2014. V. 454. № 1. P. 74–83.
Yamakawa K., Nakano-Narusawa Y., Hashimoto N. et al. Development and clinical trials of nucleic acid medicines for pancreatic cancer treatment // Int. J. Mol. Sci. 2019. V. 20. № 17. Article 4224.
Portugal J. Insights into DNA-drug interactions in the era of omics // Biopolymers. 2021. V. 112. № 4. e23385.
Zygmuntowicz A., Burmańczuk A., Markiewicz W. Selected biological medicinal products and their veterinary use // Animals. 2020. V. 10. № 12. Article 2343.
Sansone F., Dudic M., Donofrio G. et al. DNA Condensation and cell transfection properties of guanidinium calixarenes: dependence on macrocycle lipophilicity, size, and conformation // J. Am. Chem. Soc. 2006. V. 128. № 45. P. 14528–14536.
Giuliani M., Morbioli I., Sansone F. et al. Moulding calixarenes for biomacromolecule targeting // Chem. Commun. 2015. V. 51. № 75. P. 14140–14159.
Padnya P.L., Andreyko E.A., Mostovaya O.A. et al. The synthesis of new amphiphilic p-tert-butylthiacalix[4]arenes containing peptide fragments and their interaction with DNA // Org. Biomol. Chem. 2015. V. 13. № 21. P. 5894–5904.
Mostovaya O., Padnya P., Shiabiev I. et al. Pamam-calix-dendrimers: synthesis and thiacalixarene conformation effect on DNA binding // Int. J. Mol. Sci. 2021. V. 22. № 21. Article 11901.
Kulikova T., Padnya P., Shiabiev I. et al. Electrochemical sensing of interactions between DNA and charged macrocycles // Chemosensors. 2021. V. 9. № 12. Article 347.
Гафиатуллин Б.Х., Радаев Д.Д., Осипова М.В. и др. Амфифильные N-олигоэтиленгликоль-имидазолиевые производные п-трет-бутилтиакаликc[4]арена: синтез, агрегация и взаимодействие с ДНК // Macroheterocycles. 2021. Т. 14. № 2. С. 171–179.
Yakimova L.S., Nugmanova A.R., Mostovaya O.A. et al. Nanostructured polyelectrolyte complexes based on water-soluble thiacalix[4]arene and pillar[5]arene: self-assembly in micelleplexes and polyplexes at packaging DNA // Nanomaterials. 2020. V. 10. № 4. Article 777.
Пуплампу Д.Б., Якимова Л.С., Вавилова А.А. и др. Производные п-трет-бутилтиакаликс[4]арена, функционализированные по нижнему ободу бис(3-аминопропил)амином: синтез и взаимодействие с ДНК // Macroheterocycles. 2015. Т. 8. № 1. С. 75–80.
Якимова Л.С., Пуплампу Д.Б., Евтюгин Г.А. и др. Полифункциональные разветвлeнные азотсодержащие производные п-трет-бутилтиакаликс[4]арена как эффективные агенты для компактизации ДНК из тимуса телeнка // Изв. АН. Сер. хим. 2017. № 8. С. 1515–1523.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал