Коллоидный журнал, 2022, T. 84, № 5, стр. 574-594
Ковалентные и супрамолекулярные конъюгаты каликсаренов с некоторыми флуоресцентными красителями ксантенового ряда
А. А. Артеменко 1, В. А. Бурилов 1, *, С. Е. Соловьева 2, И. С. Антипин 1
1 ФГАОУ ВО “Казанский (Приволжский) федеральный университет”
420008 Казань, ул. Кремлевская, 18, Россия
2 Институт органической и физической химии им. А.Е. Арбузова ФИЦ Казанский научный центр РАН
420088 Казань, ул. Академика Арбузова, 8, Россия
* E-mail: ultrav@bk.ru
Поступила в редакцию 06.05.2022
После доработки 15.06.2022
Принята к публикации 17.06.2022
- EDN: XTFHZK
- DOI: 10.31857/S0023291222600122
Аннотация
В настоящем обзоре представлены системы с участием производных каликс[n]аренов и наиболее распространенных флуоресцентных красителей флуоренового ряда – родаминов Б, 6Ж, 123 и флуоронового ряда – флуоресцеина и эозина Н. В первой части обзора рассматриваются системы с ковалентной иммобилизацией красителей на макроциклической платформе, приводятся принципы их конструирования и потенциального применения в качестве хемосенсоров. Во второй части обзора рассматриваются системы, полученные за счет супрамолекулярных взаимодействий типа “гость–хозяин” и их использование в качестве хемо – и биосенсоров, работа которых основана на принципах высвобождения флуоресцентного красителя за счет конкурентного комплексообразования. Третья часть обзора посвящена коллоидным системам с участием ксантеновых красителей. Рассматривается использование насыщенных красителем коллоидных систем в качестве хемосенсоров, показана возможность использования красителей в качестве модельных молекул-гостей, способных концентрироваться в гидрофобном слое агрегатов, а также продемонстрирован их потенциал в качестве флуоресцентного зонда для изучения процессов агрегации.
ВВЕДЕНИЕ
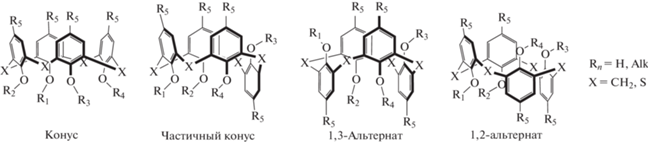
Супрамолекулярная химия, или, как ее еще называют, химия за пределами молекулы, интенсивно развивается вот уже более 30 лет [1]. Используя комбинацию нековалентных взаимодействий, прежде всего водородного связывания, π–π стекинга, а также электростатических взаимодействий, создано множество супрамолекулярных систем для различных применений, а именно – молекулярные машины, хемо/биосенсоры, каталитические системы, средства доставки лекарств и т.д [2–5]. Среди классических представителей базовых молекул – гостей, изучаемых супрамолекулярной химией, помимо традиционных краун-эфиров [6], кукурбитурилов [7], циклодекстринов [8] особое место занимают производные каликс[n]аренов [9–11]. Благодаря своей архитектуре и уникальным химическим свойствам, возможности модификации как нижних фенольных гидроксильных групп, так и ароматических колец, а также разнообразию стереоизомерных форм, которые можно выделять в индивидуальном виде (схема 1 ), именно эти макроциклы полностью соответствуют определению Бомера: “макроциклы с (почти) неограниченными возможностями” [12].
C точки зрения коллоидной химии производные каликс[n]аренов представляют также большой интерес. На их основе можно получать совершенно разнообразные дифильные молекулы, используя как ковалентную модификацию макроциклов необходимыми полярными группами, так и нековалентную, получая так называемые супрамолекулярные дифилы за счет способности макроцикла к взаимодействию по типу гость–хозяин [13]. Двойные системы макроцикл – флуоресцентный краситель представляют собой особый интерес [14–16].
Схема 1 . Стереоизомерные формы производных (тиа)каликс [4]аренов.
Схема 2 . Структуры красителей, обсуждаемых в обзоре, и три типа их совместных конъюгатов с каликсаренами.
Благодаря особой чувствительности флуоресцентных молекул к микроокружению и полярности среды они представляют один из самых лучших молекулярных зондов. В случае производных каликсаренов введение красителя может осуществляться как ковалентно, так и нековалентно внутрь полости макроцикла или же внутрь гидрофобной зоны агрегатов, сформированных макроциклами, если речь идет о дифильных производных (Схема 2, I −III). Среди подобных флуоресцентных красителей наибольшее распространение получили производные ксантеновых красителей флуоренового и флуоронового ряда – родамины (Б, 6Ж, 123), флуоресцеин и эозин Н.
Настоящий обзор посвящен системам на основе производных каликс[n]аренов и красителей и включает в себя как ковалентные конъюгаты, так и нековалентные. Отдельно также рассматривается использование вышеобозначенных красителей в качестве гидрофобных зондов для оценки агрегационных параметров, сорбционной емкости различных коллоидных систем и материалов.
КОВАЛЕНТНО-СВЯЗАННЫЕ СИСТЕМЫ КРАСИТЕЛЬ–КАЛИКСАРЕН
Введение структурных мотивов флуоресцентных красителей открывает новые направления для синтеза различных сенсоров. В литературе больше представлены макроциклические системы, ковалентно связанные с различными производными родамина, что объясняется его высоким квантовым выходом и интенсивной люминесценцией в видимой области спектра. Придание подобным системам водорастворимых свойств является перспективным для биоаналитических целей.
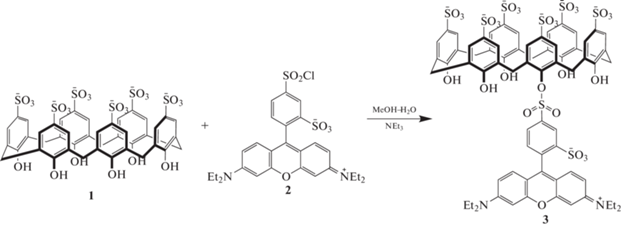
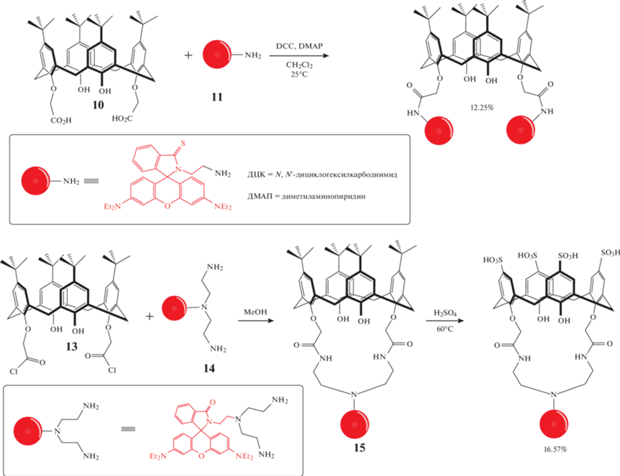
Так, при взаимодействии сульфонатного каликс [6]арена 1 с лиссамин родамин Б сульфонилхлоридом 2 в водно-спиртовом растворе с добавлением триэтиламина был получен лиганд 3 (схема 3 ), способный образовывать стойкий комплекс с катионом ${\text{UO}}_{2}^{{2 + }}$ в присутствии ионов различных металлов. Наличие флуоресцентной метки, длина волны излучения которой смещена в красную область, практически исключает фоновую флуоресценцию примесейвреальных образцах, что является преимуществом дляиспользования микрочипов на основе лиганда3 для определения ионов ${\text{UO}}_{2}^{{2 + }}$ [16].
Схема 3 . Макроциклический лиганд для определения ионов ${\text{UO}}_{2}^{{2 + }}$.
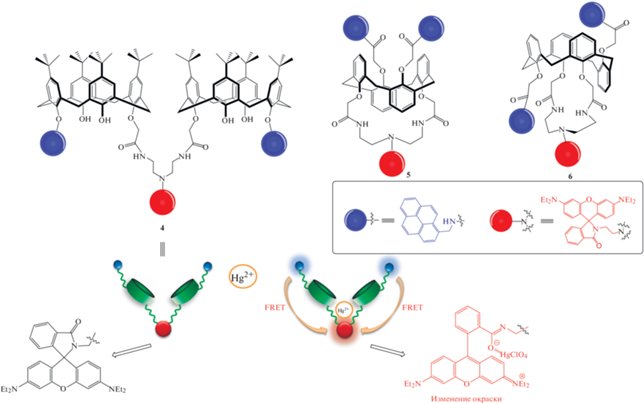
В работах [17, 18] были получены хемосенсоры, работающие на принципе фeрстеровского резонансного переноса энергии (FRET) на основе каликсарена, в структуру которых входит два каликсареновых звена с амидопиренилметильными фрагментами в каждом, соединенных звеном родамина Б в форме спиролактама 4 либо содержащих обе хромофорные группы на одном макроцикле, соответственно 5, 6.
Схема 4 . FRET-хемосенсоры на ионы Hg2+.
В растворах соединений 4–6 катион ртути Hg2+ в присутствии других катионов селективно хелатируется макроциклом, что приводит к раскрытию спиролактамного фрагмента родамина Б и сопровождается розовым окрашиванием раствора. В результате FRET от донора-пирена к акцептору-родамину происходит усиление флуоресценции при λ = 576 нм (схема 4 ).
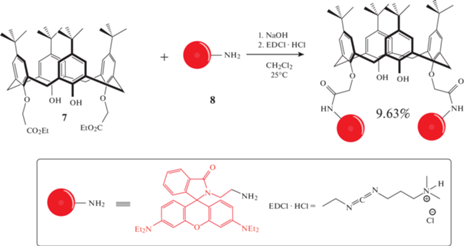
Введение фрагмента родамина Б в структуру каликсарена является распространенным методом получения хемосенсоров на макроциклической платформе. Группой ученых [19] при взаимодействии каликс [4]арена 7 и аминоэтилродамина 8 был получен сенсор 9, содержащий два фрагмента родамина (схема 5 ). За счет образования устойчивого комплекса c Hg2+, которое сопровождается раскрытием спиролактамного цикла и появлением розовой окраски раствора, макроцикл 9 может выступать в качестве визуального хемосенсора.
Схема 5 . Хемосенсор на основе родамина Б.
По такому же принципу построена работа сенсора 12 (схема 6 ), полученного при взаимодействии каликс[4]арена 10 с тиоспиролактамным производным родамина Б 11 [20]. В водном растворе с нейтральным рН макроцикл 12 селективно связывается с ионом Hg2+, что сопровождается изменением цвета раствора с прозрачного до розового и приводит к значительному увеличению интенсивности флуоресценции при λ = 582 нм, что не наблюдается в случае других катионов металлов. По причине своей водорастворимости, он может использоваться в биологических целях для флуоресцентного и визуального определения ионов ртути внутри клеток.
Продолжая исследования в области получения хемосенсоров, способных работать в водных средах, был синтезирован сульфонатный макроцикл 16 (схема 6 ) [21]. Как и в случае вышеописанных производных каликс [4]аренов, данное соединение способно селективно связывать катионы ртути Hg2+, что приводит к значительному росту флуоресценции при λ = 573 нм. Добавление в раствор ионов других металлов подобные изменения в спектрах излучения не вызывает.
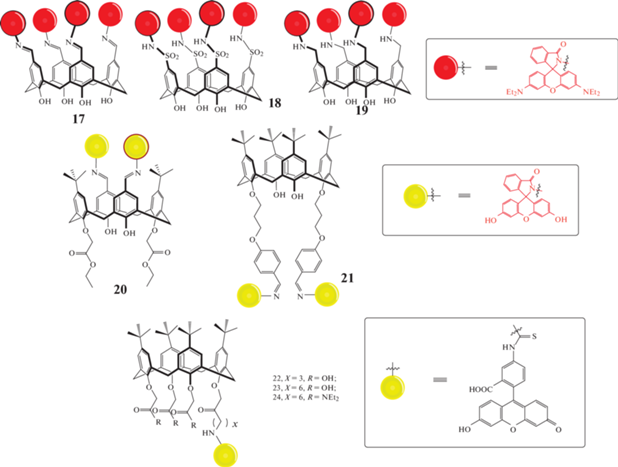
В работе [22] исследователями были получены производные каликс[4]аренов 17–19 (схема 7 ). При изучении способности связывания их с различными катионами щелочных, щелочноземельных и переходных металлов, как и ожидалось, была обнаружена селективность в отношении Hg2+, причем наибольшее увеличение эмиссии при λ = 588 нм продемонстрировал каликсарен 18, чуть менее интенсивный отклик был у имин-производного каликсарена 17, а макроцикл 19 продемонстрировал лишь небольшое увеличение интенсивности флуоресценции. Дальнейшие исследования показали, что чувствительность этих сенсоров составляет 3–5 нмоль/л. Помимо этого, макроциклы 17 и 18 обладают высокой клеточной проницаемостью и низкой цитотоксичностью, поэтому могут быть использованы для анализа, отслеживания и визуализации Hg2+ в живых системах.
Схема 6 . Хемосенсоры на ионы Hg2+ на основе тиоспиролактама родамина Б и конъюгата спиролактама родамина Б с сульфонатным каликс[4]ареном.
Объединение каликсареновых систем с флуоресцеином также является перспективным направлением для синтеза хемосенсоров на различные ионы. В работе [23] были синтезированы два макроцикла 20–21 (схема 7 ), в структуру которых входят флуоресцеиновые фрагменты, закрепленные либо на верхнем, либо на нижнем ободе. Было обнаружено, что оба каликсарена 20–21 способны селективно связывать ионы Cu2+, однако каликсарен 21 проявляет более значительный флуоресцентный отклик в сравнении с соединением 20, позволяя определять ионы Cu2+ в наномолярном диапазоне. В присутствии ионов Cu2+ растворы макроциклов 20–21 окрашиваются в желтый (в ацетонитриле) или в розовый (в смеси ацетонитрил–вода) цвета.
Преимущество введения структурного мотива флуоресцеина в макроциклическую системы обусловлено его коммерческой доступностью, а также его способность к возбуждению видимой частью электромагнитного спектра. Исследователями [24] был впервые синтезирован ряд производных п-трет-бутил-каликс [4]арена 22–24, содержащих фрагменты флуоресцеина в открытой форме (схема 7 ). Обнаружено, что полученные макроциклы способны координировать ионы Nd3+ и Er3+. Было показано, что лантаноиды проявляют более интенсивную люминесценцию в ближнем ИК-диапазоне за счет переноса энергии при возбуждении фрагмента флуоресцеина. Наибольшая интенсивность люминесценции наблюдалась у комплекса Nd3+ с макроциклом 22, имеющим более короткий спейсер, вероятно, в результате более эффективного взаимодействия и, следовательно, более короткого расстояния между карбоксильной группой флуоресцеинового фрагмента и иона Nd3+. Время жизни этих комплексов оказалось относительно велико для органических комплексов ионов лантаноидов, люминесцирующих в ближней ИК области: до 1.23–1.26 мс для комплексов Nd3+ и 1.63–1.71 мс для комплексов Er3+, растворенных в ДМСО. Таким образом, люминесценция лантаноидов в ближней ИК-области может быть сенсибилизирована за счет введения фрагмента флуоресцеина в структуру макроцикла.
Схема 7 . Производные каликс[4]арена, содержащие четыре фрагмента родамина Б, а также два/один фрагмент флуоресцеина.
НЕКОВАЛЕНТНО-СВЯЗАННЫЕ СИСТЕМЫ КРАСИТЕЛЬ–КАЛИКСАРЕН
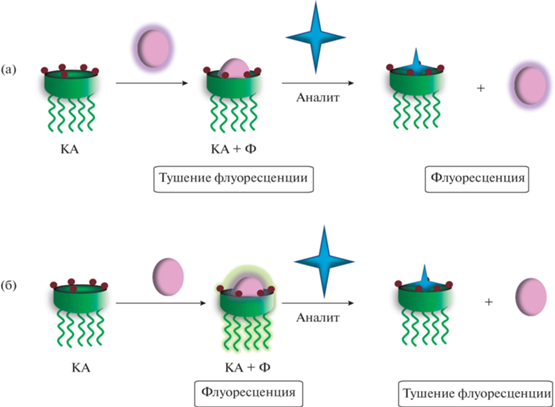
За счет своего пространственного строения каликсарены способны образовывать устойчивые ковалентные комплексы типа “гость–хозяин” как с нейтральными, так и с заряженными молекулами. Эта особенность часто применяется при дизайне хемосенсоров, принцип работы которых основан на вытеснении красителя (схема 8 ). На первом этапе происходит образование агрегатов с флуоресцентными красителями (КА + Ф). В зависимости от выбранных макроциклов и флуорофоров происходит либо тушение флуоресценции (А), либо наоборот, образование флуоресцирующего агрегата (Б). Далее, при введении аналита, который способен образовывать более устойчивый комплекс с супрамолекулярным хозяином, происходит вытеснение красителя из полости макроцикла, что сопровождается флуоресцентым откликом. Таким образом, могут быть получены сенсоры, позволяющие флуориметрически детектировать молекулы самого различного строения.
В работе [25] было показано, что родамин Б может быть включен в полость сульфонатных каликс[n]аренов 25 а–с (n = 4, 6, 8), что сопровождается батохромным сдвигом и тушением флуоресценции (схема 9 ). При добавлении ацетилхолина, который также способен связываться с каликсаренами, наблюдается вытеснение красителя из полости, и флуоресценция восстанавливается. Также отмечается, что константа комплексообразования Ка возрастает на два порядка с увеличением размера полости макроцикла. Таким образом, супрамолекулярный комплекс сульфонатного каликсарена с родамином Б может выступать в качестве хемосенсора на ацетилхолин.
Схема 8 . Хемосенсоры, работающие за счет конкурентного вытеснения красителя.
Схема 9 . Флуоресцентный сенсор на ацетилхолин.
Позже было показано [26], что сульфонат-замещенный по верхнему ободу каликс[4]арен 25 а связывается в водных растворах с молекулой родамина Б в стехиометрическом соотношении 1 : 1, образуя стабильные комплексы (Ka/M–1 = 1090 ± 45). Однако стабильность значительно уменьшается при добавлении МеОН за счет снижения ион-дипольных и электростатических взаимодействий или при увеличении ионной силы (NaCl) по причине конкурирующих процессов связывания с макроциклом.
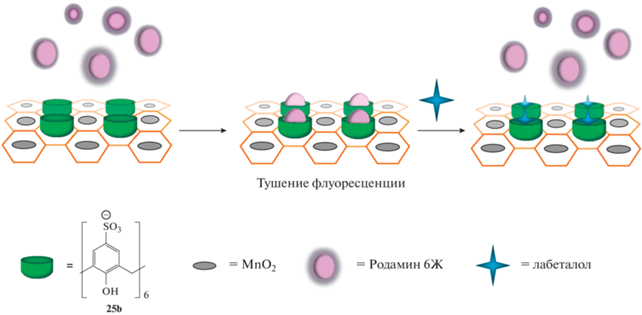
Объединение способности каликсаренов к молекулярному распознаванию и свойств графена к тушению флуоресценции за счет фeрстеровского переноса энергии открыло пути к синтезу гибридных материалов, способных детектировать и визуализировать различные молекулы. Так, из композита MnO2@RGO, состоящего из диоксида марганца MnO2, восстановленного оксида графена RGO и водорастворимого п-сульфонаткаликс [6]арена 25 b был получен чувствительный FRET-рецептор на известный β-адреноблокатор лабеталол (схема 10 ) [27]. При попадании родамина 6Ж в полость макроцикла его флуоресценция тушится за счет действия MnO2@RGO. Молекулы лабеталола вытесняют родамин из полости за счет образования более устойчивого комплекса “гость–хозяин”, что приводит к флуоресцентному отклику. Отмечается, что данный сенсор способен к распознаванию мишени в присутствии других схожих молекул (атенолола и метопролола), а также различных ионов.
Схема 10 . FRET-хемосенсор на лабеталол.
Аналогичным образом работает сенсор на ресвератрол (антиоксидант природного происхождения) [28]. Комплекс нанесенного сульфонаткаликс [6]арена 25b на подложку восстановленного оксида графена RGO способен связывать молекулы родамина 123 и родамина Б, в результате чего происходит тушение флуоресценции. При добавлении ресвератрола происходит конкурирующий процесс связывания, в результате чего молекулы красителей покидают полость макроцикла, что сопровождается увеличением интенсивности флуоресценции. Данный метод продемонстрировал высокую селективность и чувствительность при исследовании содержания ресвератрола в составе красного вина, но может быть распространен и на изюм, желе, соки и др.
Способность каликсаренов к молекулярному распознаванию также может быть дополнена люминесцентными свойствами лантаноидов. В работе [29] были получены наночастицы LaF3, легированные тербием, поверхность которых была функционализирована п-сульфонатокаликс[4]аренами 25a, d, e (схема 11 ). В качестве рецептора выступал макроцикл 25 е, продемонстрировавший по сравнению с соединениями 25a и 25d наибольшее сродство к наночастицам Tb.
Схема 11 . Гибридные наночастицы, модифицированные внешнесферным комплексом каликс[4]арена с родамином 6Ж.
Взаимодействие модифицированных каликсареном наночастиц Tb с родамином 6Ж сопровождалась сильным фотосенсибилизирующим эффектом, приводящим к длительной эмиссии родамина 6Ж при возбуждении каликсарен-модифицированных наночастиц (схема 11 ). Эффективность FRET-процесса составила 87–90%, что указывает на очень близкое расположение родамина 6Ж к поверхности наночастиц (28–32 Å).
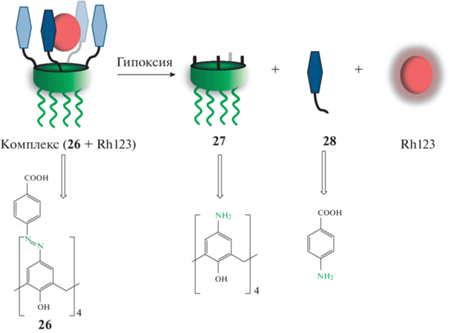
Как уже было сказано ранее, взаимодействие “гость–хозяин” является распространенным принципом, на основе которого работают самые различные макроциклические сенсоры. Так, в работе [30] супрамолекулярный комплекс азокаликс[4]арена 26 с родамином 123 используется для визуализации гипоксии (схема 12 ). При добавлении к раствору комплекса избытка дитионита натрия Na2S2O4, химического аналога азоредуктазы, происходит восстановление азогруппы, что подтверждается исчезновением в УФ-видимом спектре полосы поглощения азогруппы и сопровождается обесцвечиванием раствора. При этом происходит образование п-амино-каликсарена, п-амино-бензойной кислоты и высвобождение молекулы красителя, благодаря чему происходит восстановление флуоресценции родамина. Таким образом, комплекс азозамещенного макроцикла и флуоресцентного красителя может быть использован в качестве визуализации гипоксии в живых клетках.
Схема 12 . Супрамолекулярный комплекс для визуализации гипоксии.
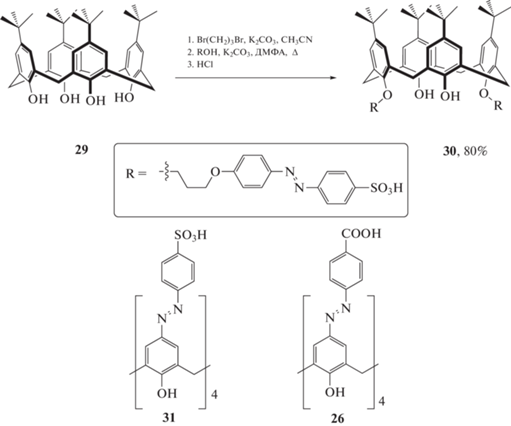
В продолжение тематики, был впервые синтезирован каликс[4]арен 30, содержащий азогруппы на нижнем ободе (схема 13 ) [31].
Схема 13 . Структуры азо-каликс[4]аренов, использованных в качестве систем для визуализации гипоксии.
Для оценки влияния положения азо-фрагмента на процесс комплексообразования с производными флуоресцеина были также получены каликс[4]арены 26, 31, содержащие азо-фрагменты на верхнем ободе. При добавлении к растворам родамина Б, родамина 6Ж и родамина 123 в натрий-фосфатном буфере растворов макроциклов 26, 30, 31 наблюдалось тушение флуоресценции, вызванное фотоиндуцированным переносом энергии. Сравнение констант устойчивости комплексов каликсаренов 26, 30, 31 и производных родамина показало, что наиболее стабильные комплексы образуются в случае сульфонат-производного 31, а наименее стабильные – в случае карбоксилат-замещенного 26, что может быть объяснено более интенсивным электростатическим взаимодействием в случае SO3H-заместителя. Последующее восстановление азогруппы при добавлении Na2S2O4 подтверждалось изменением в УФ-видимых спектрах, изменением окраски раствора и ростом флуоресценции за счет высвобождения красителя. Однако, методом масс-спектроскопии высокого разрешения было показано, что дитионит натрия помимо восстановления азо-фрагментов способен восстанавливать Rh 123 и Rh 6G до неокрашенных лейко-форм, в результате чего после высвобождения красителя происходит значительное снижение интенсивности флуоресценции.
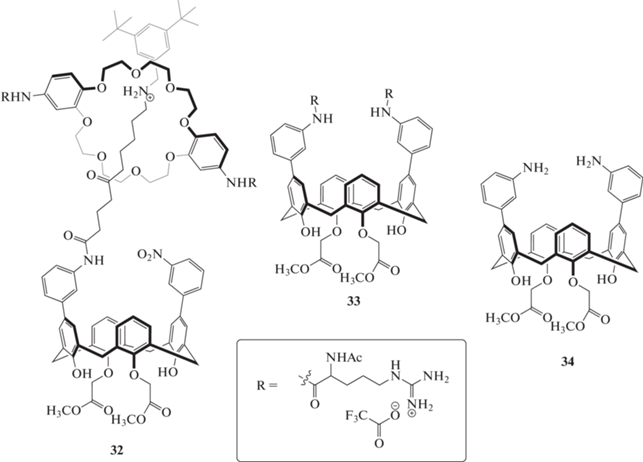
Помимо супрамолекулярных систем каликсаренов с производными родамина, в литературе также представлено достаточное количество примеров супрамолекулярных комплексов с флуоресцеином и эозином Н. В работе [32] были впервые получены [2]ротаксан 32, в котором одна из блокирующих групп была замещена на каликс [4]арен, каликс [4]арен 33 с фрагментами аргинина в качестве элементов распознавания, а также каликс [4]арен 34 с аналогичным строением макроцикла, но без фрагментов аргинина (схема 14 ). Было обнаружено, что самые устойчивые комплексы с флуоресцеином образует ротаксан (Кa (32 + флуоресцеин) = (470 ± 80) × 10–4 М–1). Примечательно, что незамещенный макроцикл 34 продемонстрировал более высокие значения констант ассоциации, по сравнению с аргинин-замещенным. Это может объясняться тем, что заместители для соединения 33 были выбраны неудачно, так как они блокируют полость каликсарена и тем самым препятствуют комплексообразованию с различными молекулами.
Схема 14 . Структуры рецепторов на основе каликс[4]аренов, образующих супрамолекулярные комплексы с флуоресцеином.
Двухкомпонентные системы, состоящие из флуоресцентного красителя и макроциклической платформы, могут использоваться для распознавания ионов металлов. Так, в работе [33] авторами получен комплекс п-сульфонатокаликс [4]арена 25 a и флуоресцеина. Добавление к раствору флуоресцеина раствора макроцикла сопровождается снижением флуоресценции за счет образования комплекса, как в отсутствие, так и в присутствии ионов Cu2+. Однако в тройной системе в присутствии Cu2+ наблюдается кооперативность связывания, что проявляется в увеличении констант: Ка (25 a + флуоресцеин) = 1.95 × 104 M–1, Kа (25 a + флуоресцеин + Cu2+) = 5.89 × 104 M–1.
Ряд работ посвящен исследованию агрегатов гуанидин-модифицированного по верхнему ободу каликс [5]арена 35 с различными флуоресцентными красителями (схема 15 ). Было показано [34], что соединение 35 способно образовывать устойчивые комплексы с флуоресцеином, эозином и бенгальским розовым, что сопровождается тушением флуоресценции за счет фотоиндуцированного переноса энергии. Сдвигов полос поглощения при этом не наблюдалось, а стехиометрическое соотношение макроцикл: краситель составило 1 : 1.
Схема 15 . Гуанидиний-содержащий рецептор, образующий комплексы с флуоресцеином и его производными.
Конъюгат гуанидин-каликс [5]арена 35 и флуоресцеина был успешно применен для визуализации и количественного анализа триметиламин N-оксида – метаболита кишечной микрофлоры, важного для диагностики таких заболеваний, как атеросклероз, тромбоз и колоректальный рак [35] и пиродоксаль-5'-фосфата – биомаркера высокометаболических раковых клеток [36]. В обоих случаях система работала за счет вытеснения красителя благодаря большему сродству макроцикла к аналиту. Наблюдаемый флуоресцентный отклик позволяет обнаруживать различные биомаркеры в режиме реального времени, что является бесспорным преимуществом в сравнении с другими методами.
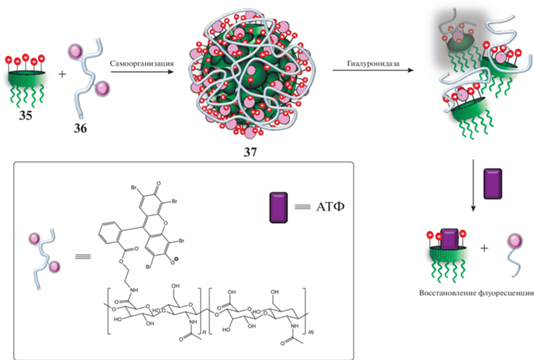
Молекулы гуанидин-каликсарена 35 способны образовывать мицеллы полиионного комплекса 37 с эозин-производным гиалуроновой кислоты 36 (схема 16 ) за счет взаимодействий по типу “гость–хозяин” между полостью макроцикла и эозином, а также ионной связи между гуанидиновыми и карбоксильными группами размером 109 нм [37]. Под действием фермента гиалуронидазы происходит нарушение супрамолекулярной сборки, а при добавлении АТФ за счет конкурентно протекающего процесса связывания высвобождаются молекулы красителя. Таким образом была получена система для визуализации АТФ и гиалуронидазы, которые являются биомаркерами опухолей, что является перспективным направлением для биомедицинской химии.
Схема 16 . Сенсор для определения АТФ и гиалуронидазы.
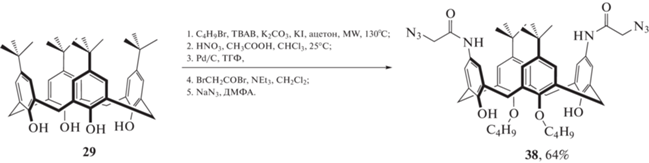
Нашей исследовательской группой был получен новый каликс[4]арен 38 в стереоизомерной форме “конус” (схема 17 ), содержащий азидацетамидные группы по верхнему ободу [38]. Было показано, что данный макроцикл способен образовывать устойчивый комплекс с эозином Н в стехиометрическом соотношении 1 : 2 (38 : эозин Н), что сопровождается значительным тушением флуоресценции.
Схема 17 . Диазидокаликс [4]арен, способный образовывать комплексы с эозином Н.
КОЛЛОИДНЫЕ СИСТЕМЫ КРАСИТЕЛЬ–КАЛИКСАРЕН
Способность каликсаренов к самоорганизации открывает возможности для создания на их основе функциональных коллоидных систем, работающих в водных средах, которые в свою очередь могут быть использованы и для аналитических целей, и для создания средств доставки лекарственных препаратов, и для получения нанореакторов для мицеллярного катализа в воде и т.д. Введение ксантеновых красителей в такие системы позволяет определить структурные особенности полученных коллоидных систем благодаря сольватохромному эффекту, возникающему при попадании красителей в гидрофобный слой агрегатов, а коллоидные системы, насыщенные красителем, также могут применяться для аналитических целей, используя ранее продемонстрированный принцип вытеснения красителя при перестроении/разрушении агрегатов, либо для флуоресцентного трекинга полученных коллоидных систем.
Большое значение для построения подобных систем имеют дифильные каликсарены. Так, в нашей группе с использованием клик-химии были получены новые дифильные производные каликс [4]арена 39–40 [39], содержащие два или четыре диэтилентриаминовых фрагмента на верхнем ободе, способные образовывать в водных растворах устойчивые везикулярные агрегаты, средние гидродинамические диаметры которых составляют 150–200 нм (схема 18 ).
Схема 18 . Хемосенсоры на АДФ на основе аминомодифицированных каликс [4]аренов.
Показано, что полученные макроциклы способны взаимодействовать с эозином Н. При концентрациях ниже критической концентрации агрегации (ККА) соединения 39 образуют комплексы в соотношении 1 : 1 за счет электростатических взаимодействий с ионизированными аминогруппами верхнего обода макроцикла. При увеличении концентрации и последующей агрегации макроцикла часть красителя адсорбируется в гидрофобный слой агрегатов, о чем свидетельствует и стехиометрия эозин Н : 39 3 : 2. Макроциклы 40 при концентрациях ниже ККА образуют агрегаты в соотношении 2 : 1 (эозин Н : 40), а при концентрациях выше ККА происходит изменение стехиометрии до 7 : 3 (эозин Н : 40 а) и 4 : 1 (эозин Н : 40b). Таким образом, более липофильный макроцикл 40b способен связывать большее количество красителя в гидрофобном слое агрегатов. На основе этих макроциклов были разработаны сенсоры для распознавания и визуализации аденинсодержащих нуклеотидов, построенные на принципе конкурентного вытеснения эозина Н из агрегатов макроциклов (схема 18 ). Было также отмечено, что дизамещенные каликсарены 39a, b связывают менее заряженные АДФ более эффективно, чем АТФ В результате, на основе соединения 39 b были получены ковалентно связанные полидиацетиленовые везикулы 41 для селективного колориметрического обнаружения молекул АДФ.
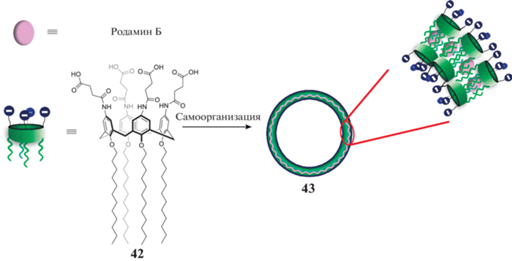
Итальянскими учеными [40] был получен дифильный каликс[4]арен 42 с четырьмя карбоксильными группами на верхнем ободе и четырьмя додецильными заместителями на нижнем (схема 19 ). Было показано, что в водных растворах молекулы макроцикла 42 образуют дискретные и стабильные наночастицы в форме везикулы 43 с многослойной стенкой. Данные везикулы способны адсорбировать родамин Б. Поскольку не были зафиксированы значительные изменения дзета-потенциала после инкапсуляции красителя, авторы исключают значительные электростатические взаимодействия между катионным красителем и анионной поверхностью карбоксилатных фрагментов. Для подтверждения присутствия красителя в бислое везикул к образцу добавляли 0.2% тритона X-100. В результате происходило разрушение везикул и высвобождение родамина Б, что сопровождалось усилением флуоресценции. Аналогично родамину Б, везикулы способны связывать и куркумин. Инкапсуляция куркумина позволила увеличить как его растворимость в воде, так и его химическую стабильность, что важно для медицинских целей.
Схема 19 . Адсорбция родамина Б везикулами на основе тетра-карбокси производного каликс [4]арена.
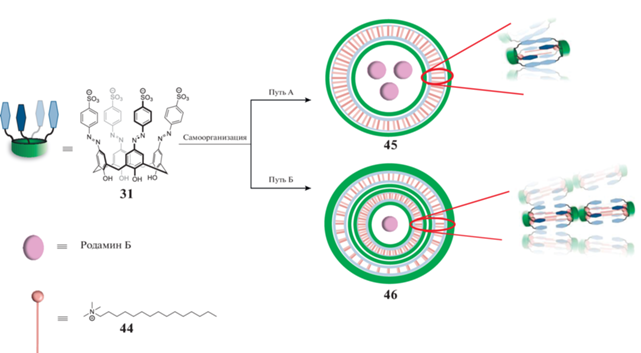
Исследования показали [41], что для совместной доставки биологически активных гидрофобных и гидрофильных соединений может быть использована система азабензокаликс[4]арена 31 и катионного ПАВ – цетилтриметиламмония бромида 44 (ЦТАБ, схема 20 ). Было обнаружено, что добавление молекул ЦТАБ к водному раствору макроцикла приводит к образованию смешанных агрегатов, форма которых зависит от стехиометрического соотношения ЦТАБ : 31. При соотношении 1 : 1 образуются однослойные везикулы 45 (путь А), а при увеличении концентрации ПАВ в три раза происходит расширение везикулы с образованием мультиламеллярной структуры 46 (путь Б). Данная система может выступать в качестве наноконтейнеров как для гидрофобных (на примере красителя Судана I), так и для гидрофильных молекул (на примере родамина Б). Во втором случае флуоресцентным методом была показана зависимость размера везикулы от количества инкапсулированного красителя − чем больше бислоев, тем меньше молекул родамина Б способны связываться мицеллами. Способность везикул (31 + ЦТАБ) связываться с гидрофобными и гидрофильными субстратами позволяет использовать подобные системы в качестве наноконтейнеров для доставки лекарственных средств.
Схема 20 . Однослойные и многослойные везикулы на основе сульфонатного аза-каликс[4]арена, способные инкапсулировать гидрофобные и гидрофильные красители.
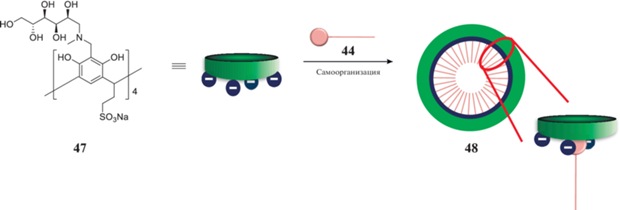
Введение молекул ЦТАБ в водные растворы N-метил-D-глюкамин-каликс[4]резорцина 47 в эквимолярном соотношении (схема 21 ) приводит к образованию везикул с гидрофобной полостью, способных инкапсулировать молекулы родамина Б [42]. Исследование биологической активности макроцикла 47, ЦТАБ (44) и их агрегатов показало, что каликсрезорцин, в отличие от ЦТАБ, обладает наименьшей токсичностью по отношению к клеткам микроорганизмов и эритроцитам, однако комбинация каликсрезорцина с ПАВом не приводит к уменьшению токсичности последнего.
Схема 21 . Самоорганизация супрамолекулярных дифилов на основе сульфонатного каликс[4]резорцина и ЦТАБ.
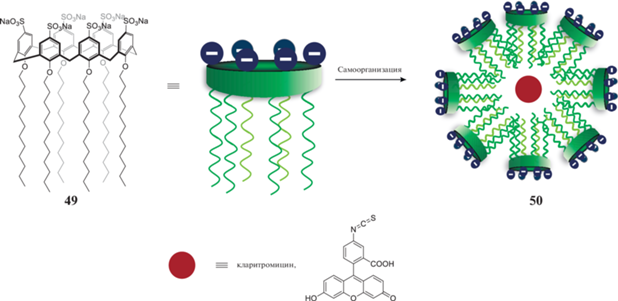
Дифильные производные каликс[6]аренов также могут выступать в качестве прекурсоров для получения наноконтейнеров [43]. Было показано, что п-сульфонаткаликс [6]арен 49 (схема 22 ) способен самоорганизовываться в полидисперсные наноструктуры со средним диаметром 136 нм и поверхностным зарядом –49 мВ, адсорбируя гидрофобные молекулы, такие как флуоресцеин-изотиоцианат или кларитромицин. При исследовании биологической активности агрегата каликсарена и кларитромицина было обнаружено усиление антибактериальной активности.
Схема 22 . Адсорбция различных молекул агрегатами сульфонатокаликс[6]арена.
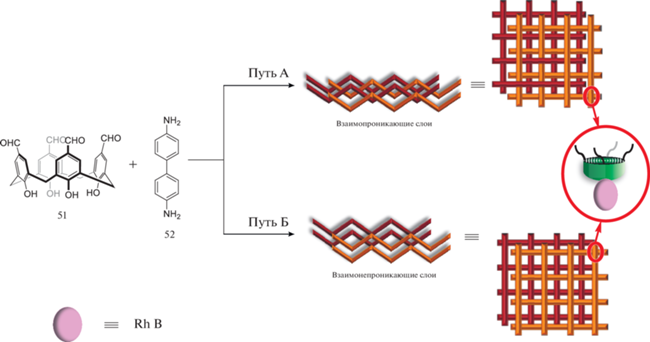
Недавно было продемонстрировано использование каликсаренов для получения ковалентно-связанных пористых органических каркасов [44]. Была впервые синтезирована периодическая двумерная органическая сеть каликс[4]аренов, соединенных линейным бензидиновым линкером через динамические иминные связи (схема 23 ). При конденсации исходных соединений 51 и 52 двумя различными способами были получены две разные структуры. Более концентрированная реакционная смесь приводила к образованию взаимопроникающих кристаллических каркасов (путь А), а из более разбавленных смесей получали взаимонепроникающие (путь Б). Оба типа каркаса за счет поверхностного отрицательного заряда каликсаренов, обусловленного депротонированием свободных гидроксильных групп при рН 7.0, способны селективно связывать положительно заряженные красители, что было показано на примере родамина Б.
Схема 23 . Связывание родамина Б ковалентно-связанными пористыми органическими каркасами.
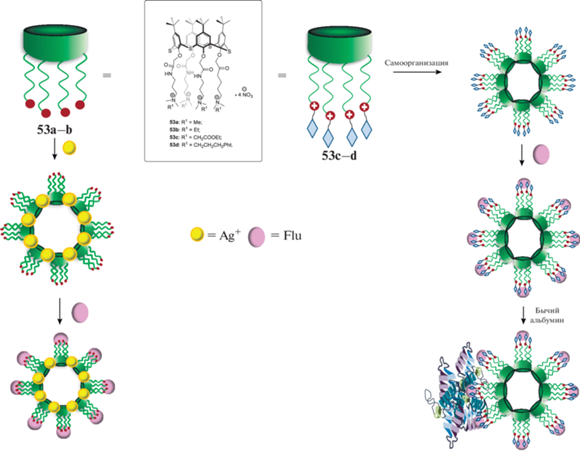
Дифильные п-трет-бутилтиакаликс [4]арены, содержащие четвертичные аммониевые фрагменты по нижнему ободу (схема 24 ), также способны к самоассоциации [45]. Интересно отметить, что способны к агрегации лишь макроциклы, содержащие объемные заместители при атоме азота 53c–d, в случае же макроциклов с небольшими заместителями 53a–b для формирования агрегатов необходимо добавление нитрата серебра. Полученные из 53a–b агрегаты способы связываться с молекулами флуоресцеина, а агрегаты, полученные из макроциклов 53c–d, эффективно взаимодействуют с бычьим альбумином. Таким образом, на основе этих соединений могут быть получены как сенсоры с флуоресцентной меткой, так и наноконтейнеры для доставки лекарств с использованием транспортного белка.
Схема 24 . Связывание флуоресцеина и БСА агрегатами на основе аммонийных тиакаликс[4]аренов.
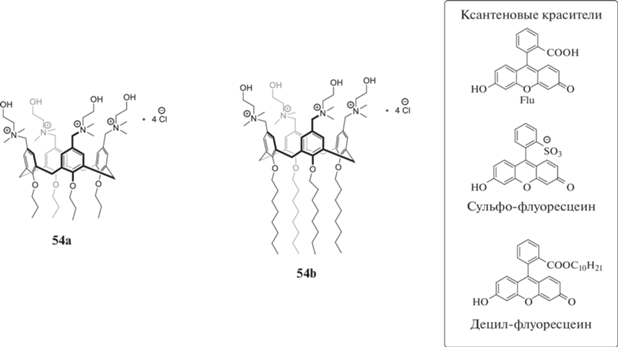
Каликс [4]арены 54a, b, содержащие аммонийные группы, также способны образовывать в воде стабильные агрегаты [46 ] . При изучении их совместной агрегации с некоторыми производными флуоресцеина (схема 25 ) было обнаружено, что длина алкильного заместителя каликсарена имеет существенное влияние на агрегацию. Макроцикл 54b способен образовывать более крупные агрегаты с значительно более низким значением ККА по сравнению с 54a, напоминая по своим агрегационным характеристикам обычный катионный ПАВ – цетилпиридиния хлорид. Образование агрегатов существенным образом влияет на спектры поглощения флуоресцеиновых красителей, что демонстрирует широкие возможности использования ксантеновых красителей не только для создания аналитических хемосенсоров, но и для изучения процессов агрегации в водных средах.
Схема 25 . Структуры производных флуоресцина, используемых для изучения агрегации аммонийных каликс[4]аренов.
ЗАКЛЮЧЕНИЕ
В обзоре рассмотрены опубликованные в последние годы примеры систем с участием производных каликсаренов и родственных структур с ксантеновыми красителями флуоренового и флуоронового ряда. Продемонстрированы системы, построенные как за счет ковалентной иммобилизации красителя, так и за счет супрамолекулярных взаимодействий. Показано, что флуоресцентные красители вкупе с производными каликсаренов могут быть использованы и как хемосенсоры на различные молекулы, включая важные метаболиты, и как модельные соединения для изучения сорбции молекул в создании коллоидных средств доставки, и как молекулярные зонды для изучения процессов агрегации в коллоидных системах.
Список литературы
Amabilino D.B., Gale P.A. Supramolecular chemistry anniversary // Chem. Soc. Rev. 2017. V. 46. P. 2376–2377.
Webber M.J., Appel E.A., Meijer E.W. et al. Supramolecular biomaterials // Nat. Mater. 2016. V. 15. P. 13–26.
Ma X., Zhao Y. Biomedical applications of supramolecular systems based on host−guest interactions // Chem. Rev. 2015. V. 115. P. 7794–7839.
Guo Ch., Sedgwick A.C., Hirao T. et al. Supramolecular fluorescent sensors: an historical overview and update // Coord. Chem. Rev. 2021. V. 427. P. 213560.
Cao X., Gao A., Hou J.-T. et al. Fluorescent supramolecular self-assembly gels and their application as sensors: a review // Coord. Chem. Rev. 2021. V. 434. P. 213792.
Pedersen C.J. The discovery of crown ethers (Noble lecture) // Angew. Chem. Int. Ed. 1988. V. 27. № 8. P. 1021–1027.
Martin Del Valle E. M. Cyclodextrins and their uses: a review // Process Biochem. 2004. V. 39. № 9. P. 1033–1046.
Barrow S.J., Kasera S., Rowland M.J. et al. Cucurbituril-based molecular recognition // Chem. Rev. 2015. V. 115. № 22. P. 12320–12406.
Jiang C., Song Zh., Yu L. et al. Fluorescent probes based on macrocyclic hosts: construction, mechanism and analytical applications // TrAC – Trends Anal. Chem. 2020. V. 133. P. 116086.
Wang J., Ding X., Guo X. Assembly behaviors of calixarene-based amphiphile and supra-amphiphile and the applications in drug delivery and protein recognition // Adv. Colloid Interface Sci. 2019. V. 269. P. 187–202.
Соловьева С.Е., Бурилов В.А., Антипин И.С. Производные тиакаликс[4]арена по нижнему ободу: синтез и супрамолекулярные свойства // Макрогетероциклы. 2017. Т. 10. № 2. С. 134–146.
Bohmer V. Calixarenes, Macrocycles with (Almost) Unlimited Possibilities // Angew. Chem. Int. Ed. 1995. V. 34. № 7. P. 713–745.
Антипин И.С., Алфимов М.В., Бурилов В.А. и др. Функциональные супрамолекулярные системы: дизайн и области применения // Успехи химии. 2021. Т. 90. № 8. С. 895–1107.
Wong J.K.-H., Todd M.H., Rutledge P.J. Recent Advances in Macrocyclic Fluorescent Probes for Ion Sensing // Molecules. 2017. V. 22. № 2. P. 200–228.
Kumar R., Sharma A., Singh H. et al. Revisiting fluorescent calixarenes: from molecular sensors to smart materials // Chem. Rev. 2019. V. 119. № 16. P. 9657–9721.
Lu Q., Callahan J.H., Collins G.E. The selective detection of uranium(VI) on a microchip using a derivatized 4-sulfonic calix[6]arene // Chem. Commun. 2000. V. 2000. № 19. P. 1913–1914.
Othman A.B., Lee J.W., Wu J.-Sh. et al. Calix[4]arene-based, Hg2+-induced intramolecular fluorescence resonance energy transfer chemosensor // J. Org. Chem. 2007. V. 72. № 20. P. 7634–7640.
Lee Y.H., Lee M.H., Zhang J.F. et al. Pyrene excimer-based calix[4]arene FRET chemosensor for mercu-ry(II) // J. Org. Chem. 2010. V. 75. № 21. P. 7159–7165.
Chinta J.P., Dessingou J., Rao C.P. Synthesis, characterization and ion recognition studies of lower rim 1,3-di{rhodamine} conjugate of calix[4]arene // J. Chem. Sci. 2013. V. 125. № 6. P. 1455–1461.
Anandababu A., Anandan S., Ashokkumar M. A Simple discriminating p-tert-butylcalix[4]arene thiospirolactam rhodamine B based colorimetric and fluorescence sensor for mercury ion and live cell imaging applications // ChemistrySelect. 2018. V. 3. № 16. P. 4413–4420.
Bhatti A.A., Oguz M., Yilmaz M. New water soluble p-sulphonatocalix[4]arene chemosensor appended with rhodamine for selective detection of Hg2+ ion // J. Mol. Struct. 2020. V. 1203. P. 127436.
Yilmaz B., Keskinates M., Bayrakci M. Novel integrated sensing system of calixarene and rhodamine molecules for selective colorimetric and fluorometric detection of Hg2+ ions in living cells // Spectrochim. Acta A Mol. Biomol. Spectrosc. 2021. V. 245. P. 118904.
Chawla H.M., Shukla R., Pandey S. Novel fluorescein appended calix[4]arenes for preferential recognition of Cu2+ ions // Tetrahedron Lett. 2013. V. 54. № 16. P. 2063–2066.
Oude Wolbers M.P., van Veggel F.C.J.M., Peters F.G.A. et al. Sensitized near-infrared emission from Nd3+ and Er3+ complexes of fluorescein-bearing calix[4]arene cages // Chem. Eur. J. 1998. V. 4. № 4. P. 772–780.
Zhang Y.-J., Cao W.-X., Xu J. Interaction of sulfonated calix[n]arenes with rhodamine b and its application to determine acetylcholine in a real neutral aqueous medium // Chin. J. Chem. 2002. V. 20. № 4. P. 322–326.
Liu Y., Li C.-J., Guo D.-S. et all. A comparative study of complexation of β-cyclodextrin, calix[4]arenesulfonate and cucurbit[7]uril with dye guests: fluorescence behavior and binding ability // Supramol. Chem. 2007. V. 19. № 7. P. 517–523.
Ye H., Yang L., Zhao G. A FRET-based fluorescent approach for labetalol sensing using calix[6]arene functionalized MnO2@graphene as a receptor // RSC Adv. 2016. V. 6. № 83. P. 79350–79360.
Li C.-P., Tan S., Ye H. et al. A novel fluorescence assay for resveratrol determination in red wine based on competitive host-guest recognition // Food Chem. 2019. V. 283. P. 191–198.
Cheignon C., Heurté M., Knighton R.C. Investigation of the supramolecular assembly of luminescent lanthanide nanoparticles surface functionalized by p-sulfonato-calix[4]arenes with charged aromatic compounds // Eur. J. Inorg. Chem. 2021. V. 2021. № 36. P. 3761–3770.
Geng W.-C., Jia S., Zheng Z. et al. A noncovalent fluorescence turn-on strategy for hypoxia imaging // Angew. Chem. Int. Ed. 2019. V. 58. № 8. P. 2377–2381.
Mironova D.A., Burilov V.A., Galieva F.B. et al. Azocalix[4]arene-rhodamine supramolecular hypoxia-sensitive systems: a search for the best calixarene hosts and rhodamine guests // Molecules. 2021. V. 26. № 18. P. 5451.
Smukste I., House B.E., Smithrud D.B. Host-[2]rotaxane: advantage of converging functional groups for guest recognition // J. Org. Chem. 2003. V. 68. № 7. P. 2559–2571.
Gawhale S., Jadhav A., Rathod N. et al. Inclusion complex formation of ternary system: Fluoroscein-p-sulfonato calix[4]arene-Cu2+ by cooperative binding // Spectrochim. Acta A Mol. Biomol. Spectrosc. 2015. V. 148. P. 382–388.
Wang Y.-Y., Kong Y., Zheng Z. et al. Complexation of a guanidinium-modified calixarene with diverse dyes and investigation of the corresponding photophysical response // Beilstein J. Org. Chem. 2019. V. 15. P. 1394–1406.
Yu H., Geng W.-C., Zheng Z. et al. Facile Fluorescence Monitoring of Gut Microbial Metabolite Trimethylamine N-oxide via Molecular Recognition of Guanidinium-Modified Calixarene // Theranostics. 2019. V. 9. № 16. P. 4624–4632.
Yue Y.-X., Kong Y., Yang F. et al. Supramolecular tandem assay for pyridoxal-5′-phosphate by the reporter pair of guanidinocalix[5]arene and fluorescein // ChemistryOpen. 2019. V. 8. № 12. P. 1437–1440.
Gao J., Yu H., Chen F.-Y. et al. A hyaluronidase/ATP tandem stimuli-responsive supramolecular assembly // Chem. Commun. 2019. V. 38 № 55. P. 14387–14390.
Бурилов В.А., Фатыхова Г.А., Миронова Д.А. и др. Новые амфифильные чашеобразные рецепторы на основе каликс[4]аренов в конформации конус: синтез, самоагрегация и связывание красителя эозина Y // Макрогетероциклы. 2015. V. 8. № 4. P. 409–414.
Burilov V.A., Fatikhova G.A., Dokuchaeva M.N. et al. Synthesis of new p-tert-butylcalix[4]arene-based polyammonium triazolyl amphiphiles and their binding with nucleoside phosphates // Beilstein J. Org. Chem. 2018. V. 14. P. 1980–1993.
Granata G., Consoli G.M.L., Lo Nigro R. et all. Supramolecular assembly of a succinyl-calix[4]arene derivative in multilamellar vesicles // Supramol. Chem. 2016. V. 28. № 5–6. P. 377–383.
Кашапов Р.Р., Бекмухаметова А.М., Захарова Л.Я. и др. Самоагрегация и солюбилизирущие свойства супрамолекулярной системы на основе азобензосульфонатного каликс[4]арена и ЦТАБ // Макрогетероциклы. 2017. V. 10. № 4–5. P. 454–459.
Кашапов Р.Р., Разуваева Ю.С., Зиганшина А.Ю. и др. Агрегация супрамолекулярной системы на основе N-метил-D-глюкаминового каликс[4]резорцина и ЦТАБ в водной среде // Макрогетероциклы. 2019. Т. 12. № 4. С. 346–349.
Ali I., Imran M., Saifullah S. et al. Amphiphilic p-sulfonatocalix[6]arene based self-assembled nanostructures for enhanced clarithromycin activity against resistant Streptococcus pneumoniae // Colloids Surf. B. 2020. V. 186. P. 110676.
Garai B., Shetty D., Skorjanc T. et al. Taming the topology of calix[4]arene-based 2D-Covalent organic frameworks: interpenetrated vs noninterpenetrated frameworks and their selective removal of cationic dyes // J. Am. Chem. Soc. 2021. V. 143. № 9. P. 3407–3415.
Andreyko E.A., Padnya P.L., Stoikov I. I. Supramolecular self-assembly of water-soluble nanoparticles based on amphiphilic p-tert-butylthiacalix[4]arenes with silver nitrate and fluorescein // Colloids Surf. A: Physicochem. Eng. Asp. 2014. V. 454. P. 74–83.
Cheipesh T.A., Zagorulko E.S., Mchedlov-Petrossyan N.O. et al. The difference between the aggregates of short-tailed and long-tailed cationic calix[4]arene in water as detected using fluorescein dyes // J. Mol. Liq. 2014. V. 193. P. 232–238.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал