Коллоидный журнал, 2022, T. 84, № 6, стр. 740-751
Роль комплексного подхода при определении размеров наночастиц в дисперсиях
Е. В. Кузнецова 1, *, Н. М. Кузнецов 1, К. Т. Калинин 1, П. В. Лебедев-Степанов 2, 3, А. А. Новиков 4, С. Н. Чвалун 1, 5
1 Национальный исследовательский центр “Курчатовский институт”
123182 Москва,
пл. Академика Курчатова, д. 1, Россия
2 Федеральный научно-исследовательский центр “Кристаллография и фотоника”
Российской академии наук
119333 Москва, Ленинский пр-т, д. 59, Россия
3 Национальный исследовательский ядерный университет МИФИ
115409 Москва,
Каширское ш., д. 31, Россия
4 Российский государственный университет нефти и газа (НИУ)
им. И. М. Губкина
119991 Москва, Ленинский пр-т, д. 65 корп.1, Россия
5 Институт синтетических полимерных материалов им. Н.С. Ениколопова
Российской академии наук
117393 Москва, Профсоюзная ул., д. 70, Россия
* E-mail: kuznetsova.kate992@gmail.com
Поступила в редакцию 13.07.2022
После доработки 25.08.2022
Принята к публикации 28.08.2022
- EDN: KZWNKQ
- DOI: 10.31857/S0023291222600389
Аннотация
В работе получены водные дисперсии металлических наночастиц (НЧ) золота и серебра, стабилизированных цитратом натрия, а также полимерных НЧ на основе поли(лактида-со-гликолида) (70 : 30 мол. %), стабилизированных поли(виниловым) спиртом, размер которых определяли методами просвечивающей электронной микроскопии (ПЭМ), динамического рассеяния света (ДРС) и аналитического ультрацентрифугирования (АУЦ). Показано, что диаметр как металлических, так и полимерных частиц, определенный методом ПЭМ, существенно ниже гидродинамического диаметра (Dh) НЧ, установленного методом ДРС. Также обнаружено, что величина (Dh) исследуемых частиц, полученная из ДРС распределений, завышена по сравнению со значением (Dh), определенным АУЦ, поскольку метод АУЦ менее чувствителен к полидисперсности частиц по размерам и наличию в дисперсии крупных объектов.
ВВЕДЕНИЕ
В настоящее время наночастицы (НЧ) активно используют в различных областях промышленности в качестве красителей, пищевых и косметических добавок, химических и биологических сенсоров, катализаторов и пр. [1–3]. В биомедицинской области НЧ также находят свое применение в качестве диагностических агентов [4], средств фотодинамической терапии раковых опухолей [5], систем адресной доставки различных лекарственных препаратов [6–8] и др.
НЧ обладают уникальными свойствами, которые существенно зависят от их размера, формы, поверхностного заряда и пр. Известно, что размер частиц влияет на их биосовместимость, биораспределение и способность проникать через клеточные мембраны. Например, в работе [9] авторы обнаружили, что внутрибрюшинное введение малых и крупных золотых НЧ (ЗНЧ) со средним диаметром (D) менее 5 и более 50 нм, соответственно, не оказывает негативного влияния на здоровье лабораторных мышей, тогда как введение ЗНЧ, у которых величина D варьируется от 8 до 37 нм, приводит к гибели большинства животных в течение трех недель. Sahin и др. показали, что при одинаковой весовой концентрации полимерных НЧ на основе статистического сополимера поли(лактида-со-гликолида) (ПЛГА), стабилизированных поли(виниловым) спиртом (ПВС), частицы с величиной гидродинамического диаметра (Dh), равной 160 нм, эффективнее проникают в клетки линии HEK293 по сравнению с более крупными частицами с величиной Dh = 230 нм [10]. Таким образом, аккуратное определение размера НЧ является актуальной задачей с точки зрения их применения в биомедицине и предсказания их воздействия на организм.
В настоящее время наиболее распространенными и относительно простыми методами определения размера НЧ являются просвечивающая электронная микроскопия (ПЭМ) и динамическое рассеяние света (ДРС). В методе ПЭМ тонкий слой предварительно высушенного на сетке образца исследуют с помощью пучка электронов высокой энергии (80–300 кэВ), проходящих сквозь образец и взаимодействующих с ним [11]. Контраст на ПЭМ, возникающий из-за поглощения образцом электронов, позволяет получать изображения высокого разрешения, анализ которых дает информацию о форме и размере исследуемых частиц. Для получения достоверных и воспроизводимых результатов методом ПЭМ необходимо надлежащее количество репрезентативных изображений с равномерным распределением частиц. Количество частиц в образце, которое может быть визуализировано методом ПЭМ, так называемый лимит обнаружения, зависит от многих факторов, таких как подготовка пробы, объем образца, а также размер и состав частиц. Так, при одинаковой концентрации серебряных НЧ (СНЧ) (0.01 мас./об. %) в 1 мкм3 образца, который содержит СНЧ с D = 10 нм, может быть визуализировано 18 частиц, тогда как в 55 мкм3 образца, содержащего СНЧ с D = 100 нм, – всего одна [11]. К недостаткам метода относится необходимость удаления растворителя на этапе подготовки пробы, что может приводить к нежелательной агрегации частиц. Кроме того, анализ изображений, осуществляемый вручную или в автоматическом режиме (попиксельно) с помощью специального программного обеспечения, может приводить к неточностям и ошибкам определения размера частиц. Это связано с характерным для ПЭМ изображений шумом, который затрудняет четкое установление границ частицы.
В большей степени предварительная сушка образца затрудняет исследование методом ПЭМ биологических объектов, так как удаление растворителя может приводить к существенному изменению их структуры. Предотвратить нежелательные структурные изменения и/или агрегацию частиц позволяет использование крио просвечивающей электронной микроскопии (крио-ПЭМ), в рамках которой образцы предварительно замораживают, а не высушивают. Крио-ПЭМ успешно применяют для исследования не только биологических объектов, но и металлических НЧ [12, 13], детонационных наноалмазов [14] и пр. Однако лимит обнаружения, сложность подбора режима замораживания и постобработки изображений, а также высокая стоимость оборудования ограничивает повсеместное использование крио-ПЭМ.
Отметим, что исследование методом ПЭМ полимерных НЧ имеет ряд дополнительных сложностей. Во-первых, сверхглубокий вакуум и высокоинтенсивное ионизирующее излучение в камере электронного микроскопа может приводить к нагреву, загрязнению углеводородами и радиолизу полимеров [15]. Во-вторых, полимерные НЧ типа “ядро−корона” и “Янус” возможно исследовать методом ПЭМ лишь с помощью процедуры селективного контрастирования [15]. Так, для изучения методом ПЭМ полимерных НЧ со строением “ядро−корона”, формируемых амфифильными блок-сополимерами поли(лактид)-б-поли(этиленоксид) (ПЛА-б-ПЭО) [16, 17], а также гидрофобными сополимерами ПЛГА в присутствии гидрофильного стабилизатора ПВС [18, 19], как правило, применяют токсичный негативный контрастирующий агент ацетат уранила. Кроме того, при сушке образцов на этапе пробоподготовки происходит коллапс стабилизирующей короны частиц, и величина D НЧ, определенная методом ПЭМ, оказывается существенно ниже величины их Dh. Например, в работе [19] значение Dh частиц на основе ПЛГА (соотношение лактидных и гликолидных звеньев – 75 : 25 мол. %, средневесовая молекулярная масса – 19 кДа, индекс полидисперсности – 2.2), стабилизированных ПВС, превышало величину D на ~ 50 нм. Таким образом, для определения размера как металлических, так и полимерных НЧ и, соответственно, предсказания их поведения в организме человека необходимо привлекать дополнительные методы исследования.
В отличие от ПЭМ метод ДРС позволяет исследовать коллоидные растворы НЧ in situ. Кроме того, в методе ДРС усреднение полученных экспериментальных данных производится по существенно большему числу частиц, чем в исследовании ПЭМ. В ДРС измеряется зависимость флуктуации интенсивности рассеяния света, возникающей в результате броуновского движения частиц в растворе, от времени [20, 21]. Получаемые экспериментальные данные представляют собой автокорреляционную функцию фототока (g2(τ)), для которой рассчитывают распределения по размерам исследуемых частиц с помощью, как правило, специального программного обеспечения, например, “Zetasizer software” [22]. Широко используемый для определения размера коллоидных НЧ метод ДРС имеет ряд ограничений и недостатков. Так, при исследовании ДРС полидисперсных образцов присутствие крупных частиц может затруднять детектирование частиц малых размеров [16, 23, 24], так как известно, что интенсивность рассеяния света (I) находится в степенной зависимости от диаметра частицы (I ~ D6 для частиц с D < 100 нм, I ~ D2 для частиц с D > 200 нм) [25]. В работе [23] авторы установили, что при наличии в растворе всего 5 мас. % крупных СНЧ с величиной Dh, равной 55 или 80 нм, сигнал от основной фракции СНЧ малого размера (Dh = 10 нм) на распределении интенсивности рассеяния света по Dh частиц отсутствует. Кроме того, ДРС чаще используют для характеризации сферических частиц. Исследование же объектов несферической формы (эллипсоидальных частиц, стержней, дисков, ламелей и пр.) затруднено, так как классический метод ДРС не учитывает вклад вращательного движения частицы, и может приводить к артефактам, например, появлению ложного пика на распределении интенсивности рассеяния света по Dh частиц [26].
Помимо ПЭМ и ДРС для определения размера коллоидных НЧ и оценки полидисперсности по размерам применяют также атомно-силовую микроскопию, анализ траекторий частиц, рентгеновское рассеяние, аналитическое ультрацентрифугирование (АУЦ), флуоресцентную корреляционную спектроскопию и пр. [27]. Методом АУЦ исследуют седиментацию НЧ под воздействием центробежной силы, а возникающие при этом в образце градиенты концентрации детектируют в реальном времени с помощью оптической системы. Экспериментальные данные записываются в виде профилей концентрации c(r, t) в зависимости от радиального расстояния от ротора (r) и времени (t), которые можно преобразовать в распределения коэффициентов седиментации c(s) и коэффициентов диффузии c(Df) с помощью программного обеспечения “Sedfit” [28]. В отличие от метода ДРС АУЦ подходит для исследования полидисперсных систем [29]. Кроме того, метод позволяет исследовать поверхность частиц [30], взаимодействия металлических частиц с белками [31] и пр. К недостаткам метода относятся сложность интерпретации данных, высокая стоимость оборудования и длительное время анализа.
В данной работе в качестве объектов исследования были выбраны два типа НЧ: металлические частицы (ЗНЧ и СНЧ), стабилизированные цитратом натрия, и полимерные (ПЛГА) частицы, стабилизированные ПВС. С использованием взаимодополняющих экспериментальных методов, а именно ПЭМ, ДРС и АУЦ, был определен средний размер коллоидных НЧ, а также проведена оценка полидисперсности по размерам. Показано, что величина D как металлических, так и полимерных частиц возрастает в ряду DПЭМ < DАУЦ < DДРС, что связано с особенностями методов исследования, обсуждению которых посвящена данная статья.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Цитрат натрия, золотохлористоводородную кислоту (HAuCl4), дубильную кислоту и нитрат серебра (AgNO3) (все – Sigma Aldrich, США) использовали без дополнительной очистки. Поли(лактид-со-гликолид) (ПЛГА) синтезировали методом полимеризации с раскрытием цикла. Сополимеризацию D,L-лактида (3.92 г) и гликолида (0.98 г) проводили в расплаве в конической колбе при температуре 160°C в присутствии активатора этиленгликоля (4.9 мг) (Sigma Aldrich, США) и катализатора октоата олова (2.45 мг) (Sigma Aldrich, США) в течение 3 ч. Продукт реакции растворяли в тетрагидрофуране и осаждали в охлажденный гексан. Методом 1H ядерно-магнитного резонанса установили, что соотношение лактидных и гликолидных звеньев в полимере составило 70 : 30 мол. %. Методом гель-проникающей хроматографии определили средневесовую молекулярную масса сополимера (Mw) – 97 кДа и его индекс полидисперсности – 2.12. Поли(виниловый) спирт (ПВС) (Mw = 30–70 кДа, гидролизованный 87%) (Sigma Aldrich, США) использовали без дополнительной очистки. Используемые органические растворители класса “ос. ч.” (Химреактив, Россия) дополнительно не очищали. Для приготовления растворов использовали деионизированную воду (17.5 МОм см), полученную на установке “Водолей-М” (Химэлектроника, Россия).
Получение золотых наночастиц (ЗНЧ)
Для получения ЗНЧ, стабилизированных цитратом натрия, использовали модифицированную методику Bastús et al. [32, 33]: в полипропиленовой пробирке объемом 10 мл смешивали 6 мл дважды дистиллированной воды, 71 мкл раствора HAuCl4 (25 мМ) и 88 мкл раствора цитрата натрия (60 мМ). Затем полученный раствор инкубировали в закрытой пробирке при 90°C в течение 15 мин на циркулирующей водяной бане. В результате получали окрашенную в розовый цвет дисперсию ЗНЧ, которую затем охлаждали до 15°C на водяной бане. Полученную дисперсию хранили при 4°С.
Получение серебряных наночастиц (СНЧ)
Для получения серебряных наночастиц (СНЧ), стабилизированных танином и цитратом натрия, использовали методику Bastús et al. [34]: готовили 100 мл водного раствора, содержащего цитрат натрия (5 мМ) и дубильную кислоту (25 мкМ). Затем раствор переносили в трехгорлую круглодонную колбу и нагревали до температуры кипения растворителя (100°С) в течение 15 мин при интенсивном перемешивании. Для предотвращения испарения растворителя использовали обратный холодильник. После начала кипения к раствору добавляли 1 мл AgNO3 (25 мМ), после чего наблюдали изменение окраски раствора в ярко-желтый цвет. Полученную дисперсию хранили при 4°С.
Получение полимерных наночастиц
Для получения ПЛГА частиц, стабилизированных ПВС, использовали стандартную методику наноосаждения [35]. Навеску полимера массой 100 мг растворяли в 10 мл ацетона. Полученный раствор по каплям добавляли к 10 мл водного раствора стабилизатора ПВС с концентрацией 5 мг/мл. Ацетон испаряли в течение 4 ч при комнатной температуре при постоянном перемешивании (700 об./мин). Поученную водную дисперсию центрифугировали (40000 g, 30 мин) для удаления остатков ацетона и несвязанного ПВС. Супернатант отбирали, осажденные ПЛГА НЧ диспергировали в деионизированной воде. Процедуру очистки повторяли трижды. Полученную дисперсию хранили при 4°С.
Динамическое рассеяние света (ДРС)
Водные дисперсии металлических и полимерных НЧ исследовали на анализаторе “Zetasizer Nano ZS” (Malvern Instruments Ltdю, США), оснащенным He–Ne лазером с длиной воны 633 нм. Фотодетектор анализатора расположен под углом 173°. Дисперсии объемом 1 мл помещали в кварцевую кювету толщиной 10 мм, измерения проводили при 25°С. Распределения гидродинамических диаметров (Dh, нм) НЧ в дисперсиях были рассчитаны из автокорреляционных функций интенсивности рассеянного света с использованием программного обеспечения “Zetasizer software”.
Просвечивающая электронная микроскопия (ПЭМ)
Металлические НЧ исследовали с помощью электронного микроскопа “JEOL JEM-2100” (JEOL Ltd., Япония) с ускоряющим напряжением 200 кВ, оснащенным камерой “Ultrascan 4000” (Gatan, США) в качестве детектора, в режиме светлого поля. Медные сетки, покрытые углеродной пленкой, использовали в качестве подложек. На подложку наносили 3 мкл водной дисперсии НЧ, выдерживали 1 мин. Затем подложку промывали 10 мкл деионизированной воды, избыток раствора удаляли фильтровальной бумагой. Перед ПЭМ измерениями образец высушивали в течение 30 мин.
Полимерные НЧ исследовали с помощью электронного микроскопа “Titan 80-300 TEM/STEM” (“FEI”, США) с ускоряющим напряжением 300 кВ, оснащенным камерой “BM-Ultrascan” (Gatan, США), в режиме светлого поля. Для усиления контраста применяли процедуру негативного контрастирования с помощью контрастирующего агента ацетата уранила. В качестве подложек также использовали медные сетки, покрытые углеродной пленкой. На подложку наносили 3 мкл водной дисперсии НЧ, выдерживали 1 мин. Затем подложку промывали 10 мкл деионизированной воды и сразу же наносили 10 мкл 0.5 мас. % раствора ацетата уранила, выдерживали 30 с. После каждого этапа избыток раствора удаляли фильтровальной бумагой. Перед ПЭМ исследованиями образец высушивали в течение 30 мин.
Аналитическое ультрацентрифугирование (АУЦ)
Скоростную седиментацию металлических НЧ исследовали с помощью аналитической ультрацентрифуги “Optima AUC” (Beckman Coulter, США) с использованием оптической системы сканирования поглощения в УФ/видимой области. В ультрацентрифугу помещали четырехъячеечный титановый ротор “An-60 Ti”, загруженный аналитической ячейкой с двухсекторным центральным элементом Epon (длина оптического пути 12 мм) и балансировочной ячейкой. В ячейку загружали 420 мкл раствора металлических НЧ и 440 мкл чистого растворителя цитратного буфера ([η0] = 0.001 Па с, ρ0 = 0.9971 г/см3). Скорость вращения ротора составила 3000 об./мин, сканирование поглощения проводили при длине волны λ = 430 и 525 нм для СНЧ и ЗНЧ соответственно. Измерения проводили при 25°С.
Для исследования скоростной седиментации полимерных НЧ с помощью аналитической ультрацентрифуги “Optima AUC” (Beckman Coulter, США) использовали оптическую систему интерференции (длина волны λ = 660 нм). В ультрацентрифугу помещали четырехъячеечный титановый ротор “An-60 Ti”, загруженный аналитической ячейкой с двухсекторным центральным элементом Epon (длина оптического пути 12 мм) и балансировочной ячейкой. В ячейку загружали 420 мкл раствора полимерных НЧ и 440 мкл чистого растворителя деионизированной воды ([η0] = 0.001 Па с, ρ0 = 0.9971 г/см3). Скорость вращения ротора составила 5000 об./мин. Измерения проводили при 25°С.
Для анализа полученных седиментационных профилей использовали модель Is–g*(s) с регуляризацией Тихонова−Филлипса, входящую в программное обеспечение “Sedfit” [36]. Модель Is‒g*(s) описывает седиментацию не диффундирующих частиц, и представляет собой анализ граничных значений методом наименьших квадратов.
Перед всеми измерениями водные дисперсии НЧ извлекали из холодильника (4°С) и термостатировали при комнатной температуре в течение 1 ч, затем обрабатывали в ультразвуковой ванне в течение 15 мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для безопасного и эффективного применения как металлических, так и полимерных НЧ в биомедицине требуется аккуратное определение их размера, а также оценка полидисперсности по размерам, поскольку известно, что размер НЧ существенно влияет на их биосовместимость, биораспределение, эффективность проникновения в клетки и пр.
Для характеризации металлических и полимерных частиц в работе использовали ПЭМ, ДРС и АУЦ. Репрезентативные ПЭМ изображения ЗНЧ и СНЧ, стабилизированных цитратом натрия, и ПЛГА частиц, стабилизированных ПВС, приведены на рис. 1а, 1г и 1ж соответственно.
Рис. 1.
Репрезентативные ПЭМ изображения ЗНЧ (а), СНЧ (г) и ПЛГА НЧ (ж). Распределения ЗНЧ (б), СНЧ (д) и ПЛГА НЧ (з) по диаметрам (D, нм), полученные при анализе ПЭМ изображений. Распределения ЗНЧ (в) и СНЧ (е) по характеристическим отношениям (Dmax/Dmin), полученные при анализе ПЭМ изображений. Стрелками на рис. 1а и 1г обозначены металлические НЧ несферической формы. Стрелками на рис. 1ж обозначены ПЛГА ядра, окруженные слоем ПВС.
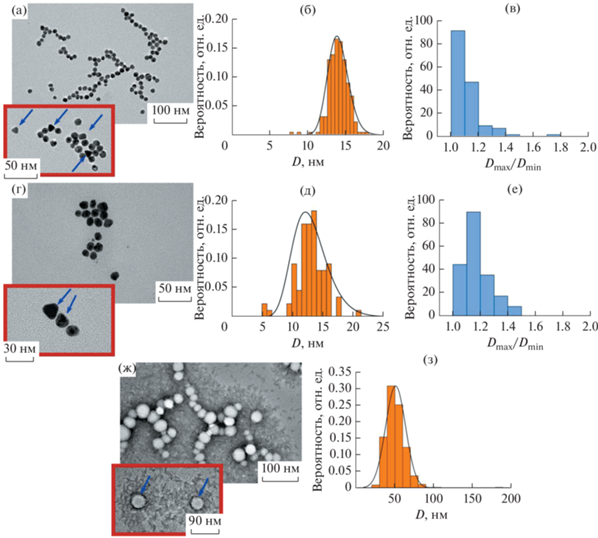
Металлические частицы обладают преимущественно сферической морфологией, однако на полученных снимках также присутствуют ЗНЧ и СНЧ несферической формы (обозначены стрелками на рис. 1а и 1г). Как видно из рис. 1б и 1д, ПЭМ распределения частиц мономодальные с хорошо выраженным максимумом, положение которого соответствует наиболее вероятному диаметру (D) ЗНЧ и СНЧ, равному 14 и 13 нм соответственно. Средняя относительная полуширина ПЭМ распределения ${{\sigma }_{{{\text{ПЭМ}}}}} = \left( {\frac{{{{\sigma }_{D}}}}{D}} \right)\,\, \times \,\,100\% ~$, где ${{\sigma }_{D}}$ – полуширина распределения на полувысоте максимума, для ЗНЧ составила 14%, тогда как для СНЧ – 29%. Из анализа ПЭМ изображений получили также распределения характеристического отношения (Dmax/Dmin) металлических частиц, то есть отношения максимального диаметра частицы (Dmax) к минимальному (Dmin) (рис. 1в, 1е). Величина Dmax/Dmin для ЗНЧ и СНЧ варьируется в диапазоне от 1.0 до 1.8 и от 1.0 до 1.4, тогда как наиболее вероятное значение Dmax/Dmin составляет 1.1 ± 0.1 и 1.2 ± 0.1 соответственно.
Как видно из рис. 1ж, полимерные частицы на основе ПЛГА также обладают сферической морфологией. Отметим, что в водной дисперсии исследуемые полимерные НЧ представляют собой гидрофобное ПЛГА ядро, покрытое стабилизирующей ПВС короной, которая препятствует агрегации частиц и выделению их в отдельную фазу (осадок) [18, 19]. При осаждении на подложку и последующей сушке образца происходит коллапс стабилизирующего ПВС слоя [18, 19]. Таким образом, метод ПЭМ позволяет оценить лишь диаметр ПЛГА ядер (обозначены стрелкой на рис. 1ж), величина которого существенно ниже значения среднего диаметра частиц в сольватированном состоянии. Полученное ПЭМ распределение мономодальное с хорошо выраженным максимумом (рис. 1з), положение которого соответствует величине D, равной 52 нм (${{\sigma }_{{{\text{ПЭМ}}}}}$ = 30%).
Водные дисперсии металлических и полимерных НЧ исследовали методом ДРС. В случае ЗНЧ обнаружили бимодальное распределение интенсивности рассеяния света по гидродинамическим диаметрам (Dh) частиц (рис. 2а). Положение максимума основного и минорного пика на распределении соответствует величине Dh, равной 35 и 2 нм соответственно. При этом автоматический пересчет в программном обеспечении “Zetasizer software” распределения интенсивности рассеяния в распределения объема и числа частиц приводит к мономодальным распределениям с максимумом ~ 2 нм (рис. 2б). Отметим, что при анализе ПЭМ изображений ЗНЧ с D менее 5 нм обнаружены не были (рис. 1б).
Рис. 2.
Распределения интенсивности рассеяния света по гидродинамическим диаметрам (Dh, нм) для ЗНЧ (а), СНЧ (в) и ПЛГА НЧ (д); распределения объема и числа частиц по Dh для ЗНЧ (б), СНЧ (г) и ПЛГА НЧ (е).

Ранее Хлебцов и др. при исследовании методом ДРС водной дисперсии ЗНЧ со средним диаметром 60 нм также обнаружили бимодальное распределение интенсивности рассеяния света по Dh частиц с основным (~59 нм) и минорным (~5–6 нм) максимумами [37]. Авторы установили, что появление ложного минорного пика малых размеров на распределении ДРС связано с вкладом вращательной диффузии в измеряемую корреляционную функцию вследствие анизотропии исследуемых ЗНЧ (по данным ПЭМ характеристическое отношение частиц составляло 1.33 ± 0.22). Вероятно, бимодальное распределение интенсивности рассеяния света, наблюдаемое для исследуемых в данной работе ЗНЧ (рис. 2а), может быть связано с присутствием в дисперсии некоторого количества анизотропных ЗНЧ с Dmax/Dmin > 1.1 (рис. 1в).
Отметим, что значение Dh ЗНЧ, соответствующее положению основного максимума на распределении ДРС интенсивности рассеяния (рис. 2а), в 2.5 раза превышает величину D, полученную из анализа ПЭМ изображений (табл. 1). В свою очередь величина ${{\sigma }_{{{\text{ДРС}}}}}$ основного пика ДРС распределения в ~5 раз выше относительной ширины ПЭМ гистограммы (табл. 1).
Таблица 1.
Средний размер металлических и полимерных НЧ, а также средняя относительная полуширина распределения по размерам, определенные методами ПЭМ, ДРС и АУЦ
| Образец | D, нм (ПЭМ) | σПЭМ, % | Dh, нм (ДРС) | σДРС, % | Dh, нм (АУЦ) | $\sigma $АУЦ, % |
|---|---|---|---|---|---|---|
| Металлические НЧ | ||||||
| ЗНЧ | 14 | 14 | 35 | 75 | 22 | 14 |
| СНЧ | 13 | 29 | 21 | 41 | 16 | 11 |
| Полимерные НЧ | ||||||
| ПЛГА | 52 | 30 | 141 | 39 | 111 | 29 |
Для водной дисперсии СНЧ наблюдали мономодальное распределение интенсивности рассеяния света по Dh частиц (рис. 2в). Величина Dh, соответствующая максимуму на полученном распределении, составила 21 нм. Пересчет распределения интенсивности рассеяния в распределения объема и числа частиц приводит к мономодальным распределениям с максимумом 16 и 13 нм соответственно (рис. 2г). Мономодальность распределения, по-видимому, обусловлена более узким распределением характеристических отношений СНЧ по сравнению с ЗНЧ (рис. 1в, 1е). Относительная ширина ДРС распределения интенсивности рассеяния оказалась в ~ 1.4 раза выше относительной ширины ПЭМ распределения (табл. 1).
Для водной дисперсии ПЛГА частиц, стабилизированных ПВС, также обнаружили мономодальное распределение интенсивности рассеяния света по Dh частиц (рис. 2д). Величина Dh, соответствующая максимуму на полученном распределении, составила 141 нм. Автоматический пересчет распределения интенсивности рассеяния в распределения объема и числа частиц приводит к мономодальным распределениям с максимумом 132 и 108 нм соответственно (рис. 2е). Величина Dh ПЛГА НЧ значительно превышает (в ~2.7 раза) значение D частиц. Это может быть связано с тем, что при исследовании ПЛГА частиц методом ДРС стабилизирующая гидрофильная ПВС корона находится в набухшем состоянии из-за сольватации молекул растворителя, тогда как при изучении частиц методом ПЭМ ПВС корона, напротив, находится в сколлапсированном состоянии [18, 19]. В свою очередь, относительная ширина ДРС распределения интенсивности рассеяния в ~1.3 раза превышает относительную ширину ПЭМ гистограммы (табл. 1).
Как видно из табл. 1, величины D металлических и полимерных НЧ оказались ниже соответствующих величин Dh в 1.75–2.7 раза, причем наиболее существенная разница наблюдается для ПЛГА частиц. Таким образом, метод ПЭМ в отличие от ДРС не позволяет определить средний размер исследуемых частиц в сольватированном состоянии. Также отметим, что из-за высокой чувствительности ДРС к полидисперсности и присутствию крупных частиц в образце экспериментально определенные величины Dh НЧ могут быть завышены [38, 39]. Поэтому в данной работе в качестве дополнительного метода определения среднего размера НЧ в сольватированном состоянии, а также оценки ширины распределения по размерам был выбран метод АУЦ.
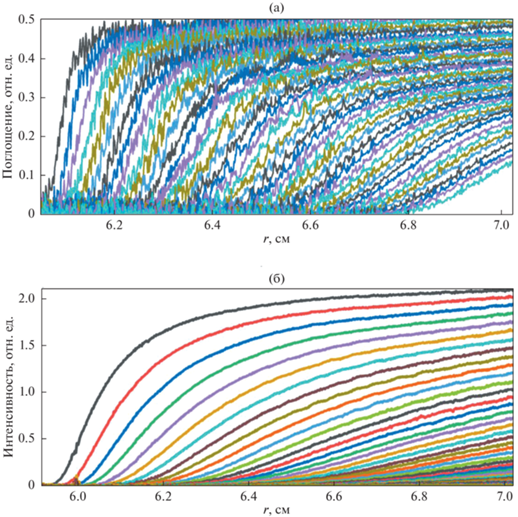
Репрезентативные экспериментальные седиментационные профили, то есть профили концентрации c(r, t) в зависимости от радиального расстояния от ротора (r) и времени (t), для водной дисперсии ЗНЧ и ПЛГА частиц, полученные в режиме поглощения и интерференции, приведены на рис. 3а и 3б соответственно.
Рис. 3.
Экспериментальные седиментационные профили ЗНЧ (а) и ПЛГА НЧ (б) в водной дисперсии, полученные в режиме поглощения и интерференции соответственно.
Рассчитанное в программе “Sedfit” распределение коэффициентов седиментации c(s) ЗНЧ, где s есть отношение скорости осаждения частиц в растворителе к приложенному ускорению, имеет хорошо выраженный максимум, положение которого соответствует величине smax ~ 3600 Св (рис. 4а). Помимо основной фракции ЗНЧ с smax ~ 3600 Св в дисперсии также присутствуют частицы, для которых величина s варьируется в достаточно широком диапазоне от 5000 до 13 000 Св. Распределение с(Dh), полученное автоматическим пересчетом распределения c(s) в “Sedfit”, приведено на рис. 4б. Величина Dh, соответствующая положению максимума на c(Dh), составляет 22 нм, средняя относительная полуширина распределения ${{\sigma }_{{{\text{АУЦ}}}}}$ – 14%. Сравнение ПЭМ гистограммы (рис. 1б), распределения частиц по размерам от интенсивности рассеяния света, полученного методом ДРС (рис. 2а), и распределения с(Dh) (рис. 4б) для ЗНЧ указывает на то, что минорный пик на распределении ДРС в области размеров ~2–5 нм является ложным, так как методами ПЭМ и АУЦ частиц столь малого размера обнаружено не было. Кроме того, при центрифугировании дисперсии ЗНЧ на более высоких скоростях (10 000 об./мин) седиментации частиц малого размера (Dh < 10 нм) также не наблюдали.
Рис. 4.
Рассчитанные распределения коэффициентов седиментации (s, Св) ЗНЧ (а), СНЧ (в) и ПЛГА НЧ (д) и гидродинамических диаметров (Dh, нм) ЗНЧ (б), СНЧ (г) и ПЛГА НЧ (е) в водной дисперсии.
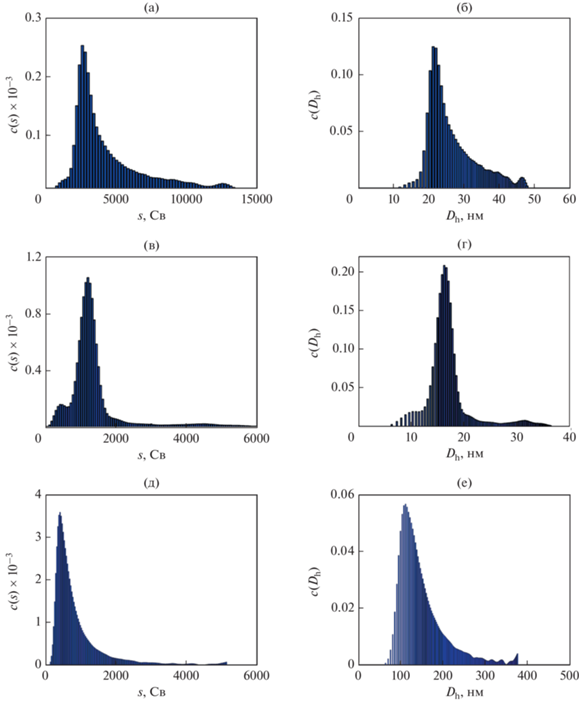
Водную дисперсию СНЧ также исследовали методом АУЦ, рассчитанные для частиц распределения с(s) и c(Dh) приведены на рис. 4в и 4г соответственно. Согласно рассчитанному распределению с(s) основной фракцией в дисперсии являются СНЧ с величиной smax ~ 800 Св, однако также присутствует малая доля частиц с s ~ 290 Св и частиц, для которых s варьируется в диапазоне от 1200 до 4000 Св (рис. 4в). Распределение с(Dh) частиц серебра имеет хорошо выраженный максимум, величина Dh, соответствующая его положению, составляет 16 нм. Отметим, что по сравнению с ЗНЧ (рис. 4б) доля крупных СНЧ, для которых s > smax, оказалась ниже (рис. 4г).
Рассчитанные распределения с(s) и c(Dh) для ПЛГА частиц, стабилизированных ПВС, приведены на рис. 4д и 4е соответственно. Согласно полученному распределению с(s) основной фракцией в дисперсии являются частицы с величиной smax ~ 430 Св, однако также присутствуют частицы, для которых s варьируется в диапазоне от 1000 до 5000 Св (рис. 4д). Распределение с(Dh) частиц характеризуется хорошо выраженным максимумом, величина Dh, соответствующая его положению, составляет 111 нм. Отметим, что ранее в работе [19] водную дисперсию стабилизированных ПВС частиц на основе ПЛГА с близким молекулярным составом (75 : 25 мол. %) исследовали методом малоуглового рентгеновского рассеяния (МУРР). По данным МУРР размер рассеивающего объекта (Dmax), учитывающий вклад ПЛГА ядра и ПВС короны, составляет 100 нм. Таким образом, величина Dh, полученная при исследовании ДРС, оказалась завышена по сравнению с размерами ПЛГА частиц, определенными методами АУЦ и МУРР.
ЗАКЛЮЧЕНИЕ
Водные дисперсии металлических и полимерных НЧ исследовали методами ПЭМ, ДРС и АУЦ. Показано, что диаметр (D) частиц в зависимости от метода определения возрастает в ряду DПЭМ < DАУЦ < DДРС. Меньшие значения DПЭМ по сравнению с величинами DАУЦ и DДРС частиц связаны с особенностью подготовки пробы, а именно с осаждением дисперсии на подложку и ее последующей сушкой, в результате чего происходит десольватация молекул гидрофильного стабилизатора, адсорбированных на поверхности частиц, и их коллапс. Таким образом, метод ПЭМ позволяет визуализировать форму ядер металлических и полимерных НЧ, а также оценить их размер и полидисперсность по размерам, однако не дает информации о размере частицы в сольватированном состоянии, необходимой для их безопасного и эффективного использования в биомедицине. Метод ДРС, напротив, подходит для определения размера НЧ непосредственно в растворе, однако величины DДРС частиц оказались завышены по сравнению с DАУЦ, поскольку в случае ДРС полидисперсность по размерам НЧ, а также наличие небольшого количества крупных частиц в большей степени влияет на точность определения размера.
Таким образом, для характеризации НЧ различной природы (определения их размерoв и формы) следует использовать несколько взаимодополняющих экспериментальных методов. Применение ПЭМ в качестве базового метода не позволяет получить полное представление о размере частиц в дисперсии в виду своей локальности и невозможности учета вклада сольватной оболочки в размер частицы. Поэтому всегда следует проводить дополнительные исследования как минимум одним интегральным методом.
Список литературы
Stark W.J., Stoessel P.R., Wohlleben W., Hafner A. Industrial applications of nanoparticles // Chemical Society Reviews. 2015. V. 44. P. 5793–5805. https://doi.org/10.1039/C4CS00362D
Aithal S., Mishriki S., Gupta R. et al. SARS-CoV-2 detection with aptamer-functionalized gold nanoparticles // Talanta. 2022. V. 236. P. 122841. https://doi.org/10.1016/j.talanta.2021.122841
Nguyen T.H.A., Nguyen V.C., Phan T.N.H. et al. Novel biogenic silver and gold nanoparticles for multifunctional applications: green synthesis, catalytic and antibacterial activity, and colorimetric detection of Fe(III) ions // Chemosphere. 2022. V. 287. № 3. P. 132271. https://doi.org/10.1016/j.chemosphere.2021.132271
Салаватов Н.А., Большакова А.В., Морозов В.Н. и др. Золотые наностержни с функционализированной органокремнеземной оболочкой: синтез и перспективы применения в тераностике опухолей // Коллоид. журн. 2022. Т. 84. № 1. С. 97–104. https://doi.org/10.1134/S1061933X22010100
Bucharskaya A.B., Khlebtsov N.G., Khlebtsov B.N. et al. Photothermal and photodymanic therapy of tumors with plasmonic nanoparticles: challenges and prospects // Materials. 2022. V. 15. № 4. P. 1606. https://doi.org/10.3390/ma15041606
Xiang Q., Wu Z., Tian E.-K. et al. Gold nanoparticle drug delivery system: principle and application // Journal of Biomaterials and Tissue Engineering. 2022. V. 12. № 3. P. 445–460. https://doi.org/10.1166/jbt.2022.2934
Miranda R.R., Sampaio I., Zucolotto V. Exploring silver nanoparticles for cancer therapy and diagnosis // Colloids and Surfaces B: Biointerfaces. 2022. V. 210. P. 112254. https://doi.org/10.1016/j.colsurfb.2021.112254
Седуш Н.Г., Кадина Ю.А., Разуваева Е.В. и др. Наносомальные лекарственные формы на основе биоразлагаемых сополимеров лактида с различной молекулярной структурой и архитектурой // Российские нанотехнологии. 2021. Т. 16. № 4. С. 462–481. https://doi.org/10.1134/S2635167621040121
Chen Y.-S., Hung Y.-C., Liau I., Huang G.S. Assessment of the in vivo toxicity of gold nanoparticles // Nanoscale Research Letters. 2009. V. 4. P. 858–864. https://doi.org/10.1007/s11671-009-9334-6
Sahin A., Esendagli G., Yerlikaya F. et al. A small variation in average particle size of PLGA nanoparticles prepared by nanoprecipitation leads to considerable change in nanoparticles’ characteristics and efficacy of intracellular delivery // Artificial Cells, Nanomedicine, and Biotechnology. 2017. V. 45. № 8. P. 1657–1664. https://doi.org/10.1080/21691401.2016.1276924
Dudkiewicz A., Tiede K., Loeschner K. et al. Characterization of nanomaterials in food by electron microscopy // Trends in Analytical Chemistry. 2011. V. 30. P. 28–43. https://doi.org/10.1016/j.trac.2010.10.007
Камышинский Р.А., Кузнецов Н.М., Лебедев-Степанов П.В. и др. Микроструктура и реологическое поведение стабилизированного гидрозоля наночастиц золота // Кристаллография. 2021. Т. 66. № 4. С. 572–577. https://doi.org/10.1134/S106377452104009X
Михуткин А.А., Камышинский Р.А., Кузнецов Н.М. и др. Исследование 3D-структуры гидрогеля с наночастицами золота методом криогенной электронной микроскопии // Российские нанотехнологии. 2022. Т. 17. № 3. С. 394–399. https://doi.org/10.1134/S2635167622030119
Kuznetsov N.M., Belousov S.I., Bakirov A.V. et al. Unique rheological behavior of detonation nanodiamond hydrosols: The nature of sol-gel transition // Carbon. 2020. V. 161. P. 486–494. https://doi.org/10.1016/j.carbon.2020.01.054
Renz P., Kokkinopoulou M., Landfester K., Lieberwirth I. Imaging of polymeric nanoparticles: Hard Challenge for Soft Objects // Macromolecular Chemistry and Physics. 2016. V. 217. P. 1879–1885. https://doi.org/10.1002/macp.201600246
Razuvaeva E.V., Kulebyakina A.I., Streltsov D.R. et al. Effect of composition and molecular structure of poly(L-lactic acid)/poly(ethylene oxide) block copolymers on micellar morphology in aqueous solution // Langmuir. 2018. V. 34. P. 15470–15482. https://doi.org/10.1021/acs.langmuir.8b03379
Kadina Y.A., Razuvaeva E.V., Streltsov D.R. et al. Poly(ethylene glycol)-b-poly(D,L-lactide) nanoparticles as potential carriers for anticancer drug oxaliplatin // Molecules. 2021. V. 26. P. 602. https://doi.org/10.3390/molecules26030602
Razuvaeva E.V., Kalinin K.T., Sedush N.G. et al. Structure and cytotoxicity of biodegradable poly(D,L-lactide-co-glycolide) nanoparticles loaded with oxaliplatin // Mendeleev Communications. 2021. V. 31. P. 512–514. https://doi.org/10.1016/j.mencom.2021.07.025
Razuvaeva E., Sedush N., Shirokova E. et al. Effect of preparation conditions on the size of nanoparticles based on poly(D,L-lactide-co-glycolide) synthesized with bismuth subsalicylate // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2022. V. 648. P. 129198. https://doi.org/10.1016/j.colsurfa.2022.129198
Brar S.K., Verma M. Measurements of nanoparticles by light-scattering techniques // Trends in Analytical Chemistry. 2011. V. 30. № 1. P. 4–17. https://doi.org/10.1016/j.trac.2010.08.008
Bhattacharjee S. DLS and zeta potential – What they are and what they are not? // Journal of Controlled Release. 2016. V. 235. P. 337–351. https://doi.org/10.1016/j.jconrel.2016.06.017
Dynamic Light Scattering (DLS), Malvern, UK. https:// www.malvernpanalytical.com/en/products/technology/light-scattering/dynamic-light-scattering (accessed on July 13, 2022).
Tomaszewska E., Soliwoda K., Kadziola K. et al. Detection limits of DLS and UV-Vis spectroscopy in characterization of polydisperse nanoparticles colloids // Journal of Nanomaterials. 2013. V. 2013. P. 60. https://doi.org/10.1155/2013/313081
Desyatskova A.M., Razuvaeva E.V., Puchkova Y.A. et al. Effect of stereocomplex formation between enantiomeric poly(L,L)- and poly(D,D-lactide) chains on self-organization of amphiphilic poly(lactide)-b-poly(ethylene oxide) copolymers in dilute aqueous solution // Mendeleev Communications. In press.
Stetefeld J., MeKenna S.A., Patel T.R. Dynamic light scattering: a practical guide and applications in biomedical sciences // Biophysical Reviews. 2016. V. 8. P. 409–427. https://doi.org/10.1007/s12551-016-0218-6
Хлебцов Б.Н., Хлебцов Н.Г. Об измерении размера золотых наночастиц методом динамического светорассеяния // Коллоид. журн. 2011. Т. 73. № 1. С. 105–114. https://doi.org/10.1134/S1061933X11010078
Сапрыкин А.И., Самойлов П.П. Проблемы аналитики наночастиц в объектах окружающей среды и других сложных системах // Экология. Серия аналитических обзоров мировой литературы. 2020. № 109. С. 1–70.
Analytical ultracentrifugation (AUC). Sedfit. https://sedfitsedphat.github.io/sedfit.htm (accessed on July 13, 2022).
Carney R.P., Kim J.Y., Qian H. et al. Determination of nanoparticle size distribution together with density or molecular weight by 2D analytical centrifugation // Nature Communications. 2011. V. 2. P. 335. https://doi.org/10.1038/ncomms1338
Krpetic Z., Davidson A.M., Volk M. et al. High-resolution sizing of monolayer-protected gold clusters by differential centrifugal sedimentation // ACS Nano. 2013. V. 7. № 10. P. 8881–8890. https://doi.org/10.1021/nn403350v
Bekdemir A., Stellacci F. A centrifugation-based physicochemical characterization method for the interaction between proteins and nanoparticles // Nature Communications. 2016. V. 7. P. 13121. https://doi.org/0.1038/ncomms13121
Bastús N.G., Comenge J., Puntes V. Kinetically controlled seeded growth synthesis of citrate-stabilized gold nanoparticles of up to 200 nm: size focusing versus Ostwald ripening // Langmuir. 2011. V. 27. № 17. P. 11098–11105. https://doi.org/10.1021/la201938u
Gorbachevskii M.V., Kopitsyn D.S., Kotelev M.S. et al. Amplification of surface-enhanced Raman scattering by the oxidation of capping agents on gold nanoparticles // RSC Advances. 2018. V. 8. P. 19051–19057. https://doi.org/10.1039/C8RA00417J
Bastús N.G., Merkoçi P., Piella J., Puntes V. Synthesis of highly monodisperse citrate-stabilized silver nanoparticles of up to 200 nm: kinetic control and catalytic properties // Chemistry of Materials. 2014. V. 26. № 9. P. 2836–2846. https://doi.org/10.1021/cm500316k
Fessi H., Puisieux F., Devissaguet J.Ph. et al. Nanocapsule formation by interfacial polymer deposition following solvent displacement // International Journal of Pharmaceutics. 1989. V. 55. P. 1–4. https://doi.org/10.1016/0378-5173(89)90281-0
Schuck P. Size-distribution analysis of macromolecules by sedimentation velocity ultracentrifugation and Lamm equation modeling // Biophysical Journal. 2000. V. 78. № 3. P. 1606–1619. https://doi.org/10.1016/S0006-3495(00)76713-0
Хлебцов Б.Н., Ханадеев В.А., Пылаев Т.Е., Хлебцов Н.Г. Метод динамического рассеяния света в исследованиях силикатных и золотых наночастиц // Изв. Сарат. ун-та. Нов. сер. Сер. Физика. 2017. Т. 17. № 2. С. 71–84.
Souza T.G.F., Ciminelli V.S.T., Mohallem N.D.S. A comparison of TEM and DLS methods to characterize size distribution of ceramic nanoparticles // Journal of Physics: Conference Series. 2016. V. 733. P. 012039. https://doi.org/10.1088/1742-6596/733/1/012039
Filipe V., Hawe A., Jiskoot W. Critical evaluation of nanoparticle tracking analysis (NTA) by NanoSight for the measurement of nanoparticle and protein aggregates // Pharmaceutical Research. 2010. V. 27. P. 796–810. https://doi.org/10.1007/s11095-010-0073-2
Дополнительные материалы
- скачать ESM.jpg
- Приложение 1. Графическая аннотация
Инструменты
Коллоидный журнал


