Коллоидный журнал, 2023, T. 85, № 3, стр. 319-327
Сравнительный анализ характеристик водных суспензий магнитных наночастиц оксидов железа различного фазового состава
А. С. Коваленко 1, *, О. А. Шилова 1, 2, А. М. Николаев 1, С. В. Мякин 2, 3
1 Институт химии силикатов им. И.В. Гребенщикова
Российской академии наук
199034 Санкт-Петербург, наб. Макарова, 2, Россия
2 Санкт-Петербургский государственный технологический институт
(технический университет)
190013 Санкт-Петербург, Московский просп., 26, Россия
3 Институт аналитического приборостроения РАН
198095 Санкт-Петербург, ул. Ивана Черных, 31/33, Россия
* E-mail: anastasiya.bychk@yandex.ru
Поступила в редакцию 20.02.2023
После доработки 30.03.2023
Принята к публикации 31.03.2023
- EDN: ZORDCA
- DOI: 10.31857/S0023291223600116
Аннотация
Изучено взаимодействие с водной средой наночастиц оксидов железа, отвечающих составу твердых растворов магнетит-маггемитового ряда с различным соотношением катионов Fe2+/Fe3+. Установлено, что для наночастиц, наиболее близко соответствующих составу маггемита (γ-Fe2O3), характерны наибольшие значения гидродинамического диаметра и резкое снижение pH дисперсионной среды при диспергировании порошков в воде. Для наночастиц, фазовый состав которых соответствует твердому раствору из середины магнетит-маггемитового ряда, наблюдается плавное и менее выраженное снижение рН. Показано, что разбавление водных суспензий, полученных из предварительно высушенных порошков, в диапазоне концентраций от 100 до 0.001 мг/л с последующей ультразвуковой обработкой приводит к существенному увеличению гидродинамического диаметра частиц оксидов железа. Рассмотрен возможный механизм исследуемого взаимодействия наночастиц с водной средой, включающий гидратацию образованных ионами железа льюисовских кислотных центров и изменение характера диссоциации гидроксильных групп в зависимости от pH суспензии. Изучено влияние пассивации поверхности исследуемых нанопорошков олеиновой кислотой на рассматриваемые процессы. Полученные результаты позволяют прогнозировать агрегативную устойчивость и ряд других характеристик исследуемых суспензий при разбавлении их водой.
ВВЕДЕНИЕ
Субмикронные и наноразмерные магнитные частицы оксидов железа и водные суспензии на их основе находят ряд применений в различных областях, включая медицину [1, 2] и сельское хозяйство [3–5]. Одним из важнейших общих требований, предъявляемых к водным суспензиям, является их седиментационная и агрегативная устойчивость, которые зависят от состояния поверхности наночастиц и особенностей их взаимодействия с водной средой. В зависимости от своего происхождения (условий получения) оксиды железа сильно различаются по своему химическому и фазовому составу, а также магнитным свойствам и состоянию поверхности. Поэтому важной задачей является сравнительное исследование их взаимодействия с дисперсионной средой (в частности, водной) для суспензий различной концентрации. В [6–10] рассмотрены подходы к регулированию активности поверхности оксидов железа за счет обработки различными реагентами, включая кремний- и фосфорорганические соединения [6, 7], а также органические кислоты [8–12]. Обработку поверхности материалов олеиновой кислотой успешно используют для биохимических и медицинских применений [10–13]. Размеры коммерческих магнитных наночастиц оксидов железа и их ζ-потенциалы в водных суспензиях были изучены в [14]. Основные характеристики поверхности наночастиц магнетита в растворах хлорида натрия при изменении рН и концентрации ионов железа (Fe2+ и Fe3+) подробно описаны в работе [15]. Авторы исследовали влияние рН на ζ-потенциал наночастиц порошков магнетита, как синтезированных методом совместного осаждения, так и коммерческих, в водных растворах хлорида натрия различных концентраций. Исследования показали, что для всех исследованных наночастиц в кислой среде ζ-потенциал был положительный, а в щелочной – отрицательный. При этом ζ-потенциал равнялся 0 при значении рН ≈ 6, который являлся изоэлектрической точкой. При увеличении концентрации FeCl2 или FeCl3 изоэлектрическая точка смещалась в область более высоких рН (от 6 до 7.5) [15]. В работе [16] для наночастиц магнетита изоэлектрические точки были обнаружены при рН 6.2 и 6.7.
Авторы обзоров [17, 18], в которых рассматриваются поверхностные характеристики магнитных наночастиц оксидов железа, отмечают, что положение изоэлектрической точки варьируется в диапазоне рН от 5.2 до 7.26 и зависит от происхождения или условий синтеза образца, наличия примесей, эффекта растворимости, предварительной обработки, фонового электролита, метода измерения, а также моделей, применяемых для отображения и аппроксимации экспериментальных данных.
Вместе с тем относительно малоизученным остается вопрос о влиянии фазового состава оксидов железа, в частности соотношения в них атомов Fe(II, III) на характеристики поверхности наночастиц при взаимодействии с водной средой, в том числе при последовательном разбавлении суспензий водой.
Наиболее часто применяемым методом синтеза магнитных наночастиц оксидов железа является осаждение из водных растворов солей железа (II, III) на воздухе. В результате, как правило, образуются наночастицы, составы которых соответствуют твердым растворам магнетит-маггемитового ряда [19, 20]. Наши предыдущие исследования [5, 20, 21] показали, что водные суспензии указанных магнитных наночастиц оксидов железа можно успешно использовать для обработки вегетирующих растений ряда овощных культур в качестве иммуностимуляторов, оказывающих положительное влияние на их рост, развитие и продуктивность. При этом для применения в арготехнологиях наиболее приемлемыми являются водные суспензии с низкой концентрацией наночастиц FeOx (0.001–0.1 мг/л).
Целью данной работы являлось изучение влияния фазового состава магнитных нанопорошков оксидов железа, соответствующих твердым растворам магнетит-маггемитового ряда, с различным соотношением катионов Fe2+ и Fe3+, на особенности их взаимодействия с водной средой при разных концентрациях FeOx в водных суспензиях.
ЭСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез магнитных нанопорошков оксидов железа
Нанопорошки оксидов железа (образцы № 1, № 2, № 3, № 4) для приготовления водных суспензий получали методом совместного осаждения из водных растворов хлоридов железа с использованием различных технологических приемов, таких как барботирование аргоном при повышенной температуре, ультразвуковое воздействие, длительное выдерживание осадка в маточном растворе, добавление поверхностно-активного вещества (олеиновой кислоты) [19, 20]. Ниже приведено подробное описание методики синтеза каждого нанопорошка оксида железа.
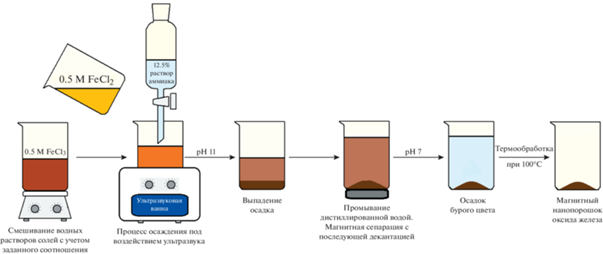
Синтез нанопорошка оксида железа с использованием ультразвуковой обработки (образец № 1). Водные растворы хлоридов железа FeCl2 и FeCl3 в молярном соотношении Fe2+ : Fe3+ = 1 : 2 смешивали при комнатной температуре и при постоянном барботировании аргоном. Молярное соотношение было выбрано согласно литературным данным [22]. Затем к раствору хлоридов железа покапельно добавляли водный раствор аммиака (12.5 мас. %) для получения наночастиц магнетита в соответствии с химической реакцией (1):
(1)
$\begin{gathered} {\text{FeC}}{{{\text{l}}}_{{\text{2}}}}{\text{ + 2FeC}}{{{\text{l}}}_{{\text{3}}}}{\text{ + 8N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH = }} \\ {\text{ = F}}{{{\text{e}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}}{\text{ + 8N}}{{{\text{H}}}_{{\text{4}}}}{\text{Cl + 4}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Затем свежеполученные наночастицы подвергали окислению для более полного перехода Fe2+ в Fe3+, предполагая получить маггемит Fe2O3:
(2)
${\text{4F}}{{{\text{e}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}}{\text{ + }}{{{\text{O}}}_{{\text{2}}}}{\text{ = 6F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}$Чтобы способствовать окислению Fe2+, процесс осаждения проводили под воздействием ультразвука (240 Вт, 40 кГц) в течение 30 мин. Полученные наночастицы извлекали из маточного раствора методом магнитной сепарации с использованием неодимового магнита, промывали дистиллированной водой и сушили при 100°C в течение 24 ч на воздухе. Схема синтеза приведена на рис. 1.
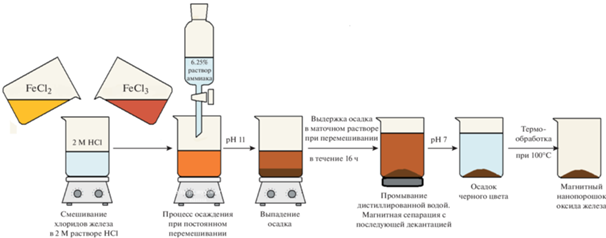
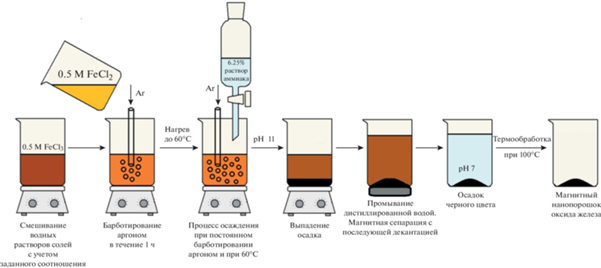
Синтез порошка оксида железа с использованием барботирования аргоном при повышенной температуре 60°С (образец № 2). Водные растворы хлоридов железа (FeCl2 и FeCl3) смешивали при комнатной температуре в молярном соотношении FeCl2 : FeCl3 = 1 : 2. Осаждение проводили водным раствором аммиака (6.25 мас. %), который покапельно добавляли к раствору хлоридов железа. Для интенсификации процесса осаждения с целью предотвращения быстрого окисления Fe2+ до Fe3+ его проводили при барботировании аргоном. В то же время процесс осаждения осуществляли при повышенной температуре 60°C, что, с одной стороны, интенсифицировало процесс осаждения, препятствуя окислению, но, с другой стороны, наоборот, могло способствовать процессу окисления. Порошок из маточного раствора извлекали методом магнитной сепарации с использованием неодимового магнита, промывали дистиллированной водой и сушили при 100°C в течение 24 ч на воздухе. Схема синтеза показана на рис. 2.
Рис. 2.
Схема синтеза нанопорошка оксида железа с использованием барботирования аргоном и при повышенной температуре (60°C).
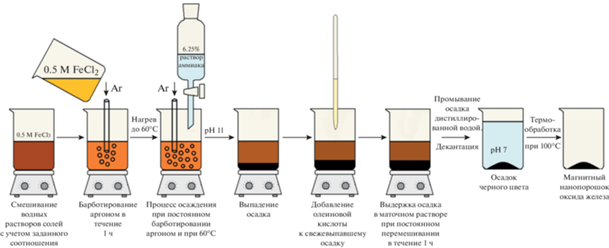
Синтез нанопорошка оксида железа, модифицированного олеиновой кислотой (образец № 3). Синтез осуществляли по той же методике, что и для рассмотренного выше образца № 2, вплоть до стадии осаждения порошка. Затем было проведено несколько операций по созданию оболочки из олеиновой кислоты. Для этого к свежеосажденному осадку добавляли 1 мл олеиновой кислоты. Полученную смесь интенсивно перемешивали магнитной мешалкой в течение 1 ч при температуре 60°C. Осадок извлекали из раствора не методом магнитной сепарации, а посредством декантации, затем промывали водой и сушили при 100°C в течение 24 ч на воздухе. Схема синтеза приведена на рис. 3.
Рис. 3.
Схема синтеза нанопорошка оксида железа с использованием барботирования аргоном, нагрева и с добавлением олеиновой кислоты.
Синтез оксида железа с использованием длительной выдержки осадка в маточном растворе (образец № 4). При синтезе нанопорошка оксида железа с использованием данной методики хлориды железа (как и в предыдущих вариантах) смешивали в заданном стехиометрическом соотношении FeCl2 : FeCl3 = 1 : 2. Отличие состояло в том, что изначально соли железа растворяли в водном растворе, подкисленном соляной кислотой (2 М). Процесс осаждения проводили 6.25% раствором аммиака. Перемешивание осуществлялось только с помощью магнитной мешалки и без каких-либо дополнительных внешних воздействий. При этом время выдержки осадка в маточном растворе составляло 16 ч. Извлечение осадка из маточного раствора проводили методом магнитной сепарации с последующей декантацией. Полученный осадок промывали дистиллированной водой и сушили в сушильном шкафу в воздушной атмосфере при 100°С. Схема синтеза нанопорошка с использованием данной методики проиллюстрирована на рис. 4.
Характеристики нанопорошков
Ранее методом рентгенофазового анализа (РФА) с использованием расчетов параметров элементарных ячеек нами было установлено, что в результате варьирования условий синтеза были получены нанопорошки оксидов железа с фазовым составом, соответствующим твердым растворам магнетит-маггемитового ряда, отличающиеся содержанием катионов Fe2+ и Fe3+ и, соответственно, катионных вакансий (табл. 1) [19]. Используя уравнение зависимости параметра элементарной ячейки (a) твердого раствора магнетит-маггемитового ряда от количества атомов железа, которое принято за x [15], была рассчитана доля вакансий соответствующих катионов железа и, соответственно, определено соотношение Fe2+/Fe3+ в твердом растворе магнетит-маггемитового ряда, приняв долю вакансий 0.33 как 100% маггемита, а долю вакансий 0 – как 100% магнетита (см. табл. 1), в соответствии с уравнением (3):
Таблица 1.
Кристаллографические данные магнитных нанопорошков, использованных для приготовления водных суспензий [5, 19, 20]
| Наименование | Состав* | Параметр элементарной ячейки a, Å*** | Количество катионных вакансий на элементарную ячейку**** | Соотношение Fe2+/Fe3+ |
ОКР, нм***** |
|---|---|---|---|---|---|
| Маггемит [23, 24] | γ-Fe2O3 | 8.336–8.339 | 0.33 | 0/2.67 | – |
| № 1 | Fe2.7O4 | 8.341(4) | 0.30 | 0.09/2.61 | ~14 |
| № 2 | Fe2.78O4 | 8.355(4) | 0.22 | 0.33/2.45 | ~20 |
| № 3 | Fe2.8O4@C17H33COOH** | 8.359(4) | 0.20 | 0.39/2.41 | ~12 |
| № 4 | Fe2.86O4 | 8.367(3) | 0.16 | 0.51/2.35 | ~14 |
| Магнетит [23, 25] | Fe3O4 | 8.396–8.397 | 0 | 1.0/2.0 | – |
* Вычислен с учетом количества катионных вакансий; ** поверхность нанопорошка оксида железа модифицирована олеиновой кислотой; *** рассчитывается из данных рентгенофазового анализа методом наименьших квадратов; **** вычислено по уравнению (3) с учетом данных о параметре элементарной ячейки (и с учетом того, что для чистого магнетита количество катионных вакансий равно 0, а для чистого маггемита – 1/3); ***** вычислено по формуле Шеррера.
Согласно данным табл. 1, нанопорошок № 1 характеризуется выраженным преобладанием Fe3+, и, следовательно, наиболее близок по фазовому составу к маггемиту; № 2 имеет фазовый состав из середины магнетит-маггемитового ряда; № 3 аналогичен № 2, но его поверхность модифицирована оболочкой из олеиновой кислоты; № 4, среди исследуемых в данной работе нанопорошков, отличается наибольшим содержанием Fe2+ и, соответственно, по своему составу наиболее близок к магнетиту. Размер первичных наночастиц можно оценить по величинам областей когерентного рассеяния (ОКР), значения которых были рассчитаны по данным рентгенофазового анализа [5, 20]. Основные характеристики нанопорошков, установленные в ходе предыдущих исследований [5, 19, 20], приведены в табл. 1. Все порошки обладали магнитными свойствами [5].
Приготовление водных суспензий
На основе синтезированных магнитных нанопорошков оксидов железа были приготовлены водные суспензии различных концентраций (0.001–100 мг/л). Исходные водные суспензии исследуемых нанопорошков с концентрацией 100 мг/л были приготовлены посредством диспергирования 3 мг порошка в 30 мл дистиллированной воды с использованием обработки в ультразвуковой ванне (240 Вт, 40 кГц, 20 мин). Суспензии меньших концентраций (10; 1; 0.1; 0.01 и 0.001 мг/л) получали из исходной суспензии путем ее последовательного разбавления и повторного ультразвукового диспергирования в условиях, аналогичных приготовлению исходной суспензии.
Методика оценки коллоидных характеристик исследуемых нанопорошков
Гидродинамический диаметр (D) и ζ-потенциал наночастиц порошков оксидов железа в приготовленных суспензиях исследовали методами динамического и электрофоретического рассеяния света с использованием анализатора размера наночастиц NanoBrook 90 Plus Zeta (кювета BI-SCP, электрод AQ-1327). Измерения проводили через 1 ч после приготовления суспензий. Перед измерением гидродинамического диаметра и ζ-потенциала для каждой суспензии измеряли величину рН с использованием рН-метра “Мультитест” ИПЛ-301 (НПП “СЕМИКО”, Россия).
Методика исследования кислотно-основных характеристик поверхности нанопорошков
Кислотно-основные характеристики поверхности нанопорошков исследовали методом динамической рН-метрии посредством измерения кинетики рН суспензии, получаемой диспергированием навесок исследуемых образцов массой 30 мг в 30 мл дистиллированной воды при перемешивании магнитной мешалкой. Измерения рН суспензии проводили с использованием рН-метра “Мультитест” ИПЛ-301 (НПП “СЕМИКО”, Россия) через 5, 10, 20, 30, 60 с и далее через каждые 30 с в интервале времени от 1 до 5 мин и через каждые 60 с в течение последующих 5 мин после погружения навески порошка.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Коллоидные характеристики водных суспензий нанопорошков оксидов железа
Изменение размера наночастиц по мере разбавления водных суспензий. Зависимость гидродинамического диаметра частиц оксидов железа различного фазового состава от концентрации суспензий представлена на рис. 5.
Рис. 5.
Зависимость гидродинамического диаметра частиц (D) оксидов железа различного фазового состава от концентрации (C) водной суспензии образцов № 1 (◆), № 2 (◼), № 3 (▲) и № 4 (⚫). Погрешность значений – это отклонение D от среднего по нескольким измерениям.
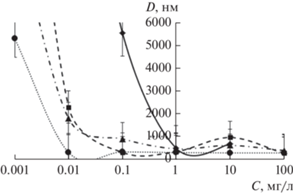
Из рис. 5 хорошо просматривается тенденция к существенному увеличению размера наночастиц и образованию агрегатов по мере разбавления суспензий. При этом чем больше соотношение катионов Fe2+/Fe3+, тем медленнее растет величина гидродинамического диаметра. Самый большой рост гидродинамического диаметра наблюдается для нанопорошка № 1, состав которого практически соответствует маггемиту (γ-Fe2O3).
Сопоставление значений гидродинамического диаметра и ζ-потенциала частиц оксидов железа различного фазового состава в зависимости от концентрации суспензий, а также рН полученных суспензий представлены в табл. 2.
Таблица 2.
Электрокинетические свойства водных суспензий исследуемых частиц оксидов железа
| Исследуемые параметры порошков |
Концентрация водной суспензии (С), мг/л | |||||
|---|---|---|---|---|---|---|
| 100 | 10 | 1 | 0.1 | 0.01 | 0.001 | |
| № 1 | ||||||
| D, нм | – | 670 ± 130 | 500 ± 200 | >5000 | >6000 | >6000 |
| ζ, мВ | – | 0 | –15.9 ± 1.7 | –22.1 ± 1.7 | –32.2 ± 3.3 | –19.9 ± 19.3 |
| рН | – | 6.7 | 6.7 | 6.5 | 6.8 | 6.6 |
| № 2 | ||||||
| D, нм | 270 ± 10 | 960 ± 20 | 340 ± 20 | 330 ± 10 | 2300 ± 900 | 1300 ± 1000 |
| ζ, мВ | 19.8 ± 4.1 | 11.4 ± 4.2 | –21.2 ± 4.4 | 0 | –28.1 ± 4.3 | –37.0 ± 4.2 |
| рН | 6.5 | 6.7 | 6.9 | 6.8 | 7.0 | 7.1 |
| № 3 | ||||||
| D, нм | 400 ± 30 | 610 ± 20 | 470 ± 40 | 900 ± 200 | 1800 ± 840 | >6000 |
| ζ, мВ | –23.0 ± 2.8 | –22.0 ± 2.9 | –60.6 ± 11.9 | –15.8 ± 11.8 | –19.9 ± 11.1 | –9.41 ± 15.3 |
| рН | 6.7 | 6.9 | 6.8 | 6.7 | 6.7 | 6.6 |
| № 4 | ||||||
| D, нм | 280 ± 3 | 290 ± 30 | 300 ± 20 | 330 ± 120 | 300 ± 40 | >5000 |
| ζ, мВ | 25.8 ± 3.04 | 0 | 0 | 0 | 0 | –11.7 |
| рН | 6.1 | 6.3 | 6.7 | 6.9 | 6.5 | 7.4 |
Из табл. 2 видно, что дисперсной фазой приготовленных суспензий на основе синтезированных нанопорошков оксидов железа являются не отдельные наночастицы оксидов железа, а их агломераты, размеры которых составляют несколько сотен нанометров. Полной дезагрегации частиц в суспензиях не удалось достичь даже несмотря на использование в процессе приготовления суспензий ультразвуковой (УЗ) обработки. При этом разбавление суспензий с применением дополнительной УЗ обработки не привело к последующей дезагрегации частиц в агломератах, как этого можно было бы ожидать, исходя из работ авторов [26, 27], а наоборот, способствовало их агломерации, особенно при низких концентрациях (0.001–0.1 мг/л). Возможно, подобное отличие связано с тем, что авторы [26, 27] дезагрегировали наночастицы, не подвергая их сушке. В нашем случае порошки были высушены, что, по-видимому, усилило склонность наночастиц к агломерации.
Кроме этого, стоит отметить, что при увеличении доли катионов Fe2+ укрупнение агрегатов наночастиц по мере разбавления суспензий, в целом, происходит менее интенсивно. В частности, следует отметить, что у частиц порошка № 4 значение ζ-потенциала равно нулю в широком диапазоне концентраций (0.01–10 мг/г), что может быть обусловлено определенным балансом между ионами железа, кислорода и ОН-группами на поверхности при данном соотношении Fe2+/Fe3+ [15, 17]. Этот факт согласуeтся с наименьшими значениями гидродинамического диаметра, наблюдаемыми для данного порошка № 4, поскольку при нулевом ζ-потенциале частицы обладают наименьшей способностью к удержанию гидратных оболочек.
Согласно литературным данным, для агрегативной устойчивости суспензий абсолютные значения ζ-потенциалов должны быть больше 30 мВ [27]. Судя по абсолютному значению ζ-потенциалов, среди исследуемых в данной работе суспензий наибольшей устойчивостью отличаются несколько суспензий: № 1 в концентрации 0.01 мг/л (ζ ≈ –32 мВ); № 2 в концентрациях 0.01 мг/л (ζ ≈ ≈ –28 мВ) и 0.001 мг/л (ζ ≈ –37 мВ); № 3 в концентрации 1 мг/л (ζ ≈ –61 мВ). Достаточно высокие значения ζ-потенциалов для крупных агломератов можно связать с образованием на их поверхности гидратных оболочек [28]. Известно, что чем прочнее гидратная оболочка, тем толще диффузный слой и тем больше ζ-потенциал [29].
Из данных табл. 2 видно, что изменение концентрации суспензий для порошков № 1 и № 3 не сказалось на знаке ζ-потенциала, который оставался отрицательным во всем исследуемом диапазоне концентраций. В то же время для порошков № 2 и № 4 наблюдался переход от положительных значений ζ-потенциала к отрицательным с переходом через нулевые значения. Нулевые значения ζ-потенциалов соответствуют изоэлектрическим точкам для данных суспензий в данных концентрациях. Изоэлектрические точки полученных суспензий находятся в диапазоне pH от 6.3 до 6.8, что согласуется с известными данными для синтетических наночастиц магнетита [16] и наночастиц магнетита и маггемита, полученных методом совместного осаждения из хлоридов железа, с использованием гидроксида аммония в качестве осадителя [18]. Как указывалось выше [18], положение изоэлектрических точек магнитных наночастиц оксидов железа может существенно изменяться в зависимости от условий синтеза наночастиц, а также от выбора прибора для измерения.
Таким образом, при приготовлении водных суспензий из сухих порошков магнитных оксидов железа, отвечающих составам твердых растворов магнетит-маггемитового ряда, затруднительно получить устойчивую суспензию даже при использовании многократной ультразвуковой обработки в связи с их сильной склонностью к агломерации как в порошках, так и затем в их суспензиях.
Исследование кислотно-основных характеристик методом динамической рН-метрии. Результаты динамической рН-метрии, характеризующие изменение рН дистиллированной воды с течением времени после диспергирования в ней исследуемых нанопорошков, представлены на рис. 6.
Рис. 6.
Изменение рН водной среды в результате взаимодействия с порошками оксидов железа № 1 (⚫), № 2 (⚪), № 3 (*) и № 4 (△).
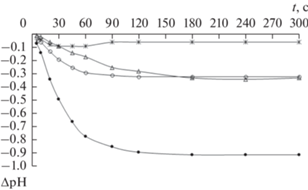
Полученные данные показали, что поверхность исходных исследуемых нанопорошков, в целом, имеет кислый характер. Наиболее резкое снижение pH водной суспензии, особенно в течение первой минуты (примерно на 0.8 при общем снижении около 0.9), наблюдалось для нанопорошка № 1. Это свидетельствует о преобладании на поверхности частиц этого порошка кислотных центров Льюиса, образованных катионами Fe3+, которые при взаимодействии с водной средой способны к присоединению ОН-групп от молекул воды по механизму:
(4)
${\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}}{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {{({\text{Fe--OH}})}^{{2 + }}} + {{{\text{H}}}^{ + }},$Суспензии порошков № 2 и № 4 характеризуются значительно менее выраженным снижением pH, при этом в течение первых 2 мин после диспергирования в воде снижение pH более значительно для порошка № 2 с промежуточным содержанием катионов Fe2+ в магнетит-маггемитовом ряду, в то время как для порошка № 4 с бóльшим содержанием катионов Fe2+ снижение рН происходит более плавно. Такой характер изменения рН может быть обусловлен присутствием на поверхности частиц этих порошков гидроксильных групп Fe–OH, имеющих близкий к амфотерному характер. В зависимости от кислотно-основных свойств среды данная группа может приобретать как положительный (при присоединении протонов в кислой среде с образованием групп Fe–OH2+), так и отрицательный заряд (вследствие отщепления протона в щелочной среде с образованием группы Fe–O–) [17], что, в свою очередь, определяет, соответственно, положительные или отрицательные значения ζ-потенциала. Следовательно, протоны и гидроксильные ионы идентифицируются как потенциалопределяющие ионы.
Для наночастиц порошка № 3, поверхность которых модифицирована олеиновой кислотой, наблюдается незначительное плавное снижение рН, что соответствует присутствию на поверхности слабо диссоциирующей олеиновой кислоты. Модификация поверхности образца олеиновой кислотой приводит к пассивации поверхностных центров, включающих атомы железа, и препятствует значительному укрупнению агломератов. По-видимому, концентрация суспензии около 1 мг/л, при которой наблюдается резкое снижение ζ-потенциала, в данном случае является критической. Выше этой концентрации наблюдается существенное снижение абсолютной величины ζ-потенциала и укрупнение агломератов частиц. Резкое снижение ζ-потенциала для суспензий данного образца при значениях рН свыше 6.7 (табл. 2) может быть связано с усилением диссоциации олеиновой кислоты при переходе от слабокислой среды к нейтральной и слабощелочной.
ЗАКЛЮЧЕНИЕ
Установлено существенное влияние на коллоидные характеристики магнитных наночастиц оксидов железа их фазового состава и концентрации водных суспензий. Показано, что при разбавлении водных суспензий на основе наночастиц оксидов железа, соответствующих составу твердых растворов магнетит-маггемитового ряда с различным соотношением катионов Fe2+/Fe3+ (0.03; 0.13; 0.16; 0.22), в диапазоне концентраций от 100 до 0.001 мг/л (в сочетании с ультразвуковым воздействием) их гидродинамические диаметры увеличиваются в 5–20 раз – от менее 500 до более 6000 нм. Увеличение содержания катионов Fe3+ приводит к более значительному росту гидродинамического диаметра наночастиц.
Разбавление суспензий от 100 до 0.001 мг/л приводит к повышению рН в диапазоне от 6.1 до 7.4, что для наночастиц оксидов железа, имеющих фазовый состав твердого раствора из середины магнетит-маггемитового ряда, сопровождалось сменой знака ζ-потенциала с положительного на отрицательный.
Исследования показали, что при взаимодействии исследуемых магнитных нанопорошков оксидов железа с водной средой они проявляли кислый характер поверхности, усиливающийся с ростом содержания Fe3+. Поверхность нанорошка, практически соответствующего фазовому составу маггемита, характеризуется преобладанием кислотных центров Льюиса, образованных катионами железа Fe3+ и обусловливающих резкое снижение pH при диспергировании порошка в воде, в то время как для нанопорошков с бóльшим содержанием Fe2+ характерны кислотные центры Бренстеда, соответствующие гидроксильным группам и более плавному снижению pH. Модифицирование поверхности наночастиц оксидов железа олеиновой кислотой привело к пассивации поверхностных групп оксидов железа и способствовало появлению отрицательного дзета-потенциала и слабокислому поведению в водной среде.
Полученные результаты демонстрируют возможность регулирования характера взаимодействия наночастиц оксидов железа с водной средой за счет варьирования фазового состава магнитных нанопорошков оксидов железа, модификации их поверхности и варьирования концентрацией водных суспензий.
Список литературы
Sankaranarayanan S.A., Thomas A., Revi N. et al. Iron oxide nanoparticles for theranostic applications – Recent advances // Journal of Drug Delivery Science and Technology. 2022. V. 70. P. 103196. https://doi.org/10.1016/j.jddst.2022.103196
Yeste M.P., Fernández-Ponce C., Félix E. et al. Solvothermal synthesis and characterization of ytterbium/iron mixed oxide nanoparticles with potential functionalities for applications as multiplatform contrast agent in medical image techniques // Ceramics International. 2022. V. 48. № 21. P. 31191–31202. https://doi.org/10.1016/j.ceramint.2022.06.194
Ezealigo U.S., Ezealigo B.N., Aisida S.O. et al. Iron oxide nanoparticles in biological systems: Antibacterial and toxicology perspective // Journal of Colloid and Interface Science Open. 2021. V. 4. P. 100027. https://doi.org/10.1016/j.jciso.2021.100027
Tombuloglu H., Slimani Y., Akhtar S. et al. The size of iron oxide nanoparticles determines their translocation and effects on iron and mineral nutrition of pumpkin (Cucurbita maxima L.) // Journal of Magnetism and Magnetic Materials. 2022. V. 564. № 1. P. 170058. https://doi.org/10.1016/j.jmmm.2022.170058
Kovalenko A.S., Nikolaev A.M., Khamova T.V. et al. Synthesis of iron oxide magnetic nanoparticles and their effect on growth, productivity, and quality of tomato // Glass Physics and Chemistry. 2021. V. 47. № 1. P. 67–74. https://doi.org/10.1134/S1087659621070063
Кропачева Т.Н., Антонова А.С., Журавлева А.Ю. Модифицирование поверхности магнитных оксидов железа фосфоновыми комплексонами // Физикохимия поверхности и защита материалов. 2020. Т. 56. № 3. С. 231–237. https://doi.org/10.31857/S0044185620030225
Икаев А.М., Мингалёв П.Г., Лисичкин Г.В. Химическое модифицирование поверхности оксидов железа кремний- и фосфорорганическими соединениями // Коллоидный журнал. 2007. Т. 69. № 6. С. 791–797.
Mikhaylov V.I., Kryuchkova A.V., Sitnikov P.A. et al. Magnetite hydrosols with positive and negative surface charge of nanoparticles: Stability and effect on the lifespan of Drosophila melanogaster // Langmuir. 2020. V. 36. № 16. P. 4405–4415. https://doi.org/10.1021/acs.langmuir.0c00605
Yang H.-M., Park C.W., Ahn T. et al. A direct surface modification of iron oxide nanoparticles with various poly(amino acid)s for use as magnetic resonance probes // Journal of Colloid and Interface Science. 2013. V. 391. P. 158–167. https://doi.org/10.1016/j.jcis.2012.09.044
Masuku M., Ouma L., Pholosi A. Microwave assisted synthesis of oleic acid modified magnetite nanoparticles for benzene adsorption // Environmental Nanotechnology, Monitoring & Management. 2021. V. 15. P. 100429. https://doi.org/10.1016/j.enmm.2021.100429
Mengesha A., Hoerres A., Mahajan P. Cytocompatibility of oleic acid modified iron oxide nanoparticles // Materials Letters. 2022. V. 323. P. 132528. https://doi.org/10.1016/j.matlet.2022.132528
Asif S., Kaur G., Sharma S. et al. Oleic acid magnetic iron oxide nanoparticles improve iron uptake by the modification of NADH-HCF (III) oxidoreductase without affecting cellular viability // Gene Reports. 2020. V. 21. P. 100837. https://doi.org/10.1016/j.genrep.2020.100837
Gambhir R.P., Rohiwal S.S., Tiwari A.P. Multifunctional surface functionalized magnetic iron oxide nanoparticles for biomedical applications: A review // Applied Surface Science Advances. 2022. V. 11. P. 100303. https://doi.org/10.1016/j.apsadv.2022.100303
Wu K., Liu J., Saha R. et al. An investigation of commercial iron oxide nanoparticles: Advanced structural and magnetic properties characterization // ACS Omega. 2021. V. 6. P. 6274–6283. https://doi.org/10.1021/acsomega.0c05845
Sun Z.-X., Su F.-W., Forsling W. et al. Surface characteristics of magnetite in aqueous suspension // Journal of Colloid and Interface Science. 1998. V. 197. № 1. P. 151–159. https://doi.org/10.1006/jcis.1997.5239
Salazar-Camacho C., Villalobos M, Luz Rivas-Sánchez M., Arenas-Alatorre J. et al. Characterization and surface reactivity of natural and synthetic magnetites // Chemical Geology. 2013. V. 347. P. 233–245. https://doi.org/10.1016/j.chemgeo.2013.03.017
Vidojkovic S.M., Rakin M.P. Surface properties of magnetite in high temperature aqueous electrolyte solutions: A review // Advances in Colloid and Interface Science. 2017. V. 245. P. 108–129. https://doi.org/10.1016/j.cis.2016.08.008
Kosmulski M. The pH dependent surface charging and points of zero charge. IX. Update // Advances in Colloid and Interface Science. 2021. V. 296. P. 102519. https://doi.org/10.1016/j.cis.2021.102519
Шилова О.А., Николаев А.М., Коваленко А.С. и др. Синтез магнитных нанопорошков оксида железа – магнетита и маггемита // Журнал неорганической химии. 2020. Т. 65. № 3. С. 398–402. https://doi.org/10.31857/S0044457X20030137
Shilova O.A., Panova G.G., Nikolaev A.M. et al. Aqueous chemical co-precipitation of iron oxide magnetic nanoparticles for use in agricultural technologies // Letters in Applied NanoBioScience. 2021. V. 10. № 2. P. 2215–2239. https://doi.org/10.33263/LIANBS102.22152239
Панова Г.Г., Шилова О.А., Николаев А.М. и др. О влиянии наночастиц оксида железа на растения в вегетативный период развития // Агрофизика. 2019. № 3. С. 40–50. https://doi.org/10.25695/ AGRPH.2019.03.07
Liu S. Wu G., Chen H.-Zh. et al. Preparation and characterization of Fe3O4/SiO2 particles for dual-particle electrophoretic display // Synthetic Metals. 2012. V. 162. №. 1–2. P. 89–94. https://doi.org/10.1016/j.synthmet.2011.11.016
Nasrazadani S., Raman A. The application of infrared spectroscopy to the study of rust systems—II. Study of cation deficiency in magnetite (Fe3O4) produced during its transformation to maghemite (γ-Fe2O3) and hematite (α-Fe2O3) // Corrosion Science. 1993. V. 34. № 8. P. 1355–1365. https://doi.org/10.1016/0010-938X(93)90092-U
Pecharroman C., Gonzalez-Carreno T., Iglesias J.E. The infrared dielectric properties of maghemite, γ-Fe2O3, from reflectance measurement on pressed powders // Physics and Chemistry of Minerals. 1995. V. 22. P. 21–29. https://doi.org/10.1007/BF00202677
Anthony J.W. Bideaux R.A., Bladh K.W. Magnetite. Handbook of Mineralogy. Chantilly. VA: Mineralogical Society of America, 2018.
Koshevaya E., Nazarovskaia D., Simakov M. et al. Surfactant-free tantalum oxide nanoparticles: Synthesis, colloid properties, and application as a contrast agent for computed tomography // Journal of Materials Chemistry B. 2020. V. 8. № 36. P. 8337–8345. https://doi.org/10.1039/D0TB01204A
Drozdov A.S., Ivanovski V., Avnir D. et al. A universal magnetic ferrofluid: Nanomagnetite stable hydrosol with no added dispersants and at neutral pH // Journal of Colloid and Interface Science. 2016. V. 468. P. 307–312. https://doi.org/10.1016/j.jcis.2016.01.061
Помогайло А.Д., Розенберг А.С., Уфлянд И.Е. Наночастицы металлов в полимерах. М.: Химия, 2000.
Добычин Д.П., Каданер Л.И., Серпинский В.В. Физическая и коллоидная химия: Учебное пособие для студентов химических и биологических специальностей педагогических институтов. М.: Просвещение, 1986.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал