Координационная химия, 2019, T. 45, № 2, стр. 120-128
Катехолаты трифенилсурьмы(V) на основе o-хинонов – производных бензо[b][1,4]-диоксинов и -диоксепинов
А. И. Поддельский 1, *, Л. С. Охлопкова 1, И. Н. Мещерякова 1, Н. О. Дружков 1, И. В. Смолянинов 2, Г. К. Фукин 1
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
, Нижний, Новгород, Россия
2 Федеральный исследовательский центр Южный научный центр РАН
, Ростов-на-Дону, Россия
* E-mail: aip@iomc.ras.ru
Поступила в редакцию 08.05.2018
После доработки 24.08.2018
Принята к публикации 15.06.2018
Аннотация
Синтезированы новые катехолатные комплексы трифенилсурьмы(V) (Etgly-3,6-DBCat)SbPh3 (I), (Propgly-3,6-DBCat)SbPh3 (II) и (Cat-3,6-DBCat)SbPh3 (III) на основе аналогов стерически-экранированного 3,6-ди-трет-бутил-о-бензохинона – 5,8-ди-трет-бутил-2,3-дигидробензо[b][1,4]диоксин-6,7-диона (L1), 6,9-ди-трет-бутил-2,3-дигидробензо[b][1,4]диоксепин-7,8-диона (L2) и 1,4-ди-трет-бутил-дибензо[b,e][1,4]диоксин-2,3-диона (L3) – производных 2,3-дигидробензо[b][1,4]диоксина, 2,3-дигидробензо[b][1,4]диоксепина и дибензо[1,4]диоксина. Показано, что при комнатной температуре катехолаты I и II реагируют с молекулярным кислородом присоединяя молекулу O2 с образованием соответствующих спироэндопероксидов IV и V. При реакции катехолата III с кислородом происходит глубокое окисление комплекса с выделением нейтрального о-бензохинона. Молекулярное строение комплексов I и III установлено методом РСА (CIF files CCDC № 1840299 (I · толуол) и 1840300 (III)).
Обратимое присоединение молекулярного кислорода катехолатами и о-амидофенолятами трифенилсурьмы(V) – один из интересных примеров необычнoгo химического поведения комплексных соединений металлов главных групп, связанный с присутствием в составе комплекса металла редокс-активного лиганда о-хинонового типа [1–5]. Как ранее было показано, наиболее активными среди катехолатов трифенилсурьмы(V) по отношению к молекулярному кислороду являются 4-метокси- и 4,5-диметокси-3,6-ди-трет-бутилкатехолаты трифенилсурьмы(V) [5–7]. Их активность обусловлена присутствием в 3,6-ди-трет-бутилкатехолатном лиганде сильных электронодонорных метоксизаместителей [7, 8]. Аналогичными свойствами должны обладать родственные катехолатные комплексы сурьмы(V) (Etgly-3,6-DBCat)SbPh3 (I), (Propgly-3,6-DBCat)SbPh3 (II) и (Cat-3,6-DBCat)SbPh3 (III) – производные диоксинов и диоксепинов (схема 1). В настоящей работе представлены результаты исследования строения и некоторых физико-химических свойств данных новых комплексов трифенилсурьмы(V).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Введение в 3,6-ди-трет-бутил-о-бензохинон этилен- и пропиленгликолевых групп приводит к получению новых о-бензохинонов, функционализированных электронодонорными группами (5,8-ди-трет-бутил-2,3-дигидробензо[b][1,4]диоксин-6,7-дион (L1) и 6,9-ди-трет-бутил-2,3-дигидро-2H-бензо[b][1,4]диоксипин-7,8-дион) (L2)) [9, 10]. 1,4-Ди-трет-бутилдибензо[b,e][1,4]диоксин-2,3-дион (L3) – производное дибензо[1,4]диоксина впервые получен в данной работе по реакции 3,6-ди-трет-бутил-о-бензохинона (3,6-Q) с пирокатехином в условиях щелочного катализа.
Катехолатные производные трифенилсурьмы(V) I–III (cхема 1) получают методом окислительного присоединения данных о-бензохинонов к трифенилсурьме. Необходимо отметить, что окисление трифенилстибина данными о-бензохинонами протекает медленнее, чем, например, 3,6-ди-трет-бутил-о-бензохиноном.
Схема 1.
Катехолаты I–III выделены в индивидуальном виде и охарактеризованы с помощью ИК, ЯМР спектроскопии, масс-спектрометрии и элементного анализа.
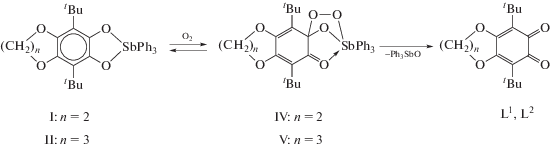
Молекулярное строение катехолатов I и III в кристаллическом состоянии установлено методом РСА (рис. 1). Центральные атомы сурьмы в обоих комплексах находятся в искаженном тетрагонально-пирамидальном окружении. Параметр τ, применяемый для описания полиэдров с КЧ 5, составляет 0.02 для I и 0.15 для III (τ = 1 в случае идеальной тригональной бипирамиды и τ = 0 для идеальной тетрагональной пирамиды [11]). Длины связи Sb(1)–C(29) апикальной фенильной группы в I и Sb(1)–C(33) в III на 0.037–0.043 и 0.028–0.035 Å, соответственно, меньше длин связей Sb–C фенильных групп в основании пирамиды (табл. 1). Геометрические характеристики редокс-активных лигандов (длины связей C–O и C–C шестичленного углеродного кольца редокс-активного лиганда) в комплексах I и III близки к значениям охарактеризованных ранее катехолатных комплексов трифенил- [12–20], дифениларил-, фенилдиарил- и триарил- [21–30] и триалкилсурьмы(V) [31–33].
Рис. 1.
Молекулярное строение катехолатов: I (а) и III (б). Атомы водорода не показаны. Эллипсоиды 50%-ной вероятности.
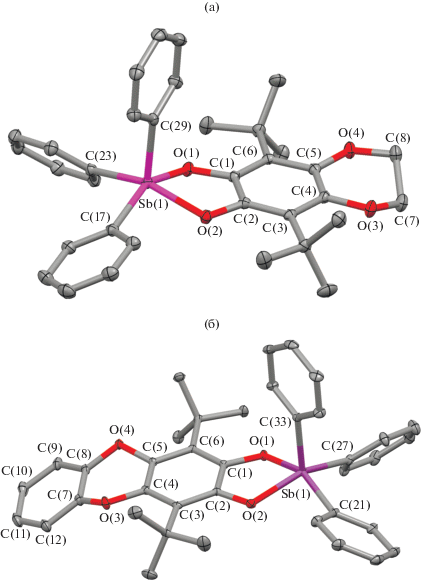
Таблица 1.
Избранные длины связей (d) и валентные углы (ω) в комплексах I и III
| Связь | d, Å | Связь | d, Å | ||
|---|---|---|---|---|---|
| I | III | I | III | ||
| Sb(1)–O(1) | 2.0030(11) | 2.0174(7) | O(4)–C(8) | 1.433(2) | 1.3753(13) |
| Sb(1)–O(2) | 2.0271(11) | 2.0201(8) | C(1)–C(2) | 1.414(2) | 1.4174(13) |
| Sb(1)–C(17) | 2.1398(17) | C(1)–C(6) | 1.397(2) | 1.3961(13) | |
| Sb(1)–C(21) | 2.1379(11) | C(2)–C(3) | 1.398(2) | 1.4002(14) | |
| Sb(1)–C(23) | 2.1464(17) | C(3)–C(4) | 1.412(2) | 1.4069(15) | |
| Sb(1)–C(27) | 2.1308(11) | C(4)–C(5) | 1.388(2) | 1.3877(14) | |
| Sb(1)–C(29) | 2.1032(16) | C(5)–C(6) | 1.415(2) | 1.4055(14) | |
| Sb(1)–C(33) | 2.1024(10) | C(7)–C(8) | 1.501(3) | 1.3849(17) | |
| O(1)–C(1) | 1.3646(19) | 1.3534(12) | C(7)–C(12) | 1.3840(16) | |
| O(2)–C(2) | 1.3722(19) | 1.3592(12) | C(8)–C(9) | 1.3829(16) | |
| C(4)–O(3) | 1.3942(19) | 1.3947(13) | C(9)–C(10) | 1.3951(18) | |
| C(5)–O(4) | 1.3885(19) | 1.3985(13) | C(10)–C(11) | 1.382(2) | |
| O(3)–C(7) | 1.421(2) | 1.3735(15) | C(11)–C(12) | 1.389(2) | |
| Угол | ω, град | ω, град | Угол | ω, град | ω, град |
| I | III | I | III | ||
| O(1)Sb(1)O(2) | 78.25(4) | 78.07(3) | O(2)Sb(1)C(27) | 146.77(4) | |
| O(1)Sb(1)C(17) | 151.05(5) | O(2)Sb(1)C(29) | 103.11(5) | ||
| O(1)Sb(1)C(21) | 156.06(4) | O(2)Sb(1)C(33) | 104.59(4) | ||
| O(1)Sb(1)C(23) | 84.33(5) | C(17)Sb(1)C(23) | 98.65(6) | ||
| O(1)Sb(1)C(27) | 84.19(4) | C(21)Sb(1)C(27) | 100.50(4) | ||
| O(1)Sb(1)C(29) | 100.76(5) | C(17)Sb(1)C(29) | 106.32(6) | ||
| O(1)Sb(1)C(33) | 97.38(4) | C(21)Sb(1)C(33) | 103.83(4) | ||
| O(2)Sb(1)C(17) | 85.74(6) | C(23)Sb(1)C(29) | 104.02(6) | ||
| O(2)Sb(1)C(21) | 85.86(4) | C(27)Sb(1)C(33) | 105.39(4) | ||
| O(2)Sb(1)C(23) | 150.00(5) | ||||
Интересно отметить особенности кристаллических упаковок данных комплексов. В кристаллической ячейке комплекса I молекулы собраны в цепочки, в которых фенильное кольцо в апикальном положении одной молекулы комплекса направлено практически в центр ароматического кольца катехолатного лиганда соседней молекулы (рис. 2а). При этом расстояния между атомами C(32) и С(4)–С(6) ароматического кольца катехолатного лиганда соседней молекулы составляют 3.630(2), 3.655(2) и 3.765(2) Å соответственно, что превышает удвоенный ван-дер-ваальсов радиус углерода (3.4 Å [34]). Расстояния между соответствующим атомом водорода H(32) и атомами С(4)–С(6) соседней молекулы составляют 2.75, 2.73, 2.88 Å соответственно, и сопоставимы с суммой ван-дер-ваальсовых атомов водорода и углерода (2.9 Å [34]). В кристаллах комплекса III соседние молекулы связаны попарно (рис. 2б); апикальные фенильные кольца молекул направлены практически в центры ароматических колец катехолатных лигандов. Расстояния между атомом С(36) фенильной группы одной молекулы и атомами С(3)–С(5) катехолатного лиганда парной молекулы составляют 3.732(2), 3.622(2) и 3.631(2) Å соответственно, между атомом H(36) при атоме C(36) одной молекулы и данными атомами углерода катехолатного лиганда соседней молекулы – 2.82, 2.70 и 2.7 Å соответственно. Таким образом, можно предположить, что цепочечные и димерные мотивы в I и III соответственно, реализуются за счет H…π-взаимодействий.
Рис. 2.
Фрагменты кристаллических упаковок комплексов I (а) и III (б). Атомы водорода не показаны. Эллипсоиды 50%-ной вероятности.
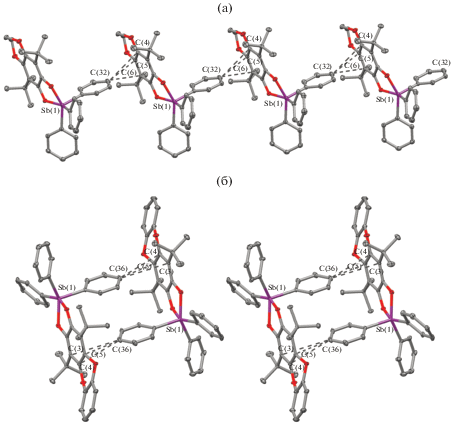
Электрохимическое поведение катехолатного комплекса II исследовано методом циклической вольтамперометрии (ЦВА) в растворе дихлорметана на СУ-электроде в анаэробных условиях. На ЦВА-кривых комплекса регистрируются две стадии окисления при потенциалах $Е _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{1}$ = 0.65, $Е _{{{\text{р а }}}}^{{\text{2}}}$ = 0.99 В, отвечающие изменению состояния окисления координированного катехолатного лиганда (рис. 3). Фиксируемые значения потенциалов окисления являются практически идентичными полученным ранее для 4,5-диметокси-3,6-ди-трет-бутилкатехолатного производного трифенилсурьмы(V) ($Е _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{1}$ = 0.65, $Е _{{{\text{р а }}}}^{{\text{2}}}$ = 1.08 В) [7, 8]. Единственным отличием является смещение потенциала окисления второго пика в катодную область на 0.09 В.
Рис. 3.
Циклические вольтамперограммы окисления комплекса II в диапазоне развертки потенциала: от ‒0.7 до 1.20 В (1); от –0.7 до 0.85 В (2). CH2Cl2, СУ-анод, 0.15 М Bu4NClO4, с = 0.002 моль/л, Ag/Ag-Cl/KCl (нас.), Ar.
В результате первого квазиобратимого одноэлектронного процесса генерируется относительно устойчивый (Ic/Ia = 0.75) во времени эксперимента ЦВА монокатионный комплекс [(Propgly-3,6-SQ)SbPh3]+. Невысокая стабильность формирующегося комплекса подтверждается появлением на обратной ветви вольтамперограммы пика восстановления (–0.69 В) продукта химической реакции, следующей за переносом электрона. Регистрируемый катодный пик можно отнести к восстановлению декоординированного о-бензохинона. Вторая стадия окисления необратима и ведет к формированию неустойчивого дикатиона [(Рropgly-3,6-BQ)SbPh3]++, в результате распада которого также образуется свободный о-бензохинон. Импульсная развертка потенциала приводит к фиксации пика восстановления декоординированного о-бензохинона (рис. 4).
Рис. 4.
Циклические вольтамперограммы окисления комплекса II в диапазоне импульсной развертки потенциала от –0.9 до 1.1 В. CH2Cl2, СУ-анод, 0.15 М Bu4NClO4, с = 0.0015 моль/л, Ag/AgCl/KCl (нас.), Ar.
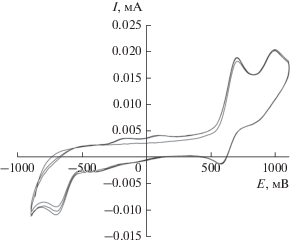
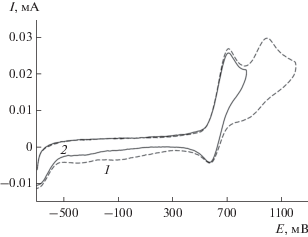
Значение потенциала окисления первого редокс-перехода $Е _{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}^{{\text{1}}}$ = 0.65 В предполагает возможность протекания реакции с кислородом воздуха с образованием спироэндопероксидного комплекса [7, 35, 36]. В присутствии кислорода воздуха происходит изменение электрохимической картины: токи двух пиков снижаются и появляется новый анодный пик при 1.35 В (рис. 5). Подобное поведение ранее фиксировалось для 4,5-диметокси-3,6-ди-трет-бутилкатехолата трифенилсурьмы(V), для которого пик окисления спироэндопероксидного комплекса наблюдался при потенциале 1.28 В. Постепенно на ЦВА появляются пики декоординированного о-бензохинона, что указывает на малую устойчивость соответствующего спироэндопероксида в данных условиях.
Рис. 5.
Циклические вольтамперограммы окисления комплекса II в диапазоне развертки потенциала от ‒ 0.6 до 1.6 В: анаэробные условия (1); аэробные условия (2). CH2Cl2, СУ-анод, 0.15 М Bu4NClO4, с = 0.0015 моль/л, Ag/AgCl/KCl (нас.).

Действительно, обнаружено, что катехолаты I–III являются высокочувствительными к кислороду воздуха. Взаимодействие этилен- и пропиленгликольсодержащих катехолатов I и II с кислородом воздуха приводит к образованию соответствующих спироэндопероксидных производных IV и V (схема 2), что находит свое отражение в изменениях, наблюдаемых в спектрах ЯМР комплексов в присутствии кислорода воздуха. Однако с течением времени происходит более глубокое окисление с высвобождением нейтральных о-бензохинонов (схема 2), что подтверждается данными спектроскопии ЯМР: при выдерживании растворов комплексов на воздухе постепенно появляются сигналы, соответствующие свободным о-бензохинонам L1 и L2 (синглеты при 1.30 м.д. – протоны трет-бутильных групп (в обоих о-бензохинонах) и синглет при 4.35 м.д. для этиленгликользамещенного о-бензохинона или квинтиплет при 2.22 м.д. и триплет при 4.25 м.д. от пропиленгликользамещенного о‑бензохинона). Полученные результаты согласуются с данными электрохимических исследований для комплекса II на воздухе: декоординация соответствующего о-бензохинона для этого комплекса происходит быстрее, чем для диметоксизамещенного производного. В случае катехолата III при реакции с кислородом воздуха практически сразу наблюдается образование свободного о-хинона L3.
Схема 2.
Таким образом, на основе о-бензохинонов – производных 2,3-дигидробензо[b][1,4]диоксина, 2,3-дигидробензо[b][1,4]диоксепина и дибензо[1,4]диоксина синтезированы новые катехолатные комплексы трифенилсурьмы(V), содержащие в положениях 4 и 5 3,6-ди-трет-бутилкатехолатного лиганда электронодонорные этиленгликолевую, пропиленгликолевую и о-фенилендиолатную группы. Показано, что при комнатной температуре катехолаты трифенилсурьмы(V) реагируют с молекулярным кислородом присоединяя молекулу O2 с образованием соответствующих спироэндопероксидов. Однако данные спироэндопероксидные производные малоустойчивы и с течением времени происходит более глубокое окисление с высвобождением нейтральных о-бензохинонов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные растворители очищали и обезвоживали по стандартным методикам [37]. о‑Бензохиноны L1 и L2 получали в соответствии с литературными методиками [9, 10]. Синтез комплексов проводили в вакуумированных ампулах в отсутствие кислорода и влаги.
Спектры ЯМР 1H и 13С регистрировали на спектрометре Bruker AVANCE DPX-200 (внутренний стандарт – тетраметилсилан, растворитель CDCl3), ИК-спектры – на Фурье-ИК-спектрометре ФСН-1201 (диапазон 400–4000 см–1, вазелиновом масле). Элементный анализ (C, H, Sb) проводили пиролитическим методом с гравиметрическим окончанием.
Электрохимические потенциалы исследуемых соединений измеряли методом ЦВА в трехэлектродной ячейке с помощью потенциостата IPC-pro в дихлорметане или ацетонитриле, в среде аргона. Рабочий электрод – стационарный стеклоуглеродный (СУ) диаметром 2 мм, вспомогательный электрод – платиновая пластина (S = 18 мм2). Электрод сравнения (Ag/AgCl/KCl) с водонепроницаемой диафрагмой. Концентрация комплекса II составила 0.0030–0.0015 моль/л. Число электронов, переносимых в ходе электродного процесса оценивали относительно стандарта – ферроцена. Скорость развертки потенциала 0.2 В с–1, фоновый электролит – 0.1 М Bu4NClO4 (99%, Acros).
РСА комплексов проведен на дифрактометре Bruker Smart Apex I (I · толуол) и Bruker D8 Quest CMOS(III) при 100 K. Структуры определены прямым методом и уточнены полноматричным методом наименьших квадратов по $F_{{hkl}}^{2}$ в анизотропном приближении для всех неводородных атомов. Атомы водорода помещены в геометрически рассчитанные положения и уточнены изотропно. Расчеты выполнены с помощью программного комплекса SHELXTL [38]. Учет поглощения проведен с помощью программы SADABS [39]. Кристаллографические данные, параметры рентгеноструктурного эксперимента и уточнения для I · толуол и III приведены в табл. 2. Структурные данные депонированы в Кембриджском центре кристаллографических данных (№ 1840299 (I · толуол) и 1840300(III); deposit@ccdc.cam.ac.uk; www: http:// www.ccdc.cam.ac.uk).
Таблица 2.
Кристаллографические данные, характеристики эксперимента и уточнения для I · толуол и III
| Параметр | Значение | |
|---|---|---|
| I · толуол | III | |
| М | 723.52 | 679.42 |
| T, K | 150(2) | 100(2) |
| Сингония | Моноклинная | Триклинная |
| Пр. гр. | P21/c | P1 |
| Параметры ячейки: | ||
| a, Å | 15.8733(6) | 11.4757(5) |
| b, Å | 9.7467(4) | 11.6202(5) |
| c, Å | 22.5386(9) | 14.0014(6) |
| α, град | 90 | 80.1740(10) |
| β, град | 97.6800(10) | 79.5290(10) |
| γ, град | 90 | 60.8220(10) |
| V, Å3 | 3455.7(2) | 1595.69(12) |
| Z | 4 | 2 |
| ρ(выч.), г/см3 | 1.391 | 1.414 |
| μ, мм–1 | 0.839 | 0.904 |
| F(000) | 1496 | 696 |
| 2θmax, град | 52 | 74.07 |
| Число измеренных отражений | 20380 | 35330 |
| Число независимых отражений | 6728 | 16159 |
| Rint | 0.0231 | 0.0228 |
| Число уточняемых параметров | 422 | 394 |
| R1, wR2 (I > 2σ(I)) | 0.0269, 0.0652 | 0.0277, 0.0665 |
| R1, wR2 (по всем данным) | 0.0323, 0.0675 | 0.0332, 0.0685 |
| GOOF по F 2 | 1.059 | 1.062 |
| Остаточная электронная плотность (max/min), e/Å3 | 1.067/–0.278 | 1.288/–0.527 |
Синтез L3. К раствору 3,6-Q (1 г, 4.5 ммоль) в ДМФА (30 мл) добавляли пирокатехин (0.5 г, 4.5 ммоль), NaOH (0.018 г, 0.45 ммоль (10 мол. %)) и MnO2 (0.1 г, 1.15 ммоль (25 мол. %)). Полученную реакционную смесь нагревали при 50°С при перемешивании в течение 6 ч. Цвет раствора менялся от зелено-бордового до красно-оранжевого. За ходом реакции следили с помощью метода ТСХ. Спустя 6 ч в реакционную смесь при постоянном перемешивании и нагревании порционно добавляли пирокатехин (1 г, 9 ммоль) до тех пор, пока в системе не осталось непрореагировавшего 3,6-Q (в соответствии с ТСХ). Затем реакционную смесь фильтровали через бумажный складчатый фильтр. В полученный раствор при перемешивании добавляли воду по каплям для осаждения L3. Выпавший продукт собирали на стеклянном фильтре Шотта № 4 и сушили на воздухе. Выход аналитически чистого продукта L3 0.44 г (30%).
ИК-спектр (ν, см–1): 1671 с, 1664 с, 1650 ср, 1633 ср, 1624 с, 1574 ср, 1556 с, 1537 ср, 1497 с, 1480 с, 1414 сл, 1397 ср, 1365 ср, 1324 с, 1308 с, 1295 с, 1201 ср, 1171 сл, 1154 сл, 1108 сл, 1053 сл, 1034 сл, 977 ср, 939 сл, 931 сл, 903 сл, 818 сл, 805 сл, 779 сл, 761 с, 647 сл., 595 сл, 563 сл. ЯМР 1H (CDCl3; δ, м.д.): 1.48 (с., 18H, t-Bu), 7.13–7.24 (м., 4H, аром. C6H4). ЯМР 13C (CDCl3; δ, м.д.): 30.45, 35.85, 116.28, 124.83, 127.49, 137.84, 149.38, 183.02.
Синтез 4,5-(этан-1,2-диолато)-3,6-ди-трет-бутил-катехолато)трифенилсурьмы(V) (I). Смешивали растворы трифенилсурьмы (0.0843 г, 0.24 ммоль) и L1 (0.0664 г, 0.24 ммоль) в растворе толуола при комнатной температуре. При перемешивании реагентов происходило постепенное изменение цвета с зеленого на желтый. После завершения реакции толуол удаляли при пониженном давлении и остаток растворяли в гексане. Полученный раствор оставляли на 2 сут при температуре –15ºС. Комплекс I, выделенный из гексана, представляет собой оранжевые кристаллы. Выход 88%.
ИК-спектр (ваз. масло; ν, см–1): 1578 ср, 1528 с, 1478 ср, 1433 ср, 1405 с, 1367 ср, 1349 с, 1306 с, 1250 ср, 1207 ср, 1173 ср, 1156 сл, 1127 ср, 1100 с, 1072 ср, 1019 ср, 998 ср, 970 ср, 954 ср, 927 сл, 916 сл, 895 ср, 848 сл, 802 сл, 782 сл, 772 ср, 738 ср, 731 с, 694 с, 675 ср, 661 сл, 588 сл, 581 сл, 568 сл, 550 сл, 518 сл, 509 сл, 499 сл, 480 сл, 461 ср, 450 ср, 439 сл, 427 сл, 417 ср, 403 ср. ЯМР 1H (CDCl3; δ, м.д.): 1.52 (с., 18H, t-Bu), 4.11 (с., 4H, –CH2CH2–), 7.36–7.50 (м., 9H, аром., SbPh3), 7.67–7.76 (м., 6H, аром., SbPh3). EI-MS (m/z): 630, 632 ([M]+).
Синтез (4,5-(пропан-1,3-диолато)-3,6-ди-трет-бутилкатехолато)трифенил-сурьмы(V) (II) выполняли путем взаимодействия 0.0882 г (0.25 ммоль) трифенилсурьмы и 0.073 г (0.25 ммоль) L2 по методу, аналогичному для комплекса I. Выход желто-оранжевого порошка II 91%.
ИК-спектр (ваз. масло, см–1): 1570 ср, 1530 с, 1471 ср, 1429 ср, 1395 с, 1360 ср, 1329 с, 1311 ср, 1242 ср, 1201 ср, 1165 ср, 1150 сл, 1127 ср, 1105 с, 1077 ср, 1023 сл, 995 ср, 965 ср, 952 сл, 923 сл, 910 сл, 891 ср, 847 сл, 785 сл, 774 с, 735 ср, 730 с, 691 с, 673 сл, 657 сл, 580 сл, 571 сл, 540 сл, 520 сл, 496 сл, 477 сл, 460 ср, 450 ср, 441 сл, 419 сл, 405 ср. ЯМР 1H (CDCl3; δ, м.д.): 1.53 (с., 18H, t-Bu), 2.04 (квинт., 3J(H,H) = 5.0 Гц, 2H, ‒CH2CH2CH2–), 3.90 (т., 3J(H,H) = 5.0 Гц, 4H, ‒CH2CH2CH2–), 7.38–7.52 (м., 9H, аром., SbPh3), 7.67–7.78 (м., 6H, аром., SbPh3). EI-MS (m/z): 644, 646 ([M]+).
Синтез (4,5-(фенилен-1,2-диолато)-3,6-ди-трет-бутилкатехолато)трифенил- сурьмы(V) (III) выполняли путем взаимодействия 0.163 г (0.5 ммоль) L3 и 0.177 г (0.5 ммоль) трифенилсурьмы по методу, аналогичному для комплекса I. Выход оранжевого порошка III 80%.
ЯМР 1H (CDCl3; δ, м.д.): 1.62 (с., 18H, t-Bu), 6.90 (ш.с., 4H, аром. C6H4), 7.40–7.62 (м., 9H, аром., SbPh3), 7.66–7.82 (м., 6H, аром., SbPh3).
ЯМР 13C (CDCl3, δ, м.д.): 31.99, 36.34, 115.43, 120.13, 122.87, 129.14, 131.09, 134.90, 136.25, 137.79, 141.54, 145.14. EI-MS (m/z): 678, 680 ([M]+).
Синтез 4,5-(этан-1,2-диолато)-2-оксо-3,6-ди-трет-бутилциклогекса-3,5-диен-1-пероксо-1-олато-O,O',O'')трифенилсурьмы (V) [(Etgly-L)(O2)SbPh3] (IV) и 4,5-(пропан-1,3-диолато)-2-оксо-3,6-ди-трет-бутилциклогекса-3,5-диен-1-пероксо-1-олато-O',O'') трифенилсурьмы (V) [(Propgly-L)(O2)SbPh3] (V) выполняли путем растворения соответствующих исходных катехолатов I и II в дейтерохлороформе на воздухе и выдерживания полученного раствора в течение нескольких часов.
IV: ЯМР 1H (CDCl3, δ, м.д.): 1.29 (ш.с., 18 H, t‑Bu), 4.28 (с, 4Н, O–CH2–CH2–O), 7.30–7.80 (м., 15H, аром., SbPh3).
V: ЯМР 1H (CDCl3; δ, м.д.): 1.29 (ш.с., 18 H, t‑Bu), 2.19 (м., 2Н, O–CH2–CH2–CH2–O), 4.21 (м., 4Н, O–CH2–CH2–CH2–O), 7.30–7.80 (м., 15H, аром., SbPh3).
Работа выполнена с использованием научного оборудования Центра коллективного пользования “Аналитический центр ИМХ РАН”. Рентгенодифракционные исследования комплексов проведены в рамках госзадания (Тема № 44.2, рег. № АААА-А16-116122110053-1).
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 16-33-60157 мол_а_дк).
Список литературы
Abakumov G.A., Poddel’sky A.I., Grunova E.V. et al. // Angew. Chem. Int. Ed. 2005. V. 44. P. 2767.
Cherkasov V.K., Abakumov G.A., Grunova E.V. et al. // Chem. Eur. J. 2006. V. 12. № 14. P. 3916.
Poddel’sky A.I., Kurskii Yu.A., Piskunov A.V. et al. // Appl. Organomet. Chem. 2011. V. 25. № 3. P. 180.
Fukin G.K., Baranov E.V., Jelsch C. et al. // J. Phys. Chem. A. 2011. V. 115. № 29. P. 8271.
Абакумов Г.А., Черкасов В.К., Грунова Е.В. и др. // Докл. Акад. Наук. 2005. Т. 405. № 2. С. 199.
Поддельский А.И., Смолянинов И.В., Курский Ю.А. и др. // Изв. АН. Сер. хим. 2009. № 3. С. 520.
Смолянинов И.В., Поддельский А.И., Берберова Н.Т. и др. // Коорд. химия. 2010. Т. 36. № 9. С. 650 (Smo-lyaninov I.V., Poddel’skiy A.I., Berberova N.T. et al. // Russ. J. Coord. Chem. 2010. V. 36. P. 644. doi 10.1134/S1070328410090022).
Смолянинов И.В., Поддельский А.И., Смолянинова С.А. и др. // Журн. общ. химии. 2014. Т. 84. № 9. С. 1523.
Прокофьева Т.И., Вольева В.Б., Прокофьев А.И. и др. // Хим. гетероцикл. соед. 2000. Т. 36. № 8. С. 1057.
Шурыгина М.П., Дружков Н.О., Арсеньев М.В. и др. // Журн. орган. химии. 2011. Т. 47. № 4. С. 490.
Addison A.W., Rao T.N., Reedijk J. et al. // Dalton Trans. 1984. P. 1349.
Hall M., Sowerby D.B. // J. Am. Chem. Soc. 1980. V. 102. P. 628.
Holmes R.R., Day R.O., Chandrasekhar V. et al. // Inorg. Chem. 1987. V. 26. P. 163.
Poddel’sky A.I., Baranov E.V., Fukin G.K. et al. // J. Organomet. Chem. 2013. V. 733. P. 44.
Поддельский А.И., Илякина Е.В., Смолянинов И.В. и др. // Изв. АН. Сер. хим. 2014. № 4. С. 923.
Протасенко Н.А., Поддельский А.И., Смолянинов И.В. и др. // Изв. АН. Сер. хим. 2014. № 4. С. 930.
Poddel’sky A.I., Smolyaninov I.V., Fukin G.K. et al. // J. Organomet. Chem. 2016. V. 824. P. 1.
Poddel’sky A.I., Arsenyev M.V., Astaf’eva T.V. et al. // J. Organomet. Chem. 2017. V. 835. P. 17.
Поддельский А.И., Арсеньев М.В., Охлопкова Л.С. и др. // Коорд. химия. 2017. Т. 43. № 12. С. 744 (Poddel’sky A.I., Arsen’ev M.V., Okhlopkova L.S. et al. // Russ. J. Coord. Chem. 2017. V. 43. P. 843. doi 10.1134/S1070328417120089).
Арсеньев М.В., Охлопкова Л.С., Поддельский А.И. и др. // Коорд. химия. 2018. Т. 44. № 1. С. 71 (Arsen’ev M.V., Okhlopkova L.S., Poddel’skii A.I. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 162. doi 10.1134/ S1070328418020021).
Holmes R.R., Day R.O., Chandrasekhar V. et al. // Inorg. Chem. 1987. V. 26. P. 157.
Fukin G.K., Baranov E.V., Poddelskii A.I. et al. // ChemPhysChem. 2012. V. 13. P. 3773.
Ke I.-Sh., Gabbai F.P. // Inorg.Chem. 2013. V. 52. P. 7145.
Jones J.S., Wade C.R., Gabbai F.P. // Angew. Chem. Int. Ed. 2014. V. 53. P. 8876.
Hirai M., Gabbai F.P. // Chem. Sci. 2014. V. 5. P. 1886.
Poddel’sky A.I., Smolyaninov I.V., Berberova N.T. et al. // J. Organomet. Chem. 2015. V. 789–790. P. 8.
Hirai M., Gabbai F.P. // Angew. Chem. Int. Ed. 2015. V. 54. P. 1205.
Tofan D., Gabbai F.P. // Chem. Sci. 2016. V. 7. P. 6768.
Poddel’sky A.I., Druzhkov N.O., Fukin G.K. et al. // Polyhedron. 2017. V. 124. P. 41.
Chen C.-H., Gabbai F.P. // Angew. Chem. Int. Ed. 2017. V. 56. P. 1799.
Фукин Г.К., Захаров Л.Н., Домрачев Г.А. и др. // Изв. АН СССР. Сер. хим. 1999. С. 1744.
Poddel’sky A.I., Somov N.V., Druzhkov N.O. et al. // J. Organomet. Chem. 2011. V. 696. P. 517.
Poddel’sky A.I., Smolyaninov I.V., Fukin G.K. et al. // J. Organomet. Chem. 2018. V. 867. P. 238.
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015.
Poddel’sky A.I., Smolyaninov I.V., Kurskii Y.A. et al. // J. Organomet. Chem. 2010. V. 695. № 8. P. 1215.
Смолянинова С.А., Поддельский А.И., Смолянинов И.В. и др. // Коорд. химия. 2014. Т. 40. № 5. С. 274 (Smolyaninova S.A., Poddel’sky A.I., Smolyaninov I.V. et al. // Russ. J. Coord. Chem. 2014. V. 40. P. 273. doi 10.1134/S107032841405011X).
Гордон А., Форд Р. Спутник химика. М: Мир, 1976. С. 437.
Sheldrick G.M. SHELXTL. Version 6.14. Structure Determination Software Suite, Madison (WI, USA): Bruker AXS, 2003.
Sheldrick G.M. SADABS. Version 2012/1. Bruker/Siemens Area Detector Absorption Correction Program. Madison (WI, USA): Bruker AXS, 2012.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия