Координационная химия, 2019, T. 45, № 2, стр. 67-78
Новые координационные полимеры Zn(II) и Cd(II) с 1,2-бензолдикарбоновой кислотой: синтез и строение
А. А. Витиу 1, 2, Э. Б. Коропчану 2, 3, П. Н. Боурош 1, 3, *
1 нститут прикладной физики
Кишинев, Республика Молдова
2 Институт химии
Кишинев, Республика Молдова
3 Тираспольский государственный университет
Кишинев, Республика Молдова
* E-mail: bourosh.xray@phys.asm.md
Поступила в редакцию 20.02.2018
После доработки 15.06.2018
Принята к публикации 14.05.2018
Аннотация
С целью синтеза координационных полимеров Zn(II) и Cd(II) использована 1,2-бензолдикарбоновая (фталевая) кислота (1,2-BdcН2) и бипиридиновые лиганды. В результате проведена целенаправленная сборка четырех комплексов, структура которых исследована методом РСА. Три из полученных соединений – новые координационные полимеры [Zn2(1,2-Bdc)2(Bpe)2]n · 0.25n(Dmf) · 0.25nH2O (I), [Zn2(1,2-Bdc)2(Bpp)2]n (II), [Cd(1,2-Bdc)(Bpp)(H2O)]n (III) (Bpe = биc(4-пиридил)этан, Bpp = 1,2-бис(4-пиридил)пропан, Dmf = диметилформамид) (CIF files CCDC № 1824264 (I), 1824265 (II), 1824266 (III)), четвертое – известное соединение Cd(II) – [Cd(1,2-Bdc)(H2O)]n. В результате исследования структуры I–III выявлена размерность полимеров: для Zn(II) – 3D, для Cd(II) – 2D. В I и II найдены различные формы координационных полиэдров Zn(II), а в I–III обнаружены разные способы координирования к металлам дважды депротонированного лиганда (1,2-Bdc)2–.
В последние десятилетия проблема дизайна и рационального синтеза координационных полимеров на основе самосборки ионов металлов и смешанных органических лигандов – одна из самых востребованных, включая исследования материалов с нецентросимметричными структурами [1, 2]. При этом разумный выбор органических лигандов – одна из основ в стратегии построения координационных полимеров с интригующими топологиями и перспективными свойствами. Для изменения размерности координационных соединений широко используют комбинирование различных карбоновых кислот с ароматическими N-донорными лигандами бипиридинового типа, которые могут функционировать как мостиковые лиганды, способные образовывать высокоразмерную архитектуру [3–5]. Из лигандов типа бипиридина особый интерес представляют гибкие, такие как 1,2-биc(4-пиридил)этан (Bpe) и 1,2-бис(4-пиридил)пропан (Bpp). Они могут принимать различные конформации из-за относительных ориентаций метиленовых групп между двумя пиридиновыми кольцами [6]. Анализ Кембриджской базы структурных данных (КБСД) [7] показывает, что до настоящего времени зарегистрировано 27 соединений переходных металлов с остатками 1,2-дикарбоновой кислотой (1,2-Bdc)2– и лигандами типа бипиридина: (собственно бипиридин (Bipy), Bpe, Bpp и биc(4-пиридил)этeн), 21 из которых – соединения с Biру. При этом восемь комплексов Zn(II) [8–13] и два – соединения Cd(II) [14, 15], только пять не содержат Bipy [8–10]. Часть соединений этого класса кристаллизуются в нецентросимметричных пр. гр., что предполагает получение соединений с полезными физическими свойствами, такими как генерация второй гармоники (SHG), сегнетоэлектричество, пьезо- и пироэлектричество. В результате эти комплексы можно использовать для электронных и нелинейных оптических устройств (NLO), обработки сигналов и хранение информации [16, 17].
С целью рационального синтеза функциональных координационных полимеров нас заинтересовали соединения Zn(II) и Cd(II) с 1,2-бензолдикарбоновой кислотой cодержащие Bpe и Bpp. В результате получены четыре соединения, три из которых – новые координационные полимеры: [Zn2(1,2-Bdc)2(Bpe)2]n · 0.25n(Dmf) · 0.25nH2O (I), [Zn2(1,2-Bdc)2(Bpp)2]n (II), [Cd(1,2-Bdc)(Bpp)(H2O)]n (III) (Dmf = диметилформамид), четвертое – известное соединение Cd(II) [Cd(1,2-Bdc)(H2O)]n [18]. При этом не удалось получить соединение Cd(II) с (1,2-Bdc)2– и Bpe, но удалось получить новое соединение Zn(II) c (1,2-Bdc)2– и Bpp, хотя в КБСД есть два соединения этого металла с этими же лигандами [8, 9]. Настоящая работа – продолжение исследований соединений переходных металлов с карбоновыми кислотами и лигандами класса бипиридина [19].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений I–III проводили в гидротермальных условиях.
Синтез I. Смесь 1,2-BdcH2 (0.18 г, 1 ммоль), Zn(BF4)2 · nH2O (0.24 г, 1 ммоль), Bpe (0.18 г, 1 ммоль), воды (3 мл), метанола (3 мл) и Dmf (5 капель) герметизировали в 8 мл реактора с футеровкой из тефлона и нагревали в автоклаве при 120°C в течение 48 ч. Затем автоклав медленно охлаждали до комнатной температуры. Бесцветные кристаллы, пригодные для РСА, отфильтровывали из раствора. Кристаллы растворимы в метаноле, этаноле, Dmf и нерастворимы в эфире. Выход 21%.
| Найдено, %: | С 84.17; | Н 6.00; | N 8.81. |
| Для C40.75H34.25N4.25O8.50Zn2 | |||
| вычислено, %: | C 83.57; | H 5.94; | N 8.40. |
Синтез II. Смесь 1,2-BdcH2 (0.18 г, 1 ммоль), Zn(BF4)2 · nH2O (0.24 г, 1 ммоль), Bpp (0.15 г, 1 ммоль), воды (3 мл), метанола (3 мл) и Dmf (5 капель) герметизировали в 8 мл реактора с футеровкой из тефлона и нагревали в автоклаве при 120°C в течение 48 ч. Затем автоклав медленно охлаждали до комнатной температуры. Беcцветные кристаллы, пригодные для РСА, отфильтровывали из раствора. Кристаллы растворимы в метаноле, этаноле, Dmf и нерастворимы в эфире. Выход 25%.
Синтез III. Смесь 1,2-BdcH2 (0.18 г, 1 ммоль), Cd(BF4)2 · nH2O (0.24 г, 1 ммоль), Bpp (0.15 г, 1 ммоль), воды (3 мл), метанола (3 мл) и Dmf (10 капель) герметизировали в 8 мл реактора с футеровкой из тефлона и нагревали в автоклаве при 120°C в течение 24 ч. Затем автоклав медленно охлаждали до комнатной температуры. Беcцветные кристаллы, пригодные для РСА, отфильтровывали из раствора. Кристаллы растворимы в метаноле, этаноле, Dmf и нерастворимы в эфире. Выход 30%.
Все химические вещества и растворители приобретали у Aldrich и использовали без дополнительной очистки.
РСА I–III. Рентгеновские дифракционные данные измерены на дифрактометре Xcalibur E (графитовый монохроматор, MoKα излучение) при комнатной температуре. Определение параметров элементарной ячейки и обработка экспериментальных данных выполнены по программе CrysAlis Oxford Diffraction Ltd. [20]. Структура соединений I–III определена прямыми методами и уточнена методом наименьших квадратов в анизотропном полноматричном варианте для неводородных атомов (SHELX-97) [21]. Для определения структуры II иcпользованы экспериментальные данные, полученные с двойникового кристалла. В структуре соединения III для пропанового фрагмента лиганда Bpp определено разупорядочение по двум позициям в соотношении 1 : 1. Позиции атомов водорода, связанные с атомами кислорода, получены из разностных синтезов Фурье, положения всех остальных атомов водорода рассчитаны геометрически. Характеристики эксперимента и уточнения структуры I–III приведены в табл. 1, межатомные расстояния и валентные углы в координационных узлах – табл. 2, геометрические параметры водородных связей (ВС) – в табл. 3. Позиции и тепловые параметры атомов соединений депонированы в КБСД (CIF files CCDC № 1824264 (I), 1824265 (II), 1824266 (III); deposit@ccdc.ca.ac.uk или www.ccdc.cam.ac.uk/ conts/retrieving.html).
Таблица 1.
Кристаллографические данные и характеристики эксперимента для структуры I–III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| М | 850.21 | 855.49 | 492.79 |
| Сингония | Моноклинная | Гексагональная | Моноклинная |
| Пр. гр. | P21/n | P61 | P21/n |
| а, Å | 12.4678(4) | 12.1988(6) | 10.5046(3) |
| b, Å | 17.8150(10) | 12.1988(6) | 10.1790(3) |
| с, Å | 20.6837(11) | 49.197(4) | 18.2972(5) |
| β, град | 96.237(3) | 90 | 103.166(3) |
| V, Å3 | 4566.9(4) | 6340.2(6) | 1905.02(9) |
| Z | 4 | 6 | 4 |
| ρ(выч.), г/см3 | 1.237 | 1.344 | 1.718 |
| μ, мм–1 | 1.101 | 1.189 | 1.183 |
| F(000) | 1746 | 2640 | 992 |
| Размеры кристалла, мм | 0.4 × 0.15 × 0.1 | 0.4 × 0.2 × 0.1 | 0.4 × 0.36 × 0.12 |
| Область θ, град | 2.93–25.00 | 3.14–25.00 | 3.04–25.50 |
| Интервалы индексов отражений | –14 ≤ h ≤ 10, –13 ≤ k ≤ 21, –24 ≤ l ≤ 22 |
–14 ≤ h ≤ 5, –10 ≤ k ≤ 13, –35 ≤ l ≤ 57 |
–12 ≤ h ≤ 8, –12 ≤ k ≤ 10, –21 ≤ l ≤ 22 |
| Число измеренных/независимых рефлексов (Rint) | 15 594/8008 (0.0466) | 12 931/6019 (0.0703) | 6426/3532 (0.0216) |
| Заполнение, % | 99.5 | 99.7 | 99.4 |
| Число рефлексов с I > 2σ(I) | 4928 | 3269 | 3003 |
| Число уточняемых параметров | 512 | 459 | 271 |
| GOOF | 1.007 | 1.009 | 1.003 |
| R фактор (I > 2σ(I)) | R1 = 0.0770, wR2 = 0.2138 |
R1 = 0.0892, wR2 = 0.2129 |
R1 = 0.0342, wR2 = 0.0813 |
| R фактор (по всему массиву) | R1 = 0.1305, wR2 = 0.2461 |
R1 = 0.1536, wR2 = 0.2499 |
R1 = 0.0428, wR2 = 0.0858 |
| Δρмax/ρмin, e Å–3 | 0.916/–0.430 | 0.596/–0.356 | 0.621/–0.940 |
Таблица 2.
Межатомные расстояния и валентные углы в координационных полиэдрах Zn(II) и Cd(II) в I–III*
| Связь | d, Å | Угол | ω, град | Угол | ω, град |
|---|---|---|---|---|---|
| I | |||||
| Zn(1)–O(1) | 1.969(5) | O(1)Zn(1)O(5) | 97.8(2) | O(5)Zn(1)N(1B) | 117.2(2) |
| Zn(1)–O(5) | 1.932(6) | O(1)Zn(1)N(A) | 126.3(2) | N(1A)Zn(1)N(1B) | 105.3(2) |
| Zn(1)–N(1A) | 2.029(5) | O(1)Zn(1)N(1B) | 106.4(2) | ||
| Zn(1)–N(1B) | 2.036(6) | O(5)Zn(1)N(1A) | 104.7(2) | ||
| Zn(2)–O(4)#1 | 1.945(4) | O(4)#1Zn(2)O(7)#2 | 98.4(2) | O(7)#2Zn(2)N(2A) | 119.0(2) |
| Zn(2)–O(7)#2 | 1.953(4) | O(4)#1Zn(2)N(1C) | 118.4(2) | N(1C)Zn(2)N(2A) | 108.6(2) |
| Zn(2)–N(1C) | 2.017(6) | O(4)#1Zn(2)N(2A) | 105.8(2) | ||
| Zn(2)–N(2A) | 2.021(5) | O(7)#2Zn(2)N(1C) | 107.0(2) | ||
| II | |||||
| Zn(1)–O(1) | 1.94(1) | O(1)Zn(1)O(5) | 103.4(8) | O(5)Zn(1)N(2A)#1 | 97.6(7) |
| Zn(1)–O(5) | 1.89(2) | O(1)Zn(1)N(1A) | 108.4(5) | N(1A)Zn(1)N(2A)#1 | 104.4(4) |
| Zn(1)–N(1A) | 2.07(1) | O(1)Zn(1)N(2A)#1 | 120.6(5) | ||
| Zn(1)–N(2A)#1 | 2.03(1) | O(5)Zn(1)N(1A) | 123.4(7) | ||
| Zn(2)–O(3) | 1.95(1) | O(3)Zn(2)O(7)#3 | 140(1) | N(1B)Zn(2)O(7)#3 | 103(1) |
| Zn(2)–O(7)#3 | 2.23(3) | O(3)Zn(2)O(8)#3 | 92.3(7) | N(2B)#2Zn(2)O(7)#3 | 95(3) |
| Zn(2)–O(8)#3 | 2.46(3) | O(3)Zn(2)N(1B) | 99.6(5) | N(1B)Zn(2)O(8)#3 | 95.2(7) |
| Zn(2)–N(1B) | 2.055(8) | O(3)Zn(2)N(2B)#2 | 114(3) | N(2B)#2Zn(2)O(8)#3 | 148(3) |
| Zn(2)–N(2B)#2 | 2.03(5) | O(7)#3Zn(2)O(8)#3 | 53.5(4) | N(2B)#2Zn(2)N(1B) | 97(2) |
| III | |||||
| Cd(1)–O(1) | 2.349(3) | O(1)Cd(1)O(2) | 54.70(9) | O(3)#1Cd(1)O(4)#1 | 53.83(9) |
| Cd(1)–O(2) | 2.430(3) | O(1)Cd(1)O(3)#1 | 85.97(9) | O(3)#1Cd(1)O(1w) | 123.9(1) |
| Cd(1)–O(3)#1 | 2.355(3) | O(1)Cd(1)O(4)#1 | 139.34(9) | O(3)#1Cd(1)N(1) | 101.1(1) |
| Cd(1)–O(4)#1 | 2.483(3) | O(1)Cd(1)O(1w) | 150.1(1) | O(3)#1Cd(1)N(2)#2 | 92.3(1) |
| Cd(1)–O(1w) | 2.463(3) | O(1)Cd(1)N(1) | 94.8(1) | O(1w)Cd(1)O(4)#1 | 70.5(1) |
| Cd(1)–N(1) | 2.349(3) | O(1)Cd(1)N(2)#2 | 98.5(1) | N(1)Cd(1)O(4)#1 | 88.1(1) |
| Cd(1)–N(2)#2 | 2.369(3) | O(2)Cd(1)O(3)#1 | 139.59(9) | N(2)#2Cd(1)O(4)#1 | 90.0(1) |
| O(2)Cd(1)O(4)#1 | 165.90(9) | N(1)Cd(1)O(1w) | 82.3(1) | ||
| O(2)Cd(1)O(1w) | 95.53(9) | N(2)#2Cd(1)O(1w) | 80.0(1) | ||
| O(2)Cd(1)N(1) | 92.0(1) | N(1)Cd(1)N(2)#2 | 161.8(1) | ||
| O(2)Cd(1)N(2)#2 | 85.6(1) | ||||
Таблица 3.
Геометрические параметры водородных связей в I–III
| D–H···A | Расстояние, Å | Угол DHA, град |
Симметрические преобразования для атомов А | ||
|---|---|---|---|---|---|
| D–H | H···A | D···A | |||
| I | |||||
| O(1w)–H(1)···O(2) | 0.83 | 2.07 | 2.87(3) | 162 | x, y, z |
| O(1w)–H(2)···O(8) | 0.85 | 2.15 | 3.00(3) | 178 | –x + 3/2, y – 1/2, –z + 1/2 |
| C(1)–H···O(8) | 0.93 | 2.47 | 3.199(9) | 136 | –x + 3/2, y – 1/2, –z + 1/2 |
| C(4)–H···O(4) | 0.93 | 2.61 | 3.523(8) | 166 | x – 1, y, z |
| C(9)–H···O(5) | 0.93 | 2.59 | 3.493(8) | 163 | –x + 3/2, y – 1/2, –z + 1/2 |
| C(10)–H···O(3) | 0.93 | 2.63 | 3.335(9) | 134 | –x + 3/2, y – 1/2, –z + 1/2 |
| C(11)–H···O(8) | 0.93 | 2.30 | 3.091(8) | 143 | –x + 1/2, y – 1/2, –z + 1/2 |
| C(12)–H···O(3) | 0.93 | 2.48 | 3.369(9) | 161 | x – 1, y, z |
| C(2A)–H···O(1D) | 0.93 | 2.69 | 3.560(9) | 156 | x + 1, y, z |
| C(5A)–H···O(6) | 0.93 | 2.35 | 3.181(10) | 148 | x, y, z |
| C(1B)–H···O(6) | 0.93 | 2.41 | 3.32(1) | 165 | –x + 1/2, y – 1/2, –z + 1/2 |
| C(4B)–H···O(1D) | 0.93 | 2.77 | 3.616(9) | 152 | –x + 1/2, y – 1/2, –z + 1/2 |
| II | |||||
| C(5A)–H···O(2) | 0.93 | 2.47 | 3.28(2) | 147 | x, y, z |
| C(11A)–H···O(2) | 0.93 | 2.21 | 2.99(2) | 140 | y, –x + y, z – 1/6 |
| C(1B)–H···O(3) | 0.93 | 2.52 | 3.10(2) | 120 | x, y, z |
| C(11B)–H···O(7) | 0.93 | 2.59 | 3.18(2) | 121 | x, y + 1, z |
| III | |||||
| O(1w)–H(1)···O(4) | 0.84 | 2.31 | 2.855(4) | 123 | –x + 1/2, y + 1/2, –z + 1/2 |
| O(1w)–H(2)···O(2) | 0.87 | 1.81 | 2.672(4) | 173 | –x, –y + 2, –z |
| C(10)–H···O(4) | 0.93 | 2.55 | 3.461(5) | 165 | x + 1/2, –y + 3/2, z – 1/2 |
| C(12)–H···O(1) | 0.93 | 2.51 | 3.337(5) | 149 | –x + 1/2, y – 1/2, –z + 1/2 |
| C(18)–H···O(3) | 0.93 | 2.50 | 3.354(5) | 152 | x + 1, y, z |
| C(19)–H···O(1) | 0.93 | 2.42 | 3.296(5) | 157 | –x + 3/2, y – 1/2, –z + 1/2 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В результате РСА было определено, что взаимодействие солей Zn(II) и Cd(II) с участием анионов BF4‾ с 1,2-BdcH2 и Bpe или Bpp привело к образованию четырех координационных полимеров. Соединения I–III (схема) новые и содержат оба органических лиганда, тогда как в реакции между Cd(II), 1,2-BdcH2 и Bpe получился известный координационный полимер [18]. Все полученные материалы – координационные полимеры, отличающиеся по составу, топологии и размерности.
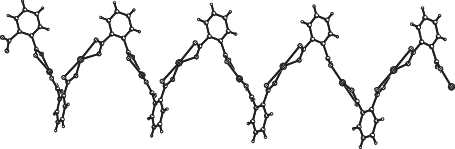
Coединение I cодержит в независимой части элементарной ячейки фрагмент координационного 3D-полимера [Zn2(1,2-Bdc)2(Bpe)2]n, образованный двумя кристаллографически независимыми атомами Zn(1) и Zn(2), двумя дважды депротонированными лигандами (1,2-Bdc)2–, тремя нейтральными лигандами Bpe, два из которых центросимметричные, и кристаллизационными молекулами Dmf, H2O в соотношении металл : Dmf : H2O = 2 : 0.25 : 0.25. Координационные полиэдры (КП) обоих атомов Zn(1) и Zn(2) в I – тетраэдры, образованные донорным набором атомов N2O2; атомы азота принадлежат двум кристаллографически различным лигандам Вpe, кислорода – двум различным (1,2-Bdc)2– (рис. 1). В КП атомов Zn(1) и Zn(2) межатомные расстояния Zn–O 1.945(4)–1.969(5), Zn–N 2.017(6)–2.036(6) Å (табл. 2) соответствуют значениям, найденным в соединениях с тетраэдрическим окружением атомов цинка (КЧ 4) [8]. Анализ КБ-СД показывает, что КЧ атомов Zn(II) в соединениях этого класса, содержащих Biру, может принимать различные значения (и 5, и 6) [11, 12]. В координационном полимере I два независимых лиганда (1,2-Bdc)2– координируются к металлу по бидентатно-мостиковому типу (рис. 1), хотя известно, что этот лиганд может координироваться разнообразно: монодентатно, бидентатно-хелатно и различными мостиковыми способами – μ2, μ3, μ4 [22, 23]. В результате, в кристалле I образуются спиральные цепочки, расположенные вдоль параметра a элементарной ячейки, а межатомные расстояния Zn(1)···Zn(2)* между атомами, связанными лигандами (1,2-Bdc)2–, равны 6.367 и 6.575 Å (рис. 2а). Лиганды Bpe в I координируются к атомам металла бидентатно-мостиковым способом через концевые атомы азота (рис. 2б), связывая между собой как атомы Zn(1) c Zn(2) (рис. 2б), так и Zn(1) c Zn(1)*, Zn(2) c Zn(2)*; межатомные расстояния Zn(1)···Zn(2), Zn(1)···Zn(1)* и Zn(2)···Zn(2)* равны, соответственно, 13.228, 13.279 и 13.383 Å. Лиганды Bpe в кристалле I хоть и различаются по симметрии, но практически подобны. В нецетросимметричном лиганде торсионный угол ССН2СН2С, содержащий этановый фрагмент, равен 176°, а двугранный угол между плоскостями ароматических колец – 2.8°; эти данные не сильно отличаются от подобных в центросимметричных лигандах Вpe. В кристале I можно выделить двумерную сетку, в формировании которой участвуют оба лиганда (1,2-Вdc)2– и нецентросимметричный лиганд Вpe (рис. 3а). Сетку достраивают до трехмерного каркаса центросимметричные лиганды Вpe (рис. 3б). Такое же строение найдено в координационном 3D-полимере [Zn2(1,2-Вdc)2(Вpp)2]n (IV) [8], в котором оба лиганда (1,2-Вdc)2– и Вpp вовлечены в координацию подобно I, образуя тетраэдрическое окружение двух кристаллографически независимых атомов металла. Однако эти результаты сильно отличаются от найденных в координационном 1D-полимере с теми же лигандами [Zn2(1,2-Вdc)2(Вpp)]n [9], в котором Вpp объединяют два иона Zn2+ в димеры, посредством дикарбоксилатных лигандов связанныe в цепочки. При этом в 1D-полимере [9] не только тип КП атома металла отличается от обнаруженных в I и в IV, а также лиганды (1,2-Вdc)2– координируются к атомам Zn(II) различным способом.
Рис. 1.
Фрагмент координационного полимера в I с нумерацией функциональных атомов независимой части элементарной ячейки.
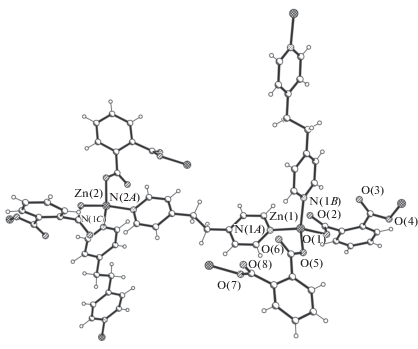
Рис. 2.
Строение координационного 1D-полимера, образованного лигандами (1,2-Вdc)2– в I (а); строение координационного 1D-полимера, образованного несимметричным лигандом Вpe в I (б).
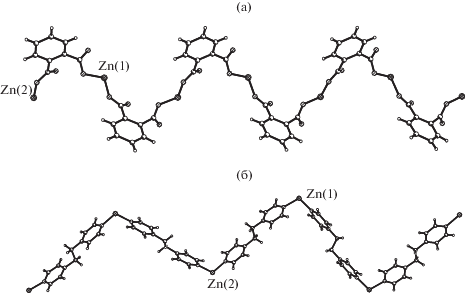
Рис. 3.
Строение координационного 2D-полимера, образованного лигандами (1,2-Вdc)2– в I (а); строение координационного 3D-полимера с вовлечением симметричных лигандов Вpe в виде линий в I (б).
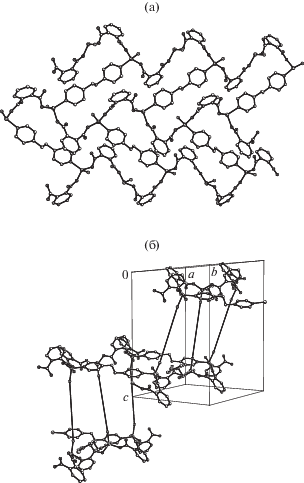
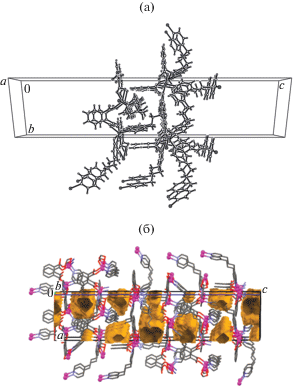
Координационный полимер в кристалле I стабилизирован слабыми водородными связями (BC) типа С–Н···О. При этом в свободных полостях координационного 3D-полимера включены остатки кристаллизационных молекул Dmf и H2O, связанные BC (табл. 3, рис. 4a). Объем свободных полостей в I после удаления кристаллизационных молекул составляет 1265.1 Å3 (или 27.7% от объема элементарной ячейки) (рис. 4б).
Рис. 4.
Координационный 3D-полимер и связанные с ним кристаллизационные молекулы Dmf и H2O в I (а); выделение свободных полостей в структуре I при удалении кристаллизационных молекул (б).
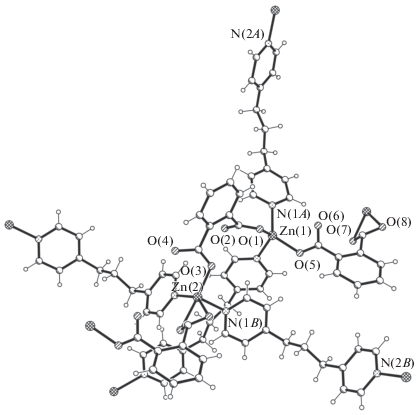
Coединение II cодержит в независимой части элементарной ячейки фрагмент координационного 3D-полимера [Zn2(1,2-Вdc)2(Вpр)2]n, включающий два кристаллографически независимых атома Zn(1) и Zn(2), два дважды депротонированных лигандов (1,2-Вdc)2– и два нейтральных лиганда Вpp. Координационные полиэдры атомов металла Zn(1) и Zn(2) в II различаются; для Zn(1) – тетраэдр, образованный донорным набором атомов N2O2 (атомы азота двух кристаллографически различных лигандов Вpр, кислорода – двух различных (1,2-Вdc)2–), для Zn(2) – сильно искаженная тетрагональная пирамида (ТП) с донорным набором атомов N2O3, так как индекс τ полиэдра ТП, рассчитанный по формуле τ = β – α/60 [24, 25], равен 0.135, и его значение ближе к 0, чем к 1. В КП Zn(2) два атома азота принадлежат двум кристаллографически различным лигандам Вpр, три атома кислорода – двум различным (1,2-Вdc)2– (рис. 5). В КП атома Zn(1) межатомные расстояния Zn–O 1.94(1) и 1.89(2), Zn–N 2.07(1) и 2.03(1) Å, а для атомов Zn(2): Zn–O 1.95(1), 2.23(3) и 2.46(3), Zn–N 2.055(8) и 2.03(5) Å (табл. 2). Если тип КП атома Zn(1) подобен тетраэдрам в I и в IV, то обнаруженный для Zn(2) тип ТП подобен таковому для атома металла в комплексе Zn(II) c (1,2-ВdcH)– и Вipy [11].
Рис. 5.
Фрагмент координационного полимера в II с нумерацией функциональных атомов независимой части элементарной ячейки.
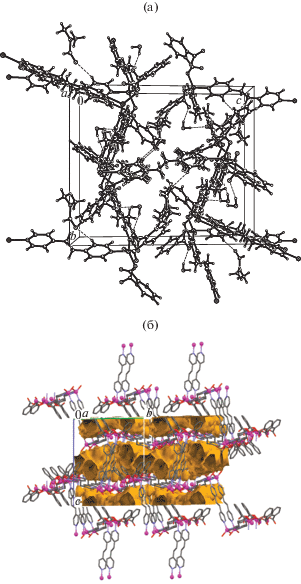
В координационном полимере Zn(II) (II) два независимых лиганда (1,2-Вdc)2– координируются к атомам металла различным способом. Один лиганд связывается с двумя атомами металла по бидентатно-мостиковому типу, привлекая два атома кислорода различных карбоксильных групп, а второй использует тридентатный хелатно-мостиковый способ и связывает атомы Zn(1) и Zn(2) через один/два атома кислорода различных карбоксильных групп (рис. 6). В кристалле образуются цепочки вдоль параметра b элементарной ячейки, в которых чередуются атомы металла и кристаллографически независимые лиганды (1,2-Вdc)2–. Межатомные расстояния Zn(1)···Zn(2) и Zn(1)···Zn(2)* 6.047 и 6.397 Å. Лиганды Вpр в кристалле II координируютcя к атомам металла бидентатно-мостиковым способом (рис. 5), при этом один из них связывает два атома Zn(1), второй – два атома Zn(2). Межатомные расстояния Zn(1)···Zn(1)* и Zn(2)···Zn(2)* 13.287 и 12.199 Å. Оба лиганда Вpр в кристалле находятся в общем положении; торсионные углы С–СН2–СН2–С, содержащие пропановый фрагмент, в одном лиганде равны 166° и 171°, в другом – 166° и 176°. При этом двугранные углы между плоскостями ароматических колец в этих лигандах равны 109.2° и 98.4°, что их отличает от подобных углов в I. В кристалле II цепочки, в формировании которых участвуют оба лиганда (1,2-Вdc)2–, достраиваются лигандами Вpр до координационного 3D-полимера и стабилизируются слабыми ВС С–Н···О (табл. 3, рис. 7a). Объем свободных полостей в II (763.5 Å3) составляет 12.0% объема элементарной ячейки (рис. 7б).
Рис. 6.
Строение координационного 1D-полимера, образованного лигандами (1,2-Вdc)2– в II c нанизанными лигандами Вpр.
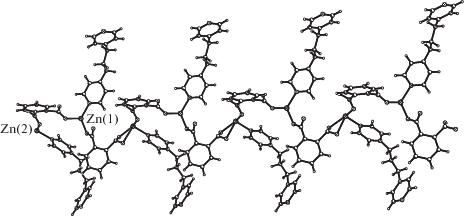
Рис. 7.
Фрагмент координационного 3D-полимера в II (а); выделение свободных каналов в структуре II (б).
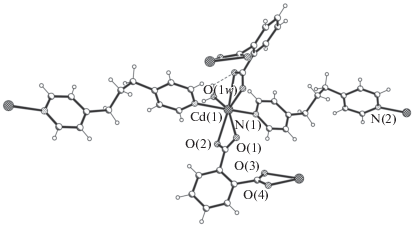
Coединение III cодержит в независимой части элементарной ячейки фрагмент координационного 2D-полимера [Сd(1,2-Вdc)(Вpр)]n, образованный одним кристаллографически независимым атомом Cd(1), дважды депротонированным лигандoм (1,2-Вdc)2– и нейтральным лигандoм Вpp. Координационный полиэдр атома Cd(1) в III – пентагональная бипирамида, образованная донорным набором атомов N2O5. Атомы азота принадлежат двум лигандам Вpр, кислорода – двум лигандам (1,2-Вdc)2– и координированной молекуле воды (рис. 8). Межатомные расстояния Cd–O(Вdc) 2.349(3)–2.483(3), Cd–N(Вpp) 2.349(3) и 2.369(3), Cd–O(w) 2.463(3) Å (табл. 2). Координационный полиэдр атома Cd(1) в III подобен найденному в комплексе Cd(II) без Вpp [18], но отличается от найденных в комплексах этого металла, содержащих (1,2-Вdc)2– или (1,2-HВdc) – и Вipy [14, 15].
Рис. 8.
Фрагмент координационного полимера в III с нумерацией функциональных атомов независимой части элементарной ячейки.
В координационном 2D-полимере (III) лиганд (1,2-Вdc)2– координируется к двум атомам металла по тетрадентатному хелатно-мостиковому типу, т.е. привлекая к связыванию оба атома кислорода карбоксильных групп (рис. 8, 9). В кристалле образуются цепочки вдоль параметра b элементарной ячейки, в которых атомы металла связаны лигандами (1,2-Вdc)2–, а межатомное расстояние Cd(1)···Cd(1)* равно 6.577 Å. Лиганды Вpр в кристалле координируются к атомам металла так же, как в I и II. Расстояние Cd(1)···Cd(1)* равнo 14.627 Å (рис. 8), а двугранный угол между плоскостями ароматических колец в Вpp (91.5°) немного отличается от подобного в II.
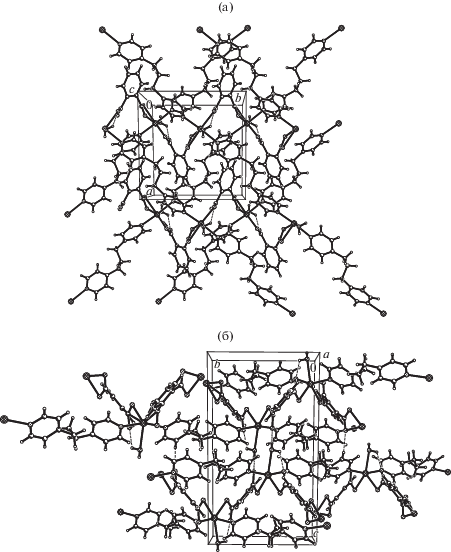
В кристале III цепочки, в формировании которых вовлечены лиганды (1,2-Вdc)2–, достраиваются лигандами Вpр до координационного 2D-полимера, стабилизированного дополнительно слабыми ВС О(w)–Н···О и С–Н···О, в которые в качестве доноров протонов вовлечены атомы ароматических фрагментов лигандов Вpp, акцепторов – атомы кислорода карбоксильных групп лигандов (1,2-Вdc)2– (табл. 3, рис. 10а). При этом 2D-слои, параллельные плоскости ab, связаны между собой как ВС O(w)–Н···О, так и слабыми ВС С–Н···О (табл. 3, рис. 10б). Элементарная ячейка III не содержит свободного объема.
Рис. 10.
Фрагмент координационного 2D-полимера, стабилизированного дополнительно слабыми водородными связями О–Н···О и С–Н···О (а); упаковка слоев в кристалле III (б).
В результате реакции солей Zn(II) и Cd(II) с 1,2-бензолдикарбоновой кислотой и лигандов типа бипиридина Вpe и Вpp получены четыре соединения, три из которых – новые координационные полимеры: [Zn2(1,2-Вdc)2(Вpe)2]n · 0.25n(Dmf) · · 0.25nH2O (I), [Zn2(1,2-Ddc)2(Dpp)2]n (II), [Cd(1,2-Вdc)(Вpp)(H2O)]n (III) и одно известное соединение Cd(II), не содержащее оба органических лиганда [18]. Меняя условия реакции и растворители, удалось получить новое соединение Zn(II) c (1,2-Вdc)2– и Вpp, хотя соединения этого металла с этими же лигандами известны [8, 9].
Список литературы
Gu Z.-G., Zhou X.-H., Jin Y.-B. et al. // Inorg. Chem. 2007. V. 46. P. 5462.
Xie Y.-M., Liu J.-H., Wu X.-Y. et al. // Cryst. Growth Des. 2008. V. 8. P. 3914.
Biradha K., Sarkar M., Rajput L. // Chem. Commun. 2006. P. 4169.
Manna S.C., Konar S., Zangrando E. et al. // Eur. J. Inorg. Chem. 2005. P. 4646.
Li Z.-G., Wang G.-H., Jia H.-Q. et al. // CrystEngComm. 2008. V. 10. P. 983.
Carlucci L., Ciani G., Proserpio D.M., Rizzato S. // CrystEngComm. 2002. V. 4. P. 121.
Allen F.H. // Acta Crystallogr. B. 2002. V. 58. № 3–1. P. 380.
Zheng Yu.-Q., Zhang J., Liu J.-Yo. // CrystEngComm. 2010. V. 12. P. 2740.
Chen Yu-B., Zhang J., Cheng J.-K. et al. // Inorg. Chem. Commun. 2004. V. 7. P. 1139.
Ou Y.-C., Liu W.-T., Li J.-Y. et al. // Chem. Commun. 2011. V. 47. P. 9384.
Tang En, Dai Yu-M., Lin Sh. // Acta Crystallogr. C. 2004. V. 60. P. m433.
Li X.-M., Wang Q.-W., Cui Y.-Ch. et al. // J. Huaxue (Chin.) (Chin. J. Struct. Chem.). 2006. V. 25. P. 621.
Wu Li-li, Rong He, Zhen W., Hui-hua S. // Chem. Res. Chin. Univ. 2011. V. 27. P. 724.
Wang X., Qin Ch., Wang E., Xu L. // J. Mol. Struct. 2005. V. 737. P. 49.
Suresh E., Boopalan K., Jasra R.V., Bhadbhade M.M. // Inorg. Chem. 2001. V. 40. P. 4078.
Tobin J.M., Mark A.R. // Angew. Chem. Int. Ed. 1995. V. 341. P. 155.
Paul A.M., Charlotte L.S., Kenneth R.P. // J. Am. Chem. Soc. 2001. P. 7742.
Robl C. // Z. Anorg. Allg. Chem. 1988. V. 566. P. 144.
Витиу А.А., Коропчану Э.Б., Боурош П.Н. // Коорд. химия. 2017. Т. 43. № 11. С. 676. (Vitiu A.A., Coropceanu Ed.B., Bourosh P.N. // Russ. J. Coord. Chem. 2017. V. 43. № 11. P. 745. doi 10.1134/S1070328417110100).
CrysAlis RED. O.D.L. Version 1.171.34.76. 2003.
Sheldrick G. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Порай-Кошиц М.А. // Журн. структур. химии. 1980. Т. 21. № 3. С. 146.
Baca S.G., Simonov Yu.A., Gerbeleu N.V. et al. // Polyhedron. 2001. V. 20. P. 831.
Reger D.L., Pascui A.E., Smith M.D. et al. // Inorg. Chem. 2012. V. 51. P. 11820.
Melnic E., Coropceanu E.B., Forni A. et al. // Cryst. Growth Des. 2016. V. 16. P. 6275.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия