Координационная химия, 2019, T. 45, № 4, стр. 249-256
Синтез и кристаллическая структура продуктов реакции аценафтендииминового комплекса магния с тозилазидом
В. А. Додонов 1, А. А. Скатова 1, И. Л. Федюшкин 1, *
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
* E-mail: igorfed@iomc.ras.ru
Поступила в редакцию 15.11.2018
После доработки 22.11.2018
Принята к публикации 26.11.2018
Аннотация
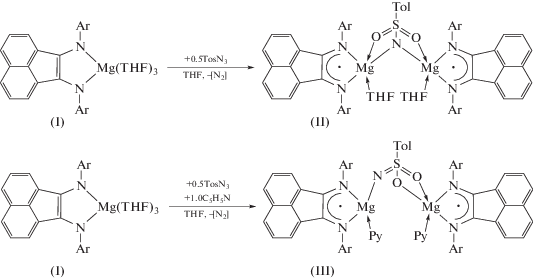
Реакция [(Dpp-Bian)Mg(THF)3] (I) (Dpp-Bian = 1,2-бис[(2,6-диизопропилфенил)имино]аценафтен) с тозилазидом (TosN3) дает биядерный амидный комплекс [(Dpp-Bian)Mg(THF)(NTos)(THF)Mg(Dpp-Bi-an)] (II), в котором атомы магния связаны с атомом азота мостиковой п-толилсульфамидной группой. В присутствии пиридина данная реакция приводит к соединению [(Dpp-Bian)Mg(Py)- (NTos)(Py)Mg(Dpp-Bian)] (III), в котором NTos имеет иную координацию с атомом металла. В обоих соединениях дииминовый лиганд восстановлен до анион-радикала. Новые парамагнитные соединения II и III охарактеризованы методами ИК-, ЭПР-спектроскопии, элементным анализом, а также РСА (СFА files CCDC № 1878433 (II · 1.5C5H12) и 1878432 (III · 2C7H8 · 0.5OC4H8)).
Диимины семейства Bian (бис(имино)аценафтены) можно легко восстановить до дианионов активированным магнием в полярных растворителях. Так, в зависимости от условий реакции были получены и структурно охарактеризованы многочисленные магниевые производные [(Dpp-Bian)Mg(THF)3] (I) (Dpp = 2,6-диизопропилфенил), [(Dpp-Bian)Mg(THF)2], [(Dpp-Bian)Mg(Py)3] [1], [(Dtb-Bian)Mg(THF)2] (Dtb = 2,5-ди-трет-бутилфенил) [2], [(Bph-Bian)Mg(THF)2] (Bph = 2-бифенил) [3], в которых лиганд Bian находится в дианионном состоянии. В наибольшей степени была исследована реакционная способность [(Dpp-B-ian)Mg(THF)3]. Было показано, что данный комплекс способен проявлять как восстановительные свойства за счет переноса электрона с дииминового лиганда на металл при связывании субстрата, так и вступать в реакции присоединения органических соединений, содержащих подвижный атом водорода, таких как алкины, енолизуемые кетоны, нитрилы и др. Так, I восстанавливает дифенилкетон с образованием пинаколятного комплекса [{(Dpp-Bian)Mg(THF)}2{O2C2Ph4}], а реакция с 9(10H)-антраценоном дает 9-антраценолятный радикал-анионный комплекс [4]. По реакции I с избытком PhC≡CH был получен комплекс [{Dpp-Bian(H)}Mg(C≡CPh)(THF)2]. Реакция протекает посредством окислительного присоединения связи С–H [5]. При последующей обработке данного комплекса бензофеноном был получен парамагнитный карбинолят [(Dpp-Bian)Mg{OC(Ph2)C≡CPh}(THF)2] [5]. Соединение [(Dpp-Bian)Mg(THF)3] легко окисляется разнообразными галоген-содержащими реагентами (например, Ph3SnCl, CuCl, HgCl2 или SiCl4), давая соединения, напоминающие реактивы Гриньяра с общей формулой [(Dpp-B-ian)MgX(S)]n (S = THF: X = Cl, Br, n = 2; S = DME: X = I, n = 1) с одновременным образованием Ph6Sn2, Cu0, Hg0, или Si2Cl6 соответственно [6]. Добавление дибензилкетона, 1,1-дифенилкетона или камфоры к I приводит к соответствующим енолятным производным [7]. Действие перекиси бензоила или пербензойной кислоты на I дает комплексы [(Dpp-Bian)MgO2CPh(THF)]2 и [(Dpp-Bian)(H)MgO2CPh(THF)]2 соответственно [8]. Комплекс магния I реагирует с этилгалогенидами с образованием продуктов лиганд-центрированного окислительного присоединения [{(Dpp-Bian)(Et)}MgX(THF)n] (X = Cl, n = 0; X = Br, n = 2; X = I, n = 1) [9].
Большой прогресс в области химии координационных производных магния был достигнут при использовании β-дикетиминатных лигандов [10, 11]. Так, впервые были получены соединения со связью магний–магний [{(ArNacnac)Mg}2] (ArNa-cnac = [(ArNCMe)2CH]), где Ar = Dpp (2,6-диизопропилфенил) [12], Ar = Dep (2,6-диэтилфенил) [13], Ar = Mes (2,4,6-триметилфенил) [14] или Ar = Xyl (2,6-диметилфенил) [13]. Эти соединения проявили себя как универсальные восстановители в органической и неорганической химии [15]. Так, реакции двухэлектронного восстановления дициклогексилкарбодиимида [12], азобензола [16], циклооктатетраена [16] и антрацена [17] приводят к внедрению субстрата по связи Mg–Mg. β-Дикетиминатные комплексы магния дают продукты восстановительного сочетания с 1-адамантанилазидом и трет-бутилизоцианатом – гексазеновые и оксамидные комплексы соответственно [16]. При этом образуются новые связи N–N и С–С. β-Дикетиминатные производные магния со связью Mg–Mg выступают восстановителями для малых молекул, например CO2, вызывая его диспропорционирование на CO и карбонатный лиганд [18]. Кроме того, с их применением может быть реализована контролируемая активация CO2, Ph2CCO, N2O [19] и CO [20].
В последнее время наше основное внимание сосредоточено на изучении реакционной способности галлиевого производного [(Dpp-Вian)Ga−Ga(Dpp-Bian)], содержащего связь металл–металл [21]. Были открыты процессы восстановления щелочными [22] и щелочноземельными металлами [23], лантанидами [24]; процессы окислительного присоединения [25]; сольват-индуцированного внутримолекулярного переноса электрона [26] и обратимого присоединения алкинов [27, 28]. Особенно интересными оказались результаты исследования реакционной способности дигаллана в отношении соединений, содержащих кумулированные и сопряженные связи углерод–углерод и углерод–элемент [29–31]. Дигаллан [(Dpp-Bi-an)Ga−Ga(Dpp-Bian)] оказался способен связывать оксид серы(IV) с образованием дитионитных комплексов [30] и обратимо присоединять изотиоцианаты [29].
Азиды, содержащие кумулированные кратные связи, обладают способностью легко вступать в реакции циклоприсоединения и далее могут быть модифицированы с образованием ценных органических продуктов. Однако к настоящему времени реакционная способность Dpp-Bian производных металлов главных подгрупп в отношении азидов остается неисследованной.
В настоящей работе мы сообщаем об изучении реакции комплекса магния [(Dpp-Bian)Mg(THF)3] с тозилазидом, содержащим в своем составе как азидную, так и сульфоновую группы, и о продуктах их взаимодействия – комплексах [(Dpp-Bi-an)Mg(THF)(NTos)(THF)Mg(Dpp-Bian)] (II · · 1.5C5H12) и [(Dpp-Bian)Mg(Py)(NTos)(Py)Mg(Dpp-Bian)] (III · 2C7H8 · 0.5OC4H8), их молекулярной структуре и спектральных характеристиках (далее для простоты комплексы обозначены как II и III).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходное соединение I, а также вновь полученные комплексы II и III чувствительны к кислороду и влаге воздуха, поэтому все манипуляции по их синтезу, выделению и идентификации выполняли в вакууме с использованием техники Шленка. Толуол, ТHF, пентан сушили и хранили над натрий бензофеноном или натрий-калиевым сплавом. Пиридин сушили и хранили над натрием.
ИК-спектры получали на спектрометре Bruker TENSOR 37. Для их регистрации готовили суспензии соединений в вазелиновом масле. Спектры ЭПР получали на спектрометре Bruker ER 200 D-SRC, снабженном двойным резонатором ER 4105 DR (рабочая частота 9.5 ГГц) и термоконтроллером ER 4111 VT. В качестве стандарта при определении g-фактора использовали дифенилпикрилгидразил (ДФПГ, g = 2.0037). Соединения Dpp-Bian [32], [(Dpp-Bian)Mg(THF)3] [1], TosN3 [33] получали по опубликованным методикам. Элементный анализ на C, H, N, S выполняли на приборе Elementar Variomircocube. Выходы продуктов рассчитывали на используемое для синтеза количество исходного Dpp-Bian (0.50 г, 1.0 ммоль).
Синтез комплекса II. 0.99 г (0.5 ммоль) TosN3 добавляли к раствору комплекса I в ТHF (25 мл). Цвет раствора мгновенно менялся с зеленого на красный. Смесь перемешивали в течение 1 сут, затем все летучие вещества удаляли в вакууме и остаток растворяли в 15 мл пентана. Медленное концентрирование раствора приводило к образованию красных кристаллов. Выход 0.44 г (60%).
ИК-спектр (ν, cм–1): 407 ср, 430 ср, 516 оч. сл, 554 сл, 581 ср, 606 ср, 670 с, 682 ср, 761 оч. с, 768 с, 802 с, 818 ср, 855 оч. с, 874 ср, 920 ср, 935 оч. с, 982 сл, 1023 ср, 1081 ср, 1110 сл, 1130 сл, 1184 ср, 1222 сл, 1254 ср, 1316 ср, 1358 сл, 1421 ср, 1429 сл, 1517 ср, 1528 ср.
| Найдено, %: | C 76.78; | H 8.11; | N 4.74; | S 1.77. |
| Для C94.5H121N5O4SMg2 | ||||
| вычислено, %: | C 77.12; | H 8.29; | N 4.76; | S 2.18. |
Синтез комплекса III. 0.99 г (0.5 ммоль) TosN3 добавили к раствору комплекса I в ТHF (25 мл). Раствор мгновенно менял цвет с зеленого на красный. Далее добавляли 0.08 г (1.0 ммоль) пиридина. Раствор перемешивали в течение 1 сут. Все летучие вещества удаляли в вакууме и остаток растворяли в толуоле. Медленное концентрирование раствора приводило к образованию красных кристаллов. Выход 0.32 г (40%).
ИК-спектр (ν, cм–1): 465 сл, 519 сл, 554 ср, 575 ср, 637 сл, 669 ср, 683 ср, 708 ср, 752 с, 762 с, 787 ср, 804 ср, 818 ср, 835 ср, 858 сл, 926 ср, 941 ср, 949 ср, 990 ср, 1042 ср, 1067 сл, 1105 ср, 1184 ср, 1225 ср, 1254 с, 1275 сл, 1318 ср, 1329 ср, 1362 ср, 1495 ср, 1526 с, 1593 ср, 1603 ср, 1642 ср, 1653 ср, 1671 ср.
| Найдено, %: | C 78.46; | H 7.36; | N 6.33; | S 1.96. |
| Для C105H117N7O2.5SMg2 | ||||
| вычислено, %: | C 78.93; | H 7.38; | N 6.14; | S 2.01. |
РСА II и III. Пригодные для РСА кристаллы соединений II и III получены кристаллизацией из пентана и толуола соответственно. Выбранные для анализа кристаллы были покрыты минеральным маслом (Aldrich) и зафиксированы на стеклянном капилляре, затем помещены в холодный поток азота дифрактометров StoeIPDS 2 или Stadi Vari. Структуры решены с использованием программы SHELXS/T [34]. Оставшиеся неводородные атомы локализованы прямым методом посредством последовательных вычислений разностных карт Фурье. Положения атомов уточнены полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении для всех неводородных атомов с использованием SHELXL [34]. Вклады атомов водорода учтены при вычислениях, но не уточнены. Во всех случаях местоположения наибольших пиков, а также величины остаточной электронной плотности в окончательных разностных картах Фурье химически незначительны.
В кристаллической ячейке II присутствует две сольватные молекулы пентана в общем положении, разупорядоченные в значительной степени, поэтому уточненные в изотропном приближении. Толилсульфамидный лиганд разупорядочен по двум положениям с соотношением 0.894 : 0.106. В кристаллах III присутствует четыре сольватных молекулы толуола в общем положении, одна из которых разупорядочена с молекулой ТHF в соотношении 1 : 1. Основные кристаллографические характеристики и параметры рентгеноструктурных экспериментов для II и III приведены в табл. 1, некоторые длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур II · 1.5C5H12, III · · 2C7H8 · 0.5OC4H8
| Параметр | Значение | |
|---|---|---|
| II · 1.5C5H12 | III · 2C7H8 · 0.5OC4H8 | |
| М | 1471.64 | 1597.73 |
| Сингония | Триклинная | Триклинная |
| Пр. гр. | P1 | P1 |
| Температура, К | 100(2) | 100(2) |
| a, Å | 13.8840(5) | 13.1542(7) |
| b, Å | 14.4214(5) | 15.3969(7) |
| c, Å | 22.6686(9) | 24.9121(12) |
| α, град | 98.840(3) | 83.328(4) |
| β, град | 99.585(3) | 87.487(4) |
| γ, град | 102.968(3) | 65.022(4) |
| V,Å3 | 4274.3(3) | 4542.6(4) |
| Z | 2 | 2 |
| ρ(выч.), г/см3 | 1.143 | 1.168 |
| μ, мм–1 | 0.11 | 0.10 |
| F(000) | 1590 | 1712 |
| Размер кристалла, мм | 0.26 × 0.18 × 0.112 | 0.174 × 0.128 × 0.046 |
| Область измеренийпо θ, град | 1.478/26.123 | 1.603/26.181 |
| Индексы областей | –17 ≤ h ≤ 11, –17 ≤ k ≤ 17, –27 ≤ l ≤ 27 |
–16 ≤ h ≤ 16, –19 ≤ k ≤ 18, –30 ≤ l ≤ 29 |
| Наблюдаемых отражений | 36 444 | 38 474 |
| Независимых отражений (Rint) | 16 594 (0.0716) | 17 691 (0.0556) |
| Отражений с I > 2σ(I) | 8071 | 10 627 |
| Поправка на поглощение | STOE X-RED, LANA (max/min 0.9919/0.9774) | STOE X-RED, LANA (max/min 0.9954/0.9841) |
| Данные/ограничения/параметры | 16 594/33/976 | 17 691/193/1233 |
| GOOF | 0.869 | 1.009 |
| R1/wR2 (I> 2σ(I)) | 0.0679/ 0.1716 | 0.0652/0.1408 |
| R1/wR2 (по всем отражениям) | 0.1299/0.1923 | 0.1250/0.1686 |
| Δρmax/Δρmin, e Å–3 | 0.704/–0.613 | 0.494/–0.397 |
Таблица 2.
Некоторые длины связей (Å) и углы (град) в соединениях II · 1.5C5H12, III · 2C7H8 · 0.5OC4H8
| II · 1.5C5H12 | III · 2C7H8 · 0.5OC4H8 | ||
|---|---|---|---|
| Связь | d, Å | Связь | d, Å |
| S(1)–O(1) | 1.475(3) | S(1)–O(2) | 1.505(2) |
| S(1)–O(2) | 1.484(3) | S(1)–O(1) | 1.527(2) |
| S(1)–N(5) | 1.503(3) | S(1)–N(5) | 1.460(2) |
| Mg(1)–N(2) | 2.106(3) | Mg(2)–O(2) | 2.062(2) |
| Mg(1)–N(1) | 2.138(3) | Mg(2)–O(1) | 2.034(2) |
| Mg(1)–N(5) | 2.088(3) | Mg(2)–N(4) | 2.089(2) |
| Mg(2)–O(2) | 2.175(3) | Mg(2)–N(3) | 2.129(2) |
| Mg(2)–N(4) | 2.131(3) | Mg(2)–N(7) | 2.143(3) |
| Mg(2)–N(5) | 2.116(3) | Mg(1)–N(2) | 2.090(2) |
| N(4)–C(4) | 1.339(4) | Mg(1)–N(1) | 2.074(2) |
| N(2)–C(2) | 1.331(4) | Mg(1)–N(6) | 2.147(3) |
| N(1)–C(1) | 1.336(4) | Mg(1)–N(5) | 1.927(3) |
| N(3)–C(3) | 1.336(5) | N(4)–C(4) | 1.339(3) |
| C(2)–C(1) | 1.446(4) | N(1)–C(1) | 1.338(3) |
| N(3)–C(3) | 1.327(3) | ||
| Угол | ω, град | Угол | ω, град |
| O(1)S(1)O(2) | 111.6(3) | O(2)S(1)O(1) | 100.73(10) |
| O(1)S(1)N(5) | 111.1(4) | N(5)S(1)O(2) | 117.25(13) |
| O(2)S(1)N(5) | 110.65(16) | N(5)S(1)O(1) | 118.17(13) |
| N(2)Mg(1)O(1) | 87.71(12) | O(2)Mg(2)N(4) | 106.20(9) |
| N(2)Mg(1)N(1) | 81.38(11) | O(2)Mg(2)N(3) | 161.41(10) |
| N(1)Mg(1)O(1) | 168.62(14) | O(1)Mg(2)O(2) | 69.49(8) |
| N(5)Mg(1)O(1) | 69.97(11) | N(4)Mg(2)N(3) | 81.89(9) |
| N(1)Mg(1)N(2) | 84.05(9) | ||
| N(5)Mg(1)N(2) | 125.96(11) | ||
| N(5)Mg(1)N(1) | 119.30(11) | ||
| S(1)O(2)Mg(2) | 93.99(10) | ||
| S(1)O(1)Mg(2) | 94.45(10) | ||
Координаты атомов и другие параметры структур депонированы в Кембриджском банке структурных данных (CCDC № 1878433 (II · · 1.5C5H12) и 1878432 (III · 2C7H8 · 0.5OC4H8); www.ccdc.cam.ac.uk/structures).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Добавление 1/2 мол. экв. тозилазида к раствору I, полученному in situ кипячением диимина Dpp-Bian в ТHF, приводит к мгновенному изменению цвета раствора с зеленого на красный, что свидетельствует об изменении дианионного состояния лиганда Dpp-Bian на анион-радикальное. Из пентанового раствора были выделены красные кристаллы биядерного комплекса магния II с выходом 60% (cхема 1). Если в реакционную смесь добавить 1 мол. экв. пиридина, то молекулы координационного ТHF в комплексе II полностью замещаются на молекулы пиридина, при этом изменяется характер координации п-толилсульфамидного лиганда (cхема 1). Образующееся соединение III выделено перекристаллизацией из толуола в виде красных кристаллов с выходом 40%. В ИК-спектрах соединений II и III присутствуют интенсивные полосы 1316 и 1184 см–1 (для II), 1318 и 1184 cм–1 (для III), соответствующие симметричным и асимметричным валентным колебаниям O2SN-групп.
Схема 1.
Следует отметить, что взаимодействие I с тозилазидом в мольном соотношении 1 : 1 также, как и проведение реакции в пиридине в качестве растворителя, приводит к разрушению металлокомплексов и образованию свободного Dpp-Bian.
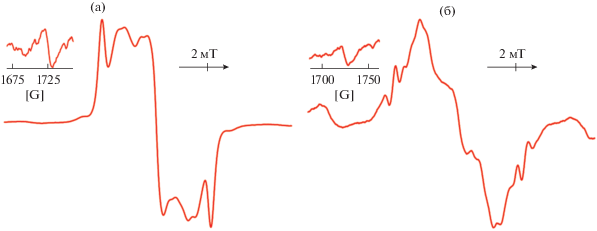
Исследование растворов соединений II и III в толуоле методом спектроскопии ЭПР при низких температурах (150 K) подтвердило, что они представляют собой бирадикальные комплексы с двумя локализованными на лигандах неспаренными электронами. Анизотропные спектры соединений II и III представлены на рис. 1. В спектрах ЭПР соединений II и III наблюдаются сигналы в половинном поле (Δms = 2), характерные для бирадикалов.
Согласно данным РСА, соединение II (рис. 2a) – биядерный пятикоординационный комплекс магния с мостиковым п-толилсульфамидным лигандом, характеризующимся двойными связями S(1)–O(1) (1.476(3)), S(1)–O(2) (1.484(3) Å) и одинарной связью S(1)–N(5) (1.502(3) Å) так же, как в комплексе [(RRTB-SC)2Li4(THF)4] (RRTBSC = = (R,R)-транс-1,2-бис(2,4,6-триизопропилбензолсульфонамидато)циклогесан) (S–O 1.463 и 1.469, S–N 1.551 Å) [35]. Дополнительный контакт Mg···O ведет к тому, что связи S–O немного удлинены, S–N укорочена, например, по сравнению с аналогичными связями в [In(${\text{N}}_{2}^{{{\text{Tos}}}}$NL)(CH2SiMe3)] (H2${\text{N}}_{2}^{{{\text{Tos}}}}$NL = (2-NC5H4)-CH2N(CH2CH2NHTos)2), в котором атомы кислорода не участвуют в координации (S–O 1.443 и 1.452, S–N 1.576 Å) [36]. Угол между плоскостями лигандов в II составляет 80.09°.
Рис. 2.
Молекулярная структура II (a) и III (б). Тепловые эллипсоиды с 30%-ной вероятностью. Атомы водорода не показаны.
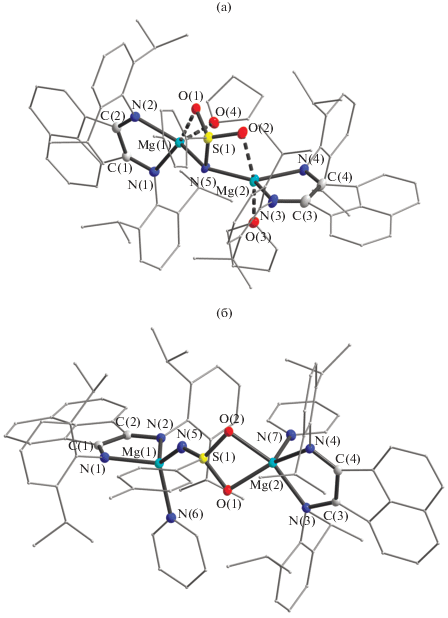
Замещение молекул ТHF молекулами пиридина приводит к тому, что в комплексе III характер координации лиганда TosN несколько меняется – атом N(5) образует только одну связь с атомом металла вместо двух, как в комплексе II (pис. 2б). Это сопровождается еще большим удлинением связей S–O 1.505(2) и 1.527(2) Å в III против S–O 1.476(3) и 1.484(3) Å в II, носящих характер полуторных, а связь S–N укорачивается на 0.04 Å и принимает характер двойной (S–N 1.460(2) Å в III против S–N 1.502(3) Å в II). Аналогичное строение лиганда TosN наблюдается в [ArN(SO2-p-Tol)Li(THF)2]2 (S–O 1.463(2) и 1.464(2), S–N 1.520(3) Å) [37]. Расстояния Mg–O также заметно укорачиваются, что говорит в пользу того, что они частично ковалентные (cредн. Mg(2)–O(2) 2.062(2), Mg(2)–O(1) 2.034(2) Å в III, Mg(1)–O(1) 2.193(7), Mg(2)–O(2) 2.176(3) Å в II).
Таким образом, показано, что при взаимодействии с TosN3 комплекс магния [(Dpp-Bian)-Mg(THF)3] демонстрирует выраженные восстановительные свойства, несмотря на высокую склонность азидов и дианионных комплексов Dpp-Bian к реакциям циклоприсоединения. Продемонстрировано влияние донорной способности растворителя на способ координации сульфамидного лиганда. Образующиеся производные представляют собой устойчивые соединения, поэтому последующая модификация связанных азидных субстратов с целью получения ценных органических продуктов маловероятна.
Работа по синтезу и рентгеноструктурным исследованиям полученных соединений выполнена при финансовой поддержке Российского научного фонда (проект № 14-13-01063), ЭПР-спектроскопическая характеристика металлокомплексов – за счет средств Российского фонда фундаментальных исследований (проект № 18-33-01057).
Список литературы
Fedushkin I.L., Skatova A.A., Chudakova V.A. et al. // Eur. J. Inorg. Chem. 2003. V. 2003. № 18. P. 3336.
Fedushkin I.L., Chudakova V.A., Skatova A.A. et al. // Z. Anorg. Allg. Chem. 2004. V. 630. № 4. P. 501.
Fedushkin I.L., Chudakova V.A., Skatova A.A., Fukin G.K. // Heteroatom Chem. 2005. V. 16. № 7. P. 663.
Fedushkin I.L., Skatova A.A., Cherkasov V.K. et al. // Chem. Eur. J. 2003. V. 9. № 23. P. 5778.
Fedushkin I.L., Khvoinova N.M., Skatova A.A., Fukin G.K. // Angew. Chem. Int. Ed. 2003. V. 42. № 42. P. 5223.
Fedushkin I.L., Skatova A.A., Lukoyanov A.N. et al. // Russ. Chem. Bull. 2004. V. 53. № 12. P. 2751.
Fedushkin I.L., Skatova A.A., Fukin G.K. et al. // Eur. J. Inorg. Chem. 2005. V. 2005. № 12. P. 2332.
Fedushkin I.L., Chudakova V.A., Hummert M., Schumann. H. // Z. Naturforsch. B. 2008. V. 63. № 2. P. 161.
Fedushkin I.L., Makarov V.M., Rosenthal E.C.E., Fukin G.K. // Eur. J. Inorg. Chem. 2006. V. 2006. № 4. P. 827.
Bourget-Merle L., Lappert M.F., Severn J.R. // Chem. Rev. 2002. V. 102. № 9. P. 3031.
Tsai Y.-C. // Coord. Chem. Rev. 2012. V. 256. № 5. P. 722.
Green S.P., Jones C., Stasch A. // Science. 2007. V. 318. № 5857. P. 1754.
Stasch A., Jones C. // Dalton Trans. 2011. V. 40. № 21. P. 5659.
Bonyhady S.J., Jones C., Nembenna S. et al. // Chem. Eur. J. 2010. V. 16. № 3. P. 938.
Jones C. // Nature Rev. Chem. 2017. V. 1. № P. 0059.
Bonyhady S.J., Green S.P., Jones C. et al. // Angew. Chem. Int. Ed. 2009. V. 48. № 16. P. 2973.
Jones C., McDyre L., Murphy D.M., Stasch A. // Chem. Commun. 2010. V. 46. № 9. P. 1511.
Lalrempuia R., Stasch A., Jones C. // Chem. Sci. 2013. V. 4. № 12. P. 4383.
Boutland A.J., Pernik I., Stasch A., Jones C. // Chem. Eur. J. 2015. V. 21. № 44. P. 15749.
Anker M.D., Kefalidis C.E., Yang Y. et al. // J. Am. Chem. Soc. 2017. V. 139. № 29. P. 10036.
Fedushkin I.L., Lukoyanov A.N., Ketkov S.Y. et al. // Chem. Eur. J. 2007. V. 13. № 25. P. 7050.
Fedushkin I.L., Lukoyanov A.N., Fukin G.K. et al. // Chem. Eur. J. 2008. V. 14. № 28. P. 8465.
Fedushkin I.L., Lukoyanov A.N., Tishkina A.N. et al. // Chem. Eur. J. 2010. V. 16. № 25. P. 7563.
Sanden T., Gamer M.T., Fagin A.A. et al. // Organometallics. 2012. V. 31. № 11. P. 4331.
Fedushkin I.L., Dodonov V.A., Skatova A.A. et al. // Chem. Eur. J. 2018. V. 24. № 8. P. 1877.
Fedushkin I.L., Skatova A.A., Dodonov V.A. et al. // Inorg. Chem. 2014. V. 53. № 10. P. 5159.
Fedushkin I.L., Nikipelov A.S., Morozov A.G. et al. // Chem. Eur. J. 2012. V. 18. № 1. P. 255.
Fedushkin I.L., Nikipelov A.S., Lyssenko K.A. // J. Am. Chem. Soc. 2010. V. 132. № 23. P. 7874.
Zhang W., Dodonov V.A., Chen W. et al. // Chem. Eur. J. 2018. V. 24. № 56. P. 14994.
Fedushkin I.L., Skatova A.A., Dodonov V.A. et al. // Inorg. Chem. 2016. V. 55. № 17. P. 9047.
Dodonov V.A., Skatova A.A., Cherkasov, A.V., Fedush-kin I.L. // Russ. Chem. Bull. 2016. V. 65. № 5. P. 1171.
Paulovicova A., El-Ayaan U., Shibayama K. et al. // Eur. J. Inorg. Chem. 2001. V. 2001. № 10. P. 2641.
Curphey T.J. // Org. Prep. Proc. Int. 2009. V. 13. № 2. P. 112.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Peng Y.-L., Huang Y., Chuang H.-J. et al. // Polymer. 2010. V. 51. № 19. P. 4329.
Blake M.P., Schwarz A.D., Mountford P. // Organometallics. 2011. V. 30. № 5. P. 1202.
Zhao J., Song H., Cui C. // Organometallics. 2007. V. 26. № 8. P. 1947.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия