Координационная химия, 2019, T. 45, № 4, стр. 242-248
Кластерные анионы бора [B10X10]2– (X = H, Cl) в реакциях комплексообразования марганца(II) с 2,2'-бипиридилом
В. В. Авдеева 1, *, А. В. Вологжанина 2, Е. А. Малинина 1, К. Ю. Жижин 1, Н. Т. Кузнецов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова
Москва, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 28.09.2018
После доработки 10.10.2018
Принята к публикации 26.10.2018
Аннотация
Изучены реакции комплексообразования марганца(II) с 2,2'-бипиридилом в присутствии кластерных анионов бора [B10H10]2– и [B10Cl10]2– в ацетонитриле. Показано влияние соотношения реагентов на состав и строение комплексных соединений. Синтезированы моно- и биядерные комплексы марганца(II) состава [(Mn(Bipy)3]2+ и [Mn2(Bipy)4Cl2]2+ с кластерными анионами бора в качестве противоионов. Методом РСА установлено строение комплексов [Mn(Bipy)3][B10H10], [Mn(Bipy)3][B10Cl10]0.5[B10Cl9H]0.5 · CH3CN (III) и [Mn2(Bipy)4(µ-Cl)2][B10Cl10] · 2CH3CN (IV ⋅ 2CH3CN) (CIF files CCDC № 1868278 (I), 1868279 (III · CH3CN) и 1868280 (IV · 2CH3CN)). Изучены термические свойства [Mn(Bipy)3][B10H10].
Систематическое исследование координационных свойств кластерных анионов бора [BnHn]2– (n = 10, 12) показывает, что эти электрон-дефицитные системы способны участвовать в реакциях комплексообразования. При этом решающую роль в формировании координационного полиэдра играет природа металла-комплексообразователя. Установлено, что в реакциях комплексообразования металлов–мягких кислот по Пирсону незамещенные кластерные анионы бора [1–3] координируются к атому металла трехцентровыми двухэлектронными связями, тогда как замещенные производные кластерных анионов бора [BnHn – mXm] (n = 10, 12; m = 1 – n) [4–7] могут быть связаны с металлом через заместитель (например, в [Pb(Bipy)(DMF)(2-B10Н9OH)] ∙ DMF [8], {Pb(Bipy)2-[2,6(9)-B10H8(OC(O)CH3)(OH)]}2 ∙ 3H2O [9]) или через ВН-группы борного полиэдра, как в [Ag(CH3CN)3]2(Ag2(2-B10H9F)2] [10] и [Et3NH]- [Cu[1-B10H9(N2)]2] [11].
Самостоятельным направлением в координационной химии кластерных анионов бора является исследование реакций комплексообразования металлов, имеющих несколько устойчивых степеней окисления. Реакции комплексообразования в их присутствии могут сопровождаться окислительно-восстановительными процессами, протекание которых обусловлено, в том числе, присутствием кластерных анионов бора, проявляющих восстановительные свойства. В [12–16] широко изучены реакции комплексообразования меди(I)/меди(II) с азагетероциклическими лигандами и анионами [BnНn]2– (n = 10, 12). Поведение кластерных анионов бора в реакциях комплексообразования железа(II/III), кобальта(II/III) и никеля(II) обобщено в обзоре [7].
Координационная химия перхлорированного клозо-декаборатного аниона [B10Cl10]2– изучена не систематически. Получен ряд моноядерных комплексных соединений серебра(I) [17], меди(II) [18], железа(II) [19], кобальта(II) [20] с N-содержащими лигандами (1,10-фенантролин (Phen), 2,2'-бипиридил (Bipy), NH3). В этих комплексах анион [B10Cl10]2– образует вторичные связи с молекулами органических лигандов и растворителей B–Cl···H–X (X = N, O), обнаруженные при анализе данных РСА и спектроскопии ЯКР 35Cl.
Другим примером металлов, имеющих несколько устойчивых степеней окисления, является марганец. Он относится к биометаллам, критически важным для жизнедеятельности организмов [21] и необходим для выполнения функций репродуктивной, центральной нервной и эндокринной систем. Биологическую активность марганец, как и другие 3d-металлы, проявляет в составе координационных соединений с органическими лигандами [22]. Координационные соединения марганца обладают каталитической активностью. Обнаружены марганец-порфирины, являющиеся молекулярными магнетиками, и комплексы, образующие нанопористые структуры [23], открывающие путь к синтезу новых материалов с заданными свойствами.
Координационная химия марганца(II) с кластерными анионами бора [B10H10]2– и [B12H12]2– практически неизучена. Известны трис-хелатные комплексы с другими кластерными анионами бора [Mn(Phen)3][В6Н7]2 [24] и [Mn(Bipy)3][B20H18] · 2DMF [25], которые получали по обменным реакциям при взаимодействии солей кластерных анионов бора с хлоридом марганца(II) в присутствии Phen и Bipy соответственно.
В настоящей работе в продолжение исследований реакций комплексообразования металлов, имеющих несколько устойчивых степеней окисления, изучена модельная реакция комплексообразования марганца(II) с N-содержащим органическим лигандом Bipy в присутствии анионов [B10H10]2– и [B10Cl10]2–; определено влияние условий проведения реакций на состав и строение полученных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Комплекс (Et3NH)2[B10H10] получали в результате многостадийного синтеза при взаимодействии декаборана-14 с триэтиламинбораном через стадию образования 1,6-бис(триэтиламин)декаборана [26]. (Et3NH)2[B10Cl10] получали хлорированием (Et3NH)2[B10H10] хлором в водном растворе [27].
Синтез [Mn(Bipy)3][B10X10] (X = H (I), Cl (II). К раствору (Et3NH)2[B10X10] (1 ммоль) в ацетонитриле (5 мл) приливали раствор, содержащий MnCl2 (1 ммоль) и Bipy (3 ммоль) в том же растворителе (10 мл). В течение суток наблюдали образование кристаллов желтого цвета I или II. Выход ~90%.
| Найдено, %: | С 56.09; | H 5.28; | N 13.07; | B 16.78; | Mn 8.44. |
| Для C30H34N6B10Mn (I) | |||||
| вычислено, %: | C 56.15; | H 5.34; | N 13.10; | B 16.85; | Mn 8.56. |
| Найдено, %: | С 36.48; | H 2.40; | N 8.47; | B 10.90; | Mn 5.45. |
| Для C30H24N6B10Cl10Mn (II) | |||||
| вычислено, %: | C 36.54; | H 2.45; | N 8.52; | B 10.96; | Mn 5.57. |
Монокристалл I, подходящий для РСА, получали непосредственно из реакционного раствора. В синтезe II после отделения основной массы кристаллов II из разбавленного реакционного раствора выпадали кристаллы [Mn(Bipy)3][B10Cl10]0.5-[B10Cl9H]0.5 · CH3CN (III · CH3CN) с небольшим выходом (менее 5%), которые содержали сокристаллизованные анионы [B10Cl10]2– и [B10Cl9H]2–. Наличие аниона [B10Cl9H]2– объясняется недостаточной полнотой реакции хлорирования аниона [B10H10]2– на предыдущей стадии синтеза.
ИК-спектр I (NaCl; ν, см–1): ν(BH) 2488, 2446; ν(Bipy) 1590 c, 1471 с, 1441 c, 1378 c, 1314, 1246, 1159, 1016 с, 737, 652; π(CH) 776.
ИК-спектр II (NaCl; ν, см–1): ν(BCl) 1155, 1002, 843; ν(Bipy) 1599 c, 1468 с, 1440 c, 1378 c, 1316, 1244, 1014 с, 736, 652; π(CH) 766.
Синтез [Mn2(Bipy)4(µ-Cl)2][B10Cl10] (IV) проводили согласно методике, описанной для II, при этом соотношение MnCl2 : Bipy = 1 : 2. В течение 24 ч из реакционного раствора выпадали кристаллы желтого цвета. Методом РСА изучили кристалл IV · 2CH3CN, отобранный непосредственно из реакционного раствора.
| Найдено, %: | C 39.97; | H 2.55; | N 9.22; | B 8.98; | Mn 9.10. |
| Для C40H32N8B10Cl12Mn2 (IV) | |||||
| вычислено, %: | C 40.13; | H 2.69; | N 9.36; | B 9.03; | Mn 9.18. |
ИК-спектр IV (NaCl; ν, см–1): ν(BCl) 1156, 1004, 854; ν(Bipy) 1596 c, 1458 с, 1440 c, 1378 c, 1317, 1246, 1156, 1017 с, 737; π(CH) 762.
Элементный анализ на углерод, водород и азот проводили на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba), на бор и марганец – методом ICP MS на атомно-эмиссионном спектрометре с индуктивно связанной плазмой iCAP 6300 Duo.
ИК-спектры синтезированных комплексов записывали на ИК Фурье-спектрометре ИНФРАЛЮМ ФТ-02 (НПФ АП Люмекс) в области 4000–600 см–1 с разрешением 1 см–1. Образцы готовили в виде суспензии исследуемого вещества в вазелиновом масле (Aldrich).
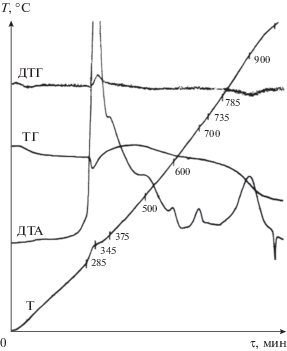
Термогравиметрическое и дифференциальнотермическое исследование соединения I проводили на дериватографе Паулик–Паулик–Эрдей Q-1500Д на воздухе в интервале 20–1000°С в платиновом тигле. Скорость нагрева образца 10 K/мин.
РСА. Набор дифракционных отражений для I получен И.Н. Поляковой в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker SMART APEX2. Для соединений III · CH3CN и IV · 2CH3CN РСА выполнен в ЦКП ИНЕОС РАН. Экспериментальный набор отражений получен на дифрактометре Bruker APEX II (двухкоординатный CCD детектор, MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор). Поглощение учтено эмпирически по программе SADABS [28]. Структуры III, IV решены по программе SHELXT [29]. Все неводородные атомы локализованы в разностных синтезах электронной плотности и уточнены по $F_{{hkl}}^{{\text{2}}}$ (SHELXL-14 [30] и OLEX2 [31]). Неводородные атомы уточнены в анизотропном приближении за исключением атомов бора клозо-декаборатного аниона в структуре I, разупорядоченного по двум положениям. В связи с разупорядочением этот анион уточняли в изотропном приближении с наложением ограничений на длины связей B–B. Атомы водорода найдены геометрически и уточнены в изотропном приближении в модели жесткого тела; Uiso(H) = 1.5Ueq(Xi) для метильных групп, или 1.2Ueq(Xi) для остальных атомов, где Ueq(X) – эквивалентные тепловые параметры атомов, с которыми связан атом водорода.
Кристаллографические характеристики и детали дифракционного эксперимента приведены в табл. 1. Координаты атомов, величины тепловых параметров и список всех отражений для исследованных структур депонированы в Кембриджском банке структурных данных (CCDC № 1868278, 1868279 и 1868280 для I, III · CH3CN и IV · 2CH3CN соответственно); deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I, III · CH3CN, IV · 2CH3CN
| Параметр | Значение | ||
|---|---|---|---|
| I | III · CH3CN | IV · 2CH3CN | |
| Брутто-формула | C30H34N6B10Mn | C32H27.9N7B10Cl9.1Mn | C44H38N10B10Cl12Mn2 |
| М | 641.68 | 996.15 | 1350.22 |
| T, K | 120 | 120 | 120 |
| Сингония | Тригональная | Моноклинная | Ромбическая |
| Пр. гр. | $R\bar {3}c$ | Р21/с | Pna21 |
| Z | 12 | 4 | 4 |
| a, Å | 14.1895(19) | 17.5165(7) | 25.6666(18) |
| b, Å | 14.1895(19) | 13.0253(5) | 10.5239(7) |
| c, Å | 57.520(8) | 19.1401(7) | 21.6195(15) |
| β, град | 90 | 95.794(1) | 90 |
| V, Å3 | 10030(3) | 4344.7(3) | 5839.7(7) |
| ρ(выч.), г см–3 | 1.275 | 1.523 | 1.536 |
| μ, см–1 | 0.427 | 0.900 | 1.025 |
| F(000) | 3972 | 1994 | 2704 |
| 2θmax, град | 53 | 62 | 59 |
| Число измеренных отражений | 23 234 | 49 639 | 57 168 |
| Число независимых отражений | 2283 | 13 807 | 15 380 |
| Число отражений с I > 2σ(I) | 1144 | 9397 | 12 745 |
| Количество уточняемых параметров | 173 | 542 | 705 |
| R1, wR2 (I > 2σ(I)) | 0.0667, 0.1240 | 0.0504, 0.1222 | 0.0478, 0.0957 |
| R1, wR2 (по всем данным) | 0.1383, 0.1555 | 0.0873, 0.1381 | 0.0741, 0.1065 |
| GOОF | 1.005 | 1.040 | 1.006 |
| Остаточная электронная плотность (min/max), e Å–3 | –0.434/0.456 | –0.973/0.653 | –0.537/0.935 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе исследовали реакцию комплексообразования марганца(II) с Bipy в присутствии клозо-декаборатных анионов [B10H10]2– и [B10Cl10]2–. Установлено, что соотношение Bipy : Mn влияет на состав и строение образующихся комплексов.
При трехкратном избытке Bipy в реакционном растворе образуется катионный комплекс марганца(II) [Mn(Bipy)3]2+, который выводится из реакционного раствора с противоионом [B10H10]2– или [B10Cl10]2– согласно схеме:
Соединения I и II выпадают из реакционного раствора в виде монокристаллов ярко-желтого цвета. В ИК-спектрах I и II присутствуют полосы валентных колебаний связей B–Cl или B–H и полный набор колебаний координированного гетероциклического лиганда в области 1600–700 см–1.
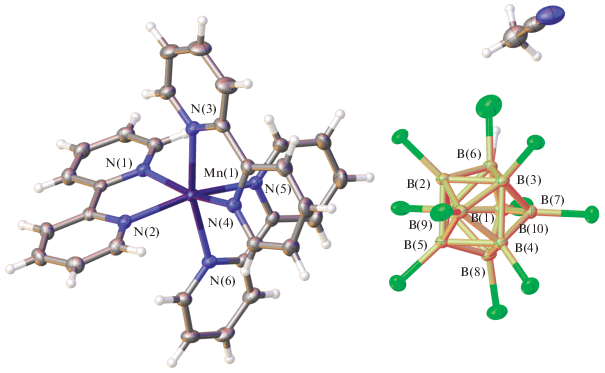
Согласно РСА, соединение I построено из катионных комплексов [Mn(Bipy)3]2+ и анионов [B10H10]2–, разупорядоченных по двум положениям. Координационный полиэдр MnN6 – искаженный октаэдр ((Mn–N) 2.221(1)–2.247(1) Å). Отсутствие прочных межмолекулярных взаимодействий приводит к разупорядочению аниона с поворотом аксиальных атомов бора примерно ~90°.
Для соединения I изучены термические свойства (рис. 1). Соединение обладает высокой термической стабильностью. Разложение соли начинается при 330°С и сопровождается сильной экзотермической реакцией. Процесс термоокислительной деструкции носит ступенчатый характер. Термическое разложение соединения I приводит к образованию летучих продуктов, разложению борного кластера и образованию сложной смеси продуктов окисления.
При проведении реакции комплексообразования в присутствии аниона [B10Cl10]2– после выделения основного продукта реакции II из маточного раствора с небольшим выходом получены кристаллы III · CH3CN, строение которых определено методом РСА (рис. 2). В кристалле III · CH3CN сокристаллизуются два соединения: комплекс II и комплекс марганца с анионом [B10Cl9H]2– – промежуточный продукт хлорирования клозо-декаборатного аниона. Поскольку октаэдрический катион [Mn(Bipy)3]2+ находится в общем положении, диапазон связей Mn–N шире, чем для аналогичного комплекса в структуре I ((Mn–N) 2.221(2)–2.278(2) Å). В отличие от кристалла I, соединение III · CH3CN содержит в кристалле молекулу растворителя и упорядоченный анион. Анион образует множество вторичных связей B–Cl···H–C с участием как молекул Bipy, так и ацетонитрила.
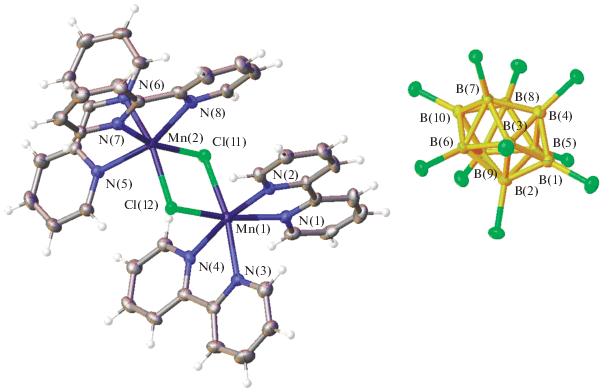
При проведении реакции комплексообразования марганца(II) с декахлор-клозо-декаборатным анионом и двукратным избытком Bipy по отношению к MnCl2 из реакционного раствора был выделен биядерный комплекс марганца(II) IV согласно схеме:
Соединение IV осаждается из реакционного раствора в виде сольвата IV · 2CH3CN. Согласно полученным данным, соединение построено из биядерного катионного комплекса марганца(II) [Mn2(Bipy)4(µ-Cl)2]2+ и анионов [B10Cl10]2– (рис. 3). Строение катионного комплекса марганца(II) аналогично структуре полученного нами ранее биядерного комплексa кобальта(II) [Co2(μ-Cl)2-(Phen)4][B10Cl10] [20]. В координационных полиэдрах MnN4Cl2 наблюдаются укороченные по сравнению с полиэдрами MnN6 в структурах I и III связи Mn–N (2.210(4)–2.215(4) Å), противолежащие двум связям Mn–Cl. Значения остальных связей Mn–N изменяются от 2.244(4) до 2.278(4) Å, а длины связей Mn–Cl равны 2.499(1)–2.536(1) Å. В кристалле образуются многочисленные слабые контакты, в том числе Cl...H–C с участием атомов хлора и катиона, и аниона с одной стороны, атомов водорода молекул растворителя или Bipy – с другой.
ИК-спектр комплекса IV · 2CH3CN не имеет принципиальных отличий от ИК-спектра комплекса II, что указывает на аналогичное состояние бипиридила и кластерного аниона бора.
Следует отметить, что для марганца(II), так же как и для кобальта(II), выведение крупного биядерного катионного комплекса из реакционного раствора наблюдается только в присутствии перхлорированного аниона, тогда как из реакционного раствора, содержащего анион [B10H10]2–, при двукратном избытке лиганда по отношению к металлу образуется вышеописанный комплекс I:
Таким образом, в настоящей работе изучены реакции комплексообразования марганца(II) с кластерными анионами бора [B10H10]2– и [B10Cl10]2–. Показано, что использование аниона [B10Cl10]2– позволяет синтезировать моноядерный [Mn(Bipy)3]- [B10Cl10] и биядерный [Mn2(Bipy)4(µ-Cl)2][B10Cl10] комплексы марганца, тогда как для декагидро-клозо-декаборатного аниона выделен только трис-хелатный комплекс [Mn(Bipy)3][B10H10]. Установлено, что комплекс [Mn(Bipy)3][B10H10] обладает высокой термической устойчивостью.
Наличие у марганца двух устойчивых степеней окисления открывает перспективы использования соединений марганца для направленного синтеза соединений Mn(II)/Mn(III) аналогично исследованным нами ранее комплексам Fe(II)/Fe(III), Co(II)/Co(III) с кластерными анионами бора [7, 20]. Возможность протекания окислительно-восстановительных реакций позволяет реализовать направленный синтез новых координационных соединений с заданными свойствами. Исследование координационных соединений марганца актуально для развития теоретических и прикладных аспектов координационной и бионеорганической химии.
Работа выполнена при финансовой поддержке Совета по грантам Президента РФ по государственной поддержке ведущих научных школ (грант НШ-2845.2018.3, химия аниона [B10Cl10]2–) и Российского научного фонда (грант 14-13-01115, химия аниона [B10H10]2–).
Список литературы
Malinina E.A., Avdeeva V.V., Goeva L.V., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. P. 2148. doi 10.1134/S0036023610140032
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystals. 2016. V. 6. № 5. P. 60. doi 10.3390/cryst6050060
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Polyhedron. 2016. V. 105. P. 205. doi 10.1016/j.poly.2015.11.049
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. P. 2089. doi 10.1134/ S0036023610140019
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. P. 11. doi 10.1135/ cccc2010054
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czech. Chem. Commun. 2002. V. 67. P. 679. doi 10.1135/ cccc20020679
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. P. 1673. doi 10.1134/ S0036023617130022
Жижин К.Ю., Вовк О.О., Малинина Е.А. и др. // Коорд. химия. 2001. Т. 27. № 9. С. 653 (Zhizhin K.Yu., Vovk O.A., Malinina E.A. et al. Russ. J. Coord. Chem. 2001. V. 27. № 9. P. 613. doi 10.1023/A:101793710).
Avdeeva V.V., Polyakova I.N, Goeva L.V. et al. // Russ. J. Inorg. Chem. 2014. V. 59. № 11. P. 1247. doi 10.1134/ S0036023614110047
Ivanov S., Miller S.V., Anderson O.P. et al. // Inorg. Chem. 1996. V. 35. P. 6914.
Ng L.-L., Ng B.K., Shelly K. et al. // Inorg. Chem. 1991. V. 30. № 22. P. 4278.
Malinina E.A., Kochneva I.K., Polyakova I.N. et al. // Inorg. Chim. Acta. 2018. V. 479. P. 249. doi 10.1016/ j.ica.2018.04.059
Avdeeva V.V., Dziova A.E., Polyakova I.N. et al. // Dokl. Chem. 2011. V. 437. P. 79. doi 10.1134/S001250081104001X
Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Russ. J. Inorg. Chem. 2013. V. 58. P. 1527. doi 10.1134/ S0036023614010045
Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Dokl. Chem. 2012. V. 442. P. 1. doi 10.1134/S0012500812010016
Avdeeva V.V., Dziova A.E., Polyakova I.N. et al. // Inorg. Chim. Acta. 2015. V. 430. P. 74. doi 10.1016/ j.ica.2015.02.029
Kravchenko E.A., Gippius A.A., Korlyukov A.A. et al. // Inorg. Chim. Acta. 2016. V. 447. P. 22. doi 10.1016/ j.ica.2016.03.025
Avdeeva V.V., Kravchenko E.A., Gippius A.A. et al. // Polyhedron. 2017. V. 127. P. 238. doi 10.1016/j.poly.2017.02.015
Kravchenko E.A., Gippius A.A., Polyakova I.N. et al. // Z. Anorg. Allg. Chem. 2017. V. 643. P. 1939. doi 10.1002/zaac.201700293
Avdeeva V.V., Vologzhanina A.V., Goeva L.V et al. // Inorg. Chim. Acta. 2015. V. 428. P. 154. doi 10.1016/ j.ica.2014.12.029
Яцимирский К.Б. Введение в бионеорганическую химию. Киев: Наук. Думка, 1976. 144 с.
Бионеорганическая химия // Рос. хим. журн. 2004. Т. 48. № 4. 174 с.
Березин Б.Д. Координационные соединения порфиринов и фталоцианина. М.: Наука, 1978. 280 с.
Полянская Т.М., Дроздова М.К., Волков В.В., Мякишев К.Г. // Журн. структур. химии. 2009. Т. 50. № 2. С. 381 (Polyanskaya T.M., Drozdova M.K., Volkov V.V., Myakishev K.G. // J. Struct. Chem. 2009. V. 50. № 2. P. 368).
Ильинчик Е.А., Полянская Т.М., Дроздова М.К. и др. // Журн. общ. химии. 2005. Т. 75. № 10. С. 1620 (Il-inchik E.A., Polyanskaya T.M., Drozdova M.K. et al. // Russ. J. Gen. Chem. 2005. V. 75. № 10. P. 1545. doi 10.1007/s11176-005-0464-y).
Miller H.C., Miller N.E., Muetterties E.L. // J. Am. Chem. Soc. 1963. V. 85. P. 3885.
Knoth W.H., Miller H.C., Sauer J.C. et al. // Inorg. Chem. 1964. V. 3. P. 159.
Sheldrick G.M. SADABS. Program for Empirical X-ray Absorption Correction. Bruker-Nonius, 1990–2004.
Sheldrick G.M. // Acta Crystalogr. A. 2015. V. 71. № 1. P. 3.
Sheldrick G.M. // Acta Crystalogr. C. 2015. V. 71. № 1. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. № 2. P. 339.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия