Координационная химия, 2019, T. 45, № 9, стр. 515-526
Влияние природы галогензамещенных уксусных кислот на тип образующихся комплексов с морфолином. Кристаллическая структура первого тетракарбоксилата палладия с монокарбоновой кислотой – тетракис(трифторацетато)палладата(II) морфолиния, (O(CH2CH2)2NH2)2[Pd(CF3COO)4]
И. А. Ефименко 1, *, А. В. Чураков 1, О. С. Ерофеева 1, Н. А. Иванова 1, Л. И. Демина 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт физической и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
* E-mail: ines@igic.ras.ru
Поступила в редакцию 26.02.2019
После доработки 26.03.2019
Принята к публикации 10.04.2019
Аннотация
Изучено влияние природы галогензамещенных карбоновых кислот RCOOH, где R – ClCH2, Cl2CH, Cl3C, F3C, на процессы комплексообразования галогенкарбоксилатов палладия с морфолином C4H9NO. Показано, что в реакциях с ClCH2COOH и Cl2CHCOOH образуются биядерные комплексы [(C4H9NO)2Pd2(μ-OOCR)2(OOCR)2] с координированным палладием морфолином, тогда как в реакциях с Cl3CCOOH и F3CCOOH получены первые тетрагалогенкарбоксилатные комплексы палладия с протонированным морфолином в качестве катиона – (C4H10NO)2[Pd(RCOO)4]. Показано, что основным фактором, определяющим состав образующихся комплексов, является соотношение кислотно–основных свойств морфолина и галогенкарбоновых кислот. Для образования тетраацидогалогенкарбоксилатов палладия с морфолином величина разницы рКа морфолина и кислоты должна быть не ниже 7.63. Методом РСА (охарактеризован первый тетрагалогенкарбоксилатный комплекс палладия с монокарбоновой кислотой (C4H10NO)2[Pd(OOCCF3)4 ∙ 2H2O] (I), а также комплексы транс-[(C4H9NO)2Pd(OOCCH2Cl)2 ∙ 2H2O] (II), транс-[(C4H9NO)2Pd(OOCCНСl2)2] (III) и транс-[(C4H9NO)2Pd(OOCCF3)2 ∙ 2H2O] (IV) (CIF files CCDC № 1008564, 1894300, 1008566 и 1894299 соответственно).
Противоопухолевые свойства цисплатина (цис-Pt(NH3)2Cl2) были открыты более 50 лет назад [1]. До настоящего времени в онкологии нашли применение только три соединения Pt(II) – цисплатин и два его карбоксилатных аналога – карбоплатин и оксалиплатин, обладающие наряду с высокой противоопухолевой активностью и широким спектром побочных эффектов. Вместе с тем было отмечено, что переход от соединений с хлорид-ионами (цисплатин) к соединениям с карбоксилатными ионами (карбоплатин и оксалиплатин) сопровождается понижением их токсичности [2–10]. В последующие годы осуществлялся поиск соединений с противоопухолевой активностью и среди других соединений металлов платиновой группы. Однако ни одно из исследованных соединений не обладало противоопухолевой активностью, сравнимой с активностью соединений платины(II), используемых в онкологии [11–20]. В результате исследования физико-химических и фармакологических свойств большого числа представителей различных классов соединений палладия мы выделили класс соединений палладия (AmHn)k[PdCl4] с протонированными аминами (Am) [21]. В наиболее широко изученной группе соединений указанного выше класса – катионно-анионных комплексов палладия с протонированными производными морфолина – были выявлены моноядерные соединения с катионами (морфолинием (C4H10NO)2[PdCl4] и метилморфолинием (C5H14NO)2[PdCl4]), противоопухолевая активность которых оказалась равной или превосходящей активность цисплатина при значительно меньшей их токсичности [22–25]. В плане развития исследований в этой области представляет несомненный интерес синтез карбоксилатных аналогов указанных выше хлоридных комплексов. Для исследования условий образования катион-анионных карбоксилатных комплексов палладия с протонированной молекулой морфолина, рКа которого 8.33, был использован ряд галогензамещенных уксусных кислот RCOOH (R = ClCH2, Cl2CH, Cl3C, F3C), рКа которых лежит в интервале 2.87–0.0.
В настоящей работе описан синтез ряда комплексов палладия с анионами галогензамещенных уксусных кислот – комплексов палладия с морфолином и выявлены факторы, определяющие тип полученных комплексов. В зависимости от рКа галогенкарбоновой кислоты образуются либо биядерные аминокомплексы [(C4H9NO)2Pd2(μ-OOCR)2(OOCR)2] (R = ClCH2, Cl2CH) с координированной палладием молекулой морфолина, либо моноядерные комплексы (C4H10NO)2-[Pd(RCOO)4] (R = Cl3C–, F3C–) c протонированной молекулой морфолина в качестве противоиона. Следует заметить, что в литературе описан только один тетракарбоксилат платиновых металлов – тетрапивалат платины K2[Pt((CH3)3CCO2)4], полученный с низким выходом в довольно специфических условиях [26].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза комплексов палладия с указанными выше кислотами в качестве исходного соединения использовали Pd3(μ-MeCO2)6, полученный по разработанной нами методике [27]. Кристаллический Pd3(μ-ClCH2CO2)6 синтезировали по методике [28]. Для синтеза моно-, ди- и тригалогенацетатов палладия использовали кислоты ClCH2COOH, Cl2CHCOOH и Cl3CCOOH (Sigma-Aldrich), F3COOH (“х. ч.”, Химмед), а также морфолин C4H9NO (Fluka). Все органические растворители – бензол, хлористый метилен, диэтиловый эфир, гексан – (AKROS).
Синтез [(C4H9NO)2Pd2(μ-OOCCH2Cl)2(OOCCH2Cl)2] (I). К 90%-ному раствору ClCH2COOН (1.8 г в 2 мл воды) добавляли 0.150 г (0.6 ммоль) Pd3(CH3COO)6. Реакционную смесь перемешивали при 55°С до полного растворения исходных соединений (в течение 30 мин), к профильтрованному раствору приливали 0.180 мл (2 ммоль) морфолина. Синтез вели при комнатной температуре в течение 4 ч до образования осадка. Полученный осадок светло-коричневого цвета отфильтровывали, промывали водой, высушивали при 100°С до постоянной массы. Выход 25% в расчете на введенный палладий.
ИК-спектр (ν, см–1): 1643, 1589, 1350 νas(COO–), 1350, 1408 νs(COO–), 3093 ν(NHкоoрд).
При ведении синтеза в 20%-ной кислоте образуется тот же продукт.
Синтез транс-[(C4H9NO)2Pd(OOCCH2Cl)2] (II). 0.147 г (0.5 ммоль) Pd3(OOCCH2Cl)6 растворяли в 20 мл бензола и приливали 0.087 мл (1 ммоль) морфолина. Синтез вели при постоянном перемешивании при комнатной температуре в течение 24 ч, затем реакционную смесь упаривали на роторном испарителе до ~5 мл. При добавлении 20 мл гексана образовывался осадок светло-желтого цвета, который отфильтровывали, промывали гексаном (3 × 10 мл), высушивали в вакууме при 93 Па до постоянной массы. Выход 72% в расчете на введенный палладий. Из маточного раствора вырастили монокристалл транс-[(C4H9NO)2Pd(OOCCH2Cl)2 ∙ 2Н2О] (IIа).
| Найдено, %: | С 31.21; | H 5.44; | N 5.95. |
| Для C12H22N2O6Cl2Pd (II) | |||
| вычислено, %: | С 30.82; | H 4.74; | N 5.99. |
ИК-спектр (ν, см−1): 1642 νas(COO–), 1349 νs(COO–), 3203 ν(NHкоoрд).
Синтез [(C4H9NO)2Pd2(μ-OOCCHCl2)2(OOCCHCl2)2] (III). 0.331 г (0.5 ммоль) Pd3(CH3COO)6 растворяли в 20 мл Cl2CHСООН при постоянном перемешивании в течение часа при 30°С. В профильтрованный раствор добавляли 0.253 г (3 ммоль) морфолина и перемешивали в течение 6 ч при 35–40°С до образования осадка. Полученный осадок светло-коричневого цвета отфильтровывали, промывали водой (3 × 5 мл), выдерживали над KOH, сушили при 80°С до постоянной массы и перекристаллизовывали из CH2Cl2. При ведении синтеза в 20%-нoй Cl2CHСООН получали продукт, аналогичный полученному при ведении синтеза в 100%-ной Cl2CHСООН. Выход 45% в расчете на введенный палладий.
| Найдено, %: | C 21.33; | H 2.52; | N 3.03; | Pd 23.57. |
| Для C16H22N2O10Cl8Pd2 | ||||
| вычислено, %: | C 21.38; | H 2.47; | N 3.13; | Pd 23.68. |
ИК-спектр (ν, см–1): 1669, 1610 νas(COO); 1349, 1401 νs(COO); 3133 ν(NHкоорд.).
Синтез транс-[(C4H9NO)2Pd(OOCCHCl2)2] (IV). 0.202 г (0.6 ммоль) транс-(C4H9ON)2PdCl2 и 0.271 г (1.2 ммоль) AgOOCCHCl2 в 30 мл бензола перемешивали в течение 3 ч, затем образовавшийся AgCl отфильтровывали и раствор упаривали досуха на роторном испарителе. Образовавшийся осадок растворяли в 20 мл диэтилового эфира и упаривали досуха. Продукт перекристаллизовывали из бензола. Сушили при 80°С до постоянного веса. Выход 40% в расчете на введенный палладий.
| Найдено, %: | C 27.78; | H 4.07; | N 6.10; | Pd 18.75. |
| Для C12H20N2O6Cl4Pd | ||||
| вычислено, %: | C 26.87; | H 3.74; | N 5.23; | Pd 19.84. |
ИК-спектр (ν, см–1): 1663, 1649 νas(COO–); 1349, 1327 νs(COO–), 3211, 3185 ν(NHкоорд).
Синтез (C4H10NO)2[Pd(OOCCCl3)4] (V). 0.200 г (0.3 ммоль) Pd3(CH3COO)6 растворяли в 75%-ном водном растворе Cl3CCOOH (4.57 г в 1.5 мл воды) при перемешивании в течение часа при 30°С. В профильтрованный раствор добавляли 0.154 г (1.8 ммоль) морфолина и перемешивали в течение 6 ч при 35–40°С. Образовавшийся мелкий осадок светло-коричневого цвета отфильтровывали, промывали водой (4 × 5 мл), выдерживали над KOH, сушили при 80°С до постоянной массы. Выход 66% в расчете на введенный палладий.
| Найдено, %: | C 20.78; | H 2.07; | N 3.10; | Pd 10.95. |
| Для C16H20O10N2Cl12Pd | ||||
| вычислено, %: | C 20.62; | H 2.17; | N 3.01; | Pd 11.42. |
ИК-спектр (ν, см–1): 1687, 1647 νas(COO–); 1335, 1330 νs(COO–); 3149, 3057 ν$\left( {{\text{NH}}_{{\text{2}}}^{ + }} \right);$ 1587 $\delta \left( {{\text{NH}}_{{\text{2}}}^{ + }} \right).$
Синтез транс-[(C4H9NO)2Pd(OOCCCl3)2] (VI). Реакционную смесь 0.260 г (0.75 ммоль) транс-(C4H9ON)2PdCl2 и 0.402 г (1.5 ммоль) AgOOCCHCl3 в 30 мл бензола перемешивали в течение 3 ч, затем отфильтровывали от AgCl и раствор упаривали досуха на роторном испарителе. Образовавшийся осадок растворяли в 20 мл диэтилового эфира и упаривали досуха. Продукт перекристаллизовывали из бензола. Сушили при 80°С до постоянной массы. Выход 32% в расчете на введенный палладий.
| Найдено, %: | С 24.48; | H 3.76; | N 4.29; | Pd 18.15. |
| Для C12H18O6N2Cl6Pd | ||||
| вычислено, %: | C 23.81; | H 3.00; | N 4.63; | Pd 17.58. |
ИК-спектр (ν, см–1): 1672 νas(COO–); 1309 νs(COO–); 3133 ν(NHкоорд).
Синтез (C4H10NO)2[Pd(OOCCF3)4] (VII). 0.448 г (2 ммоль) Pd3(CH3COO)6 растворяли в 20 мл F3CCOOН при 55°С. Реакционную смесь отфильтровывали от металлического Pd и к полученному раствору приливали 0.35 мл (4 ммоль) морфолина (в расчете на 1 атом Рd). Синтез вели в течение 1 ч при комнатной температуре при перемешивании. Реакционную смесь упаривали на роторном испарителе до ~5 мл, к ней приливали 15 мл диэтилового эфира и упаривали на роторном испарителе. Процедуру повторяли 3 раза до образования светло-желтого осадка, который отфильтровывали, промывали диэтиловым эфиром, высушивали под вакуумом до постоянной массы. Выход 58% в расчете на введенный палладий. При синтезе в разбавленной (20%-ной) CF3COOН образуется также VII. Из маточного раствора вырастили монокристалл (C4H10NO)2[Pd(OOCCF3)4] для РСА.
ИК-спектр (ν, см–1): 1691, 1667 νas(COO–), 1411 νs(COO–), 3112, 3035 $\nu \left( {{\text{NH}}_{{\text{2}}}^{ + }} \right),$ 1557 $\delta \left( {{\text{NH}}_{{\text{2}}}^{ + }} \right).$
Синтез транс-[(C4H9NO)2Pd(OOCCF3)2] (VIII) 0.177 г (1 ммоль) PdCl2 и 0.44 г (2 ммоль) AgCF3COO помещали в круглодонную колбу и приливали 20 мл толуола. Синтез вели в темноте при комнатной температуре 24 ч. Затем реакционную смесь профильтровывали. К полученному раствору приливали 0.180 мл (2 ммоль) морфолина. Синтез вели 2 ч. Образовавшийся светло-серый осадок отфильтровывали, промывали гексаном (3 × 10 мл), высушивали в вакууме до постоянной массы. Выход 45% в расчете на введенный палладий. Маточный раствор, полученный после отделения осадка, упаривали на роторном испарителе до образования масла, которое растворяли в 15 мл CH2Cl2. Из образовавшейся в этом растворе кристаллической массы выбрали монокристалл транс-[(C4H9NO)2Pd(OOCCF3)2 · 2Н2О] (VIIIа), пригодный для РСА.
| Найдено, %: | С 27.49; | H 4.36; | N 5.40. |
| Для C12H18N2O6F6Pd (VIII) | |||
| вычислено, %: | С 28.45; | H 3.56; | N 5.53. |
ИК-спектр (ν, см–1): 1659 νas(COO–), 1431 νs(COO–), 3183 ν(NHкоoрд).
Анализ на С, H, N выполняли на анализаторе фирмы Carlo Erba Instruments CHNS OEA 1108. Содержание палладия в образцах определяли весовым методом. ИК-спектры кристаллических образцов и растворов регистрировали в интервале 4000–550 см–1 методом НПВО на ИК-Фурье спектрометре NEXUS фирмы NICOLET (однолучевой, сканирующий, светоделитель – CsI, детектор – TGS-CsI, фотометрическая точность 0.1%, разрешение 2 см–1 с использованием приставки MIRacle фирмы PIKE Technologies с алмазным кристаллом. Кристаллические образцы наносили непосредственно на алмазный кристалл без дополнительной пробоподготовки.
РСА. Сбор экспериментальных данных для соединений IIа, IV, VII и VIIIа проведен на автоматическом дифрактометре Bruker SMART APEX II (MoKα-излучения (λ = 0.71073 Å, графитовый монохроматор) в режиме ω-сканирования. Поглощение введено по измерениям интенсивностей эквивалентных отражений [29]. Структуры расшифрованы прямым методом и уточнены полноматричным анизотропным МНК по F 2 для всех неводородных атомов (SHELXTL) [30]. Кристалл IIа – псевдомероэдрический двойник с матрицей двойникования 1 0 1 0 1 0 0 0 –1 и соотношением компонент 0.965(1)/0.035(1). В структурах VII и VIIIа трифторметильные группы ротационно неупорядочены с соотношением заселенностей 0.62/0.38 и 0.40/0.38/0.22 (для VII) и 0.48/0.34/0.19 (для VIIIа). В структурах IIа, VII и VIIIа атомы водорода, связанные с углеродом, были помещены в рассчитанные позиции и уточнены с использованием схемы “наездника”, в то время как “активные” атомы водорода (аммонийные и водные) были найдены объективно и их позиционные параметры были уточнены. Для соединения IV все атомы водорода были помещены в рассчитанные позиции и уточнены с использованием схемы “наездника”.
Кристаллографические данные, детали эксперимента и уточнения структур приведены в табл. 1. Структуры IIа, IV, VII и VIIIа депонированы в Кембриджском банке структурных данных (№ 1008564, 1894300, 1008566 и 1894299 соответственно) [31]. РСА выполнены в ЦКП ИОНХ РАН.
Таблица 1.
Кристаллографические данные и параметры уточнения для соединений IIа, IV, VII, VIIIa
| Параметр | Значение | |||
|---|---|---|---|---|
| IIа | IV | VII | VIIIа | |
| Брутто-формула | C12H26N2O8Cl2Pd | C12H20N2O6Cl4Pd | C16H20N2O10F12Pd | C12H22N2O8F6Pd |
| М | 503.65 | 536.50 | 734.74 | 542.72 |
| Размер кристалла, мм | 0.20 × 0.20 × 0.04 | 0.35 × 0.20 × 0.15 | 0.22 × 0.20 × 0.08 | 0.40 × 0.40 × 0.35 |
| Сингония | Моноклинная | Моноклинная | Моноклинная | Ромбическая |
| Пр. гр. | P21/c | P21/n | P21/с | Pbca |
| Температура, К | 160 | 150 | 173 | 230 |
| Параметры ячейки: | ||||
| a, Å | 9.8233(15) | 12.2919(4) | 9.3775(9) | 6.1596(4) |
| b, Å | 16.363(3) | 33.5948(9) | 14.7100(14) | 16.8732(11) |
| c, Å | 6.1975(10) | 19.4777(6) | 19.0247(18) | 18.9401(12) |
| β, град | 107.809(2) | 106.257(1) | 96.794(1) | 90 |
| V, Å3 | 948.4(3) | 7721.6(4) | 2605.9(4) | 1968.5(2) |
| Z | 2 | 16 | 4 | 4 |
| ρ(выч.), г/см3 | 1.764 | 1.846 | 1.873 | 1.831 |
| μ(MoKα), мм–1 | 1.301 | 1.545 | 0.850 | 1.040 |
| F(000) | 512 | 4288 | 1456 | 1088 |
| Область θ, град | 1.24–26.99 | 1.63–29.00 | 2.16–27.00 | 2.41–27.99 |
| Всего отражений | 7011 | 93 262 | 19 790 | 16 547 |
| Независимых отражений (Rint) |
2057 (0.0264) | 20442 (0.0286) | 5666 (0.0320) | 2368 (0.0241) |
| Число уточняемых параметров | 128 | 901 | 463 | 154 |
| R1 по I > 2σ(I) | 0.0245 | 0.0515 | 0.0438 | 0.0442 |
| wR2 (все данные) | 0.0626 | 0.1247 | 0.1141 | 0.1066 |
| GOOF по F 2 | 1.092 | 1.096 | 1.04 | 1.082 |
| Δρmin/Δρmax, e/Å3 | –0.664/0.528 | –2.472/4.858 | –0.826/1.216 | –0.783/0.978 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее мы исследовали возможность получения тетраацетатпалладата морфолония при взаимодействии Pd3(CH3COO)6 с морфолином в 90%-ной уксусной кислоте. Однако продуктом реакции оказался аминокомплекс палладия транс-[(C4H9NO)2Pd(OOCCН3)2] [32]. Такой результат – следствие фрагментации исходного трехъядерного ацетата палладия в концентрированной кислоте в присутствии образовавшегося в реакции ацетата морфолиния. Полученные нами результаты изучения спектров ЭСП вышеназванной реакционной смеси в видимой и УФ-области согласуются с полученными ранее результатами [33]. Подробное исследование процессов взаимодействия Pd3(CH3COO)6 с CH3COONa и CH3COOLi в уксусной кислоте [33] показали, что результатом первой стадии деполимеризации ацетата палладия являются биядерные тетраацидокомплексы Na2[Pd2(CH3COO)6] и Li2[Pd2(CH3COO)6], затем конвертирующиеся в мономеры Na2[Pd(CH3COO)4] и Li2[Pd(CH3COO)4]. Однако в случае образования катионно-анионных комплексов, когда катионами являются протонированные азотсодержащие лиганды (AmH)2[(Pd(RCOO)4], формирование конечных продуктов усложняется возможностью депротонирования ониевых катионов, координацией двух молекул Am палладием и формированием транс-диаминокомплексов транс-[(Am)2Pd(OOCR)2]. Таким образом, осуществляемая перегруппировка Андерсона [34] является реакцией замещения внутрисферных ацидолигандов молекулами, образовавшимися в реакции аминами. При этом автор [34] отмечает, что скорость превращений в перегруппировке Андерсона определяется, с одной стороны, основностью протонируемого лиганда, с другой – природой кислотного остатка, принимающего отщепившийся от ониевого лиганда протон. В [32], мы изучали возможность синтеза комплексов морфолиния с анионом [Pd(CH3COO)4]2–. Показано, что образуются только моноядерные транс-[(C4H9NO)2Pd(OOCCН3)2]. Оказалось, что в системе Pd–морфолин (рКа = 8.33)–уксусная кислота (рКа = 4.56), где ΔрКа = 3.77, невозможно протонирование морфолина уксусной кислотой и образование тетраацидоаниона.
В настоящей работе для исследования факторов, определяющих возможность образования тетраацидопалладатов морфолиния, выбрали ряд галогензамещенных уксусных кислот RCOOH, в котором значения рКа кислот лежат в интервале 2.45 (R = ClCH2)–0.0 (R = F3C) [33]. Это значительно ниже, чем рКа уксусной кислоты, что может обеспечить увеличение разницы рКа морфолина и кислоты (Δ). Взаимодействие комплексов галогензамещенных карбоксилатов палладия с морфолином практически осуществлялось в две стадии. Первая – образование в растворах галогенкарбоксилатов палладия при замещении ацетатной группы в Pd3(CH3COO)6 на соответствующие галогенацетаты без выделения образовавшихся Pd3(RCOO)6 в твердую фазу. Синтез твердых комплексов Pd3(ClCH2COO)6, Pd3(Cl3CCOO)6, Pd3(F3CCOO)6 в соответствии с аналогичной реакцией описан нами в [28] так же, как и полученный в этой работе Pd3(Cl2CНCOO)6, также являющийся трехъядерным комплексом в соответствии с аналитическими и данными ИК-cпектроскопии. Вторая стадия реакции – взаимодействие галогенкарбоксилатов палладия с морфолином – осуществлялась в водных растворах кислот RCOOH (R = ClCH2 и Cl3C) или концентрированных кислот (R = Cl2CН и F3C) при соотношении Pd : морфолин 1 : 2 в расчете на образование комплексов (AmH)2[Pd(RCOO)4]. Исследования показали, что в случае взаимодействия морфолина с моно- и дихлорацетатами палладия образуются биядерные аминокомплексы I и III, содержащие как мостиковые, так и концевые карбоксилатные группы и координированный палладием морфолин. Строение I и III установлено на основании аналитических данных и данных ИК-спектроскопии.
ИК-спектры I и III содержат полосы валентных колебаний координированных NH-групп морфолина при 3093 см–1 (для I) и 3133 см–1 (для III). Одна группа полос асимметричных колебаний карбоксилатных групп в I и III находится при 1589 и 1610 см–1, а симметричных – при 1408 и 1401 см–1 соответственно. Расщепление Δ между νas и νs полосами в I и III составляет 181 и 209 см–1 и, согласно [35], соответствует мостиковому положению этих групп в I и III. Вместе с тем полосы асимметричных колебаний у другой группы лежат в области 1643 см–1 (I) и 1669 (III) см–1, симметричных – при 1350 см–1 (I) и 1349 (III) см–1. Расщепление Δ между этими полосами составляет 293 см–1 (I) и 320 см–1 (III), что соответствует монодентатной координации этих карбоксильных групп. Для подтверждения положения полос концевых групп в I и III синтезировали моноядерные комплексы II и IV с концевыми карбоксилатными группами.
Комплекс II получали в бензоле взаимодействием Pd3(OOCCH2Cl)6 с морфолином. Комплекс IV удалось получить только при взаимодействии синтезированного нами (C4H9NO)2PdCl2] с дихлорацетатом серебра. Увеличение соотношения Pd : морфолин с 1 : 2 до 1 : 4 в синтезе III не приводит к разрыву мостиковых карбоксилатных групп и образованию моноядерного комплекса, идентичного IV. Если при синтезе III выдерживать реакционную смесь при комнатной температуре в течение полугода в присутствии оставшегося в реакционной смеси морфолина после формирования III, происходит мономеризация III с образованием моноядерного комплекса, идентичного IV.
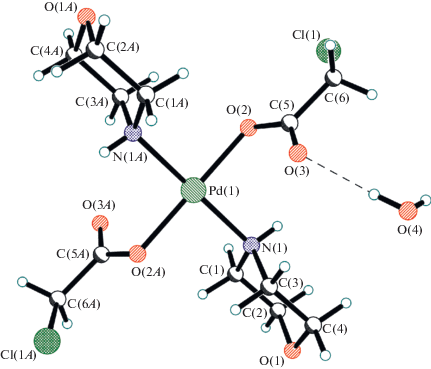
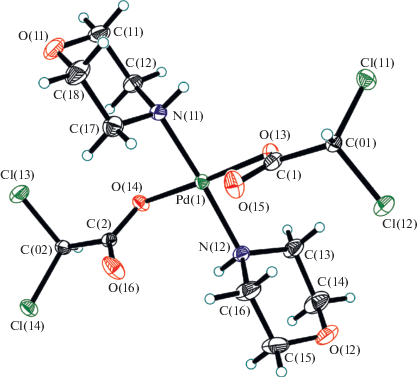
Полосы, отвечающие νas и νs колебаний концевых карбоксилатных групп II лежат при 1642 и 1349 см–1 соответственно. Расщепление между νas и νs комплекса II, составляющее 293 см–1 свидетельствует о концевом положении этих карбоксилатных групп в II, что совпадает с аналогичными характеристиками I. В ИК-спектре IV обнаружены по две полосы νas(СОО–) и νs(СОО–), а именно 1662, 1649 и 1349, 1327 см–1. Величина расщепления между νas и νs в комплексе IV равная 293 и 222 см–1, характерна для концевых карбоксилатных групп. В ИК-спектрах IV обнаружено также две частоты колебаний NH-групп (при 3211 и 3185 см–1), что согласуется с данными о более сложном взаимодействии карбоксилатных групп с протонами молекул координированного морфолина. Полученные данные ИК-спектроскопии для IIa и IV подтверждены результатами исследования этих комплексов методом РСА. В рассмотрение рентгеноструктурных данных морфолинатных комплексов палладия с монохлоруксусной (IIa) и дихлоруксусной (IV) кислотами включены также данные морфолинатного комплекса палладия с трифторуксусной кислотой (VIIIa), аналогичного по строению IIa.
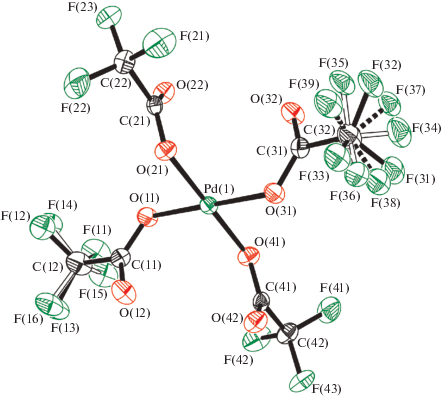
Соединения IIa, IV и VIIIa представляют собой молекулярные комплексы состава Pd[–O–C(=O)–R]2[←NH(CH2CH2)2O]2 (R = CH2Cl, CHCl2, CF3) (рис. 1–3). Во всех трех случаях центральный атом палладия имеет традиционную квадратную координацию с транс-расположением морфолиновых лигандов. Комплексы IIa и VIIIa расположены в кристаллографических центрах инверсии; а четыре независимые молекулы в структуре IV занимают общие положения. Межлигандные транс-углы у атома палладия лежат в пределах 173.2(1)°–180°, а цис-углы варьируют в интервале 88.9(1)°–91.1(1)°. Смещения атомов Pd из экваториальной плоскости лигандов N2O2 не превышают 0.04 Å. В целом молекулярная геометрия этих двух соединений близка к найденной нами ранее для “родительского” соединения транс-[(C4H9NO)2Pd(OOCCН3)2] ∙ 2Н2O (IX) [28] (табл. 2). Интересно отметить, что с ростом электроотрицательности заместителя R в ряду близкородственных комплексов IX → IIa → IV → VIIIa наблюдается тенденция к увеличению расстояний Pd ← N и уменьшению C–O(Pd), в то время как систематического изменения длин связей Pd–O не наблюдается. В молекулах IIa, VIIIa и IX атомы кислорода карбонильных групп расположены по разные стороны базовой плоскости лигандов N2O2 из-за наличия центра инверсии, в то время как во всех четырех молекулах в структуре IV эти атомы кислорода лежат по одну сторону от данной плоскости. Это может быть следствием отсутствия в IV сольватных молекул воды, что имеет место в IIa и VIIIa.
Таблица 2.
Избранные длины связей (Å) в структурах IIа, IV, VII, VIIIa
| Cвязь | IX (R = CH3) | IIа (R = CH2Cl) | IV (R = CHCl2) | VIIIа (R = CF3) | VII |
|---|---|---|---|---|---|
| Pd–N | 2.047(4) | 2.048(2) | 2.047(3)–2.074(3) | 2.057(3) | |
| Pd–O | 2.017(3) | 2.0303(16) | 2.018(3)–2.027(2) | 2.016(3) | 1.989(3)– 2.009(3) |
| C–O | 1.272(5) | 1.267(3) | 1.260(5)–1.283(4) | 1.260(5) | 1.263(5)–1.274(5) |
| C=O | 1.238(6) | 1.243(3) | 1.215(4)–1.224(5) | 1.220(5) | 1.210(5)–1.223(5) |
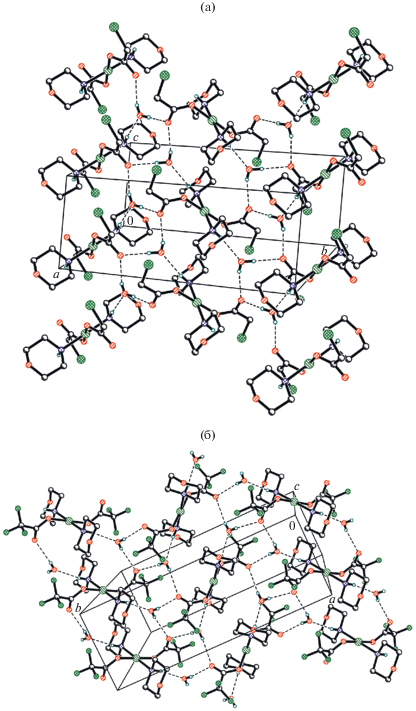
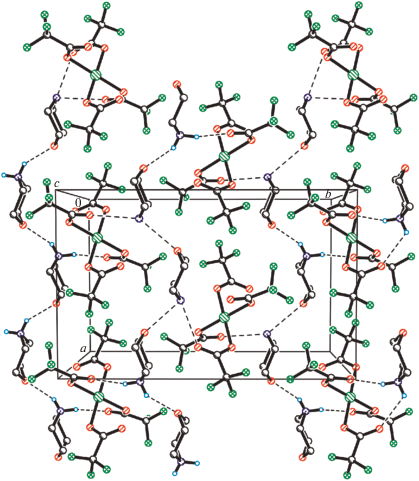
В структурах IIa и VIIIa все аминные атомы водорода морфолиновых лигандов вовлечены в водородные связи (ВС) с гидратными молекулами воды (рис. 4). В IV эти атомы водорода образуют BC как с атомами хлора ОH∙∙∙Cl (3.583–3.961Å), так и с атомами кислорода карбоксилатных лигандов соседних молекул OH∙∙∙O (2.834–2.919 Å). В результате в этих соединениях наблюдается образование сложных 3D-связанных сеток BC.
Как показали исследования, образование моноядерных карбоксилатных комплексов морфолиния (AmH)2[(Pd(RCOO)4] возможно только в реакциях с трихлоуксусной (рКа = 0.66) или трифторуксусной (рКа = 0.0) кислотами. В ИК-спектрах V и VII наблюдается по две полосы, отвечающих колебаниям νas(COO–) при 1687 и 1645 и νs(COO–) при 1335 и 1300 см–1 (Δ = 352 и 345 для V) и, соответственно, при 1691 и 1667 и 1411 см—1 (Δ = 280 и 256 для VII), а также две полосы, соответствующиx колебаниям νаs$\left( {{\text{NH}}_{{\text{2}}}^{ + }} \right)$-групп при 3149 и 3057 см–1 (для V); 3112 и 3035 см–1 (для VII). Появление двух полос колебаний карбоксилатных групп в спектрах V и VII свидетельствуют о неравноценности двух пар карбоксилатных групп в анионе [(Pd(RCOO)4]2–, поскольку только одна транс-расположенная пара может быть связана посредством ВС O∙∙∙НN с двумя катионами морфолиния. Полученные данные свидетельствуют об идентичности строения V и VII. Для подтверждения отнесения частот концевых карбоксилатных групп в V и VII синтезировали моноядерные аминатные комплексы VI и VIII, в ИК-спектрах которых наблюдается только по одной полосе колебаний νаs(СОО–) и νs(СОО–) соответственно, при 1672 и 1309 см–1 (для VI) и 1659 и 1431 см–1 (для VIII).
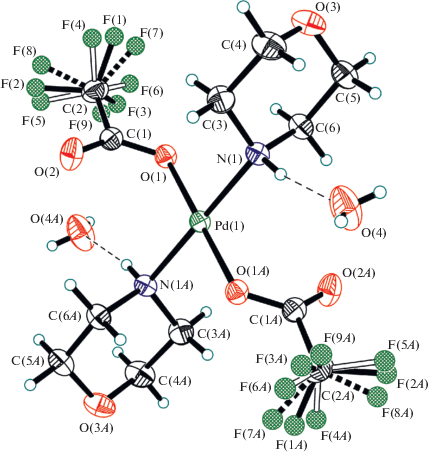
Исследование структуры первого комплекса палладия, содержащего тетраацидоанион [Pd(O2CCF3)4]2– (VII), показало, что палладий, являющийся центром аниона [Pd(O2CCF3)4]2– имеет почти правильную квадратную геометрию с цис-углами в пределах 88.3(1)°–91.6(1)° (рис. 5). Два атома кислорода карбонильных групп расположены по одну сторону базовой плоскости лигандов О4, два других – по другую. Только две карбоксилатные ветви аниона [Pd(O2CCF3)4]2– образуют BC с катионами морфолиния. Вероятно, следствием этого является возникновение в структуре VII двух пар связей Pd–O, C–O(Pd) и C=O в карбоксилатных лигандах, что подтверждает данные ИК-спектроскопии. При этом в VII связи Pd–O короче, а C–O(Pd) длиннее, чем в VIIIa (табл. 2). Морфолиниевые катионы в VII имеют геометрию кресла, оба их аминных атома водорода вовлечены в BC не только с карбонильными атомами кислорода анионов, но и с атомами кислорода соседних морфолиниевых катионов (рис. 6).
Насколько нам известно, VII – первый пример соединения, в анионе которого атом Pd координирует четыре кислотных остатка монокарбоновой трифторуксусной кислоты.
Таким образом, данное исследование показало, что комплексы палладия с тетракарбоксилатными анионами (C4H9NO)2[Pd(OOCR)4] с морфолинием можно получить с галогенкарбоновыми кислотами RCOOH (R = CF3COO– и CCl3COO–), если значение ΔрКа будет больше 7.63. При меньшем значении ΔpKa, как это имеет место при взаимодействии с кислотами RCOOH (R = ClCH2COO– и Cl2CHCOO–), образуются биядерные комплексы [(C4H9NO)2Pd2(μ-OOCR)2(OOCR)2] с координированными палладием молекулами морфолина.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Rosenberg B. // Plat. Met. Rev. 1971. V. 15. № 2. P. 42.
Lippert B. Cisplatin: Chemistry and Biochemistry of Leading Anticancer Drag. Weinheim: Wiley–VCH, 1995.
Fulford A. // Plat. Met. Rev. 1966. V. 40. № 4. P. 161.
Giachetti S., Perpoint B., Zidani R. et al. // J. Clin. Oncol. 2000. V. 18. P. 136.
Weiss R.V., Poster D.S. // Cancer Treat. Rev. 1982. V. 9. P. 37.
Groth S., Nielsen H., Sorensen J. et al. // Cancer Chemother. Pharm. 1986. V. 17. P. 191.
Petrov V.I., Fisenko V.P., Arzamatsev E.V. et al. // Guide on Experimental (Pre-Clinical) Study of New Substances for Pharmacology. Moscow, 2000. P. 398.
Brienza S., Vignoud J., Itznaki M. et al. // Proc. Am. Soc. Clin. Oncol. 1995. V. 14. P. 209.
Dress M., Dengler W.M., Hendrics H.R. et al. // Eur. J. Cancer. A. 1995. V. 31. P. 356.
Levi F., Perpoint B., Garuit C. et al. // Eur. J. Cancer. A. 1993. V. 29. P. 1608.
Tusekbozic L., Furlani A., Scarcia V., Balzarini E. // J. Inorg. Biochem. 1998. V. 72. № 3–4. P. 201.
Wimmer F.L., Wimmer S., Castan P., Cros S. et al. // Anticancer Res. 1989. V. 9. P. 791.
Fiallo M.M., Garnier-Suillerot A. // Inorg. Chem. 1987. V. 137. P. 119.
Quroga A.G., Perez J.M., Montero E.J. et al. // J. Inorg. Biochem. 1999. V. 75. № 4. P. 293.
Иванова Н.А., Курбакова А.П., Ерофеев В.В. и др // Журн. неорган. химии. 1991. Т. 36. № 11. С. 2821.
Bouquillon S., D’Hardemare A.M., Averbuch-Pouchot M.T. et al. // Acta Crystallogr. C. 1999. V. 55. P. 2028.
Pointtillart F., Train C., Villain F. et al. // J. Am. Chem. Soc. 2007. V. 129. P. 1327.
Ammar R.A.A. // Fluide Phase Equilibria. 2009. V. 285. P. 116.
Plutin A.M., Mocelo R., Alvarez A. et al. // J. Inorg. Biochem. V. 2014. V. 134. P. 76.
Barrac V., Roch F.V., Morel L. et al. // Inorg. Chem. Acta. 2016. 446. P. 54.
Захарова И.А. (Ефименко) // Исследования по неорганической химии и химической технологии. М.: Наука, 1988. С. 171.
Ефименко И.А., Шишилов О.Н. // Журн. неорган. химии. 2012. Т. 57. № 14. С. 1695.
Ефименко И.А., Чураков А.В., Иванова Н.А. и др. // Журн. неорган. химии. 2017. Т. 62. № 11. С. 1476.
Грехова А.К., Горбачева Л.Б., Иванова Н.А., Ефименко И.А. // Журн. биомед. химии. 2013. Т. 59. № 1. С. 107.
Efimenko I.A., Shishilov O.N., Ivanova N.A., Erofeeva O.S. // Precious Met. 2012. V. 33. P. 240.
Cherkashina N.V., Kozitcyna N.Yu., Aleksandrova G.G. et al. // Mend. Commun. 2002. V. 12. № 2. P. 49.
Ефименко И.А., Анкудинова П.В., Кузьмина Л.Г. и др. // Журн. неорган. химии. 2015. Т. 60. № 7. С. 935.
Шишилов О.Н., Стромнова Т.А., Чураков А.В. и др. // Журн. неорган. химии. 2006. Т. 51. № 4. С. 626.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.31.
Allen F.H. // Acta Crystallogr. B. 2002. V. 58. № 1. P. 380.
Ефименко И.А. Подобедов Р.Е., Чураков А.В. и др. // Коорд. химия. 2011. Т. 37. № 8. С. 625 (Efimenko I.A., Podobedov R.T., Churakov A.V. et al. // Russ. J. Coord. Chem. 2011. V. 37 № 8. P. 625. https://doi.org/10.1134/ S1070328411080021).
Pandey R.N., Henry P.M. // Canad. J. Chem. 1974. V. 52. P. 1241.
Кукушкин Ю.Н. Химия координационных соединений. М.: Высш. школа. 1955. 455 с.
Накамото К. ИК спектры и спектры КР неорганических координационных соединений. М.: Мир. 1991. 411 с.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия