Координационная химия, 2020, T. 46, № 2, стр. 67-72
Синтез и структура новых полимерных пивалатов лития
Е. Н. Зорина-Тихонова 1, Д. С. Ямбулатов 1, М. А. Кискин 1, Е. С. Бажина 1, С. А. Николаевский 1, *, Н. В. Гоголева 1, И. А. Луценко 1, А. А. Сидоров 1, И. Л. Еременко 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: sanikol@igic.ras.ru
Поступила в редакцию 27.09.2019
После доработки 29.09.2019
Принята к публикации 30.09.2019
Аннотация
Представлены результаты по синтезу и исследованию кристаллической структуры соединений [Li10(Piv)10(MeCN)2]n (I) и [Li6(Piv)6(MeCN)2]n (II). По данным РСА (CIF files CCDC № 1957855 (I); 1955569 (II)), соединения I и II представляют собой 1D-полимеры, образованные дека- и гексаядерными фрагментами соответственно, в составе которых атомы лития связаны между собой μ3- и μ4-мостиковыми пивалат-анионами.
Неорганические, металлоорганические и координационные соединения лития занимают важную нишу в современной химии и науках о материалах. Они являются ценными исходными соединениями для синтеза более сложных молекул, ключевыми интермедиатами различных процессов, а также компонентами функциональных материалов, используемых в различных областях техники. Карбоксилаты лития используются для синтеза гетерометaллических комплексов, в которых они связаны мостиковыми карбоксилатными группами с атомами 3d-металлов и между собой [1–7]. При этом вариация дополнительных лигандов позволяет получать как олиго- и полиядерные, так и полимерные гетерометаллические комплексы, включая металлоорганические каркасы, обладающие нетривиальными окислительно-восстановительными [8], магнитными [9, 10], сорбционными свойствами [11, 12], и выступающие в качестве предшественников сложных оксидов, используемых при производстве анодных материалов [13–15] и аккумуляторных батарей высокой eмкости [16–18]. Образование внутримолекулярных ионных связей Li–O позволяет получать гетерометаллические соединения, которые в отличие от гомометаллических комплексов устойчивы к действию избытка хелатирующих лигандов [19, 20].
Наличие легкодоступных исходных соединений является ключевым моментом как в фундаментальных исследованиях, направленных на синтез более сложных молекул, так и при получении материалов, обладающих ценными функциональными свойствами. Парадоксальным явлением можно считать тот факт, что строение и свойства некоторых ценных исходных соединений, повседневно используемых в химическом синтезе на протяжении нескольких десятилетий, не привлекают внимания научной общественности и поэтому остаются неизвестными. В качестве примеров, иллюстрирующих обоснованность данного утверждения, уместно привести два случая из химии редокс-активных комплексов. Данные о строении кристаллических фаз натриевых солей лигандов ряда бис(N-ариламино)аценафтена (Ar-bian) и препаративные методики их синтеза были опубликованы лишь в 2003 г. [21]. К моменту публикации этих данных натриевые соли Ar-bian являлись часто используемыми исходными реагентами уже более 13 лет. О кристаллической структуре и особенностях магнитного поведения семихинолятов натрия и калия, а также катехолата натрия, имеющих гораздо более длинную историю использования в лабораторной практике, было сообщено лишь в 2018 г. [22].
В настоящей работе мы публикуем методику синтеза и результаты исследования строения пивалата лития, являющегося ценным исходным реагентом при получении гетерометаллических карбоксилатных архитектур, обладающих широким структурным разнообразием и нетривиальными физико-химическими свойствами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции по синтезу пивалата лития проводили на воздухе с использованием коммерчески доступных LiOH · H2O, пивалиновой кислоты, гексана, ацетонитрила и ТГФ.
ИК-спектры соединений регистрировали в диапазоне 400–4000 см–1 на спектрофотометре PerkinElmer Spectrum 65, оснащенном приставкой Quest ATR Accessory (Specac), методом нарушенного полного внутреннего отражения (НПВО). Элементный анализ выполняли на автоматическом C,H,N,S-анализаторе EuroEA-3000 (EuroVektor).
Синтез Li(Piv). Навеску LiOH · H2O (5.5 г, 0.13 моль) растворяли в 20 мл дистиллированной воды при кипячении. К полученному раствору добавляли эквимолярное количество кристаллической пивалиновой кислоты, перемешивали и нагревали при 140°C до полного испарения воды. Полученный продукт охлаждали до комнатной температуры, промывали гексаном и сушили до постоянной массы на воздухе. Выход 12.4 г (88% в расчете на LiOH · H2O).
ИК-спектр (НПВО; ν, см–1): 2963 ср, 2933 сл, 2903 сл, 2874 сл, 1675 ср, 1578 с, 1558 о. с, 1538 о. с, 1477 о. с, 1462 ср, 1423 о. с, 1407 о. с, 1377 с, 1359 о. с, 1224 с, 1032 о. сл, 938 о. сл, 895 ср, 806 ср, 795 ср, 597 с, 547 с, 435 о. с, 428 о. с, 415 о. с.
Пригодные для РСА монокристаллы [Li10(Piv)10(MeCN)2]n (I) вырастили в результате перекристаллизации продукта Li(Piv) из смеси ТГФ–ацетонитрил при комнатной температуре.
Пригодные для РСА монокристаллы [Li6(Piv)6- (MeCN)2]n (II) вырастили в результате перекристаллизации продукта Li(Piv) из ацетонитрила в сольвотермальных условиях.
ИК-спектр (НПВО; ν, см–1): 2961 сл, 2931 о. сл, 2905 о. сл, 2872 о. сл, 1675 сл, 1578 ср, 1557 с, 1538 с, 1478 с, 1462 сл, 1422 ср, 1408 ср, 1377 ср,1360 с, 1224 ср, 1031 о. сл, 939 о. сл, 895 сл, 805 ср, 795 ср, 598 ср, 550 ср, 450 с, 435 с, 419 о. с.
РCA монокристаллов комплексов I и II выполнен на дифрактометре Bruker SMART Apex II (CCD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор) [23]. Введена полуэмпирическая поправка на поглощение [24]. Структуры расшифрованы прямыми методами и уточнены в полноматричном анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX-97 [25].
Кристаллографические параметры комплексов I и II приведены в табл. 1. Полный набор рентгеноструктурных данных депонирован в Кембриджском банке структурных данных (CCDC № 1957855 (I); 1955569 (II); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
Таблица 1.
Кристаллографические параметры и детали уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C54H96N2O20Li10 | C34H60N2O12Li6 |
| М | 1162.73 | 730.48 |
| Т, K | 150 | 296(2) |
| Сингония | Моноклинная | Триклинная |
| Пр. гр. | P21/n | P1 |
| a, Å | 11.6781(8) | 12.1867(9) |
| b, Å | 21.9413(14) | 12.2826(9) |
| c, Å | 26.8663(17) | 16.0698(11) |
| α, град | 90 | 107.760(2) |
| β, град | 93.051(1) | 90.193(2) |
| γ, град | 90 | 103.271(2) |
| V, Å3 | 6874.3(8) | 2222.6(3) |
| Z | 4 | 2 |
| ρ(выч.), г см3 | 1.123 | 1.092 |
| μ, мм–1 | 0.08 | 0.078 |
| θ, град | 2.2–28.3 | 2.26–26.37 |
| Tmin/Tmax | 0.673/0.746 | 0.6533/0.7461 |
| Число измеренных рефлексов | 82 590 | 22 818 |
| Число независимых рефлексов | 20 985 | 9044 |
| Число рефлексов с I > 2σ(I) | 11 189 | 4458 |
| Rint | 0.068 | 0.0978 |
| Число уточняемых параметров | 775 | 533 |
| GOOF | 1.00 | 1.03 |
| R1 (I > 2σ(I)) | 0.071 | 0.0894 |
| wR2 (I > 2σ(I)) | 0.218 | 0.1895 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.76/1.37 | –0.204/0.243 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Пивалат лития получается в результате реакции нейтрализации, протекающей между раствором гидроксида лития и триметилуксусной кислотой. Использование воды как растворителя для LiOH позволяет осуществлять равномерный нагрев реакционной смеси. Поддерживание температуры 140°C препятствует удалению триметилуксусной кислоты из реакционной смеси, но позволяет эффективно удалять излишки воды по завершению реакции. Пригодные для РСА монокристаллы соединения [Li10(Piv)10(MeCN)2]n (I) выращены при комнатной температуре из смеси ТГФ–ацетонитрил. Кристаллизация из ацетонитрила в сольвотермальных условиях без доступа кислорода привела к выделению монокристаллов соединения [Li6(Piv)6(MeCN)2]n (II).
Инфракрасный спектр соединения II содержит интенсивные характеристические полосы поглощения в интервалах частот 1578–1538 и 1422–1408 см–1, относящиеся, соответственно, к антисимметричным νas(COO) и симметричным νs(COO) валентным колебаниям координированных карбоксильных групп мостиковых пивалат-анионов. Деформационные колебания δ(OCO) наблюдаются в виде двух полос средней интенсивности при 805 и 795 см–1. В спектре соединения II наблюдается также группа полос при 1478, 1360 и 1224 см–1, относящихся, соответственно, к колебаниям δas, δs и γ геминальных групп CH3.
По данным РСА, соединения I и II представляют собой 1D-координационные полимеры, образованные взаимосвязанными гекса- и дека-ядерными фрагментами соответственно. Соединение I содержит 10 неэквивалентных атомов лития (рис. 1). Шесть атомов образуют три трехъядерных фрагмента схожего строения (Li(1), Li(2), Li(5) и Li(4), Li(6), Li(10)), которые между собой связаны четырьмя пивалат-анионами, два из которых проявляют μ4-мостиковый тип координации, а два других – μ3-мостиковый. Для всех анионов один атом О координирован к одному атому Li одного из трехъядерных фрагментов, тогда как другой атом О координирован ко всем трем атомам лития второго трехъядерного фрагмента в случае μ4-мостиковых анионов и к двум атомам металла в случае μ3-анионов. Атомы Li(3), Li(7), Li(8) и Li(9) образуют тетраядерный фрагмент. Атомы Li(3) и Li(7) проявляют КЧ 5, тогда как остальные металлоцентры – КЧ 4. В случае атомов Li(8) и Li(9) одно координационное место занято атомом N координированных молекул ацетонитрила. В полимерной цепочке пара трехъядерных фрагментов чередуется с одним тетраядерным, связываясь с ним тремя μ4-мостиковыми анионами пивалиновой кислоты (рис. 2). Основные длины связей составляют Li–O 1.837(7)–2.080(6) Å (для I), 1.856(4)–2.064(4) Å (для II), Li–N 2.090(7)–2.128(8) Å (для I), 2.041(4)–2.057(4) Å (для II), а межатомные расстояния Li···Li 2.665(9)–2.943(8) Å, 4.748(9)–4.924(9) Å (для I), 1.952(4)–2.856(5) Å, 4.4981(5) Å (для II).
Рис. 1.
Строение декaядерного фрагмента, образующего полимерную цепочку соединения I. Метильные группы пивалат-анионов и атомы водорода не показаны.
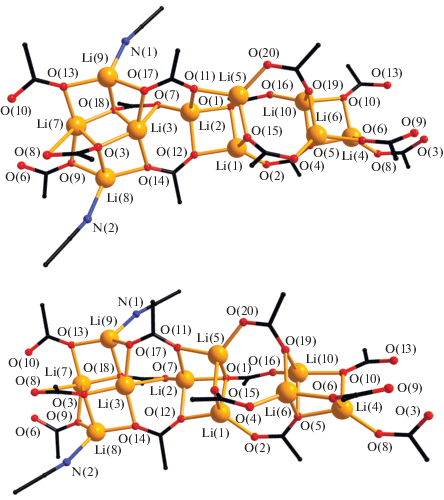
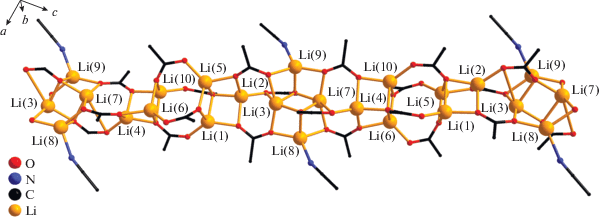
Рис. 2.
Фрагмент полимерной цепи соединения I. Метильные группы пивалат-анионов и атомы водорода не показа-ны.
Гексаядерные фрагменты соединения II содержат по три пары кристаллографически неэквивалентных атомов лития (рис. 3). В каждом из этих фрагментов четыре центральных атома лития (Li(1), Li(2) и Li(5), Li(6)) связаны шестью мостиковыми пивалат-анионами, четыре из которых проявляют μ4-мостиковый тип координации, связывая по четыре атома металла, а два других – μ3-мостиковые. Каждый анион первой пары μ4-мостиковых анионов кислоты связывает три центральных атома лития только за счет координации одного из атомов O карбоксильной группы, второй атом O карбоксильной группы участвует в связывании центральных атомов с периферийным атомом лития (Li(3) и Li(4)) внутри гекса-ядерного фрагмента. Каждый из двух μ3-мостиковых пивалат-анионов участвует в связывании двух центральных атомов лития с одним периферийным. Вторая пара μ4-мостиковых анионов кислоты связывает по два центральных атома лития, с двумя периферийными атомами металла, один из которых относится к соседнему гексаядерному фрагменту, осуществляя, таким образом, связывание отдельных фрагментов в полимерную цепь (рис. 4). Два из четырех центральных атомов лития (Li(1) и Li(5)) дополнительно координируют по одной молекуле ацетонитрила.
Рис. 3.
Строение двух типов гексаядерных фрагментов, образующих полимерную цепочку соединения II. Метильные группы пивалат-анионов и атомы водорода не показаны.
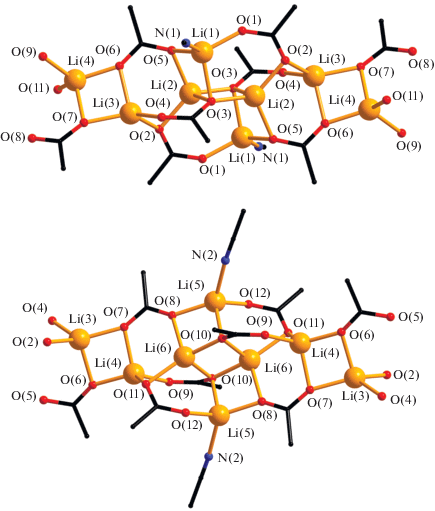
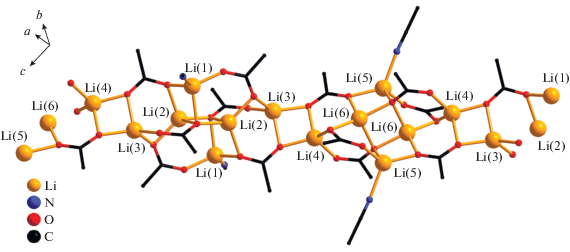
Рис. 4.
Фрагмент полимерной цепочки соединения II. Метильные группы пивалат-анионов и атомы водорода не показаны.
Интересно отметить, что структура обеих найденных нами модификаций пивалата лития существенно отличается от ранее охарактеризованного пивалата калия [K(Piv)(HPiv)(MeCN]n, содержащего в своем составе как пивалат-анионы, так и нейтральные молекулы триметилуксусной кислоты [26].
Таким образом, мы разработали надежную препаративную методику, позволяющую осуществлять синтез граммовых количеств пивалата лития, являющегося ценным исходным соединением при получении гетерометаллических карбоксилатных комплексов и металлоорганических координационных полимеров. Вариация условий кристаллизации полученного продукта позволила выделить и структурно охарактеризовать два координационных полимера состава [Li10(Piv)10(MeCN)2]n и [Li6(Piv)6(MeCN)2]n.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Сидоров А.А., Кискин М.А., Александров Г.Г. и др. // Коорд. химия. 2016. Т. 42. № 10. С. 581 (Sidorov A.A., Kiskin M.A., Aleksandrov G.G. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 621). https://doi.org/10.1134/S1070328416100031
Бажина Е.С., Александров Г.Г., Ефимов Н.Н. и др. // Изв. АН. Сер. хим. 2013. № 4. С. 962.
Бажина Е.С., Александров Г.Г., Кискин М.А. и др. // Изв. АН. Сер. хим. 2016. № 1. С. 249.
Zorina-Tikhonova E., Gogoleva N., Sidorov A. et al. // Eur. J. Inorg. Chem. 2017. P. 1396.
Gogoleva N.V., Zorina-Tikhonova E.N., Bogomyakov A.S. et al. // Eur. J. Inorg. Chem. 2017. P. 547.
Zauzolkova N.V., Nikiforova M.E., Kiskin M.A. et al. // Russ. Chem. Bull. Int. Ed. 2011. V. 60. № 2. P. 273.
Gogoleva N.V., Zorina-Tikhonova E.N., Kiskin M.A. et al. // Russ. Chem. Bull. Int. Ed. 2014. № 12. P. 2741.
Ferey G., Millange F., Morcrette M. et al. // Angew. Chem., Int. Ed. 2007. V. 46. P. 3259.
Aromi G., Bell A.R., Helliwell M. et al. // Chem. Eur. J. 2003. V. 9. P. 3024.
Bazhina E.S., Aleksandrov G.G., Kiskin M.A. et al. // Polyhedron. 2017. V. 137. P. 246.
Sapianik A.A., Zorina-Tikhonova E.N., Kiskin M.A. et al. // Inorg. Chem. 2017. V. 56. P. 1599.
Sapianik A.A., Kiskin M.A., Kovalenko K.A. et al. // Dalton Trans. 2019. V. 48. P. 3676.
Dobrokhotova Zh., Emelina A., Sidorov A. et al. // Polyhedron. 2011. V. 30. P. 132.
Burkhardt S.E., Bois J., Tarascon J.-M. et al. // Chem. Mater. 2013. V. 25. P. 132.
Луценко И.А., Кискин М.А., Александров Г.Г. и др. // Изв. АН, Сер. хим. 2018. № 3. С. 449.
Bykov M., Emelina A., Kiskin M. et al. // Polyhedron. 2009. V. 28. № 16. P. 3628.
Dobrohotova Zh.V., Sidorov A.A., Kiskin M.A. et al. // J. Solid. State Chem. 2010. V. 183. № 10. P. 2475.
Hong M., Choi H.C., Byon H.R. // Chem. Mater. 2015. V. 27. P. 2234.
Cheprakova E.M., Verbitskiy E.V., Kiskin M.A. et al. // Polyhedron. 2015. V. 100. P. 89.
Sidorov A.A., Kiskin M.A., Aleksandrov G.G., Eremenko I.L. // Russ. Chem. Bull. 2016. V. 65. № 11. P. 2754.
Fedushkin I.L., Skatova A.A., Chudakova V.A., Fukin G.K. // Angew. Chem., Int. Ed. 2003. V. 42. P. 3294.
Fokin S.V., Letyagin G.A., Romanenko G.V. et al. // Russ. Chem. Bull. Int. Ed. 2018. V. 67. № 1. P. 61.
SMART (Control) and SAINT (Integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. SADABS. Program for Scanning and Correction of Area Detector Data. Göttinngen (Germany): Univ. of Göttingen, 2004.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Kiskin M.A., Fomina I.G., Aleksandrov G.G. et al. // Inorg. Chem. Commun. 2004. V. 7. P. 734.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


