Координационная химия, 2020, T. 46, № 9, стр. 562-576
Хемосорбционный синтез, самоорганизация сложных 2D- и 3D-супрамолекулярных архитектур (роль водородных связей и вторичных взаимодействий Au···S, S···Cl) и термическое поведение псевдополимерных дибутилдитиокарбаматно-хлоридных комплексов золота(III)–ртути(II)
А. В. Иванов 1, *, О. В. Лосева 1, Т. А. Родина 1
1 Институт геологии и природопользования ДВО РАН
Благовещенск, Россия
* E-mail: alexander.v.ivanov@chemist.com
Поступила в редакцию 29.11.2019
После доработки 08.12.2019
Принята к публикации 25.12.2019
Аннотация
Изучено взаимодействие дибутилдитиокарбамата (BuDtc) ртути(II) с анионами [AuCl4]− в среде 2 M HCl. Гетерогенная реакция хемосорбционного связывания золота(III) из раствора приводит к формированию гетероядерных Au(III)–Hg(II) псевдополимерных комплексов ионного типа: ([Au{S2CN(C4H9)2}2]2[Hg2Cl6])n (I) и ([(C4H9)2NH2]0.5[Au{S2CN(C4H9)2}2]1.5[Hg2Cl6])n (II), кристаллические и супрамолекулярные структуры которых установлены методом РСА (CIF files CCDC № 1965151 (I) и 1965152 (II)). Катионная часть каждого из соединений представлена двумя структурно-неэквивалентными комплексными ионами [Au{S2CN(C4H9)2}2]+ (A и B), соотносящимися как конформеры; структура II дополнительно включает катион дибутиламмония. Противоионом в обоих случаях является биядерный [Hg2Cl6]2– – центросимметричный в структуре I и нецентросимметричный в II. За счет вторичных взаимодействий Au···S и S···Cl (а также водородных связей N–H···Cl в II) все ионные структурные единицы участвуют в построении псевдополимерных катионных и катион-анионных цепочек, которые объединяются в сложноорганизованный 2D-супрамолекулярный слой (I) или 3D каркас (II). Термическое поведение I, II изучено методом синхронного термического анализа. Термолиз комплексов сопровождается количественной регенерацией связанного золота, высвобождением HgCl2 и его частичным преобразованием в HgS.
Координационные соединения ртути(II) c хелатными лигандами представляют интерес как основа фотолюминесцентных и электролюминесцентных материалов [1, 2], а также находят применение в медицине и сельском хозяйстве в связи с проявляемой ими фунгицидной и антибактериальной активностью [3]. Дитиокарбаматы ртути(II) являются перспективными прекурсорами при получении пленочных и наноразмерных сульфидов ртути с люминесцентными и полупроводниковыми свойствами, которые широко применяются в производстве ультразвуковых и фотоэлектрических преобразователей, датчиков изображения, инфракрасных детекторов [4–6].
Дитиокарбаматные лиганды, проявляющие различные структурные функции: монодентатную, бидентатно-терминальную, бидентатно-мостиковую и тридентатно-мостиковую, образуют с катионами Hg2+ (электронная конфигурация d10) комплексы со сложноорганизованными супрамолекулярными структурами. Относительно слабые взаимодействия невалентного типа: водородные связи C–H···S, вторичные (Hg···N, Hg···S, S···S), π···π и металлофильные взаимодействия не только стабилизируют сложные супрамолекулярные архитектуры, но и обеспечивают проявление фотолюминесцентных свойств комплексов [7].
Ранее мы установили, что свежеосажденные дитиокарбаматы ртути(II) проявляют способность к хемосорбционному связыванию золота(III) из кислых растворов с образованием дитиокарбаматно-хлоридных гетерометаллических комплексов золота(III)–ртути(II) ионного типа, включающих различные полихлоро(ди)меркурат(II)-ионы: [Au(S2CNR2)2]2[HgCl4] (R = CH3 [8], R2 = (CH2)6 [9]), [Au(S2CNR2)2]2[Hg2Cl6] (R = C2H5 [8], изо-C3H7 [10], R2 = (CH2)5 [11], (CH2)4O [9]) и [Au{S2CN(CH2)6}2][HgCl3] [9]. Кроме того, показано, что специфика комплексов на основе дибутилдитиокарбаматных (BuDtc) лигандов определяется возможностью получения тройных соединений общего состава ([(C4H9)2NH2][Au{S2CN(C4H9)2}2][MCl4])n (M = Cd [12], Zn [13]). Нужно отметить, что все соединения, приведенные выше, характеризуются сложноорганизованными супрамолекулярными структурами.
В продолжение этих исследований в настоящей работе, в качестве индивидуальных форм связывания Au(III) из растворов свежеосажденным дибутилдитиокарбаматом ртути(II), препаративно выделены и структурно охарактеризованы два новых ионно-полимерных комплекса золота(III)–ртути(II) ([Au{S2CN(C4H9)2}2]2[Hg2Cl6])n (I) и ([(C4H9)2NH2]0.5[Au{S2CN(C4H9)2}2]1.5[Hg2Cl6])n (II). Кристаллические и супрамолекулярные структуры, спектральные характеристики и термическое поведение комплексов изучены методами РСА, СР-MAS ЯМР 13С спектроскопии и синхронного термического анализа (СТА).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Дибутилдитиокарбамат натрия получали взаимодействием сероуглерода (Merck) с дибутиламином (Aldrich) в щелочной среде, а исходный дибутилдитиокарбамат ртути(II) − осаждением ионов Hg2+ из водной фазы раствором Na{S2CN(C4H9)2} ⋅ ⋅ H2O, взятым в стехиометрическом соотношении [14]. По данным РСА установлено, что [Hg2{S2CN(C4H9)2}4] представляет собой биядерный комплекс, структурной особенностью которого является стабилизация центрального трициклического фрагмента [Hg2S4C2] в конформации “ванна” [15].
Синтез I, II. К 100 мг [Hg2{S2CN(C4H9)2}4] приливали 10 мл раствора AuCl3 (в 2 M HCl), содержащего 32.0 мг золота, и перемешивали в течение 30 мин. Образовавшуюся красно-коричневую однородную пластичную массу отделяли, промывали водой (при одновременном тщательном растирании стеклянной палочкой), высушивали на фильтре и растворяли в смеси толуол–ацетон (1 : 1). Для дифрактометрического эксперимента желтые кристаллы I (призматические) и II (тонкие удлиненные) получали медленным испарением растворителя при комнатной температуре. Кристаллы отбирали под микроскопом. Остаточное содержание золота в растворе определяли на атомно-абсорбционном спектрометре iCE 3000 (Thermo Electron Corporation, США). Степень связывания золота из раствора составила 73.14%.
Гетерогенная реакция связывания золота(III) из раствора свежеосажденным дибутилдитиокарбаматом ртути(II) приводит к образованию двух гетероядерных ионных комплексов золота(III)–ртути(II) и сопровождается полным перераспределением лигандов между координационными сферами Hg(II) и Au(III) с частичным распадом лиганда BuDtc:
Количество золота(III), связанного из раствора в твердую фазу (23.4 мг), определяет 86.9%-ный выход реакции.
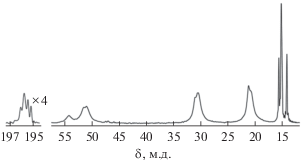
Кристаллические продукты реакции охарактеризовали по данным MAS ЯМР 13C спектроскопии (δ, м.д.): 196.0, 195.7, 195.4, 195.1 (1 : 2 : 1 : 1, >NCS2−); 54.2, 51.5, 51.0 (>N–αCH2−); 31.1, 30.6 (−βCH2−); 21.2, 20.8 (−γCH2−); 15.6, 15.2, 14.2 (−CH3).
РСА монокристаллов I, II выполнен на дифрактометре Bruker-Nonius X8 Apex CCD (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 150(2) K. Сбор данных проведен по стандартной методике: φ- и ω-сканирование узких фреймов. Поглощение учтено эмпирически с использованием программы SADABS [16]. Структура определена прямым методом и уточнена методом наименьших квадратов (по F 2) в полноматричном анизотропном приближении неводородных атомов. Положения атомов водорода рассчитаны геометрически и включены в уточнение в модели “наездника”. Расчеты по определению и уточнению структуры выполнены по комплексу программ SHELXTL [16].
Координаты атомов, длины связей и углы депонированы в Кембриджском банке структурных данных (№ 1965151 (I) и 1965152 (II); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk). Основные кристаллографические данные и результаты уточнения структур I, II приведены в табл. 1, длины связей и углы − в табл. 2, геометрические параметры водородных связей комплекса II − в табл. 3.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I, II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C36H72N4S8Cl6Au2Hg2 | C31H64N3.5S6Cl6Au1.5Hg2 |
| М | 1825.27 | 1587.55 |
| Сингония | Триклинная | Моноклинная |
| Пр. гр. | P1 | P21/c |
| a, Å | 10.6399(3) | 11.7618(8) |
| b, Å | 11.6712(3) | 25.0159(18) |
| c, Å | 12.7780(3) | 17.5347(13) |
| α, град | 103.3450(10) | 90.00 |
| β, град | 101.5940(10) | 105.387(2) |
| γ, град | 107.4260(10) | 90.00 |
| V, Å3 | 1409.34(6) | 4974.3(6) |
| Z | 1 | 4 |
| ρ(выч.), г/см3 | 2.151 | 2.120 |
| μ, мм–1 | 11.229 | 11.167 |
| F(000) | 864 | 3004 |
| Размер кристалла, мм | 0.24 × 0.20 × 0.13 | 0.28 × 0.08 × 0.08 |
| Область сбора данных по θ, град | 1.71–27.59 | 1.63–27.65 |
| Интервалы индексов отражений | –13 ≤ h ≤ 13, –15 ≤ k ≤ 15, –15 ≤ l ≤ 16 |
–14 ≤ h ≤ 15, –32 ≤ k ≤ 32, –22 ≤ l ≤ 22 |
| Измерено отражений | 14 479 | 48 505 |
| Независимых отражений (Rint) | 6499 (0.0264) | 11 481 (0.0308) |
| Отражений с I > 2σ(I) | 5749 | 9642 |
| Переменных уточнения | 269 | 501 |
| GOOF | 0.992 | 1.028 |
| R-факторы по F 2 > 2σ(F 2) |
R1 = 0.0240 wR2 = 0.0441 |
R1 = 0.0236 wR2 = 0.0419 |
| R-факторы по всем отражениям | R1 = 0.0297 wR2 = 0.0455 |
R1 = 0.0348 wR2 = 0.0437 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.931/0.984 | –0.972/1.054 |
Таблица 2.
Основные длины связей (d), валентные (ω) и торсионные (φ) углы в структурах I и II*
| I | |||
| Связь | d, Å | Связь | d, Å |
| Au(1)–S(1) | 2.3318(9) | Au(2)···S(1)a | 3.6608(10) |
| Au(1)–S(2) | 2.3349(9) | S(3)–C(10) | 1.741(3) |
| S(1)–C(1) | 1.733(4) | S(4)–C(10) | 1.737(3) |
| S(2)–C(1) | 1.739(4) | N(2)–C(10) | 1.303(4) |
| N(1)–C(1) | 1.304(4) | N(2)–C(11) | 1.482(4) |
| N(1)–C(2) | 1.479(4) | N(2)–C(15) | 1.489(4) |
| N(1)–C(6) | 1.479(4) | Hg(1)–Cl(1) | 2.6982(9) |
| Au(2)–S(3) | 2.3444(8) | Hg(1)–Cl(2) | 2.3662(10) |
| Au(2)–S(4) | 2.3328(8) | Hg(1)–Cl(3) | 2.3984(9) |
| Hg(1)–Cl(1)c | 2.5653(10) | ||
| Угол | ω, град | Угол | ω, град |
| S(1)Au(1)S(2) | 75.72(3) | Au(2)S(4)C(10) | 86.89(11) |
| S(1)Au(1)S(2)a | 104.28(3) | S(3)C(10)S(4) | 111.06(17) |
| Au(1)S(1)C(1) | 86.62(11) | Cl(1)Hg(1)Cl(2) | 107.71(4) |
| Au(1)S(2)C(1) | 86.39(12) | Cl(1)Hg(1)Cl(3) | 101.02(3) |
| S(1)C(1)S(2) | 111.20(17) | Cl(1)Hg(1)Cl(1)c | 89.47(3) |
| S(3)Au(2)S(4) | 75.62(3) | Cl(2)Hg(1)Cl(3) | 127.46(4) |
| S(3)Au(2)S(4)b | 104.38(3) | Cl(2)Hg(1)Cl(1)c | 115.42(4) |
| Au(2)S(3)C(10) | 86.43(10) | Cl(3)Hg(1)Cl(1)c | 107.72(3) |
| Hg(1)Cl(1)Hg(1)c | 90.53(3) | ||
| Угол | φ, град | Угол | φ, град |
| Au(1)S(1)S(2)C(1) | 176.9(2) | Au(2)S(3)S(4)C(10) | –179.7(2) |
| S(1)Au(1)C(1)S(2) | 177.2(2) | S(3)Au(2)C(10)S(4) | –179.7(2) |
| S(1)C(1)N(1)C(2) | 0.7(5) | S(3)C(10)N(2)C(11) | –4.0(5) |
| S(1)C(1)N(1)C(6) | –177.0(3) | S(3)C(10)N(2)C(15) | 180.0(3) |
| S(2)C(1)N(1)C(2) | –179.4(3) | S(4)C(10)N(2)C(11) | 174.5(3) |
| S(2)C(1)N(1)C(6) | 2.9(5) | S(4)C(10)N(2)C(15) | –1.5(5) |
| II | |||
| Связь | d, Å | Связь | d, Å |
| Au(1)–S(1) | 2.3274(9) | S(6)–C(19) | 1.737(3) |
| Au(1)–S(2) | 2.3323(10) | N(2)–C(10) | 1.306(4) |
| Au(1)···S(6) | 3.5698(9) | N(2)–C(11) | 1.476(4) |
| S(1)–C(1) | 1.727(4) | N(2)–C(15) | 1.473(4) |
| S(2)–C(1) | 1.737(4) | N(3)–C(19) | 1.300(4) |
| N(1)–C(1) | 1.306(4) | N(3)–C(20) | 1.490(4) |
| N(1)–C(2) | 1.479(5) | N(3)–C(24) | 1.487(4) |
| N(1)–C(6) | 1.471(5) | N(4)–C(28) | 1.377(16) |
| Au(2)–S(3) | 2.3478(9) | N(4)–C(32) | 1.459(13) |
| Au(2)–S(4) | 2.3415(9) | Hg(1)–Cl(1) | 2.3660(10) |
| Au(2)–S(5) | 2.3398(9) | Hg(1)–Cl(2) | 2.3668(10) |
| Au(2)–S(6) | 2.3326(9) | Hg(1)–Cl(3) | 2.6963(9) |
| II | |||
| Связь | d, Å | Связь | d, Å |
| Au(2)···S(1) | 3.2948(9) | Hg(1)–Cl(4) | 2.6200(9) |
| Au(2)···S(5)b | 3.8655(9) | Hg(2)–Cl(3) | 2.6564(9) |
| S(3)–C(10) | 1.741(3) | Hg(2)–Cl(4) | 2.6360(9) |
| S(4)–C(10) | 1.725(3) | Hg(2)–Cl(5) | 2.3661(10) |
| S(5)–C(19) | 1.736(3) | Hg(2)–Cl(6) | 2.3879(10) |
| Угол | ω, град | Угол | ω, град |
| S(1)Au(1)S(2) | 75.30(3) | S(5)C(19)S(6) | 110.7(2) |
| S(1)Au(1)S(2)a | 104.70(3) | Cl(1)Hg(1)Cl(2) | 132.78(4) |
| Au(1)S(1)C(1) | 87.26(13) | Cl(1)Hg(1)Cl(3) | 104.42(4) |
| Au(1)S(2)C(1) | 86.87(12) | Cl(1)Hg(1)Cl(4) | 114.39(4) |
| S(1)C(1)S(2) | 110.5(2) | Cl(2)Hg(1)Cl(3) | 101.79(3) |
| S(3)Au(2)S(4) | 75.27(3) | Cl(2)Hg(1)Cl(4) | 105.38(4) |
| S(3)Au(2)S(5) | 105.61(3) | Cl(3)Hg(1)Cl(4) | 87.26(3) |
| S(3)Au(2)S(6) | 178.95(3) | Cl(3)Hg(2)Cl(4) | 87.76(3) |
| S(4)Au(2)S(5) | 178.58(3) | Cl(3)Hg(2)Cl(5) | 106.31(3) |
| S(4)Au(2)S(6) | 103.75(3) | Cl(3)Hg(2)Cl(6) | 106.23(4) |
| S(5)Au(2)S(6) | 75.37(3) | Cl(4)Hg(2)Cl(5) | 108.92(4) |
| Au(2)S(3)C(10) | 86.36(12) | Cl(4)Hg(2)Cl(6) | 104.35(4) |
| Au(2)S(4)C(10) | 86.92(12) | Cl(5)Hg(2)Cl(6) | 133.72(4) |
| Au(2)S(5)C(19) | 86.86(12) | Hg(1)Cl(3)Hg(2) | 89.92(3) |
| Au(2)S(6)C(19) | 87.06(12) | Hg(1)Cl(4)Hg(2) | 92.05(3) |
| S(3)C(10)S(4) | 111.4(2) | ||
| Угол | φ, град | Угол | φ, град |
| Au(1)S(1)S(2)C(1) | 177.9(2) | S(5)Au(2)C(19)S(6) | 178.6(2) |
| S(1)Au(1)C(1)S(2) | 178.1(2) | S(3)C(10)N(2)C(11) | –0.8(5) |
| S(1)C(1)N(1)C(2) | –4.4(5) | S(3)C(10)N(2)C(15) | 175.9(2) |
| S(1)C(1)N(1)C(6) | 175.8(3) | S(4)C(10)N(2)C(11) | –178.3(2) |
| S(2)C(1)N(1)C(2) | 174.8(3) | S(4)C(10)N(2)C(15) | –1.6(5) |
| S(2)C(1)N(1)C(6) | –5.0(5) | S(5)C(19)N(3)C(20) | 1.6(5) |
| Au(2)S(3)S(4)C(10) | 179.6(2) | S(5)C(19)N(3)C(24) | –178.6(2) |
| Au(2)S(5)S(6)C(19) | 178.4(2) | S(6)C(19)N(3)C(20) | –179.1(2) |
| S(3)Au(2)C(10)S(4) | 179.6(2) | S(6)C(19)N(3)C(24) | 0.6(5) |
Спектры СР-MAS ЯМР 13C регистрировали на спектрометре Ascend Aeon (Bruker) с рабочей частотой 100.64 МГц, сверхпроводящим магнитом (В0 = 9.4 Тл) с замкнутым циклом конденсации гелия через внешний компрессор и Фурье-преобразованием. Использовали кросс-поляризацию (CP) с протонов: контактное время 1H−13C 2.0 мс. Подавление взаимодействий 13C−1H основывалось на эффекте декаплинга, при использовании радиочастотного поля на резонансной частоте протонов (400.21 МГц) [17]. Кристаллический образец массой 62 мг помещали в 4.0 мм керамический ротор из ZrO2. При измерении MAS ЯМР 13C использовали вращение образцa под магическим углом на частоте 3200(1) Гц; число накоплений 6900; длительность протонных π/2-импульсов 2.7 мкс; интервал между импульсами 2.0 с. Изотропные хим. сдвиги ядер 13C (м.д.) даны относительно одной из компонент внешнего стандарта – кристаллического адамантана (δ = 38.48 м.д. относительно тетраметилсилана) с поправкой на дрейф напряженности магнитного поля, частотный эквивалент которого составил 0.025 Гц/ч.
Термическое поведение I, II изучали методом СТА на приборе STA 449C Jupiter (NETZSCH) в корундовых тиглях под крышкой с отверстием, обеспечивающим давление паров при термическом разложении образца в 1 атм. Скорость нагрева составляла 5°С/мин до 1100°С в атмосфере аргона. Масса навесок 2.011–5.448 мг. Точность измерения температуры ±0.7°С, изменения массы ±1 × 10–4 мг. При съемке кривых ТГ и ДСК использовали файл коррекции, а также калибровки по температуре и чувствительности для заданной температурной программы и скорости нагрева. Независимое определение температур плавления проводили на приборе ПТП(М) (ОАО “Химлаборприбор”).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для установления структурной организации и супрамолекулярной самоорганизации комплексов их кристаллические структуры были определены методом РСА. Элементарные ячейки I/II включают 1/4 формульные единицы [Au{S2CN(C4H9)2}2]2 - [Hg2Cl6]/[(C4H9)2NH2]0.5[Au{S2CN(C4H9)2}2]1.5[Hg2Cl6] (рис. 1, табл. 1). В состав катионной части соединения I входят два структурно-неэквивалентных центросимметричных комплексных катиона [Au{S2CN(C4H9)2}2]+: А с атомом Au(1) и В – Au(2) (рис. 2а, 2б). Структура II, наряду с двумя неэквивалентными катионами золота(III), центросимметричным А – Au(1) и нецентросимметричным В – Au(2), также включает катион дибутиламмония (рис. 3а–3в, табл. 2).
Рис. 1.
Упаковка структурных единиц в кристаллах I (а) и II (б). Алкильные заместители лигандов BuDtc не приведены.
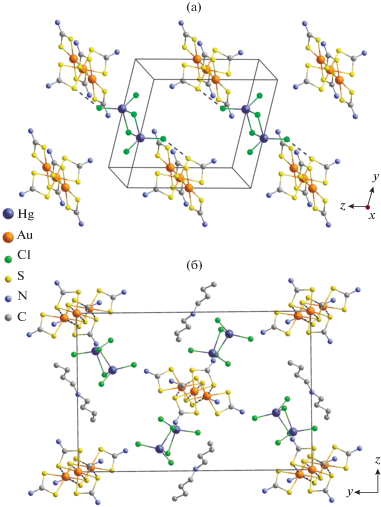
Рис. 2.
Структура двух кристаллографически независимых катионов золота(III) А (а) и В (б) и биядерного аниона [Hg2Cl6]2– (в) в соединении I. Эллипсоиды 50%-ной вероятности.
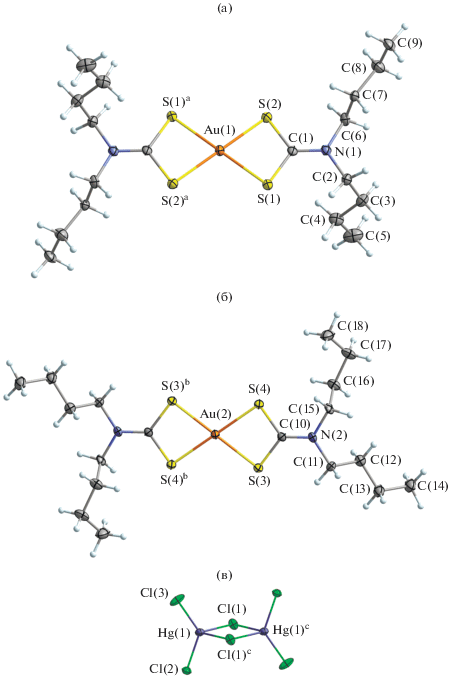
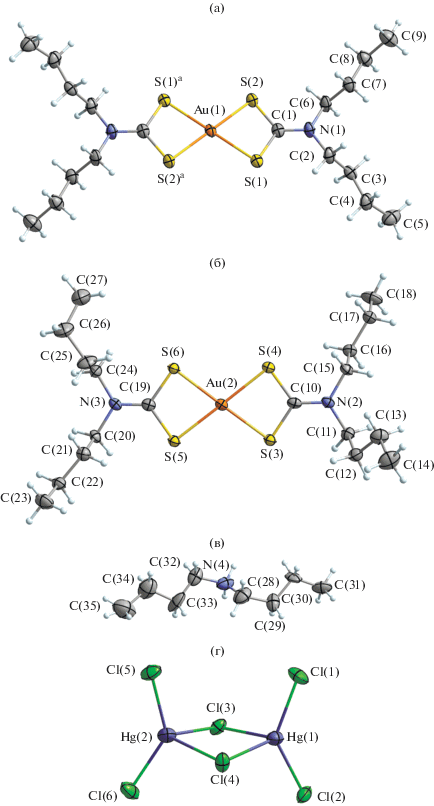
Рис. 3.
Структура двух изомерных катионов Au(III) А (а) и В (б), катиона [NH2(C4H9)2]+ (в) и биядерного аниона [Hg2-Cl6]2– (г) в соединении II. Эллипсоиды 50%-ной вероятности.
Для лигандов BuDtc характерны две общие особенности: в группировках S2CNC2 взаимное расположение атомов близко к копланарному (см. значения соответствующих торсионных углов в табл. 2) и существенно более короткие связи N–C(S)S (1.300–1.306 Å) в сравнении со связями N–CH2 (1.471–1.490 Å); длина связей C–C лежит в диапазоне 1.464(17)–1.514(9) Å. Оба отмеченных обстоятельства – прямое следствие проявления в обсуждаемых лигандах мезомерного эффекта. В каждом из катионов золота(III) комплексообразователь, S,S'-бидентатно координируя два лиганда BuDtc, находится в гомогенном окружении четырех атомов серы: образование плоских полигонов [AuS4] свидетельствует о низкоспиновом внутриорбитальном dsp2-гибридном состоянии атомов золота. Лиганды обнаруживают практически изобидентатный характер координации: Au–S 2.3318–2.3444 Å (I) и 2.3274–2.3478 Å (II) (табл. 2), что приводит к образованию двух четырехчленных металлоциклов [AuS2C], связанных общим атомом золота. Обсуждаемые малоразмерные циклы характеризуют расстояния Au⋅⋅⋅C (2.822–2.836 Å) и S⋅⋅⋅S (2.846–2.867 Å), которые значительно меньше сумм ван-дер-ваальсовых радиусов соответствующих пар атомов: 3.36 и 3.60 Å [18, 19], а их плоскостная геометрия иллюстрируется значениями торсионных углов AuSSC и SAuCS не сильно (на 0.3°−3.1°) отличающимися от 180° или 0° (табл. 2). Несмотря на глубокое структурное сходство неэквивалентных катионов [Au{S2CN(C4H9)2}2]+ в полученных комплексах, достоверные различия их соответственных геометрических характеристик (длина связей, межатомные расстояния, валентные и торсионные углы) позволяют классифицировать обсуждаемые комплексные катионы золота(III) как конформационные изомеры.
В структуре обоих соединений присутствуют биядерные анионы [Hg2Cl6]2− (Hg(1)···Hg(1)с 3.7403(2) Å (I) и Hg(1)···Hg(2) 3.7824(3) Å (II)), в которых атомы ртути, объединяемые двумя мостиковыми атомами хлора, находятся в искаженно-тетраэдрическом окружении [HgCl4] (состояние sp3-гибридизации). Существенное отличие состоит в том, что структура I включает центросимметричные комплексные анионы (рис. 2в), тогда как в II реализуется менее типичный, нецентросимметричный вариант их построения (рис. 3г). При этом центральная часть комплексных анионов представляет собой четырехчленный металлоцикл [Hg2Cl2], для которого в комплексе I характерна плоская конфигурация (торсионные углы HgClClHg и ClHgHgCl равны 180°); в II обсуждаемый цикл принимает конформацию “бабочка”, что можно представить его перегибом по оси Hg−Hg или Cl−Cl (значения соответствующих торсионных углов ClHgHgCl 161.19° и HgClClHg 161.75°). Связи комплексообразователя с концевыми атомами хлора более прочные (2.3660, 2.3984/2.3660–2.3879 Å) в сравнении с мостиковыми (2.5653, 2.6982/2.6200–2.6963 Å) (табл. 2). Валентные углы ClHgCl (89.47°−127.46°/87.26°−133.72°) (табл. 2) отклоняются от чисто тетраэдрического значения, что в целом характерно для галогеномеркурат(II)-ионов [20–22]. В соединениях I/II геометрия полиэдров ртути(II) может быть количественно охарактеризована с помощью параметра τ4 = [360° – (α + β)]/141°, где α и β – два наибольших угла LML в комплексах с четверным окружением комплексообразователя [23]. Предельные значения τ4, равные 1 (α = β = 109.5°) или 0 (α = β = 180°), указывают на реализацию для координационных сфер типа [ML4] чисто тетраэдрической или плоско-тетрагональной геометрии. Данные табл. 2 позволили рассчитать значение параметра τ4 для комплексов I (0.831) и II (0.800 [Hg(1)] и 0.832 [Hg(2)]). Следовательно, полиэдры [HgCl4] характеризуются искаженно-тетраэдрическим строением с преобладающим (80.0–83.2%) вкладом тетраэдрической составляющей в их геометрию.
Супрамолекулярные структуры исследуемых соединений существенно различны, хотя в обоих случаях их формирование обусловлено относительно слабыми вторичными взаимодействиями Au⋅⋅⋅S и S⋅⋅⋅Cl невалентного типа между изомерными катионами Au(III) и анионами Hg(II). (Концепция вторичных связей (secondary bonds) ранее предложена в [24].) Рассмотрим структурную самоорганизацию комплексов I, II более подробно.
В соединении I изомерные катионы Au(III) выполняют различные структурные функции. Так, каждый катион В образует вторичные связи S∙∙∙Cl [25] с двумя ближайшими биядерными анионами ртути(II) и наоборот. При этом построение обсуждаемых связей S(4)⋅⋅⋅Cl(2) 3.3070(13) Å (для сравнения, сумма ван-дер-ваальсовых радиусов серы и хлора 3.55 Å [18, 19]) осуществляется двумя диагонально ориентированными атомами S(4) катиона B и концевыми атомами Cl(2) аниона [Hg2Cl6]2–, в результате чего формируются катион-анионные супрамолекулярные цепочки типа (∙∙∙В∙∙∙[Hg2Cl6]2–∙∙∙)n с межатомным расстоянием Au(2)–Hg(1) 5.8010(2) Å (рис. 4). В свою очередь, катионы A, локализованные между обсуждаемыми цепочками, через диагональные атомы серы S(1) и S(1)a взаимодействуют с катионами B, участвуя за счет относительно слабых вторичных взаимодействий Au(2)···S(1)a (3.6608 Å) в попарном объединении супрамолекулярных цепочек в 2D-псевдополимерный слой (рис. 4).
Рис. 4.
Построение супрамолекулярного 2D-псевдополимерного слоя в соединении I: в катион-анионных цепочках (расположены горизонтально) вторичные связи S···Cl – точечный пунктир; короткие контакты Au···S между неэквивалентными катионами золота(III) – штриховые линии. Симметрические преобразования: a –x, –y, 1 – z; b 1 – x, –y, 1 – z; c 1 – x, 1 – y, 1 – z; d 1 – x, 1 – y, –z.
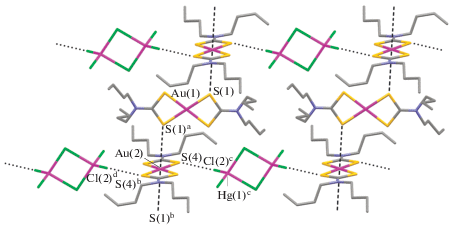
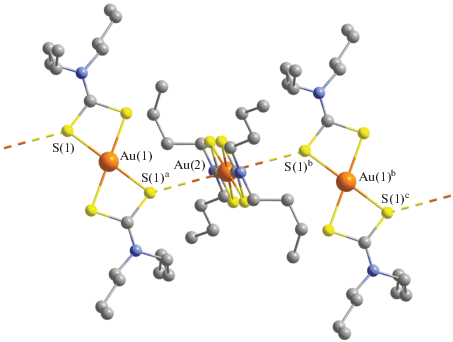
Подсистема чередующихся изомерных катионов Au(III), объединяемых вторичными взаимодействиями Au(2)···S(1), также может рассматриваться как совокупность линейных супрамолекулярных цепочек (∙∙∙А∙∙∙В∙∙∙)n, ориентированных вдоль кристаллографической оси x (межатомное расстояние Au(1)–Au(2) 5.3200(2) Å). Взаимная пространственная ориентация соседних катионов в цепочке (рис. 5) характеризуется углом в 80.51° между плоскостями, в которых лежат хромофоры [AuS4]. За счет вторичных взаимодействий атом Au(2) в катионе В достраиваетближайшее окружение до вытянутого искаженного октаэдра [AuS4 + 2]. Вершинные атомы серы в обсуждаемом октаэдре смещены c идеальных позиций, поскольку аксиальная ось S(1)а∙∙∙Au(2)∙∙∙S(1)b образует с экваториальной плоскостью угол в 70.47°, весьма существенно отклоняющийся от 90°. Экваториальную плоскость октаэдра определяют атомы серы S(3), S(4), S(3)b и S(4)b, образующие прямоугольник со сторонами S(3)⋅⋅⋅S(4) 2.867 Å и S(3)⋅⋅⋅S(4)b 3.695 Å, внутренние углы которого близки к прямому: S(4)S(3)S(4)b 89.71° и S(3)S(4)S(3)b 90.29°.
Рис. 5.
Взаимная пространственная ориентация неэквивалентных катионов золота(III) A и B структуре I. Вторичные взаимодействия Au(2)⋅⋅⋅S(1)a – пунктирные линии.
В качестве структурных единиц соединение II включает три изомерных катиона Au(III) (центросимметричный А и два нецентросимметричных В), два нецентросимметричных аниона [Hg2-Cl6]2– и статистически распределенный между двумя структурными положениями (с равной заселенностью) катион дибутиламмония [(C4H9)2NH2]+ (рис. 3). В супрамолекулярной самоорганизации II участвуют все вышеперечисленные комплексные ионы. Так, изомерные катионы золота(III), связанные парами существенно неэквивалентных вторичных связей Au(2)⋅⋅⋅S(1) 3.2948 Å и Au(1)⋅⋅⋅S(6) 3.5698 Å (сумма ван-дер-ваальсовых радиусов атомов золота и серы 3.46 Å [18, 19]), образуют линейные супрамолекулярные триады [B···A···B]3+: межатомное расстояние Au(1)–Au(2) 4.0649(3) Å, угол Au(2)Au(1)Au(2) 180°; нецентросимметричные катионы B ориентированы антипараллельно, тогда как плоскости, в которых лежат хромофоры [AuS4] соседних катионов А и В, образуют угол 16.95° (рис. 6a). Катионные триады, в свою очередь, за счет относительно слабых, симметричных вторичных взаимодействий Au(2)⋅⋅⋅S(5)a и Au(2)a⋅⋅⋅S(5) 3.8655 Å выстраивают зигзагообразные псевдополимерные цепочки (···[B···A···B]···)n, направленные вдоль кристаллографической оси x (рис. 6а): между триадами расстояние Au(2)–Au(2) 5.0552(3) Å и угол Au(1)Au(2)Au(2) 124.61°.
Рис. 6.
Фрагмент супрамолекулярной катионной цепочки (⋅⋅⋅[B⋅⋅⋅A⋅⋅⋅B]⋅⋅⋅)n в соединении II: вторичные связи Au···S – двойной пунктир (а); структура трехзвенного фрагмента {[Hg2Cl6]2−⋅⋅⋅[NH2(C4H9)2]+⋅⋅⋅[Hg2Cl6]2−}: водородные связи – пунктир (б). Симметрические преобразования: a 1 – x, 1 – y, 1 – z; b 1 + x, y, z; c –x, 1 – y, 1 – z; d 1 – x, 1 – y, –z.
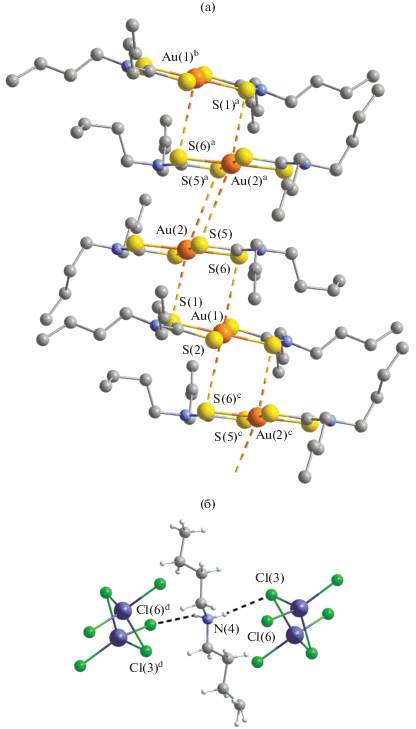
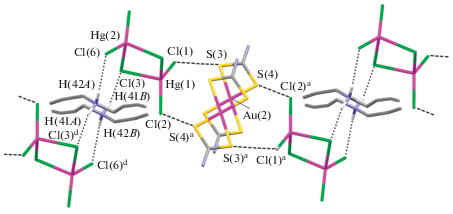
Однако основной вклад в связывание обсуждаемых катионных триад [B···A···B] вносят вторичные взаимодействия с нецентросимметричными анионами [Hg2Cl6]2– (рис. 7). В этом случае терминальные атомы хлора Cl(1) и Cl(2) биядерных анионов ртути(II), локализованных между катионными псевдополимерными цепочками, и атомы серы S(3) и S(4) одного из лигандов в каждом из двух антипараллельно ориентированных катионов B (которые принадлежат соседним катионным триадам) образуют две пары неэквивалентных вторичных связей S(3)⋅⋅⋅Cl(1) 3.4014(16) Å и S(4)⋅⋅⋅Cl(2) 3.4940(13) Å. Кроме того, другая пара атомов хлора, терминальный Cl(6) и мостиковый Cl(3), вовлечена в образование водородных связей с катионом дибутиламмония (который в каждом из структурных положений равновероятно представлен одной из двух противоположно направленных ориентаций): N(4)–H(41B)···Cl(3) 3.412(7) Å и N(4)–H(42B)···Cl(6)d 3.481(8) Å (рис. 7, табл. 3). В результате образуются трехзвенные структурные фрагменты {[Hg2Cl6]2−···[(C4H9)2NH2]+···[Hg2Cl6]2−} (рис. 6б), которые объединяют соседние катионные псевдополимерные цепочки на стыках катионных триад [B···A···B]. Таким образом, совокупное проявление всех обсуждаемых взаимодействий приводит к общему связыванию ионных структурных единиц соединения II в 3D-супрамолекулярный каркас (рис. 7).
Рис. 7.
Фрагмент супрамолекулярной структуры II: вторичные связи S···Cl – штриховые линии, водородные связи между анионами [Hg2Cl6]2– и катионами дибутиламмония – точечный пунктир. Катионы дибутиламмония статистически рас-пределены между двумя позициями с одинаковой заселенностью. Симметрические преобразования: a 1 – x, 1 – y, 1 – z; d 1 – x, 1 – y, –z.
В катионных триадах реализуются наиболее значимые вторичные связи Au⋅⋅⋅S, за счет которых атомы золота достраивают свой полигон до искаженной тетрагональной пирамиды [Au(2)S4+1] и искаженного октаэдра [Au(1)S4+2]. В вытянутой пирамиде вершинный атом S(1) смещен с идеальной позиции, поскольку угол S(1)∙∙∙Au(2)–S(4) в 82.29° заметно отклоняется от 90°. Для вытянутого октаэдра эффект смещения аксиальных атомов выражен в меньшей степени: аксиальная ось S(6)∙∙∙Au(1)∙∙∙S(6)c образует с экваториальной плоскостью угол в 86.99°. Атомы серы в основании пирамиды и экваториальной плоскости октаэдра формируют практически правильные прямоугольники, короткие и длинные стороны которых лежат в относительно узких диапазонах 2.846–2.864 и 3.689–3.734 Å соответственно, а значения внутренних углов SSS, близки к прямому: 89.38°–90.63°.
CP-MAS ЯМР 13C спектр полученного для РСА кристаллического материала ожидаемо включает резонансные сигналы групп >NC(S)S–, >N–αCH2–, –βCH2–, –γCH2– и –CH3 (рис. 8). Наиболее разрешенная и информативная в структурном отношении область дитиокарбаматных групп представлена четырьмя сигналами 13С (с соотношением интегральных интенсивностей, близким к 1 : 2 : 1 : 1), значения хим. сдвигов которых (196.0, 195.7, 195.4, 195.1 м.д.) указывают на вхождение лигандов BuDtc во внутреннюю сферу золота(III) [26–28]. Комплексы I и II включают по два и три неэквивалентных лиганда BuDtc соответственно, что полностью согласуется с наблюдаемым числом и отношением интегральных интенсивностей в обсуждаемой группе резонансных сигналов 13С, которая является результатом суперпозиции дублета (1 : 1) и триплета (1 : 1 : 1). Таким образом, приведенная в разделе “Синтез I, II” реакция не только определяет образующиеся вещества, но и корректно задает их количественное соотношение.
Рис. 8.
Спектр CP-MAS ЯМР 13C кристаллов, полученных для РСА (частота вращения образца 3.2 кГц; число накоплений 6900).
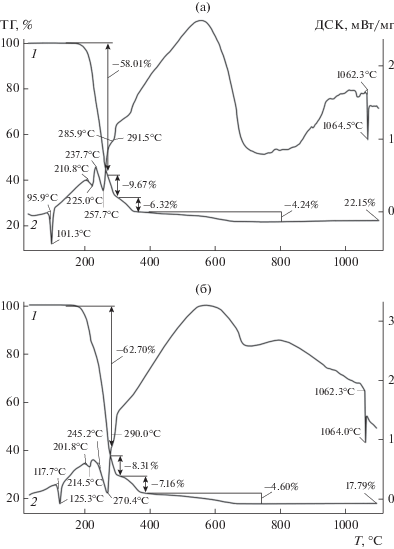
Исследование термического поведения комплексов проводили методом СТА с одновременной регистрацией кривых ТГ и ДСК. Установлено, что кристаллические комплексы I/II термически устойчивы до 176/165°С. Затем кривая ТГ фиксирует многостадийный процесс термической деструкции полученных соединений (рис. 9а, 1; 9б, 1). Дифференцирование первой, крутопадающей ступени (176–301/165–308°С), связанной с основной потерей массы (67.68/71.01%), позволяет выявить две точки перегиба (при 233/221 и 272/281°С), которые разделяют ее на три участка, свидетельствуя о сложном характере протекания термолиза с восстановлением Au(III) до элементного состояния, высвобождением HgCl2 и частичным его преобразованием в HgS. В диапазоне 301–365/308–386°С присутствует характерная ступень потери массы, обычно наблюдаемая для дитиокарбаматно-хлоридных комплексов Au(III)–Hg(II) [10] и связанная с термической диссоциацией образующегося HgS [29, 30]. Экспериментальная потеря массы на этой ступени (6.32/7.16%) указывает на то, что не менее 24.8/24.4% общего количества ртути, содержащейся в образце, преобразуется в HgS. Таким образом, остальная ртуть(II) высвобождается в форме HgCl2 (расч. 22.37/25.86%), сублимация которой предшествует процессу термического распада HgS [10] или перекрывается с ним [30]. В нашем случае обсуждаемой ступени разложения сульфида ртути(II) непосредственно предшествует участок с потерей массы 9.67/8.31% в интервале 272–301/281–308°С (после второй точки перегиба), границы которого близки к Tпл и Tкип HgCl2 [31]. Однако экспериментальная потеря массы значительно ниже расчетной, что указывает на сублимацию основного количества HgCl2 еще до достижения Tпл. (Последнее согласуется с данными работы [10].) При этом наблюдаемая потеря массы на первой ступени кривой ТГ, до второй точки перегиба, составляет 58.01/62.70%, что, с одной стороны, значительно превышает теоретически ожидаемое значение (45.49/43.77%), а с другой – полностью перекрывает недостающую потерю массы HgCl2. Пологий участок кривой ТГ (365–801/385–743°С) связан с финальной десорбцией (4.24/4.60%) продуктов термолиза. Остаточная масса при 1100°С 22.15/17.79% несколько отклоняется от расчетного значения для восстановленного золота (расч. 21.58/18.61%), мелкие шарики которого обнаруживаются при вскрытии тигля.
Кривая ДСК I/II включает несколько тепловых эффектов (рис. 9а, 2/9б, 2). Первый эндоэффект с экстремумом при 101.3/125.3°С, регистрируемый в области термической устойчивости комплексов, отражает их плавление (экстраполированная Tпл = 95.9/117.7°С). Плавление образцов при независимом определении в стеклянном капилляре установлено в диапазоне 94–96/118–120°С. Три последующие эндоэффекта с экстремумами при 225.0/214.5, 257.7/270.4 и 291.5/290.0°С (последний выявлен при дифференцировании кривой ДСК) проецируются, соответственно, на первый, второй и третий участки основной ступени потери массы. В высокотемпературной области кривая ДСК I/II фиксирует эндоэффект плавления восстановленного золота: экстраполированная Tпл = 1062.3°С.
Таким образом, препаративно выделены и методами РСА и CP-MAS ЯМР 13С охарактеризованы новые ионно-полимерные кристаллические комплексы золота(III)–ртути(II) состава ([Au{S2CN(C4H9)2}2]2[Hg2Cl6])n и ([(C4H9)2NH2]0.5-[Au{S2CN(C4H9)2}2]1.5[Hg2Cl6])n. Структурные единицы комплексов участвуют в построении сложноорганизованных 1D-, 2D- и 3D-псевдополимерных образований. Определяющую роль в их супрамолекулярной самоорганизации играют вторичные взаимодействия Au⋅⋅⋅S, S⋅⋅⋅Cl, а также водородные связи N–H···Cl. При изучении термического поведения полученных веществ установлена количественная регенерация связанного золота в относительно мягких условиях.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Priola E., Bonometti E., Brunella V. et al. // Polyhedron. 2016. V. 104. P. 25.
Amani V., Alizadeh R., Alavije H.S., Heydari S.F., Abafat M. // J. Mol. Struct. 2017. V. 1142. P. 92.
Rajarajan M. // Novus Int. J. Chem. 2013. V. 2. № 1. P. 1.
Onwudiwe D.C., Ajibade P.A. // Mat. Lett. 2011. V. 65. № 21–22. P. 3258.
Dar S.H., Thirumaran S., Selvanayagam S. // Polyhedron. 2015. V. 96. P. 16.
Manohar A., Ramalingam K., Karpagavel K. // Int. J. ChemTech Res. 2014. V. 6. № 5. P. 2620.
Prasad R., Yadav R., Trivedi M. et al. // J. Mol. Struct. 2016. V. 1103. P. 265.
Лосева О.В., Родина Т.А., Смоленцев А.И., Иванов А.В. // Коорд. химия. 2016. Т. 42. № 11. С. 683 (Loseva O.V., Rodina T.A., Smolentsev A.I., Ivanov A.V. // Russ. J. Coord. Chem. 2016. V. 42. № 11. P. 719). https://doi.org/10.1134/S1070328416110063
Лосева О.В., Родина Т.А., Иванов А.В. // Журн. общ. химии. 2019. Т. 89. № 11. С. 1766 (Loseva O.V., Rodina T.A., Ivanov A.V. // Russ. J. Gen. Chem. 2019. V. 89. № 11. P. 2273). https://doi.org/10.1134/S1070363219110185
Loseva O.V., Rodina T.A., Smolentsev A.I., Ivanov A.V. // Polyhedron. 2017. V. 134. P. 238.
Лосева О.В., Родина Т.А., Анцуткин О.Н., Иванов А.В. // Журн. общ. химии. 2018. Т. 88. № 12. С. 2024 (Loseva O.V., Rodina T.A., Antzutkin O.N., Ivanov A.V. // Russ. J. Gen. Chem. 2018. V. 88. № 12. P. 2540). https://doi.org/10.1134/S1070363218120149
Иванов А.В., Сергиенко В.И., Герасименко А.В. и др. // Коорд. химия. 2010. Т. 36. № 5. С. 353 (Ivanov A.V., Sergienko V.I., Gerasimenko A.V. et al. // Russ. J. Coord. Chem. 2010.V. 36. № 5. P. 353). https://doi.org/10.1134/S1070328410050064
Родина Т.А., Лосева О.В., Смоленцев А.И., Иванов А.В. // Журн. структур. химии. 2016. Т. 57. № 1. С. 151 (Rodina T.A., Loseva O.V., Smolentsev A.I., Ivanov A.V. // J. Struct. Chem. 2016. V. 57. № 1. P. 146). https://doi.org/10.1134/S0022476616010182
Бырько В.М. Дитиокарбаматы. М.: Наука, 1984. 341 с.
Cox M.J., Tiekink E.R.T. // Z. Kristallogr.1999. V. 214. № 9. P. 571.
APEX2 (version 1.08), SAINT (version 7.03), SADABS (version 2.11), SHELXTL (version 6.12). Madison (WI, USA): Bruker AXS Inc., 2004.
Pines A., Gibby M.G., Waugh J.S. // J. Chem. Phys. 1972. V. 56. № 4. P. 1776.
Pauling L. The Nature of the Chemical Bond and the Structure of Molecules and Crystals. London: Cornell Univ. Press, 1960. 644 p.
Bondi A. // J. Phys. Chem. 1964. V. 68. № 3. P. 441.
Exarchos G., Robinson S.D., Steed J.W. // Polyhedron. 2001. V. 20. № 24–25. P. 2951.
Elwej R., Hannachi N., Chaabane I. et al. // Inorg. Chim. Acta 2013. V. 406. P. 10.
Castiñeiras A., García-Santos I., Saa M. // Acta Crystallogr. C. 2019. V. 75. P. 891.
Yang L., Powel D.R., Houser R.P. // Dalton Trans. 2007. № 9. P. 955.
Alcock N.W. // Adv. Inorg. Chem. Radiochem. 1972. V. 15. № 1. P. 1.
Haiduc I., Edelmann F.T. Supramolecular Organometallic Chemistry. Wiley-VCH, 1999. 471 p.
Rodina T.A., Ivanov A.V., Gerasimenko A.V. et al. // Polyhedron 2012. V. 40. № 1. P. 53.
Родина Т.А., Филиппова Т.С., Иванов А.В. и др. // Журн. неорган. химии. 2012. Т. 57. № 11. С. 1582 (Rodina T.A., Filippova T.S., Ivanov A.V. et al. // Russ. J. Inorg. Chem. 2012. V. 57. № 11. P. 1490). https://doi.org/10.1134/S0036023612110113
Корнеева Е.В., Смоленцев А.И., Анцуткин О.Н., Иванов А.В. // Изв. АН. Сер. хим. 2019. № 1. С. 40 (Korneeva E.V., Smolentsev A.I., Antzutkin O.N., Ivanov A.V. // Russ. Chem. Bull., Int. Ed. 2019. V. 68. № 1. P. 40).https://doi.org/10.1007/s11172-019-2413-7
Leckey J.H., Nulf L.E. Thermal Decomposition of Mercuric Sulfide. United States: N. p., 1994. https://doi.org/10.2172/41313
Angeloski A., Rawal A., Bhadbhade M. et al. // Cryst. Growth Des. 2019. V. 19. P. 1125.
Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. М.: Химия, 1987. 319 с.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия